Рак толстой кишки ртк

К началу этого века профилактика рака толстой кишки стала приоритетным направлением в онкологии. Считается, что 90% всех РТК можно предотвратить. Канцерогенез в кишечнике благоприятен для скрининга, поскольку рак возникает на почве аденом в течение 10-15 лет, а их можно удалить на ранних этапах. Можно также заблокировать дальнейшую прогрессию на уровне аденом.
Целями скрининга являются обнаружение и удаление аденоматозных полипов и диагностика ранних стадий рака. Скрининг потенциально может уменьшить заболеваемость. Снижение показателей заболеваемости приводит к снижению смертности. Кроме того, на общих показателях смертности отразится высокая пропорция ранних раков, результаты лечения которых значительно лучше, чем в III или IV стадии. Раннее выявление РТК среди населения имеет 2 направления:
- обнаружение РТК в группах высокого риска,
- обнаружение РТК у формально здоровых людей, без каких-либо симптомов.
К методу скрининга всегда предъявляются следующие требования: недорогой, безопасный, легко проводимый, приемлемый для испытуемых и испытателей, с высокой чувствительностью (мало ложнонегативных ответов) и специфичностью (мало ложнопозитивных ответов). К группе высокого риска относят людей, имеющих семейный анамнез в отношении РТК (у родственников I степени), больных, страдающих воспалительными болезнями кишечника в течение 10 лет (хронический язвенный колит или болезнь Крона), людей с выраженным ожирением, не занимающихся физическими нагрузками.
Скрининг лиц с высоким риском начинают с 40-летнего возраста, для остальных обычный возраст начала скрининга 50 лет. В Великобритании на возрастную когорту людей старше 50 лет приходится 37% населения. 95% больных раком выявляются в возрасте старше 50 лет.
Наиболее известный тест – FOBT – определение малых количеств скрытой крови в содержимом кишечника. Он выполняется в домашней обстановке. Берутся по 2 образца кала в течение 3 дней. Требуется в течение 3 дней до теста соблюдать диету без животных белков. Тест следует повторять ежегодно. Однократное исследование одного образца кала не рекомендуется. В США этому тесту подвергаются 17.3% населения.
Другой метод иммунохимического исследования кала на скрытую кровь – FIT – более удобен, не требует специальной диеты, для его производства можно иметь меньшее число образцов кала.
Методы позволяют снизить риск смерти от РТК на 15%, кроме того, FOBT и FIT уменьшают заболеваемость РТК на 20% благодаря диагностике крупных полипов и последующего их удаления при колоноскопии [Pignone, 2002].
При положительных тестах на скрытую кровь пациенты должны обследоваться дополнительными методами.
Вторым методом скрининга является сигмоидоскопия. Шестидесятисантиметровой эндоскоп позволяет осмотреть глазом прямую кишку и нижнюю часть ободочной кишки (около одной трети).
Сигмоидоскопия в качестве метода скрининга выполняется в США у 30% здорового населения. Если полип или опухоль были найдены во время этого метода эндоскопии, выполняется затем колоноскопия. Метод позволяет уменьшить показатели смертности от РТК на 60%. Сигмоидоскопия проводится 1 раз в 5 лет. Разумеется, трудно уговорить здоровых и бессимптомных людей на производство этой достаточно неприятной и неэстетичной процедуры.
Сочетание двух методов FOBT и сигмоидоскопии в США каждые 5 лет выполняется у 39% обследуемых при скрининге. Комбинация методов может уменьшить риск смертности от РТК на 80%. Опасными находками считаются обнаружение полипа более 1 см или нескольких полипов с ворсинчатой структурой. К недостаткам сигмоидоскопии следует отнести невозможность удаления полипов, частые пропуски мелких полипов.
Колоноскопия среди методов скрининга в некоторых странах обозначена как золотой стандарт. Колоноскоп позволяет осмотреть всю ободочную кишку, удалить обнаруженные полипы. Периодические колоноскопии могут предотвратить развитие рака у 76-90% пациентов с крупными полипами [Winawer, 2003].
Колоноскопия у здорового населения выполняется 1 раз в 10 лет, а у пациентов с небольшими полипами или солитарными аденомами без тяжелой дисплазии – 1 раз в 3 года. У больных с HNPCC колоноскопию производят с интервалом в 1-2 года. Метод достаточно дорогой, требует подготовки кишечника, пациент должен пропустить работу. Колоноскопия болезненна и неприятна для обследуемых.
Метод двойного рентгенологического контрастирования толстой кишки в скрининговых программах оставлен из-за недиагностики мелких полипов, большого числа ложноположительных заключений, дороговизны, трудностей подготовки к исследованию.
Из новых методов скрининга (пока еще экспериментальных) отметим тест кала на ДНК. Из кала выделяют слущенный эпителий ободочной кишки, экстрагируют ДНК и производят ее мутационный анализ, используя панель биологических маркеров АРС, Р53, Ras, Bat-26. Эти данные позволяют отдифференцировать аденомы с малигнизацией [Ahlquist, 2000].
Кроме хирургической профилактики РТК в связи со скрининговым выявлением облигатных предраков и их удалением стали возможными и методы лекарственной профилактики РТК.
Многие агенты – фолиевая кислота, кальций, эстрогены, витамины олпитраз, урсодиол – были признаны вначале обещающими, но позднее после контролируемых исследований отвергнуты.
Профилактическая активность нестероидных антивоспалительных лекарств была подтверждена в эпидемиологических исследованиях, но эта группа препаратов из-за высокого риска осложнений также перестала использоваться в профилактических программах.
Серьезным достижением считается применение для профилактики РТК специфических ингибиторов СОХ-2 – celecoxib и rofecoxib. Особенно хорошо изучен 1-й препарат, на экспериментальных моделях он тормозит клетки рака толстой кишки посредством стимуляции апоптоза через каспазный механизм. При колоректальном канцерогенезе СОХ-2 экспрессирован в 50% в полипах и 85% в раковых клетках. В рандомизированном исследовании больные с семейным аденоматозным полипозом получали celecoxib по 400 мг в течение 6 месяцев. Отмечено снижение на 28% числа полипов по сравнению с контролем, и на 30% уменьшился размер этих полипов [Arber, 2005]. Замечено, что использование этих препаратов чревато кардиологическими осложнениями. Метод химиопрофилактики РТК пока считается экспериментальным.
- КЛЮЧЕВЫЕ СЛОВА: рак, толстая кишка, онкология, кишечник, Пентаса
За последние 10 лет в России отмечен рост заболеваемости и смертности от злокачественных новообразований [5] (табл.).
Ежегодно в России диагностируют более 46 000 новых случаев РТК, при этом на 100 вновь выявленных больных приходится более 70 умерших [1]. Повышенный риск возникновения неоплазии толстой кишки отмечен у больных воспалительными заболеваниями кишечника (ВЗК), при этом РТК у них может встречаться до 10 раз чаще, чем в общей популяции [20, 27]. Заболеваемость РТК, в том числе при язвенном колите (ЯК) и болезни Крона (БК), выше в экономически развитых странах и имеет географические различия, составляя при ЯК 2 случая на 1000 в Дании, 5 на 1000 в США, а при БК – 1,4 в скандинавской популяции и 3,9 в Великобритании и Северной Америке [15, 32]. Существуют различия в заболеваемости среди взрослых и детей: 3 и 6 случаев на 1000 в год соответственно [19]. При БК риск развития РТК колеблется от 2,5 до 4,5, что выше, чем в общей популяции, но несколько ниже, чем у больных ЯК [15]. Смертность от РТК, ассоциированного с ЯК и БК, значительно выше, чем от спорадического колоректального рака, а 5-летняя выживаемость после оперативного вмешательства ниже [3, 35].
Для злокачественных новообразований толстой кишки, развившихся при ВЗК, характерны некоторые особенности: мультицентрический рост, раннее метастазирование, преимущественно низкодифференцированный гистологический тип и высокая инвазивность [3, 12]. Первично-множественные опухоли толстой кишки с мультицентрическим ростом могут возникать одновременно (синхронно) или последовательно (метахронно) (рис. 1).
Метастазирует РТК при ВЗК так же, как и спорадический колоректальный рак, – лимфогенным, гематогенным и трансплантационным путями в лимфатические узлы, печень, мозг, легкие, кости, брюшину, отмечается прорастание в соседние органы (малый таз).
Морфологические варианты РТК при ЯК и БК включают (рис. 2): аденокарциному, слизистый рак, солидный рак, плоскоклеточный рак, недифференцированную форму, скиррозный рак, лимфому.
В качестве причин развития РТК рассматривают хроническое воспаление и длительную терапию препаратами иммуносупрессивной направленности.
Морфогенез РТК достаточно хорошо изучен. Он развивается в результате последовательных изменений: дисплазия/аденомааденокарцинома. Однако механизмы, ответственные за возникновение и накопление в эпителиальной клетке нарушений, изучены фрагментарно. В основе современных представлений о канцерогенезе лежит возможность различных канцерогенных агентов (химических, физических, вирусных, инфекционных) вызывать такие повреждения генома клеток, которые сопровождаются активацией клеточных онкогенов и/или инактивацией антионкогенов. Именно эти гены могут запускать деление клеток, участвовать в регуляции их пролиферации, дифференцировки и запрограммированной гибели – апоптозе. Клеточные онкогены (онкобелки или онкопротеины) кодируют синтез белков, стимулируют пролиферацию и замедляют апоптоз. Антионкогены, или гены-супрессоры рака, наоборот, тормозят пролиферацию клеток, и их потеря может привести к развитию рака [24].
Практически все генные мутации, участвующие в патогенезе спорадического РТК, обнаружены при злокачественной трансформации слизистой оболочки толстой кишки у больных ЯК [25]. В то же время особенностью неоплазии, ассоциированной с ВЗК, является более ранняя, чем при спорадическом РТК, мутация гена p53, приводящая к усилению пролиферативных процессов [7, 28].
Основными независимыми факторами риска РТК при ЯК считают продолжительность заболевания, протяженность воспаления в толстой кишке и первичный склерозирующий холангит (ПСХ) [43]. К дополнительным факторам риска относят начало болезни в раннем возрасте, РТК у родственников и дефицит фолиевой кислоты [41]. К факторам риска РТК при БК, помимо перечисленных выше, относят также хроническую кишечную непроходимость, хронический свищ (особенно параректальный) и, возможно, длительный прием 6-меркаптопурина [28].
В 2001 г. опубликованы результаты анализа 19 исследований риска РТК при ЯК, где указано, что при длительности ЯК 10 лет риск составляет 2%, при 20-летнем стаже заболевания – 8%, при 30-летнем – риск неоплазии возрастает до 18% [19]. Успешное проведение профилактических мероприятий в ряде стран привело к снижению риска развития РТК у больных ВЗК (рис. 3). Риск злокачественной неоплазии у пациентов с длительным течением БК толстой кишки, не подвергшихся оперативному лечению, составил 2,9% при 10-летнем анамнезе заболевании, 5,6% – при 20-летнем, 8,3% – при длительности БК более 30 лет (с увеличением стажа заболевания риск будет возрастать) [15, 17] (рис. 3). Исследование, выполненное в Копенгагене, свидетельствует, что у 70% больных БК при длительности анамнеза более 15 лет после резекции толстой кишки риск РТК не изменился [29].
Доказанным фактом является высокая вероятность злокачественной трансформации слизистой оболочки толстой кишки (СОТК) у пациентов с распространенным колитом: большинство неоплазий развивается у пациентов с тотальным колитом – в 19 раз чаще, чем в общей популяции [41]. Бытует мнение, что при проктите риск РТК наиболее низкий (в 1,5 раза выше, чем в популяции), тогда как при левостороннем поражении толстой кишки частота риска повышается в 4 раза, и он появляется примерно на 10 лет позже по сравнению с панколитом [20]. В то же время имеются сведения о более раннем и частом выявлении РТК и дисплазии при левостороннем поражении толстой кишки [31].
Проблема развития РТК при сочетании ВЗК с первичным склерозирующим холангитом (ПСХ) заслуживает особого внимания [4]. Присоединение ПСХ повышает риск неоплазии на 50%. Отмечена более частая локализация карциномы в правых отделах толстой кишки, при этом обсуждается роль желчных кислот (нарушение желчеобразования и неполноценность состава желчи) в онкогенезе при ПСХ [41]. Кроме того, риск развития РТК сохраняется у пациентов и после трансплантации печени, составляя 1% на человека в год [30].
Наличие случаев РТК у родственников повышает риск развития не только спорадической карциномы толстой кишки, но и является фактором риска неоплазии у больных ВЗК [17]. Семейный анамнез РТК повышает вероятность малигнизации СОТК в 2 и более раз [10, 33].
До настоящего времени дискутируется вопрос о значении раннего возраста начала заболевания в развитии карциномы толстой кишки в случае ВЗК. Утверждение о повышенном риске развития РТК у больных с началом заболевания в раннем возрасте основано на исследованиях, согласно которым колоректальная карцинома обнаруживается у 20% больных ЯК через 10 лет после начала заболевания и у 40% через 35 лет с дебютом заболевания до 15 лет [20].
Положение European Crohn's and Colitis Organisation (ECCO) о риске РТК при ЯК:
- при длительном течении ЯК риск развития КРР выше по сравнению с общей популяцией (УД 2);
- при тотальном ЯК риск наиболее высок, при левостороннем ЯК – средний уровень риска, при проктите этот риск не повышен (УД 2);
- наиболее высокий риск у больных с ранним началом заболевания (дебют в возрасте
Исследование концентрации основных маркеров рака толстой кишки, которое используется для диагностики, оценки прогноза и контроля лечения этого заболевания.
Анализы крови при раке толстой кишки, онкомаркеры рака толстой кишки
CA 19-9, CA 242, Gastrointestinal Cancer Antigen, GICA, Carcinoembryonic antigen, CEA, CD66e, CEACAM5.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 8 часов до исследования, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 24 часов до исследования.
Общая информация об исследовании
Рак толстой кишки (РТК) - самое частое злокачественное заболевание желудочно-кишечного тракта. Диагностика РТК носит комплексный характер, при этом лабораторные методы исследования играют одну из центральных ролей. Исследование онкомаркеров позволяет получить ценную диагностическую и прогностическую информацию. Наиболее хорошо изучены онкомаркеры СА 19-9 и раковый эмбриональный антиген.
Раковый эмбриональный антиген (РЭА) - это крупный гликопротеин, по структуре напоминающий иммуноглобулины. Он синтезируется клетками толстой кишки и, вероятно, обеспечивает межклеточные взаимодействия. Показано, что РЭА играет определенную роль в стимуляции опухолевого роста, инвазии и метастазировании.
Повышение уровня РЭА характерно для РТК. При этом высокий уровень РЭА чаще наблюдается на поздних стадиях заболевания и/или при наличии крупной опухоли. На ранних стадиях заболевания уровень РЭА, как правило, в норме. Следует также отметить, что примерно в 15 % случаев крупных РТК уровень РЭА также остается в норме. Не существует какой-либо взаимосвязи между уровнем РЭА и гистологическим типом опухоли. Повышение РЭА может наблюдаться и при некоторых неонкологических заболеваниях желудочно-кишечного тракта (гепатиты, неспецифический язвенный колит и болезнь Крона, панкреатит), онкологических заболеваниях других органов (рак молочной железы, яичника, почки) и неонкологических заболеваниях других органов (хроническая обструктивная болезнь легких, эндометриоз).
Уровень РЭА также используется для оценки прогноза заболевания. Показано, что высокий уровень РЭА в предоперационный период является неблагоприятным прогностическим признаком. Повышение уровня РЭА в послеоперационном периоде может свидетельствовать о рецидиве заболевания.
Онкомаркер CА 19-9 (карбогидратный антиген) по структуре также относится к гликопротеинам. Подобно РЭА, СА 19-9 обнаруживается в повышенной концентрации в крови пациентов с РТК и некоторыми другими заболеваниями (панкреатит, заболевания печени). Как и в случае с РЭА, уровень СА 19-9 не отражает гистологический тип опухоли. Чувствительность СА 19-9 в отношении РТК ниже, чем чувствительность РЭА. Совместное исследование онкомаркеров СА 19-9 и РЭА позволяет достигнуть более высокой чувствительности. Некоторые авторы предлагают использовать онкомаркер СА 19-9 в комбинации с РЭА для оценки прогноза РТК.
Раковый антиген СА 242 – это высокомолекулярный гликопротеин, который, как и онкомаркер СА 19-9, вырабатывается клетками эпителия желудочно-кишечного тракта, но обладает более выраженной чувствительностью и специфичностью к злокачественным образованиям. Уровень СА-242 повышается практически у всех пациентов с опухолями желудочно-кишечного тракта, особенно при раке поджелудочной железы, толстого кишечника и прямой кишки. СА-242 продуцируется опухолевыми клетками и поступает в кровоток, что делает его эффективным маркером опухоли, позволяющим диагностировать заболевание на ранней стадии и следить за его течением.
Главной особенностью онкомаркера СА 242 является низкая экспрессия при доброкачественных заболеваниях желудочно-кишечного тракта, что позволяет использовать его для дифференциальной диагностики доброкачественных и злокачественных опухолей.
В настоящее время исследование концентрации этих онкомаркеров не используется в качестве самостоятельного теста для диагностики РТК, а дополняется другими анализами (например, анализ кала на скрытую кровь) и инструментальными исследованиями (например, колоноскопия). Результат исследования на онкомаркеры оценивают с учетом всей значимой информации о пациенте.
Для чего используется исследование?
- Для диагностики рака толстой кишки (РТК);
- для оценки прогноза РТК;
- для раннего выявления рецидива РТК.
Когда назначается исследование?
- При подозрении на рак толстой кишки при наличии немотивированной слабости, потери веса, снижения аппетита, тошноты, нарушения стула, появления крови в кале, боли в животе;
- периодически при наблюдении пациента в послеоперационном периоде.
Что означают результаты?
Для каждого показателя, входящего в состав комплекса:

- В каких отделах толстой кишки может развиваться рак?
- Кто чаще страдает раком кишечника?
- Возможно ли что-то сделать для предупреждения развития рака толстой кишки?
- Какие симптомы должны насторожить в отношении злокачественной опухоли толстого кишечника?
- История пациентки с заболеванием толстой кишки
- Существуют ли методы, на 100% гарантирующие точность диагностики рака толстой кишки?
- Диагностика рака кишечника по анализу онкомаркеров
- Особенности болезни при раке прямой кишки
- Разновидности рака толстой кишки
- Цены в Европейской онкологической клинике на лечение рака толстой кишки
Толстая кишка (термин толстый кишечник некорректен с точки зрения хирургии и топографической анатомии, однако широко используется в литературе) – это протяженный отрезок желудочно-кишечного тракта, включающий в себя:
- слепую кишку с аппендиксом,
- восходящую ободочную кишку,
- поперечную ободочную кишку,
- нисходящую ободочную кишку
- и сигмовидную кишку до прямой кишки.
Общая длина толстой кишки взрослого человека составляет от 1,5 до 2 метров. Злокачественные онкологические заболевания толстой кишки занимают третье место по распространенности среди раковых заболеваний.
Опухоли обычно называемые раком кишечника или колоректальным раком, включают несколько различных по строению, преимущественному расположению и течению злокачественных новообразований. Как правило, они представляют собой аденокарциномы - новообразования из клеток слизистой оболочки, продуцирующих слизь. Хирургическое лечение опухолей толстой кишки проводится врачами - колопроктологами, онкологами, хирургами.
В каких отделах толстой кишки может развиваться рак?
Начальной частью толстой кишки является слепая кишка. Слепая кишка имеет вид купола, направленного вниз, от которого отходит червеобразный отросток — аппендикс. Немного выше в слепую кишку впадает конечный отдел тонкого кишечника — подвздошная кишка.
Слепая кишка находится в брюшной полости внизу справа — в подвздошной области. В месте впадения тонкой кишки слепая кишка заканчивается, и начинается восходящая ободочная кишка. Она имеет длину примерно 12 см, поднимается вверх до печени и делает изгиб, переходя в поперечную ободочную кишку.
Поперечная ободочная кишка расположена горизонтально, имеет длину 25–30 см. Она проходит справа налево, после чего делает изгиб и переходит в нисходящую ободочную кишку.
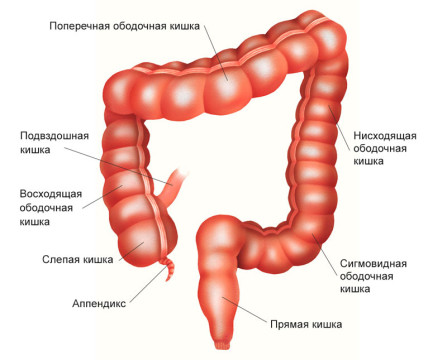
Нисходящая ободочная кишка имеет длину 10-30 см, проходит сверху вниз в левой части брюшной полости и переходит в сигмовидную ободочную кишку. Последняя, изгибаясь, переходит в прямую кишку — конечный отдел толстого кишечника.
Ширина просвета толстой кишки в разных отделах различается. В слепой кишке она в среднем составляет 7 см, а в сигмовидной — 4 см. Поэтому симптомы опухоли в конечных отделах толстого кишечника обычно нарастают быстрее.
Кто чаще страдает раком кишечника?
Чаще колоректальный рак (рак кишечника) встречается у людей старше 50-60 лет с примерно одинаковой частотой у мужчин и женщин. Наиболее часто поражается ободочная кишка. Повышают риск развития опухолей толстой кишки высококалорийная диета с большой долей животных жиров и небольшим содержанием грубой клетчатки и пищевых волокон, курение, хронические запоры, постоянный многомесячный прием нестероидных противовоспалительных средств, длительно существующие хронические воспалительные заболевания толстого кишечника – неспецифический язвенный колит, болезнь Крона, аденоматозный полип. Пациенты с имевшейся ранее злокачественной опухолью также имеют риск развития второй опухоли толстой кишки.
Метаболический синдром (комбинация артериальной гипертензии, висцерального ожирения, нарушений липидного и углеводного обмена) у мужчин способствует развитию рака толстого кишечника из-за нарушения гормонального баланса и процесса эпителизации толстой кишки. Около 10% случаев толсто-кишечных опухолей составляют наследственные формы, среди которых синдром наследственного неполипозного рака, обусловленный мутациями генов, отвечающих за репарацию ДНК, семейный аденоматозный полипоз, связанный с потерей гена FAP, и ряд других заболеваний.
Возможно ли что-то сделать для предупреждения развития рака толстой кишки?
Чтобы предупредить развитие злокачественной опухоли толстой кишки, особенно лицам старшей возрастной группы, рекомендуется вести здоровый образ жизни и придерживаться универсальных профилактических мероприятий – проходить ежегодное обследование (ректальное обследование, анализ кала на скрытую кровь, колоноскопия). На нашем сайте мы разместили подробный материал о скрининге рака толстой кишки.
Выявление предраковых изменений и злокачественных опухолей толстой кишки на ранних стадиях позволяет своевременно начать лечение. Ранняя диагностика и активное лечение, широко внедренные в широкую клиническую практику, позволили добиться высоких показателей пятилетней выживаемости – при первичном выявлении колоректального злокачественного новообразования на 1 стадии этот показатель составляет 90-93%, на 2 стадии – около 70-75%, на 3-й стадии – 40-48%. И несмотря на совершенствование методов лечения, выживаемость при первичном выявлении рака на 4-й стадии не превышает 5-9%.


Какие симптомы должны насторожить в отношении злокачественной опухоли толстого кишечника?
- Как правило, на ранних стадиях заболевания симптомы скудные: хроническая усталость, вялость, потеря интереса к жизни, общий дискомфорт в животе, необъяснимая потеря веса, гипохромная нормоцитарная анемия.
- На более поздних стадиях могут появиться упорные запоры, отвращение к пище, недержание газов или фекалий, кровь в стуле (могут быть как прожилки, так и существенное количество алой крови), болезненные позывы на неэффективные испражнения (тенезмы).
- При далеко зашедших опухолях может развиться хроническая или острая непроходимость кишечника. Симптомами этого опасного для жизни осложнения являются рези в животе, тошнота, рвота, иногда даже каловая, невозможность испражнения в сочетании с болезненными позывами на дефекацию.
- При распространении процесса по брюшине – канцероматозе брюшины — развивается асцит. При этом в брюшной полости накапливается жидкость, которая сдавливает внутренние органы и усугубляет тяжелое состояние больного.
В возрасте старше 50 лет сочетание даже невыраженного дискомфорта в области живота с гипохромной анемией (снижение гемоглобина и эритроцитов в общем анализе крови) в сочетании с повышением СОЭ и уровня лейкоцитов, а также положительным анализом кала на на скрытую кровь и повышением свертываемости крови должны в обязательном порядке повлечь за собой эндоскопическое исследование кишечника.
История пациентки с заболеванием толстой кишки

Существуют ли методы, на 100% гарантирующие точность диагностики рака толстой кишки?
Современный уровень эндоскопической техники при своевременном проведении позволяет диагностировать и типировать опухоли кишечника на самых ранних стадиях, при необходимости данные ректороманоскопии или колоноскопии с биопсией подозрительных участков могут быть дополнены проведением ректального УЗИ, ирригоскопии, УЗИ брюшной полости и малого таза. Эти исследования позволяют уточнить локализацию опухоли, степень её прорастания в близлежащие органы и ткани, наличие воспаления в окружающих тканях. Для получения всей полноты картины проводят МРТ и компьютерную томографию. Современные технологии позволяют при психологической невозможности выполнения колоноскопии провести так называемую виртуальную колоноскопию. Для диагностики наличия и локализации отдаленных метастазов используется ПЭТ-КТ (позитронно-эмиссионная томография).
Диагностика рака кишечника по анализу онкомаркеров
Онкомаркеры СА 19,9 и раково-эмбриональный антиген (РЭА) используются для скрининговой диагностики рака толстой кишки. Определение РЭА бывает полезным для предоперационного стадирования и наблюдения за больными с колоректальным раком после хирургического лечения. Как правило, на фоне прогрессирования болезни концентрация РЭА в сыворотке неуклонно растет.
Однако, повышение уровня онкомаркеров в скрининговом анализе крови не всегда означает наличие опухоли кишечника. Описаны многочисленные случаи впервые выявленного колоректального рака на поздних стадиях без существенного повышения этих показателей. Ведущими методами диагностики колоректального рака являются эндоскопические методы, а онкомаркеры используются в комплексе с другими лабораторными и клиническими показателями для оценки стадии процесса, эффективности лечения и стабильности ремиссии.
Согласно исследованиям, представленным 1 июля 2015 года на конгрессе Европейского общества медицинской онкологии (European Society for Medical Oncology World Congress on Gastrointestinal Cancer), при раке ободочной кишки средняя выживаемость среди пациентов с лишним весом на 2,5 месяца выше, чем у людей с субтильным телосложением и больных ожирением.
Особенности болезни при раке прямой кишки
Разновидности рака толстой кишки
Цены в Европейской онкологической клинике на лечение рака толстой кишки
- Консультация онколога — 4500 руб.
- Консультация химиотерапевта — 6900 руб.
- Восстановление непрерывности толстой кишки после ранее наложенной колостомы — 119700 руб.
- Фотодинамическая терапия при опухолевом стенозе толстой кишки (без стоиомости фотосенсибилизатора) — 178300 руб.
- Эндоскопическая резекция слизистой толстой кишки — 69000 руб.
В отдельном материале сайта мы подробно рассматриваем вопросы лечения рака толстой кишки.
К.м.н. И.С. Базин, профессор А.М. Гарин, С.А. Жарков, к.м.н. М.Н. Нариманов
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Статистические аспекты, вопросы канцерогенеза и факторы прогноза
Ежегодно в мире регистрируются 600 тыс. новых больных раком толстой кишки (РТК), половина из них умирает [1].
Отмечается рост заболеваемости в большинстве стран. Заболеваемость РТК в России с 1990 по 2000 год возросла у мужчин при раке ободочной кишки на 18,7%, прямой – 16,2%, а у женщин прирост составил 18,9 и 6,6% соответственно.
В России ежегодно регистрируется более 40 тыс. новых случаев рака толстой кишки (за 2000 год 47530 – первичных больных, умерло 34341 пациентов) [2].
До 6% пациентов от общего числа заболевших имеют наследственную природу болезни. Наследственный РТК включает в себя семейный неполипозный РТК (синдром Линча), а также рак, возникший из наследственных аденоматозных и гамартомных полипов.
Более чем у 90% больных возникает спорадический рак толстой кишки. К самым большим достижениям фундаментальной науки следует отнести идентификацию генетических изменений при спорадическом раке толстой кишки, которая дала возможность приступить к разработке генной терапии этого заболевания.
Впервые модель канцерогенеза РТК была представлена в литературе в 1988 году [3,4]. Ген АРС (аденоматозного полипоза кишки) ответственен за развитие аденом у больных семейным полипозом. Мутация этого гена (потеря аллели в 5–й хромосоме) ведет к гиперпролиферации нормального эпителия. При наследственном РТК потеря аллели в 5–й хромосоме не наблюдается никогда, при спорадическом ненаследственном РТК она отмечается у 30–50% больных.
Образование ранних аденом – второй этап в развитии РТК – связывают с мутированным колоректальным раковым геном ММС (ген, участвующий в передаче сигнальной трансдукции) и метилированием ДНК [5]. Метилирование ДНК необходимо для регуляции экспрессии генов и важно для метаболизма цитозин нуклеотидов.
Потеря аллели в 18 хромосоме отмечается у 70% больных РТК и 50% больных с поздними аденомами. Потерянная аллель обычно содержит ген DCC (D от слова deleted – потерянный, СС – рак ободочной кишки). DCC – это супрессорный ген, ответственный за процессы клеточной адгезии. Снижение экспрессии гена DCC ведет к метастазированию [9,10]. При развитии РТК важную роль выполняет и ген Р–53. Мутации этого супрессорного гена, тормозящего клеточную прогрессию и трансформацию, приводят к потере контроля над процессом пролиферации [11,12].
Замещение или подавление мутированных генов ras, MMC, P–53 восстановление гена DCC и т.д. – являются вполне достижимыми целями будущего лечения больных РТК.
Возраст – основной фактор риска развития РТК у здорового человека. Так, заболеваемость РТК у 40–летних составляет 8 заболевших, у 60–летних – 150 на 100 тыс. населения.
Доказано, что риск возникновения РТК у лиц, не имеющих предрасполагающих обстоятельств, составляет 1–3%; если у родственников 1–го порядка был РТК, риск повышается до 5%, среди больных язвенным колитом риск развития РТК равен 15–30%; среди пациентов с болезнью Крона – 15%, с неполипозным наследственным колоректальным раком – 15–20%; наследственным семейным полипозом 30–100% [13]. Данные группы риска должны подвергаться обязательным профилактическим осмотрам, что в ряде случаев способствует раннему выявлению РТК. Американское раковое общество рекомендует лицам старше 50 лет пройти тестирование на скрытую кровь и раз в год подвергаться сигмоскопии.
Поскольку РТК часто возникает метахронно, больные, леченные хирургически по поводу РТК, также должны рассматриваться, как группа риска – на предмет возникновения второй опухоли в кишечнике.
Наиболее известный маркер РТК – карциноэмбриональный антиген (СЕА) [15]. Диагностическое и прогностическое значение карциноэмбрионального антигена обсуждается с середины 80–х годов [16,17]. Карциноэмбриональный антиген отнюдь не обязательный маркер – у 40% больных РТК он не выявляется. Этот маркер нельзя назвать и специфическим, поскольку он обнаруживается и при других злокачественных опухолях (раке молочной железы, поджелудочной железы, легкого, яичников и даже саркомах), а также в эмбриональной ткани и незлокачественных заболеваниях (гепатотоксичность, гидронефроз, желчекаменная болезнь) [18].
Высокие цифры СЕА после операции являются признаком нерадикальности последней, возможного рецидива, короткой выживаемости. После радикальных хирургических операций систематическое определение СЕА позволяет выявить в 47% случаев рецидивы, в том числе и бессимптомные [19,20].
Американской гастроэнтерологической ассоциацией в 1989 году сформулирован консенсус по вопросам послеоперационного ведения больных РТК. Его порядок представлен в таблице 1 [21].
Информативным считается уровень СЕА в плазме более 10 ng/ml.
Маркер Са–19–9 имеет прогностическое значение при РТК. Если его уровень превышает 37 ед/мл, риск смерти в течение 3 лет после операции увеличивается в 4 раза по сравнению с теми, у кого этот показатель был отрицательным или более низким [22].
При РТК в 28% случаев экспрессируются цитокератинные антигены (СК 17 и 18). Больные, у которых обнаружена экспрессия этих антигенов, имеют наихудший прогноз выживаемости [23]. Вместе с тем цитокератинные антигены стали мишенью для моноклональных антител. В рандомизированном исследовании радикально оперированные пациенты получали раз в месяц адъювантно мышиные антитела против цитокератинного антигена 17 либо плацебо.
Муцинозные гликопротеины экспрессируют сиалозил –Тn антиген (Sialosyl–Tn). У 86% больных РТК определяется этот маркер. Те, у кого его нет, выжили 5 лет в 100% случаев, пятилетняя выживаемость больных с положительным сиалозил Тн маркером составила 73% [25].
Самой частой формой РТК является аденокарцинома тубулярной или ворсинчатой структуры – 95%. Другие варианты составляют всего 5% (это перстневидноклеточный рак, плоскоклеточный рак, аденоплоскоклеточный рак, мелкоклеточный рак и недифференцированный рак) [26].
Главным прогностическим фактором является стадия рака толстой кишки в момент первичной диагностики. К другим прогностическим факторам относят: возраст, пол, симптомность, наличие опухолевых осложнений, инвазию нервов и сосудов, число пораженных лимфоузлов, степень дифференцировки, высокие цифры ЛДГ и числа лейкоцитов в крови, плоидность ДНК, холецистэктомию в анамнезе, облучение таза в анамнезе. Остановимся на наиболее важных из них.
Чем моложе пациент, тем хуже прогноз [27]. У женщин прогноз лучше, чем у мужчин [28]. Наличие симптомов рака толстой кишки при постановке диагноза усугубляет прогноз. Бессимптомные больные (со случайной диагностикой) живут 5 лет в 71% случаев; больные, имевшие симптомы болезни до первичного диагноза, переживают пять лет в 49% случаев [29]. Наличие опухолевых осложнений (перфорации или непроходимости) ухудшает прогноз. Пятилетняя выживаемость в Дании среди имевших эти осложнения РТК (219 больных) составила 23%, а больных без этих осложнений (732 пациента) – 35% [30].
Опухоли толстой кишки получают потенциал метастазирования после прорастания подслизистого слоя кишечника, богатого лимфатическими сосудами [31]. Если опухоль не прорастает все слои кишечника, метастазы в лимфоузлы обнаруживаются лишь в 10%, если пенетрируется серозная оболочка – в 60% [32]. Если в лимфоузлах обнаруживается реактивная гиперплазия – это хороший прогностический признак [33].
При прорастании серозной оболочки, покрывающей частично прямую кишку и большую часть ободочной кишки, возможна диссеминация по брюшине [34].
Метастазы в печени обнаруживаются на секционном материале в 40% случаев, рак толстой кишки после метастазирования в печень может широко диссеминироваться по органам и тканям – легкие, кости и т.д.
Лечение рака толстой кишки
Главным методом лечения РТК остается хирургическая операция. Ее принципы не изменились за много лет и состоят: в удалении опухоли с проксимальным и дистальным запасом неизмененной кишки для элиминации подслизистого лимфатического распространения клеток; удалении региональных брыжеечных лимфоузлов; визуальном интраоперационном стадировании болезни; стремлении минимизировать постхирургические функциональные нарушения.
По современным данным, резектабильность рака ободочной кишки составляет 70–80%, послеоперационная летальность до 5%. Общая пятилетняя выживаемость варьирует от 50 до 70% в разных центрах.
Результаты хирургических операций при раке ободочной кишки в первую очередь зависят от вовлеченности в опухолевый процесс лимфоузлов и стадийности по Dukes.
При негативных лимфоузлах и Dukes A 5 лет выживают 90%, когда нет метастазов в лимфоузлах, но когда опухоль прорастает мышцу (Dukes B), выживают этот срок 80%, при Dukes C этот показатель снижается до 60%.
Если во время операции были удалены пораженные раковой опухолью лимфоузлы, пятилетняя выживаемость различается в зависимости от степени инвазии опухолью стенки кишки – 74% (Dukes A), 48% (Dukes B) – 30% (Dukes C) [36].
Результаты хирургического лечения рака прямой кишки также зависят от вовлеченности лимфоузлов и классификации по Dukes. Считается, что выживают 5 лет 50% больных. Локальные рецидивы возникают у 10% (обычно в первые 2 года).
Особое место занимает хирургия диссеминированных больных. На первом месте стоит хирургическое лечение метастазов в печень. После удаления одиночных метастазов в печень, 5–летняя выживаемость составляет 25%. Перспективной технологией является коагуляционная гипертермия метастазов (Radiofrequency, RF). Чрескожно или интраоперационно в центр метастаза вводится электрод, связанный с радиочастотным генератором.
В практику хирургии РТК вошли эндоскопические операции, сокращающие сроки пребывания пациентов в больнице, уменьшающие частоту некоторых осложнений. Вместе с тем метод ограниченно позволяет ориентироваться в брюшной полости (исключена возможность пальпации). Операции длительны даже в руках опытных хирургов, нередки случаи неадекватного удаления лимфоузлов [39].
Улучшить результаты хирургического лечения РТК возможно при использовании адъювантной терапии. На 141 больном В и С стадии колоректального рака проведено рандомизированое исследование, в котором сравнивалась пятилетняя выживаемость в контроле, в группе, где больные получали один фторурацил, и в группе, где применялся фторурацил + левамизол. 5 лет прожили в контроле 48% больных, в группе с фторурацилом – 56% и в группе с фторурацилом и левамизолом – 68% [40].
В исследовании, проведенном на 408 больных, было подтверждено, что комбинация левамизола и фторурацила уменьшает частоту рецидивов по сравнению с контролем. Выживаемость достоверно улучшилась лишь при стадии Dukes C [41].
Окончательное мнение среди онкологов по поводу ценности профилактического применения фторурацила и левамизола сложилось после публикации итогов межгруппового международного исследования (Moertel). В группе больных со стадией С летальность сократилась на 33%, а частота рецидивов на 41% по сравнению с контролем [42].
Итак, для адъювантной терапии рака ободочной кишки в стадии С (с вовлечением в опухолевый процесс регионарных лимфоузлов) следующий режим применения фторурацила и левамизола признается стандартным: левамизол 50 мг х 3 раза в день внутрь, 3 дня, каждые 4 недели; фторурацил 450 мг/м2 внутривенно 5 дней, затем с 28 дня один раз в неделю. Лечение проводится в течение года после операции [43].
Тем не менее эта комбинация уступает в популярности режиму фторурацил + кальция фолинат. В четырех крупных рандомизированных исследованиях (в Европе, США и Канаде) было доказано преимущество в выживаемости и безрецидивном течении применения фторурацила и кальций фолината. Разница с контролем по выживаемости составила от 5 до 14%, а по безрецидивному течению от 9 до 15%. Во всех исследованиях эта разница была достоверной [44,45,46,47].
Следующая комбинация признана стандартной для адъювантной терапии рака ободочной кишки в В и С стадиях:
– фторурацил 370–425 мг/м2 внутривенно 1–5 дни,
– кальций фолинат 300 мг/м2 внутривенно 1–5 дни.
Каждые 28 дней, 6 месяцев после операции.
В 1998 г. закончен анализ кооперированного международного сравнения эффективности адъювантной терапии РТК фторурацилом и кальция фолинатом и фторурацилом, кальция фолинатом и левамизолом. Последняя комбинация не улучшила выживаемость. От комбинации фторурацил + кальция фолинат выжило 66%, от комбинации фторурацил + кальция фолинат + левамизол – 67% [48].
В лечении рака прямой кишки, помимо химиотерапии, важная роль отводится лучевой терапии. Гастроинтестинальная исследовательская группа в США осуществила рандомизированное исследование на 277 послеоперационных больных раком прямой кишки в стадиях В и С. Больные были разделены на 4 группы: контроль, облучение таза (40 gy), фторурацил + семустин в течение 18 месяцев, облучение + фторурацил + семустин. После 10 лет наблюдений, статистически достоверной оказалась разница в результатах контроля и группы, где комбинировалось облучение и химиотерапия. Безрецидивное течение было соответственно в 45% и 65%, выживаемость 26% и 45% [49,50].
В исследованиях Северной онкологической группы США (NCCTG) были показаны преимущества комбинации послеоперационного облучения и химиотерапии по сравнению с одним облучением (45 gy). В исследование было включено 240 больных раком прямой кишки в стадиях В и С. Больные наблюдались 7 лет. Безрецидивное течение отмечалось в комбинированной группе в 63%, в чисто лучевой – в 42%, 5 лет прожили соответственно 58% и 47% [51].
Методические модификации применения фторурацила были осуществлены в Гастроинтестинальной исследовательской группе США.
Крупное Японское контролируемое исследование более чем на 300 больных показало, что 4–х летняя выживаемость на 13% выше в группе, где больные после операции в течение 2 лет получали UFT по 400 мг в сутки, по сравнению с группой пациентов, подвергнутых только операции [53].
Среди еще незаконченных исследований в области адъювантной химиотерапии – сравнение в рамках разных методов введения фторурацила (длительные инфузии или струйные), сравнение эффективности разных сроков адъювантной терапии (начало сразу после операции или отсроченное), продолжительность адъювантной терапии.
В настоящее время идет исследование по сравнению режима De Gramont и этой комбинации + современный противоопухолевый агент из группы кампотоцинов. Исследование не завершено.
Среди новых программ адъювантной терапии при РТК – сравнение раптитрексида и комбинации фторурацил + кальций фолинат после операций по поводу РТК Dukes C стадия.
В США планируется большое кооперированное сравнение эффективности UFT + кальций фолинат и фторурацил + кальций фолинат.
В рамках EORTC организовано сравнительное исследование адъювантной эффективности при опухолях со стадией Dukes C раптитрексида и фторурацила с кальций фолинатом. Современные режимы приема 5–фторурацила с кальций фолинатом представлены в таблице 2.
Лучевая терапия – метод, который чаще используется при ректальном раке, нежели при раке ободочной кишки. При раке прямой кишки метод применяется, как дооперационный, для уменьшения стадийности и улучшения местного контроля. Послеоперационное облучение призвано сократить локальные рецидивы, которые возникают у 25–50% оперированных больных, если первичная опухоль квалифицировалась, как Т3 или Т4 и как основной метод неоперабельного местнораспространенного ректального рака [55,56].
Идея послеоперационного облучения возникла в связи с довольно высокой констатацией локальных рецидивов до 30% при Т3N0 и 50% при Т3N1 [57]. Кооперированное исследование на большом числе больных выявило лишь уменьшение рецидивов от послеоперационного облучения (50 gy за 7 недель) в группе со стадией Dukes C; у больных со стадиями А и В рецидивы встречались одинаково в обеих группах, у 10% были постлучевые осложнения, на отдаленной выживаемости добавление лучевой терапии не сказалось. Лучше были лишь двухгодичные результаты: после облучения – 82%, в хирургической группе – 67% [58]. Подобные результаты получены и в других рандомизированных исследованиях [59].
Читайте также:

