Рак проксимального отдела желудка с переходом на пищевод прогноз

-
4 минут на чтение

Если взять всех пациентов с карциномой органа, то раковая опухоль кардиального отдела диагностируется в 15% случаев. При этом возникшие симптомы практически всегда свидетельствует о том, что патологический процесс находится уже в запущенной стадии.
- Что такое
- Классификация
- Причины
- Симптомы
- Диагностика
- Лечение
- Осложнения
- Выживаемость
- Профилактика
Что такое
Кардиоэзофагеальный рак желудка с переходом на пищевод (код по МКБ-10 – С16.0) – злокачественное опухолевидное новообразование, возникающее на соустье пищеварительного органа, в кардиальном отделе и нижней трети трубки для прохождения пищи. Это комбинированный вид формирования, поражающего сразу несколько участков желудочно-кишечного тракта.
При этом заболевание длительное время протекает бессимптомно. Такой период может длиться несколько лет, а возникшие проявления сигнализируют о стремительном прогрессировании патологического процесса. Кроме того, злокачественное поражение кардиального отдела крайне сложно диагностируется, поэтому зачастую болезнь обнаруживается на последних этапах.
Классификация
Перед лечением важно идентифицировать тип опухоли, чтобы определить объем хирургического вмешательства. Классификация, ориентированная на анатомический центр новообразования, позволяет обнаружить заболевание в области кардии.
К первому типу относится поражение дистальной области пищевода, когда центр дефекта располагается в нескольких сантиметрах от линии разграничения эпителия трубки и желудка. Если это расстояние составляет один сантиметр и меньше, то диагностируется истинный рак кардии.
Субкардиальное новообразование определяется, когда центр формирования локализуется в 2-5 см аборально от границы эпителия. Анатомический центр опухоли выявляется во время проведения рентгенографии с контрастным веществом, фиброгастроскопии, компьютерной или магнитно-резонансной томографии.
Причины
Главная причина развития патологии – наличие гастроэзофагеальной рефлюксной болезни. Заболевание характеризуется патологическими забросами кислого содержимого желудка в пищевод с последующим раздражением стенок трубки. Если процесс не лечить, то тканевые структуры воспаляются, а эпителий заменяется, вызывая предраковое состояние.
Неправильное питание также часто приводит к раку кардиального отдела желудка. Жители северных стран чаще страдают этой болезнью, так как употребляют больше горячей пищи.
Употребление острых приправ, чеснока, лука, копченостей, консервации, жареных и соленых блюд тоже увеличивает риск. Если между приемами еды слишком большие промежутки, то вероятность развития заболевания существенно возрастает.
Еще одной причиной считается курение, злоупотребление спиртными напитками. Наследственная предрасположенность тоже сильно воздействует на риск появления кардиоэзофагеального рака.
Симптомы
Кардиальная карцинома вызывает следующие клинические признаки:
- Болевой синдром в эпигастрии.
- Спазмы после приема пищи.
- Ночные болевые ощущения.
- Частую изжогу.
- Отрыжку с неприятным привкусом.
- Тошноту, рвоту с кровянистыми выделениями.
- Потерю аппетита.
- Ощущение тяжести в желудке.
Почерневший стул сигнализирует о кровотечении, которое способно привести к хронической железодефицитной анемии. Еще при раковой опухоли пациент резко теряет вес.
Диагностика
Благодаря диагностическим процедурам удается выявить локализацию формирования, размеры, степень запущенности, наличие метастазирования. Все это позволяет определиться с тактикой лечения, установить прогноз.
В первую очередь нужно сдать общий анализ крови для оценки уровня гемоглобина. Если данный показатель ниже нормы, то существует анемия из-за кровотечений.
Исследование крови на онкомаркеры позволяет оценить активность развития заболевания. В качестве инструментального метода диагностики проводят эзофагогастродуоденоскопию для визуального осмотра органов пищеварения. Ультразвуковое изучение брюшной полости поможет оценить состояние желудочно-кишечного тракта.
Если при гастроскопии была обнаружена опухоль, то во время манипуляции выполняют биопсию. Гистологическое обследование взятого биологического материала определит характер, тип новообразования, степень увеличения.
Еще выполняют рентгенографию с применением контрастного вещества для оценки состояния пищевода, обнаружения разросшихся тканевых структур. Суточная pH-метрия обнаруживает патологии верхних отделов желудочно-кишечного тракта, которые часто со временем приводят к развитию рака.
С помощью манометрии оценивается функциональность сфинктера, который должен предотвращать рефлюкс желудочного содержимого в пищеварительный канал. Компьютерная или магнитно-резонансная томография позволит определить границы новообразования, выявит метастазы. Сцинтиграфия покажет поражение раковыми клетками костной ткани.
Лечение
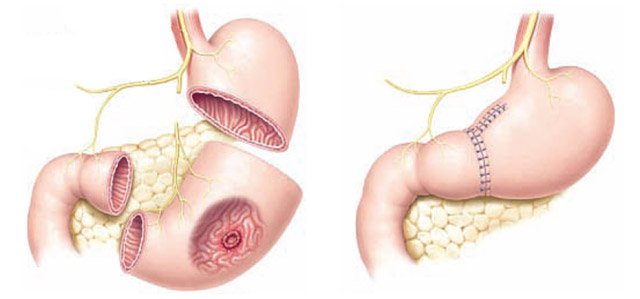
Комбинированный кардиоэзофагеальный рак лечится намного труднее. Вариант терапии подбирается в зависимости от стадии патологии, степени поражения тканевых структур. Основным методом лечения считается хирургическое вмешательство.
Во время операции желудок удаляется частично или полностью вместе с пораженным участком пищевода. При полной резекции остаток пищеварительного канала соединяется с тонким или толстым кишечником. Если удаляется значительная часть пищевода, выполняют пластику с применением области кишки.
На последнем этапе операция уже неэффективна. В этом случае пациент вынужден принимать спазмолитики, поддерживающие медикаменты. Лучевое облучение назначается и до резекции, и после нее.
М.И. Давыдов, М.Д. Тер-Ованесов, И.С. Стилиди, А.Н. Абдихакимов
Российский онкологический научный центр им. Н.Н. Блохина РАМН, Москва
Несмотря на стойкое снижение показателей заболеваемости раком желудка в целом, популяционные исследования показывают стойкое увеличение частоты опухолей проксимальной локализации и пищеводно-желудочного перехода. В США, например, частота аденокарциномы проксимального отдела желудка и дистальной трети пищевода увеличивается так интенсивно, как ни одно другое злокачественное заболевание 1.
В России рак желудка стабильно занимает второе место в структуре онкологических заболеваний (15,8 % у мужчин и 12,4 % у женщин) 2.
Большинство исследователей характеризуют рак проксимального отдела желудка с распространением на пищевод как опухоль высоко злокачественную, склонную к быстрому росту с переходом инфильтрации на пищевод и высоким индексом лимфогенного метастазирования в лимфатические узлы как брюшной полости, так и средостения. На момент хирургического лечения лимфогенные метастазы выявляются в 80% наблюдений 3. Исследования, выполненные различными авторами с проведением многофакторного анализа, позволяют отметить, что наиболее значимыми факторами прогноза является наличие метастатического поражения лимфатических узлов в сочетании с характером выполненного вмешательства R0 4. По данным Holscher и соавторов (1995) 5, фактор выполнения радикального вмешательства без оставления резидуальной опухоли R0 с достаточной очевидностью свидетельствует о его прогностическом значении применительно к отдаленным результатам лечения. Причем если выполнение радикального вмешательства R0 при раке кардии позволяет достичь 5-летней выживаемости 41,4%, то оставление даже микроскопической резидуальной опухоли R1 (клетки или комплексы клеток по линии резекции) не позволяет надеяться на благоприятный исход лечения: все пациенты погибают в первые два года. Накопленный в мире опыт позволяет отметить, что на сегодняшний день методом выбора в лечении рака проксимального отдела желудка остается хирургический.
Несмотря на достаточный мировой опыт хирургического лечения рака кардио-эзофагеального перехода, до сих пор остается множество нерешенных задач. Одной из наиболее важных является адекватная классификация местной распространенности опухоли с учетом особенностей лимфооттока. На сегодняшний день лимфатические коллекторы средостения, даже локализованные в области нижней трети пищевода (нижние периэзофагеальные лимфоузлы ?110) и зачастую непосредственно прилежащие к опухолевому компоненту в пищеводе, классифицируются как отдаленные (M1 Lym). Это, в свою очередь, сдерживает развитие такого крайне важного компонента адекватной онкохирургии кардио-эзофагеального рака как расширенная медиастинальная лимфодиссекция 6. Анализ литературных данных свидетельствует о том, что вопрос об объеме и технике выполнения медиастинальной лимфодиссекции при раке проксимального отдела желудка освещен недостаточно и требует стандартизации по аналогии с классификацией абдоминальной лимфодиссекцией D0-D3 7.
Основу настоящего исследования составляет анализ результатов лечения 1209 больных раком проксимального отдела желудка, находившихся в отделении торако-абдоминальной онкологии РОНЦ РАМН с января 1975 года по декабрь 1996 года включительно.
Пик заболеваемости пришелся на возрастной интервал от 50 до 70 лет (75,7% наблюдений). Среди пациентов отмечалось абсолютное преобладание мужчин (79,0%). Соотношение мужчин и женщин — 4:1.
В связи с преобладанием лиц среднего и пожилого возраста у 878 пациентов (72,6%) имели место различные сопутствующие заболевания. Из 1209 больных 956 (79,1%) пациентам были выполнены резекции, тогда как в 253 (20,9%) случаях — пробные и паллиативные вмешательства. Проксимальные субтотальные резекции желудка и пищевода составили 54,2% (542 операции), тогда как в 42,4% (405 операций) были выполнены чресплевральные гастрэктомии с резекцией пищевода. В 3,4% случаев (32 операции) в связи с высоким переходом рака проксимального отдела желудка на пищевод были выполнены операции субтотальной резекции пищевода из правостороннего трансторакального доступа (типа Ivor-Lewis), а в одном наблюдении — операция Торека. В группе больных (253), которым выполнены паллиативные и пробные операции, первые составили 26,9%, вторые — 73,1%.
Анализ интрамуральной распространенности опухолевого процесса позволяет отметить, что у 84,4% оперированных больных опухоль распространялась на пищевод, у 8,6% — только на кардию, и лишь у 7,0% больных опухоль локализовалась в пределах желудка. У 53,0% опухолевая инфильтрация распространялась на верхнюю треть тела желудка.
Морфологическое исследование удаленных препаратов позволяет отметить, что в абсолютном большинстве наблюдений опухоли характеризовались инфильтративным характером роста (Бормманн-III, IV — до 80,3% случаев), что в большинстве наблюдений сочеталось с выраженным структурным и клеточным атипизмом (SAT, CAT-2, 3).
Распределение больных по стадиям заболевания показало (UICC, 1992), что среди резектабельных преобладали пациенты с III и IV стадиями заболевания — 73,3%.
Общий показатель частоты поражения лимфатических узлов I и II этапов метастазирования составил 65,7%. Этот показатель существенно отличался у больных с локализацией опухоли лишь в кардиальном отделе от тех, у которых опухоль распространялась на тело — 60,9+2,2% и 72,3+2,2% соответственно(t=3,4; p

Рак пищевода 3 и 4 стадии выявляется наиболее часто — примерно у 80-90% пациентов со злокачественными опухолями данной локализации. Объяснить этот факт можно тем, что именно на этой стадии развивается выраженная симптоматика, которая заставляет человека обратиться за медицинской помощью. Вместе с тем, провести эффективное лечение бывает затруднительно ввиду распространения опухоли на отдаленные органы.
- Причина рака пищевода
- Как проявляется рак пищевода 3 стадии
- Диагностика рака пищевода
- Лечение пациентов с 3 стадией рака пищевода
Причина рака пищевода
Ведущую роль в развитии рака пищевода играют особенности питания и образ жизни человека, в частности, вредные привычки (злоупотребление алкоголем, табакокурение). Ученые выяснили, что вероятность развития злокачественных опухолей пищевода увеличивается при регулярном употреблении чрезмерно горячей или холодной пищи, а также тех продуктов питания, которые являются жесткими и могут травмировать пищевод. Среди других причин, которые могут увеличить риск развития заболевания, отмечаются:
- Синдром Пламмера-Винсона. Это редкое заболевание, которое характерно для женщин и развивается в результате недостаточного содержания в пище железа, витаминнов группы В и аскорбиновой кислоты. Около 10% пациентов, у которых выявляется синдром Пламмера-Винсона, в итоге заболевают раком пищевода.
- Стриктуры пищевода, которые развиваются в результате ожогов горячими жидкостями или химическими веществами.
- Ахалазия пищевода. Данное заболевание проявляется нарушением двигательной активности и, как следствие, затрудненным продвижением пищи. У пациентов, которые не обращаются за медицинской помощи, вероятность развития рака пищевода приближается к 5%.
- Пищевод Барретта. При этой болезни отмечается изменение эпителия пищевода, что увеличивает риск развития злокачественных опухолей.
Кроме того, рак пищевода может развиваться из доброкачественных новообразований, например, полипов. По этой причине специалисты советуют своевременно удалять их, даже если они никак не беспокоят пациента.
Как проявляется рак пищевода 3 стадии
Симптомы опухоли на данной стадии можно разделить на три основные группы. К первой группе относятся первичные или местные проявления, которые развиваются в результате поражения опухолевым процессом стенок пищевода. Среди таких симптомов отмечаются:
- Нарушение глотания (дисфагия).
- Боль в грудной клетке в области грудины.
- Обильное слюноотделение.
- Срыгивание пищей.
Вторая группа симптомов рака пищевода 3 стадии связана с распространением первичного опухолевого очага за пределы стенок пищевода. В зависимости от поражения тех или иных органов, могут отмечаться такие признаки, как охриплость голоса, эндофтальм, замедление частоты сердечных сокращений, увеличение лимфатических узлов, одышка, кашель и др. При метастазировании рака пищевода, могут поражаться печень, легкие, кости, головной мозг, что приводит к появлению дополнительных симптомов.
В третью группу входят общие признаки, характерные для любых онкологических заболеваний на поздних стадиях. К ним относятся выраженное истощение организма, общая слабость, анемия, повышенная температура тела, быстрая утомляемость.
Диагностика рака пищевода
- Нарушение глотания любой степени выраженности.
- Боль или неприятные ощущения в области пищевода при приеме пищи.
- Ощущение продвижения пищи по пищеводу.
- Рвота пищей, особенно с примесью крови.
- Появление осиплости голоса без видимых на то причин.
- Выраженный кашель после приема жидкостей.
При выявлении таких симптомов назначается комплексное обследование, которое поможет подтвердить диагноз, определить точную стадию и назначить необходимое лечение. Среди инструментальных и лабораторных методов диагностики наиболее часто назначаются:
- Рентген пищевода с контрастом. Помогает определить локализацию и размеры опухоли, а также выявить свищи, при их наличии.
- Компьютерная томография и позитронно-эмиссионная томография. Применяются для оценки состояния регионарных лимфоузлов и отдаленных органов, что важно для определения точной стадии опухолевого процесса.
- Эзофагоскопия. Этот эндоскопический метод диагностики является одним из самых важных, так как именно он позволяет получить объективную информацию об особенностях роста рака пищевода, определить точный очаг поражения и выполнить биопсию.
В зависимости от клинической картины, врач может назначить и другие методы исследования. Например, при подозрении на прорастание рака пищевода в бронхи или трахею, показана бронхоскопия, которая поможет подтвердить или опровергнуть предположения специалиста.
Отдельное внимание уделяется лабораторным методам диагностики. Общеклинические исследования, определение уровня онкомаркеров, иммуногистохимические тесты позволяют спланировать лечение и в дальнейшем отслеживать динамику и оценивать эффективность выбранной тактики.
Определение стадии рака пищевода зависит от размеров опухоли, особенностей ее роста, наличия или отсутствия метастазов. 3 стадия ставится в том случае, если размер первичной опухоли составляет 5 см или менее, она прорастает все слои пищевода и выходит за его пределы в окружающую жировую клетчатку. При этом отмечается выраженное сужение просвета пищевода и множественные метастазы в регионарные лимфатические узлы.
Лечение пациентов с 3 стадией рака пищевода
Лечение пациентов на последних стадиях любых видов рака является актуальной и очень сложной задачей для современной онкологии. Наиболее эффективными считаются радикальные методы — хирургическое вмешательство в сочетании с химио- или лучевой терапией либо без них. Чаще всего, такое лечение проводят на 1-2 стадии, которые выявляются лишь у 10-15% пациентов. Операция может применяться и при распространенном опухолевом процессе, но лишь у ограниченного числа пациентов. Ее суть заключается в удалении пораженных лимфоузлов и резекции части пищевода с последующей пластикой.
Отдельно выделяют паллиативные операции, которые направлены на восстановление просвета пищевода, удаление большей части опухоли и улучшение общего состояния пациента, что особенно актуально на 4 стадии болезни.
Консервативное лечение на 3 стадии заключается в назначении химиотерапии и лучевой терапии. Иногда данные методы комбинируют друг с другом. Такое лечение позволяет уменьшить размеры опухоли, затормозить прогрессирование рака пищевода и увеличить продолжительность жизни. В некоторых случаях размер первичного очага уменьшается настолько, что становится возможным провести хирургическое лечение. В этом случае прогноз для пациента будет более оптимистичным.
Пятилетняя выживаемость при раке пищевода зависит от стадии заболевания. своевременное выявление рака пищевода на 1 стадии с последующим хирургическим лечением позволяет добиться показателя в 50-80%. Если болезнь диагностируется на 2 стадии, то выживаемость уменьшается до 30%, а на 3 стадии — до 10-15%. Средняя продолжительность жизни пациентов, у которых опухолевый процесс достиг 4 стадии не превышает одного года.
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
1.1. Определение категорий T, N, M
Для определения стадии рака пищевода (РП) используется классификация TNM (UICC, 8-е издание). При определении стадии РП в классификациях UICC и AJCC используются идентичные критерии TNM (табл. 1).
Патоморфологические категории pT, pN и pM соответствуют клиническим характеристикам cT, cN и cM.
Опухоль пищеводно-желудочного перехода, эпицентр которой находится непосредственно на уровне зубчатой линии (1 см выше и 2 см ниже) или в пределах 5 см ниже с распространением на пищевод, классифицируется как рак пищевода.
Таблица 1. Система стадирования рака пищевода по TNM (UICC, 8-е издание)
Первичная опухоль не может быть оценена
Нет признаков первичной опухоли
Карцинома in situ/дисплазия высокой степени
Прорастание опухоли в собственную пластинку или подслизистый слой
Опухоль вовлекает собственную пластинку или мышечную пластинку слизистой оболочки
Опухоль прорастает подслизистый слой
Прорастание мышечного слоя
Прорастание прилегающих структур
Плевра, брюшина, перикард, диафрагма, вена azygos
Прилежащие анатомические структуры: аорта, позвонки или трахея
Регионарные лимфатические узлы
Регионарные лимфатические узлы не могут быть оценены
Нет метастазов в регионарных лимфатических узлах
Поражение 1-2 регионарных лимфатических узлов
Поражение 3-6 регионарных лимфатических узлов
Поражение 7 и более регионарных лимфатических узлов
Отдалённых метастазов нет
Отдалённые метастазы есть
1.2. Регионарные лимфатические узлы
Регионарными являются следующие группы лимфатических узлов:
• верхние и нижние шейные;
• лимфатические узлы корня лёгкого (билатеральные);
• верхние параэзофагеальные (выше v. azygos);
• нижние параэзофагеальные (ниже v. azygos);
• перигастральные (правые и левые кардиальные, лимфатические узлы вдоль малой кривизны, вдоль большой кривизны, супрапилорические, инфрапилорические, лимфатические узлы вдоль левой желудочной артерии).
Категория pN0 может быть установлена только после лимфодиссекции с патоморфологическим изучением не менее 7 удалённых лимфоузлов (при отсутствии в них метастазов).
1.3. Степень дифференцировки опухоли
Выделяют следующие степени дифференцировки при РП:
• GX — степень дифференцировки опухоли не может быть определена;
• G1 — высокодифференцированная опухоль;
• G2 — умеренно дифференцированная опухоль;
• G3 — низкодифференцированная опухоль;
• G4 — недифференцированная опухоль.
1.4. Отделы пищевода
При оценке локализации верхнего полюса опухоли при помощи ЭГДС используется следующее деление пищевода в зависимости от расстояния от резцов:
• шейный отдел — 2
750 мг/м 2 /сут.
1-й день
с 1-го по 4-й дни
(96-часовая инфузия)
1-й день
1-й день
25 мг/м 2
25 мг/м 2
1-й день
1-й день
Периоперационная химиотерапия при аденокарциномах нижне-грудного отдела пищевода и пищеводно-желудочного перехода
75 мг/м 2
750 мг/м 2 /сут.
с 1-го по 5-й дни (120-часо-
вая инфузия)
75 мг/м 2
2000 мг/м 2 /сут.
с 1-го по 14-й дни
75 мг/м 2
75 мг/м 2
750 мг/м 2 /сут.
1-й день
1-й день
с 1 -го по 5-й дни (120-часовая
инфузия)
Доцетаксел
Оксалиплатин
Кальция фолинат
5-фторурацил
50 мг/м 2
85 мг/м 2
200 мг/м 2
2600 мг/м 2
1-й день
1-й день
1-й день
1 -й день, 24-часовая инфузия
Режимы паллиативной химиотерапии
75мг/м 2
750 мг/м 2 /сут.
с 1-го по 5-й дни (120-часо-
вая инфузия)
1-й день
1-й день
1-й день
с 1-го по14-й дни
130 мг/м 2
2000 мг / м 2 / сут.
1-й день
1-й-14-й дни
75 мг/м 2
75 мг/м 2
750 мг/м 2 /сут.
1-й день
1-й день
с 1 -го по 5-й дни (120-часовая
инфузия)
Доцетаксел
Оксалиплатин
Кальция фолинат
5-фторурацил
50 мг/м 2
85 мг/м 2
200 мг/м 2
2600 мг/м 2
1-й день
1-й день
1-й день
1 -й день, 24-часовая инфузия
3.4. Клиническая стадия IV (M1, за исключением надключичных лимфоузлов)
Основными задачами лечения больных метастатическим РП являются улучшение качества жизни путём устранения симптомов, обусловленных ростом опухоли, и увеличение продолжительности жизни. Оценка эффективности различных режимов ХТ у этой категории больных затруднена в связи с отсутствием рандомизированных исследований, особенно при плоскоклеточном раке. По этой же причине сложно оценить и тот выигрыш, который даёт ХТ по сравнению с симптоматической терапией. Химиотерапия рекомендуется
пациентам в удовлетворительном общем состоянии (по шкале ECOG 0-2 балла) при отсутствии выраженной (III-IV степени) дисфагии, затрудняющей адекватное питание пациента. В последнем случае на первом этапе показано восстановление проходимости пищевода (стентирование, реканализация).
При дисфагии I-II степени ХТ позволяет добиться уменьшения степени её выраженности у ряда больных уже к концу первого курса.
Наиболее эффективными препаратами при обоих гистологических вариантах являются цисплатин, фторпиримидины, таксаны. При аденокарциномах также эффективны оксалиплатин, иринотекан, трастузумаб (при гиперэкспрессии HER2).
Лечение IV стадии аденокарцином пищевода и пищеводно-желудочного перехода проводится по принципам лечения рака желудка (см. соответствующую главу).
При плоскоклеточных раках стандартным режимом ХТ остаётся комбинация цисплатина с инфузией 5-фторурацила или капецитабином,частота объективных эффектов при использовании подобных режимов составляется около 35%, а продолжительность жизни не превышает 6-8 мес. Карбоплатин уступает цисплатину по непосредственной эффективности, что ограничивает его применение вне программ ХЛТ.
Применение таксанов возможно в составе двухкомпонентных схем с цисплатином или трёхкомпонентных комбинаций (с цисплатином и фторпиримидинами). В последнем случае ценой большей токсичности удаётся повысить объективный эффект до 48%, однако к удлинению продолжительности жизни это, по-видимому, не приводит.
Оптимальная продолжительность ХТ первой линии неизвестна. При стабилизации процесса на фоне ХТ обычно проводится 4 курса, в случае достижения объективного эффекта — 6 курсов. Стандартной ХТ второй линии не существует.
Её проведение возможно лишь у отдельных пациентов в общем удовлетворительном состоянии, отвечавших на ранее проводимую ХТ. Возможными вариантами являются монотерапия таксанами, гефитиниб. Рекомендуемые
режимы паллиативной ХТ представлены в табл. 4.
3.5. Паллиативное лечение
Наиболее частым симптомом РП является дисфагия. Необходимость в её устранении может возникать на всех этапах лечения и достигается различными методами: эндоскопическими процедурами (баллонная дилатация, электро-,аргонно-плазменная или лазерная деструкция, ФДТ), лучевой терапией (дистанционная или брахитерапия), постановкой внутрипросветных стентов. Эндоскопические процедуры дают быстрый, но кратковременный эффект и подходят в тех случаях, когда в ближайшее время будет начато лечение с предполагаемой высокой эффективностью (хирургическое, лекарственное, лучевое).
В том случаях, когда излечение больного невозможно, оптимальными вариантами коррекции дисфагии является брахитерапия, стентирование пищевода или дистанционная ЛТ. Паллиативная ХЛТ не имеет явных преимуществ по сравнению с ЛТ (без ХТ) и сопряжена с большей токсичностью. По результатам исследования стентирование пищевода позволяет быстрее достичь желаемых эффектов, однако при большем сроке наблюдения в сравнении с брахитерапией частота осложнений (миграция стента, боли, перфорация, желудочно-пищеводный рефлюкс) оказалась выше, а частота полного купирования дисфагии — несколько ниже. При развитии пищеводно-бронхиальных или медиастинальных свищей постановка покрытых стентов позволяет купировать данные осложнения у 70-100% больных.
Активное наблюдение показано больным для раннего выявления рецидива в пищеводе с целью последующего выполнения хирургического вмешательства, либо рецидива в средостении с целью проведения ХЛТ.
• Стадия I (после эндоскопических резекций слизистого/подслизистого слоя) и стадия II-III (после ХЛТ, кандидаты для эзофагэктомии в случае рецидива): ЭГДС — каждые 3-4 мес. в течение первых двух лет, каждые 6 мес. — в течение третьего года, далее ежегодно до общей продолжительности наблюдения 5 лет. КТ органов грудной клетки и органов брюшной полости — каждые 6 мес. в течение первых 2 лет, далее — ежегодно до общей продолжительности наблюдения 5 лет.
• Стадия I-III (после хирургического лечения): КТ органов грудной клетки и органов брюшной полости — каждые 6 мес. в течение первых 2 лет, далее — ежегодно до общей продолжительности 5 лет.
Другие методы обследований у остальных категорий пациентов рекомендуется выполнять при наличии клинических показаний.
Выполнение ПЭТ-КТ и определение маркёров в сыворотке крови для наблюдения за пациентами не рекомендуется.
Коллектив авторов: Трякин А.А., Бесова Н. С., Волков Н. М., Гладков О.А., Давыдов М. М.,
Кононец П. В., Левченко Е. В., Ткачев С. И.
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Стадии рака желудка не просто ранжирование болезни по распространению в организме, предусматривающее определённую тактику лечения, это даже больше чем прогноз на будущее. Стадия изменяет всю жизнь больного и его семьи, определяя новую модель жизни.
Между тем, обнаруженный на раннем этапе развития рак — хроническое заболевание, дающее человеку десятилетия жизни. Каждому второму пережившему лечение раннего рака желудка пациенту предстоит умереть от сердечно-сосудистого заболевания без каких-либо признаков злокачественного процесса.
Рак желудка 1 стадия
Первая стадия — это ранний рак, когда опухоль не нарушила границы слизистой оболочки, но по протяжённости может быть несколько сантиметров, главное — раковые клетки не распространились в глубину желудочной стенки.
Возможны варианты распространения:
Операция позволяет практически 95% пациентов жить дальше без каких-либо опасений и, что важно, в большинстве случаев нет необходимости в послеоперационной профилактической химиотерапии.
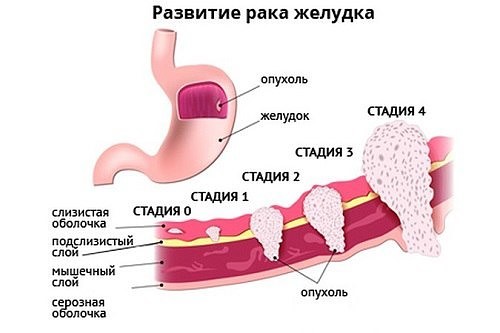
Рак желудка 2 стадия
Российская онкологическая статистика больных I и II стадий учитывает вместе, и по факту это каждый третий вновь выявленный пациент. Только при второй стадии пятилетку благополучно проживает всего 75% больных, а не более 90% как при первой.
На этом этапе заболевания большинству пациентов выполняется большая, но не обширная операция — резекция в разных модификациях, то есть удаление части органа вместе с лимфатическими узлами, кому-то потребуется полное удаление — гастрэктомия.

- при T4a возможно только N0;
- при Т1 допускается N2 и N3;
- при Т2 только N1 или N2;
- при Т3 исключительно N0 или N1.
Стадия злокачественного процесса не просто цифра для статистики, правильно установленная степень распространения гарантирует выбор оптимальной программы лечения заболевания. Правильно стадировать новообразование позволяет качественное обследование, невозможное без профессионального подхода и личного опыта специалиста.
Рак желудка 3 стадия
У каждого четвёртого пациента заболевание обнаруживают на третьей стадии, когда не во всех случаях на первом этапе возможна операция, потому что опухоль большая и поражённых метастазами лимфоузлов может быть больше 16.
Для третьей стадии характерно ранжирование по трём вариантам:
- прорастающий наружу через серозную оболочку органа процесс, но без вовлечения соседних органов, с единичным или множественным поражением лимфатического коллектора — подтип А;
- опухоль распространяется на соседние структуры и пораженных лимфоузлов не более двух, либо раковая инфильтрация в границах желудочной стенки и увеличенных лимфоузлов более трёх — подтип В;
- выходящее за пределы желудочной стенки с метастазами в большое число лимфоузлов новообразование — подтип С.
Возможность выполнения операции зависит от вовлеченности в раковый конгломерат соседних органов и сосудисто-нервных пучков. Для большинства пациентов программа лечения расширяется на химиотерапию, как до операции, так и после. Если хирургия невозможна из-за слишком большого распространения в брюшной полости, прибегают к лучевой терапии на фоне циклов ХТ.
Рак желудка 4 стадии
Четвёртая всегда означает, что есть метастазы в другие органы или по брюшине, а опухоль может быть любого размера и неважно количество поражённых злокачественными клетками лимфоузлов.
Вероятность обнаружения метастазов тем выше, чем агрессивнее процесс. Злокачественность низкодифференцированной аденокарциномы много выше, чем высокой или умеренной дифференцировки. Поэтому четвёртая стадия возможна при крошечном желудочном новообразовании низкой дифференцировки.
Симптомы рака желудка при разных стадиях
В России неразрешима проблема высокой смертности больных в течение года с момента выявления опухоли, сегодня меньше года живут почти 49% или каждый второй, а причина одна — несвоевременное обращение. Не приходят на обследование из-за того, что признаки болезни совсем не очевидны и нетипичны для злокачественного процесса.

Онкологический пациент, как правило, замечает то, что невозможно игнорировать и свидетельствует о метастатическом процессе:
- обнаруживает увеличение живота за счёт асцита, когда перестаёт сходится пояс на юбке или ремень на брюках;
- находит выпирающее из-под ложечки плотное образование;
- замечает потерю веса, потому что идеально сидевшая одежда становится слишком большой.
У многих азиатских народов карцинома желудка — наследственная болезнь, но только японцам удалось справиться со смертностью от карциномы, потому что рак выявляют исключительно ранним при регулярной, иногда и по два раза на год, гастроскопии. Гражданине Японии считают своевременное выполнение гастроскопии своей обязанностью.
Нет типичных симптомов рака желудка, но есть способ контроля за состоянием слизистой, небрежение обследованием — путь к распространённой стадии заболевания. Сделайте обследование и полгода можете спать спокойно.
- Стойко Ю. М., Вербицкий В. Г., Карачун А. М. Рак желудка: Учебное пособие. — СПб.: ВМедА, 2002. — 26 с.
- В. С. Савельев, Н. А. Кузнецов. Хирургические болезни. Том 1. М., 2006.
- М. И. Кузин, Н. М. Кузин, О. С. Шкроб и др.; под редакцией М. И. Кузина. Хирургические болезни. М.: Медицина, 2002. — 784 с.
- С. С. Харнас, В. В. Левкин, Г. Х. Мусаев. Рак желудка: клиника, диагностика, лечение. М., 2006.
Читайте также:





