Рак периферической зоны предстательной железы
Рак простаты одно из самых распространенных онкологических заболеваний мужчин, которое занимает второе место по частоте встречаемости после рака легких. Несмотря на то, что рак предстательной железы медленно прогрессирует, он является причиной смерти многих тысяч мужчин. Так как это медленно прогрессирующая опухоль, раннее ее обнаружение и принятие соответствующих мер способствует увеличению продолжительности и качества жизни. После сорка пяти лет достаточно раз в год посещать уролога и сдавать необходимые анализы, чтобы контролировать свое здоровье. Это даст возможность в случае необходимости радикально вылечить заболевание без последствий для продолжительности жизни.
Где развивается рак простаты
Для того, чтобы понять особенности развития рака предстательной железы полезно представлять строение предстательной железы и ее зональную анатомию. Упрощенно ткань предстательной железы состоит из ацинусов (собственно железистой ткани), покрытых эпителием и фибромускулярной стромы, которая играет роль каркаса. Предстательная железа окружает мочеиспускательный канал и имеет верхушку и основание. К основанию предстательной железы примыкают семявыносящие протоки и семенные пузырьки. Семенные пузырьки посредством семявыбрасывающих протоков связаны с простатической частью мочеиспускательного канала, где они открываются в районе семенного холмика (verumontanum). Рак предстательной железы возникает только из железистой (ацинарной ткани). Для понятия закономерностей роста злокачественной опухоли используют деление предстательной железы на зоны, впервые описанные McNeal. Согласно этой схеме предстательная железа делится на переднюю фибромускулярную зону. Центральную зону, которая располагается в виде конуса, обращенного основанием кзади и сужающегося впереди, с вершиной в области семенного холмика. Центральная зона со всех сторон окружена периферической зоной, самой большой зоной предстательной железы. Внутри центральной зоны расположена переходная зона, которая занимает всего до 5% объема предтательной железы. Также простатическую часть мочеиспускательного канала окружают периуретральные железы. Периферическая часть простаты занимает около 70% ее объема, 25% приходится на центральную зону и 5% приходится на переходную зону. На схеме они обозначены: Периферическая зона – PZ, центральная зона – CZ, переходная зона – TZ. Рак простаты в 70% случаев возникает в периферической зоне, в 15-20% случаев возникает в центральной зоне и в 10-15% случаев в переходной зоне. Большинство случаев рака простаты имеет многоочаговую локализацию.
Почему развивается рак простаты
Рак предстательной железы возникает тогда, когда клетки железистой ткани начинают бесконтрольно делиться, приобретая новые свойства, которые ведут к прогрессированию опухоли и метастазам. Около 95% всех опухолей простаты по клеточному строению относятся к аденокарциноме. Около 4% опухолей простаты происходят из клеток, которые выстилают мочеиспускательный канал в простатической части. В настоящее время считается, что возникновению рака простаты способствуют генетические факторы, особенности питания, уровень тестостерона. В зависимости от того, в какой зоне происходит развитие рака предстательной железы наблюдаются характерные пути распространения опухоли. При происхождении опухоли из центральной зоны рак предстательной железы распространяется на шейку мочевого пузыря, при росте из периферической зоны рак простаты поражает семенные пузырьки, прорастает капсулу предстательной железы и дает отдаленные метастазы в кости, печень и легкие.
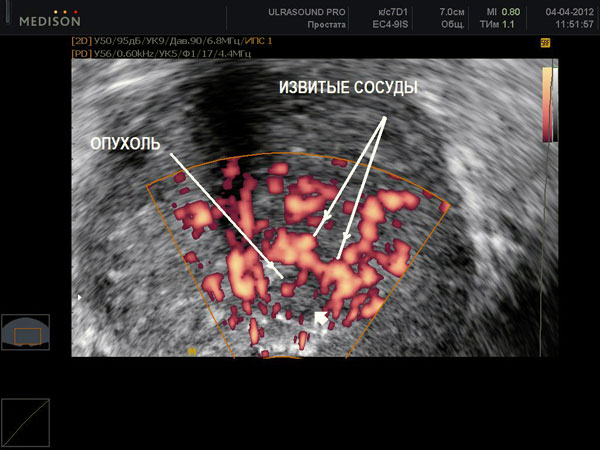
Признаки рака предстательной железы
У 47% мужчин рак простаты обнаруживается при отсутствии клинической симптоматики. В этих случаях рак был заподозрен при проведении теста на ПСА (простатоспецифический антиген) и пальцевом ректальном исследовании. Также бессимптомные формы рака были диагностированы при гистологическом исследовании тканей, после трансуретральной резекции (ТУР) предстательной железы или тотальной аденомэктомии, которые выполнялись по поводу аденомы предстательной железы. При ранних стадиях рак простаты больного могут беспокоить частые позывы к мочеиспусканию, ослабление напора струи мочи, болезненное мочеиспускание и кровь в моче. Эти симптомы неспецифичны и оцениваются в совокупности с другими данными.
На поздних стадиях рака предстательной железы при метастатическом поражении (метастазы это островки опухоли, разнесенные током крови и лимфы по отдаленным от первоначальной опухоли местам) могут возникать такие симптомы: потеря веса и аппетита, анемия, боль в костях, патологические переломы костей, боль в позвоночнике и признаки сдавления спинного мозга, отеки ног.
Диагностика рака простаты
Диагностика рака простаты состоит из трех пунктов:
- Пальцевое ректальное исследование, которое проводит врач–уролог через прямую кишку. Пальцем прощупывается поверхность предстательной железы, оценивается ее консистенция, симметричность и подвижность. При локализации опухоли в периферической зоне довольно часто можно определить подозрительные участки. Если же опухоль расположена в центральной зоне, то пальцем прощупать ее затруднительно.
- Измерение уровня ПСА. ПСА – простатоспецифический антиген. Его количество повышается при аденоме простаты, простатите, после секса, после массажа предстательной железы и зависит от размеров железы. При раке простаты уровень ПСА обычно резко повышен, хотя возможны случаи развития заболевания при нормальных значениях ПСА.
- Трансректальное узи предстательной железы (ТРУЗИ). Методика позволяющая визуализировать патологический очаг в предстательной железе. В сочетании с дуплексным сканированием сосудов простаты и эластографией обладает высокой точностью и специфичностью, не уступая КТ. При обычном ТРУЗИ (без эластографии и дуплексного сканирования) все-таки не во всех случаях можно достоверно диагностировать рак. Поэтому полагаться только на результаты узи предстательной железы нельзя.
Таким образом сочетание трех методик: определение ПСА, пальцевое ректальное исследование и ТРУЗИ обеспечивают диагностику большей части ранних случаев рака предстательной железы.
При получении данных о возможной раковой опухоли в предстательной железе производят биопсию подозрительного участка. Методика заключается в получении материала из двенадцати –восемнадцати проколов предстательной железы, которые совершаются под контролем УЗИ. Каждый прокол делают в определенной зоне. Затем материал, полученный при пункции (проколе) железы, рассматривают под микроскопом, отмечая опухолевые клетки.
Для диагностики метастазов используют КТ, МРТ и рентгенографию костей и легких. В последнее время широко используют эндоректальную КТ и ПЭТ (позитронно–эмиссионная томография) для диагностики распространения рака простаты на смежные ткани.
Лечение рака простаты
Лечение рака простаты зависит от возраста больного, стадии заболевания и наличия метастазов. Для локализованных форм рака предстательной железы применяют хирургическое лечение – радикальную простатэктомию, радиотерапию, криохирургическое лечение. Лечение распространенного рака предстательной железы имеет паллиативный характер, который борется с симптомами, облегчая самочувствие больного.
Читайте по теме:
В урологии мы работаем по таким направлениям как:
Медицинский эксперт статьи

В настоящее время оптимальный диагностический процесс раннего, а потому своевременная диагностика рака простаты включает пальцевое ректальное исследование, определение активности сывороточного ПСА и его дериватов.
УЗИ простаты (трансректальное, трансабдоминальное) и трансректальную мультифокальную биопсию простаты. Точное клиническое стадирование имеет важнейшее значение для выбора оптимальной тактики лечения больных раком простаты и позволяет определить вероятный его исход. Диагностические методы, помогающие в исследовании распространённости заболевания. пальцевое ректальное исследование, определение уровня ПСА и степени дифференцировки опухоли, лучевая диагностика рака простаты (рака предстательной железы) и тазовая лимфаденэктомия.

[1], [2], [3], [4], [5], [6], [7], [8]
Пальцевое ректальное исследование
Пальцевое ректальное исследование - базовая диагностическая методика при первичном обследовании больных аденомой простаты. Простота её использования сочетается с достаточно низкой точностью стадирования распространённости опухолевого процесса. Пальцевое ректальное исследование помогает выявить до 50,0% опухолей с экстракапсулярным ростом. Около половины случаев локализованных форм рака простаты по данным пальцевого ректального исследования, интраоперационно оказываются стадиями Т3 и даже Т4, что снижает ценность данной методики. Тем не менее простота и невысокая стоимость делают пальцевое ректальное исследование незаменимым, как при первичной диагностике, так и при последующем стадировании. особенно в комбинации с другими методами. Сывороточный простатоспецифический антиген ПСА - сериновая протеаза, которую вырабатывает почти исключительно эпителий простаты. Предельная нормативная величина ПСА составляет 4,0 нг/мл. Проведённые в последнее время исследования свидетельствуют о достаточно высокой частоте обнаружения клинически значимых случаев рака простаты (до 26,9%) при более низких значениях ПСА. В связи с этим большинство зарубежных авторов рекомендуют выполнять биопсию простаты при повышении уровня ПСА более 2 нг/мл.
Уровень ПСА в целом отражает распространённость и напрямую связан с патологической стадией и объёмом опухоли. Многие исследователи отмечают чёткую корреляцию показателей предоперационного уровня ПСА сыворотки крови с частотой экстракапсулярной экстензии. Показано, что значительный риск экстракапсулярной экстензии существует у пациентов с уровнем ПСА превышающим 10,0 нг/мл. У данной категории больных вероятность экстрапростатического распространения опухоли приблизительно в 2 раза выше по сравнению с теми, у кого ПСА менее 10,0 нг/мл. Кроме того, у 20% мужчин с уровнем ПСА более 20,0 нг/мл и у 75% с уровнем более 50 нг/мл присутствует поражение регионарных тазовых лимфатических узлов. Уровень ПСА, превышающий 50 нг/мл, ассоциирован с высоким риском диссеминированного процесса, а более 100 нг/мл всегда указывает на отдалённые метастазы.
В связи с тем. что уровень ПСА зависит от ряда сопутствующих заболеваний железы (простатит, аденома) и степени дифференцировки опухоли, его необходимо оценивать в комплексе с другими показателями.
С целью повышения специфичности данной диагностики рака простаты (рака предстательной железы) предлагают различные ПСА-параметры (дериваты), из которых важное клиническое значение имеют: коэффициент свободного и общего ПСА (f/t-ПСА), уровень ежегодного роста ПСА, значение плотности ПСА простаты и переходной зоны, возрастные нормы и период удвоения уровня ПСА. Наибольшее клиническое значение представляет собой определение коэффициента соотношения свободного и связанного ПСА (f/t-ПСА). Если подобное соотношение не превышает 7-10%, речь идёт преимущественно о раке, в то время когда коэффициент достигает 25%, можно с уверенностью говорить об аденоме простаты. Плотность ПСА представляет отношение уровня сывороточного ПСА к объёму простаты. Значения рассчитанной величины, превышающие 0,15 нг/(млхсм 2 ), свидетельствуют в пользу рака простаты. Ежегодный прирост уровня ПСА при последовательных измерениях более 0.75 нг/мл также означает злокачественный процесс. Однако специфичность данного показателя достаточно низкая вследствие использования тест-систем с различной пороговой чувствительностью.
Применение последних достижений молекулярной биологии позволяет открывать и внедрять в клиническую практику новые опухолевые маркёры, имеющие более высокую чувствительность и специфичность по сравнению с ПСА. Среди возможных альтернатив можно выделить определение хепсина, NMP 48 и ряда других. Одним из наиболее перспективных биомаркёров считают ПСА3 (DD3), который можно определить в моче после пальцевого ректального исследования простаты. Чувствительность и специфичность этого метода составляет 74 и 91%, соответственно, что имеет особое значение в группе пациентов с ПСА ниже 4,0 нг/мл.

[9], [10], [11], [12], [13], [14], [15], [16]
Биопсия простаты
Биопсия простаты важный и необходимый этап в процессе диагностики рака простаты. Она не только обеспечивает гистологическую верификацию диагноза. но и позволяет оценить распространённость опухоли и её размеры, степень дифференцировки и характер роста. Эти данные оказывают решающее влияние на определение клинической стадии заболевания и прогноза у конкретного пациента, а также на выбор метода лечения.
Общепринятая в настоящее время методика - трансректальная мультифокальная биопсия под ультразвуковым контролем при помощи специальной тонкой автоматической иглы. Широко применяемую ранее аспирационную биопсию. позволявшую только подтвердить факт существования опухоли, но не дающую Достоверной информации о гистологической структуре, используют всё реже.
С внедрением в клиническую практику определения ПСА сыворотки крови показания для выполнения биопсии расширены.
- повышение уровня ПСА выше возрастной нормы: пороговым считают значен 4 нг/мл. но v пациентов моложе 50 лет эта граница снижена до 2,5 нг/мл;
- уплотнение, выявляемое в простате при пальцевом ректальном исследовании;
- гипоэхогенные очаги, выявляемые при ТРУЗИ;
- необходимость уточнения стадии заболевания и определения метода лечения при подтвержденном раке простаты при отсутствии адекватных данных (после ТУР, открытой аденомэктомии), а также во время наблюдении после лучевой терапии при подозрении на рецидив заболевания.
Противопоказаниями для биопсии могут быть выраженные геморроидальные узлы, затрудняющие проведение ультразвукового датчика в прямую кишку, проктит, тяжёлое общее состояние пациента, обострение инфекционных заболеваний, лихорадка, прием пациентом препаратов, снижающих свертываемость крови.
Основной технический принцип системное выполнение биопсии, т.е. столбики ткани берут не только из подозрительных участков, но и равномерно из всей периферической зоны. В настоящее время стандартной по-прежнему считают шестипольную (секстантную) схему биопсии, при которой в периферической зоне каждой доли простаты берут по три столбика ткани: из базальной, средней (между базисом и апексом) и апикальной частей железы. Столбики получают по биссектрисе угла между вертикалью и прямой, проходящей по краю простаты при поперечной плоскости сканирования. Дополнительные столбики берут из гипоэхогенных пли определяемых пальпаторно очагов.
В настоящее время более перспективна методика латерализации уколов. Забор столбика проводят по краю контура железы, обеспечивая максимальное представительство ткани периферической зоны в столбике. Все большее распространение в последние годы получают схемы с 8. 10. 12 уколами и более, подтвердившие свое преимущество, особенно при ПСА менее 10 нг мл и при объеме простаты более 50 см 2 . Для железы объемом менее 50 см 2 предложена методика веерной биопсии, при которой все шесть уколов выполняли в одной плоскости, проходившей через верхушку железы, что обеспечивало более полный захват ткани периферической зоны.
Биоптат из семенных пузырьков забирают при показателях ПСА выше 20 нг/мл, локализации опухоли в базальных отделах железы, ультразвуковых признаках инвазии.
При оценке полученного биопсийного материала следует учитывать не только присутствие аденокарциномы простаты, но и распространённость поражения (одна или обе доли железы, количество столбиков с опухолью и локализация в пределах доли, частота выявления опухолевой ткани или ее протяженность в каждом столбике), степень дифференцировки опухоли по шкале Глисона, вовлечённость капсулы железы, сосудистую и периневральную инвазию (как неблагоприятный прогностический признак), а также простатическую интраэпителиальную неоплазию, особенно высокой степени, которую считают предраковым состоянием.
Поскольку отсутствие в полученных при биопсии образцах ткани раковых клеток не служит гарантией отсутствия злокачественной опухоли, естественен вопрос о необходимости повторного выполнения биопсии. Показания для повторной биопсии:
- выявленная при первичной биопсии простатическая интраэпителиальная неоплазия высокой степени;
- тенденция к увеличению количества ПСА у пациента с первичной отрицательной биопсией, ежегодный прирост ПСА, превышающий 0,75 нг/мл;
- выявление у пациента с первичной отрицательной биопсией ранее не определяемых падьпаторных и/или ультразвуковых изменений;
- подозрения о нерадикальности лучевой терапии в процессе наблюдения пациентов;
- отсутствие достаточной информации об опухоли после первично выполненной аспирационной биопсии.
Техника повторной трансректальной мультифокальной биопсии простаты отличается от первичной биопсии необходимостью взятия столбиков ткани не только из периферической зоны железы, но и из транзиторной зоны, поскольку вероятность выявления там рака при первичной отрицательной биопсии из периферической зоны существенно возрастает. Таким образом, число биоптатов при повторной процедуре возрастает по сравнению с первой биопсией. Повторную процедуру выполняют через 3-6 мес после первой.
Наиболее распространённые осложнения трансректальной биопсии простаты макрогематурия, гемоспермия, ректальное кровотечение, вегетососудистые реакции. лихорадка, острая задержка мочеиспускания, повреждение мочевого пузыря и мочеиспускательного канала. Существует также вероятность развития абсцесса простаты, эпидидимита. Распространение опухолевых клеток по ходу иглы в ткани простаты не имеет на сегодняшний день доказанного клинического значения, как и возможная гематогенная диссеминация опухоли в результате биопсии.
Степень дифференцировки аденокарциномы также оказывает влияние на частоту экстракапсулярной экстензии. Вероятность обнаружения экстракапсулярной экстензии в операционном материале при сумме Глисона менее 7 составляет 3,7-16,0%, а при сумме 7 и более 32-56%. Точность предсказания экстапростатического распространении опухоли на основании уровня ПСА и суммы Глисона (особенно у пациентов с ПСА более 10 нг/мл и суммой Глисона более 7) значительно превышает результаты МРТ н составляет соответственно 89,7% и 63,3%.

[17], [18], [19], [20], [21], [22], [23], [24], [25]
Лучевая диагностика рака простаты (рака предстательной железы)
ТРУЗИ, КТ, МРТ используют в диагностике и предоперационном стадировании рака простаты с тремя целями: определение степени местного распространения процесса (гипоэхогенные очаги, экстракапсулярная экстензия и инвазия в семенные пузырьки), состояния регионарных лимфатических узлов и наличия отдалённых метастазов. Многие исследования показали отсутствие разницы в точности определения степени местного распространения рака простаты между МРТ и ТРУЗИ. Было показано, что чувствительность ТРУЗИ при исследовании наличия и локализации экстракапсулярной экстензии составляет всего 66,0%, а специфичность в диагностике рака простаты - 46,0%.
Внедрение в клиническую практику МРТ с эндоректальной катушкой позволило повысить чувствительность и специфичность метода в диагностике экстракапсулярной экстензии. Критерии отбора для таких групп:
- более 50.0% позитивных столбиков, полученных при биопсии простаты при уровне ПСА менее 4 нг/мл и сумме Глисона 7:
- уровень ПСА 4-10 нг/мл при сумме Глисона 5-7:
- уровень ПСА 10-20 нг/мл при сумме Глисона 2-7
Наличие и распространенность метастазов в кости четко отображают прогноз, а их раннее выявление предупреждает врача о возможных осложнениях. Наиболее чувствительный метол в выявлении метастазов в кости сцинтиграфия. По своей чувствительности она превосходит физикальное обследование, определение активности щелочной фосфатазы в сыворотке крови (в 70% наблюдений костные метастазы сопровождает повышение активности костной изоформы щелочной фосфатазы), рентгенографию. Вероятность обнаружения метастазов в кости при низком уровне ПСА мала, и в отсутствии жалоб при ПСА менее 20 нг/мл, высоко- и умеренно дифференцированных опухолях от сцинтиграфии можно отказаться. В тоже время при низкодифференцированных опухолях и прорастании капсулы остеосцинтиграфия показана независимо от уровня ПСА.
Тазовая лимфаденэктомия
Необходимо отметить, что предсказательная ценность вышеперечисленных показателей увеличивается при их суммарной оценке. Большой вклад в этой области был сделан А.В. Партином и соавт., которые, проанализировав результаты выполнения РПЭ у нескольких тысяч пациентов, создали номограммы (таблицы Партина), позволяющие предсказать вероятность локализованного РПЖ, экстракапсулярной экстензии, поражения лимфатических узлов и семенных пузырьков у пациентов. Эти таблицы были разработаны на основании сопоставления значений предоперационного уровня ПСА, суммы Глисона, данных, полученных при биопсии простаты, и патоморфологического заключения макропрепарата после операции данных.
Клинические проявления рака предстательной железы определяются степенью его распространенности. Согласно современным представлениям, существуют локально ограниченная, локально распространенная и диссеминированная формы. В соответствии с этим делением для локально ограниченной и локально распространенной форм могут быть характерны расстройства мочеиспускания — учащение и ослабление струи мочи, ложные позывы или чувство неполного опорожнения мочевого пузыря, императивные позывы.
Несмотря на дискутируемую вариабельность презентирующих симптомов рака предстательной железы их можно объединить в три группы:
- симптомы, обусловленные нарушением оттока мочи вследствие обструкции шейки мочевого пузыря;
- симптомы, характерные для локальной экстензии опухоли (гематурия, обструкция мочеточников, эпизоды поясничной боли);
- симптомы, зависящие от наличия метастазов (боль в тазовых костях, потеря веса).
Возникающие в переходной зоне раковые очаги, вследствие их непосредственной локализации вблизи уретры, сопровождаются выраженной обструктивной симптоматикой. Ее проявления более продолжительны, нежели ирритативные расстройства, хотя последние вызывают мучительные позывы. Более грозные симптомы присущи локально распространенной форме рака предстательной железы — гематурия, гемоспермия, болезненное мочеиспускание. Характерно появление постоянной боли в промежности, области внутренней поверхности бедер, иррадиация боли в яички.
Локально распространенный рак, прорастая капсулу предстательной железы, выходит за пределы органа. Пальцевым ректальным исследованием определяются достаточно плотные, деревянистой консистенции узлы, локализующиеся преимущественно по периферии боковых долей. Слизистая прямой кишки становится неподвижной, а сама железа теряет четкие границы. Прорастание в семенные пузырьки, что наблюдается довольно часто, сопровождается наличием плотного тяжа, уходящего вверх от простаты.
Вопросу о раннем распознавании рака предстательной железы придается особое значение, поскольку начальные стадии успешно лечатся несколькими методами. Как часто целенаправленные профилактические осмотры позволяют выявить данное заболевание? В 1998 г. большое Европейское исследование охватывало 10 тысяч мужчин в возрасте от 54 до 76 лет. Путем определения простатспецифического антигена, пальпации предстательной железы и траисректального ультразвука у 4,5% обнаружены раковые опухоли простаты.
Отмечено, что одно пальцевое исследование в группах практически здоровых мужчин старше 50 лет позволяет распознать рак в 2,5% случаев. Чувствительность этого метода повышается с титром простатспецифического антигена (ПСА): при значениях ниже 3 нг/мл положительное значение пальцевого исследования колеблется между 4 и 11 %, в то время как при значения ПСА выше 3 нг/мл оно достигает 83 %.
Немаловажен и тот факт, что при значениях ПСА менее 4 нг/мл опухоли, как правило, небольших размеров (0,24—0,83 куб см) и хорошо дифференцированы. Только у 16% мужчин с такого рода незначительными титрами простатспецифического антигена обнаруживаются прогрессирующие опухолевые стадии (Т2 и больше).
Пальцевое ректальное исследование как единственный скрининг-метод позволяет обнаружить только 60% случаев рака, а при значениях ПСА более 4 нг/мл этот процент повышается до 83%. В этой связи необходимо придавать особое значение профессиональному уровню исследующего — чем больше у него практического опыта, тем достовернее результаты пальцевого исследования.
Имеет значение и локализация опухолевых узлов.
В исследованиях последних лет особая роль придается различиям между опухолями переходной и периферической зон. Известно, что при гистологическом исследовании радикально удаленных предстательных желез приблизительно в 25% препаратов раковые узлы обнаруживаются и в переходной зоне, а в 7% случаев рак локализуется исключительно в переходной зоне. Однако до настоящего времени остается не ясным, обладают ли относительно раковой прогрессии опухоли переходной зоны одинаковым биологическим потенциалом, как и опухоли периферической зоны.
При радикальной простатэктомии обнаруживалось, что некоторые формы рака переходной зоны, несмотря на чрезвычайно большие размеры опухоли, достигающие 85 куб. см, и высокие уровни ПСА в сыворотке, не сопровождались лимфогенным метастазированием (Т. A. Stamey et al., 1993).
Между опухолями в обеих зонах простаты есть также и некоторые морфологические различия. В переходной зоне в раке часто выявляются клетки с бледной и чистой цитоплазмой и устанавливаются более низкие степени Глисона, причем 1 и 2 обнаруживаются почти исключительно в этой зоне (D.R. Greene et al., 1991).
Однако все клинические и морфологические различия нельзя объяснить только анатомической локализацией. D.J.Grignon и W.A.Sark (1994); D.R.Greene et al. (1994) обнаружили, что ненормальный состав ДНК встречается намного чаще при опухолях периферической зоны, особенно с объемами опухоли менее 1 куб. см. Многочисленные отклонения от нормы в хромосомах 7, 8, 10, 17 и X можно обнаружить при раке переходной зоны, но только в случаях с большими объемами опухолей при Глисоне 4 и 5 степеней.
D.J.Grignin и W.A.Sark (1994) установили значительно более высокую скорость клеточной пролиферации (5%) в опухолях переходной зоны, по сравнению с 1,6% — в периферической.
Диссеминированный, или метастазирующий, рак предстательной железы сопровождается болями в костях, патологическими переломами (остеосклеротические метастазы — 98%, остеолитические — 2%). Определяется лимфостаз, увеличение паховых лимфоузлов, может возникнуть параплегия.
Метастазы в половой член сопровождаются приапизмом. Инфильтрирующий рост раковой опухоли ведет к сдавлению мочеточников; вследствие прорастания устья возникает уретерогидронефроз. Причинами последнего может стать также сдавление просвета мочеточников увеличенными лимфоузлами либо массой растущей опухоли. Компрессия обоих мочеточников приводит к почечной недостаточности, уремии и кахексии. Подобные признаки характерны для системного метастазирования.

Рис. 30. Инфузионная урограмма у пациента с прогрессирующим раком предстательной железы. Отсутствие функции левой почки, уретерогидронефроз справа. Прорастание в мочевой пузырь
Экскреторная урография, выполнение которой становится обязательным при диссеминированиом раке простаты, дает возможность выявить изменения в различных органах.
- Скелет — костные метастазы либо остеомаляция в результате почечной недостаточности или вторичного паратиреоидоза.
- Почки — гидронефроз (односторонний либо двусторонний), отсутствие функции одной из почек.
- Мочеточники — выраженная эктазия с коленообразными изгибами, уретерогидронефроз, вплоть до полного отсутствия функции одной почки вследствие сдавления увеличенными лимфоузлами, ограниченная дистальная обструкция из-за тех же условий прорастания (рис. 30).
- Мочевой пузырь — камни, трабекулярность, дивертикулы, наличие остаточной мочи.
Течение
Течение рака предстательной железы отличается разнообразием и непредсказуемостью проявлений, поскольку канцерогенез представляется сложным многоэтапным процессом, в котором происходят молекулярные, клеточные и гистологические изменения. Помимо развития первично-агрессивных форм, описана конверсия доброкачественных эпителиальных желез через этап предраковых заболеваний в инвазивный рак.
Высокой степенью агрессивности сопровождается течение заболевания в молодом возрасте, характеризуясь бурным ростом, инвазией в мочевой пузырь и семенные пузырьки, сдавливанием мочеточников с выраженным нарушением уродинамики. Нередко у больных отмечаются эпизоды острой и хронической задержки мочи, а рост опухоли в направлении прямой кишки приводит к затрудненному акту дефекации. У этих больных рано появляются метастазы в костях скелета и быстро нарастают признаки почечной недостаточности.
При пальцевом ректальном исследовании деревянистой консистенции бугристое образование имеет четкий ограниченный контур, нет инфильтрации по окружности. Больного абсолютно ничего не беспокоит. Подобные находки благоприятного многолетнего течения рака предстательной железы отмечались многими авторами и ранее. Так, J.E.Johansson et al. (1991) наблюдали вполне благоприятные 7- и 10-летние результаты лечения прогрессирующего рака простаты только одной орхиэктомией. Столь разнородные или гетерогенные группы больных раком предстательной железы обусловливают и необходимость разработки не менее дифференцированных лечебных подходов.
Нельзя забывать и о сочетании доброкачественной гиперплазии и рака предстательной железы. Столь близкие по патогенезу развития эти заболевания взаимозависимы.
Рак предстательной железы, как правило, сопровождается и одновременным гистологическим ростом гиперплазии.
Нередко (до 15% случаев) рак становится находкой в удаленном препарате доброкачественной гиперплазии по получении результатов морфологического заключения, и оперирующему хирургу ничего не остается делать, как взяться за стадирование и лечение этого рака.
Редко рак предстательной железы развивается без сопутствующей гиперплазии. Известен и такой факт: чем больше гиперплазия, тем чаще имеющийся рак растет в капсулу, тем агрессивнее ведет себя опухоль (высокий простатспецифический антиген, высокая шкала Глисона). Согласно анатомическим особенностям зонального строения предстательной железы, рак развивается при наличии гиперплазии, также в периферической зоне и обнаруживается в среднем в 8,6—16,2% случаев (рис. 31).

Рис. 31. Схематическое изображение сочетания аденомы и рака предстательной железы
Считается, что большинство случаев рака возникают в гиперплазированной простате (83,3%), но локализуются они преимущественно в периферической зоне (D. F. Botswick et al., 1992). Такое сочетание имеет и чисто практическое значение, поскольку растущая из переходной зоны гиперплазия сжимает и смещает периферическую зону. Этим объясняется более сложное получение образцов биопсии у пациентов с большими объемами гиперплазии предстательной железы.
Отмечена и такая закономерность: рак простаты выявляется у 31—51% пациентов с объемом простаты менее 50 куб. см (ПСА — 4,1—9,9 нг/мл), в то время как находки рака простаты были только у 15% пациентов с размерами аденомы предстательной железы более 50 куб. см (ПСА — 4,1—9,9 нг/мл) (W.J.Catalonaetal., 1994).
Типичными осложнениями рака простаты являются:
- острая и хроническая задержка мочи;
- одно- пли двусторонний уретерогидронефроз;
- прианизм;
- отек нижних конечностей;
- метастазы в костях с переломами;
- профузная гематурия и тампонада мочевого пузыря;
- анемия.

Рис. 32. Циркулярная инфильтрация периневральных пространств грандулярной аденокарциномы простаты
Рак предстательной железы метастазирует по периневральным пространствам (рис. 32). Если суммировать общие физические проблемы диссеминированного рака простаты, то их разновидности представляются следующими:
1. Наличие костных метастазов:
- боль; ограниченная подвижность, снижение физической активности; утеря независимости; патологические переломы; гиперкальциемия; сдавление спинного мозга, неврологическая дисфункция.
2. Локальный рецидив заболевания после операции:
- боль вследствие давящей по окружности опухолевой массы; сдавление нервов; воспаление; локальная инфильтрация;
- нагноение раны, неприятный запах, периодически возникающее кровотечение, отделение некротических масс;
- дисфукнция мочеиспускания: дизурия, гематурия, почечная недостаточность;
- гастроинтестинальная дисфункция: нарушение обычного кишечного отправления, кровь в кале, изжога, рвота, слизистый стул;
- мочевые свищи;
- лимфостаз;
- неврологические дисфункции.
Вторичные проблемы при наличии отдаленных метастазов:
- снижение функции печени; симптомы поражения головного мозга; неадекватные реакции поведения;
- проблемы относительно сексуальной функции:
- эректильная дисфункция, потеря сексуального интереса, психосексуальные проблемы;
- проблемы вторичной слабости:
- боль, неподвижность, потеря самостоятельности, социальная изоляция;
- проблемы вторичного лечения и лекарств:
- множественные вариабельные решения, полагающиеся на возможность применения новых лекарств.
Общая схема клинических проявлений рака предстательной железы представлена в табл. 2.
Читайте также:

