Рак мочевого пузыря пластика мочевого пузыря
Опухоль мочевого пузыря – новообразование, которое возникает в полости или на стенке органа. Болезнь может протекать как с яркими симптомами, так и без особых признаков, что часто приводит к поздней диагностике. По основной классификации опухоли бывают доброкачественными и злокачественными. Именно тип образования, его размеры и место определяют схему лечения опухоли мочевого пузыря и прогноз выздоровления.
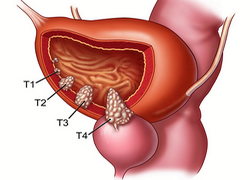
Причины появления опухоли
Механизм развития опухолей заключается в активном делении клеток. Такие процессы могут быть запущены разными факторами, которые провоцируют мутацию генетического клеточного материала. В случае с мочевым пузырем особенно опасны курение, неблагоприятная экология и работа, связанная с химическими веществами. Эти факторы могут вызывать разные виды опухолей мочевого пузыря:
- Доброкачественные: полипы, папилломы, миомы, гемангиомы, фибромы.
- Злокачественные: солидный, переходноклеточный, папиллярный и плоскоклеточный рак, аденокарцинома, а также поверхностный (неинвазивный) и инвазивный рак.
Доброкачественные опухоли часто диагностируются у рабочих, занятых в лакокрасочной, бумажной, химической и резиновой промышленности. Провоцировать заболевание может застой мочи. Чем выше ее концентрация и чем дольше она задерживается в пузыре, тем более сильным оказывается опухолегенное действие веществ в ее составе. У мужчин причинами опухолей выступают заболевания мочеполового тракта:
- аденома простаты;
- простатит;
- камни в органах мочевыделительной системы;
- стриктуры и дивертикулы мочеиспускательного канала.
Ввиду особенностей анатомического строения мужчины больше подвержены риску возникновения новообразований. Злокачественные опухоли мочевого пузыря могут развиваться по тем же причинам:
- из-за работы на вредном производстве;
- паразитарных инфекций;
- длительной задержки мочи;
- инфекций и воспаления урогенитального тракта.
Симптомы опухолевых заболеваний
Рассматривая симптомы опухоли мочевого пузыря, стоит отметить, что на раннем этапе она никак себя не проявляет. Признаки возникают, когда новообразование достигает таких размеров, при которых оно может раздражать стенки органа. В такой ситуации у человека могут быть следующие жалобы:
- изменение цвета мочи;
- спазмы и боль внизу живота;
- ощущение не полностью опорожненного мочевого пузыря;
- выделение мочи небольшими порциями;
- частые позывы к мочеиспусканию;
- нарушение менструального цикла и выделения из половых путей (у женщин);
- отечность в ногах, области промежности;
- нарушения работы органов пищеварения.
Методы диагностики опухоли мочевого пузыря
Поскольку опухоль может носить доброкачественный или злокачественный характер, особое значение приобретает дифференциальная диагностика. Она направлена на то, чтобы определить тип новообразования, поскольку от этого зависит схема лечения. Исходя из этого, в инструментальную и лабораторную диагностику опухоли мочевого пузыря включают:
- Ультразвуковое исследование (УЗИ) органов малого таза.
- Магнитно-резонансную или компьютерную томографию (МРТ или КТ) малого таза.
- Цистоскопию с биопсией новообразования для определения его типа.
- Экскреторную урографию и цистографию.
- Цитологическое тестирование мочи.

- Виды предоперационного обследования
- Пластика при экстрофии
- Заместительное лечение при опухолях
- Восстановление после операции
- Лечебная физкультура
- Видео по теме
Если мочевой пузырь утратил способность выполнения природных функций, а медицина бессильна восстановить их, применяется пластика мочевого пузыря.
Пластика мочевого пузыря – это операция, целью которой является полное замещение органа или его части. Чаще всего заместительная хирургия применяется при онкологическом поражении органов мочевой системы, в частности, мочевого пузыря, и является единственным способом сохранить жизнь больному и заметно повысить ее качество.
Виды предоперационного обследования
Чтобы уточнить диагноз, определить, где находится поражение, определить опухолевые размеры проводят следующие виды исследований:
- УЗИ малого таза. Самое распространенное и доступное исследование. Определяет размер, форму, массу почки.
- Цистоскопия. При помощи цистоскопа, введенного в мочевой пузырь через уретру, врачом обозревается внутренняя поверхность органа. Также есть возможность взятия соскоба опухоли для гистологии.
- КТ. Применяется, чтобы уточнить размеры и локализацию не только мочевого пузыря, но и близлежащих органов.
- Внутривенная урография мочевыводящих путей. Дает возможность узнать, в каком состоянии находятся вышележащие отделы мочевого тракта.
Применение перечисленных видов исследования не есть обязательным для всех пациентов, их назначают индивидуально. Кроме инструментальных исследований, перед проведением операции назначаются анализы крови:
- на биохимические показатели;
- на свертываемость крови;
- на ВИЧ-инфекцию;
- на реакцию Вассермана.
Пластика при экстрофии
Экстрофия мочевого пузыря – тяжелейшее заболевание. При патологии наблюдается отсутствие передней стенки мочевого пузыря и брюшины. Если у новорожденного присутствует атрофия мочевого пузыря, на 5 сутки следует провести операцию.
В данном случае пластика мочевого пузыря состоит из нескольких операций:
- На первом этапе устраняют дефект передней стенки мочевого пузыря.
- Устраняется патология брюшной стенки.
- Для улучшения удержания урины сводят лонные кости.
- Формируют шейки пузыря и сфинктера, чтобы достичь возможности контролировать мочеиспускание.
- Пересаживают мочеточники с целью предотвращения рефлюкса мочи в почки.
Заместительное лечение при опухолях
Если мочевой пузырь удален, при помощи пластики добиваются возможности отводить мочу. Способ отвода урины из организма выбирается, исходя из показателей: индивидуальные факторы, возрастные особенности больного, состояние здоровья оперируемого, сколько ткани было удалено во время операции. Самые эффективные методы пластики рассмотрены далее.
Способ перенаправления хирургом урины больного в мочеприемник на брюшной полости с использованием участка тонкой кишки. После уростомии моча выходит через образованный илеальный кондуит, попадая в мочесборник, прикрепленный возле отверстия в стенке брюшины.
Положительными сторонами метода считают простоту оперативного вмешательства, минимальную затрату времени в сравнении с другими способами. После операции нет необходимости в катетеризации.
Недостатками метода являются: Неудобства в связи с применением внешнего мочесборника, от которого иногда исходит специфический запах. Затруднения психологического характера по поводу неестественного процесса мочеиспускания. Иногда урина возвращается назад в почки, вызывая инфекции и камнеобразования.
Создается внутренний резервуар, к одной стороне которого присоединены мочеточники, к другой – уретра. Использовать пластический метод целесообразно, если опухолью не затронуто устье мочеиспускательного канала. Урина поступает в резервуар аналогично естественному способу.
Больной сохраняет нормальное мочеиспускание. Но у метода есть свои недостатки: изредка приходится применять катетер, чтобы полностью опорожнить мочевой пузырь. Ночью иногда наблюдается недержание мочи.
Способ заключается в применении катетера при выводе урины из организма. Метод используется при удаленной уретре. Внутренний резервуар подводится к стоме миниатюрного размера в передней брюшной стенке. Постоянно носить мешок не имеет смысла, так как моча накопляется внутри.
Последние годы медики высказываются в пользу сигмопластики. При сигмопластике используется сегмент толстой кишки, особенности строения которой дают повод считать ее более пригодной, чем тонкая. В предоперационный период особое внимание уделяется кишечнику пациента.
Диета последней недели ограничивает потребление клетчатки, ставятся сифонные клизмы, назначается прием энтеросептола, проводится антибактериальная терапия для подавления мочевой инфекции. Брюшная полость вскрывается под эндотрахеальным наркозом. Резицируется кишечная петля длиной не более 12 см. Чем длиннее трансплантант, тем труднее проходит опорожнение.
Прежде чем закрыть просвет кишечника, его обрабатывают вазелиновым маслом, чтобы предупредить копростаз в период после операции. Просвет трансплантата дезинфицируется и осушается. Если место имеет сморщенный мочевой пузырь и пузырно – мочеточниковый рефлюкс, мочеточник пересаживают в кишечный трансплантат.
Восстановление после операции
На протяжении первых двух недель послеоперационного периода моча собирается в резервуар через отверстие в брюшной стенке. Этот период необходим для того, чтобы произошло заживление места, где искусственный пузырь соединяется с мочеточниками и мочевым каналом. По истечении 2-3 дней начинают промывать искусственный мочевой пузырь.
С этой целью применяют физиологический раствор. По причине вовлечения в оперативное вмешательство кишечника 2 дня не разрешается принимать пищу, что заменяется внутривенным питанием.
По истечении двух недель подходит к концу ранний послеоперационный период:
- извлекаются дренажи;
- убираются катетеры;
- снимают швы.
Организм переходит к естественному приему пищи и процессам мочеиспускания. В послеоперационный период особое внимание уделяется правильности процесса мочеиспускания. Мочеиспускания проходят при надавливании рукой передней брюшной стенки. Важно! Нельзя допускать перерастяжения мочевого пузыря, иначе сохраняется опасность разрывов, при котором моча попадет в брюшную полость.
Первые 3 месяца послеоперационного периода мочеиспускание должно происходить каждые 2–3 часа круглосуточно. Во время восстановительного периода характерно недержание мочи, при появлении которого необходимо безотлагательно получить консультацию врача. По окончании трехмесячного периода мочеиспускание проводится через 4–6 часов.
Четвертая часть прооперированных пациентов страдает диареей, купировать которую легко: принимаются лекарства для замедления моторики кишечника. По утверждению врачей, особых изменений образа жизни в послеоперационный период не требуется. Нужно просто регулярно контролировать процессы мочеиспускания.
В течение 2 месяцев послеоперационного периода больному не разрешается поднятие тяжестей, вождение машины. В это время пациент привыкает к своему новому положению, избавляется от страхов. Особая проблема у мужчин после операции – восстановление половой функции.
Современные подходы к технике пластики учитывают необходимость ее сохранения. К сожалению, полной гарантии восстановления функционирования половой системы дать не представляется возможным. Если половая функция восстанавливается, то не раньше чем через год.
В послеоперационный период диета имеет минимальные ограничения. Запрещаются жареные и пряные блюда, способствующие ускорению притока крови, что замедляет заживление швов. Рыбные и фасольные блюда способствуют появлению специфического запаха урины.
Питьевой режим после пластики мочевого пузыря должен быть изменен в сторону повышения поступления в организм жидкости. Ежедневный прием жидкости не должен быть меньше 3 литров, включая соки, компоты, чай.
Лечебная физкультура
Упражнения лечебной физкультуры необходимо начинать выполнять, когда заживут послеоперационные раны, после месячного срока со дня операции. Лечебной гимнастикой пациенту придется заниматься в течение всей оставшейся жизни.
Упражнения выполняются для укрепления мышц тазового дна, которые способствуют выведению урины. Самыми эффективными при реабилитации после пластики мочевого пузыря признаны упражнения Кегеля. Суть их заключается в следующем:
- Упражнения для замедленного напряжения мышц. Пациент прилагает усилие, подобное такому, как при попытке приостановить мочеиспускание. Следует усиливать нарастание постепенно. На максимуме напряжение мышц удерживается в течение 5 сек. После этого происходит медленное расслабление. Повторяется упражнение 10 раз.
- Выполнение быстрого чередования сокращений и расслаблений мышц. Повтор упражнения до 10 раз.
В первые дни занятий лечебной физкультурой комплекс упражнений выполняется 3 раза, затем постепенно увеличивается. Пластиковую терапию нельзя рассматривать как полное избавление от патологии. Пластика мочевого пузыря не приводит к полноценной замене естественного. Но, если строго выполняются советы врача, ухудшения состояния организма не будет наблюдаться. С течением времени выполнение процедур становится неотъемлемой частью жизни.
Аннотация научной статьи по клинической медицине, автор научной работы — Шаплыгин Л. В., Ситников Н. В., Фурашов Д. В., Дронов В. И., Сегедин Р. Е.
The results of surgical treatment of 79 patients with invasive bladder cancer treated with radical cystectomy with continent urinary diversion (ileal neobladder) between 1997 and 2005 were analyzed. The incidence of early and late complications was 12.7 and 15.5%, respectively; postoperative mortality was 2.5%. The reservoir volume was 250-300, 400-450, and 500-600 ml 3, 6, and 12 months after surgery, respectively. Spontaneous urination and day time continence was restored in 100%; partial nocturnal incontinence was noted in 11.7of the patients. In the vast majority of cases, renal function was not impaired or improved. Thus, radical cystectomy with bladder substitution with low-pressure ileal reservoirs with anti-reflux ureteric implantation is the method of choice in treating invasive bladder cancer.
Похожие темы научных работ по клинической медицине , автор научной работы — Шаплыгин Л. В., Ситников Н. В., Фурашов Д. В., Дронов В. И., Сегедин Р. Е.
Intestinal plastic repair for urinary bladder cancer
The results of surgical treatment of 79 patients with invasive bladder cancer treated with radical cystectomy with continent urinary diversion (ileal neobladder) between 1997 and 2005 were analyzed. The incidence of early and late complications was 12.7 and 15.5%, respectively; postoperative mortality was 2.5%. The reservoir volume was 250-300, 400-450, and 500-600 ml 3, 6, and 12 months after surgery, respectively. Spontaneous urination and day time continence was restored in 100%; partial nocturnal incontinence was noted in 11.7of the patients. In the vast majority of cases, renal function was not impaired or improved. Thus, radical cystectomy with bladder substitution with low-pressure ileal reservoirs with anti-reflux ureteric implantation is the method of choice in treating invasive bladder cancer.
Кишечная пластика при раке мочевого пузыря
Л.В. Шаплыгин, Н.В. Ситников, Д.В. Фурашов, В.И. Дронов, Р.Е. Сегедин, В.А. Сидоров
Главный военный клинический госпиталь им. Н.Н. Бурденко;
Центральный военный клинический госпиталь им. А.А. Вишневского, Москва
INTESTINAL RESERVOIRS IN BLADDER CANCER
L.V. Shaplygin, N.V. Sitnikov, D.V. Furashov, V.I. Dronov, R.Ye. Segedin, V.A. Sidorov
N.N. Burdenko Main Military Clinical Hospital; A.A. Vishnevsky Central Military Clinical Hospital, Moscow
The results of surgical treatment of 79 patients with invasive bladder cancer treated with radical cystectomy with continent urinary diversion (ileal neobladder) between 1997 and 2005 were analyzed. The incidence of early and late complications was 12.7 and 15.5%, respectively; postoperative mortality was 2.5%. The reservoir volume was 250—300, 400—450, and 500—600 ml 3, 6, and 12 months after surgery, respectively. Spontaneous urination and day time continence was restored in 100%; partial nocturnal incontinence was noted in 11.7% of the patients. In the vast majority of cases, renal function was not impaired or improved. Thus, radical cystectomy with bladder substitution with low-pressure ileal reservoirs with anti-reflux ureteric implantation is the method of choice in treating invasive bladder cancer.
Рак мочевого пузыря (РМП) в общей статистике всех злокачественных новообразований составляет около 4%, а в группе онкологической патологии по встречаемости занимает 8-е место [1].
Состояние пациента, страдающего РМП, отягощается часто возникающими сложностями оттока мочи из верхних мочевых путей с реальной угрозой нарушения функции почек. Кроме лечения органного рака врачу приходится решать и столь трудную задачу, как восстановление нарушенного оттока мочи. Результаты применения комбинированных и сочетанных методов лечения РМП и использования современных рациональных подходов к деривации мочи не удовлетворяют урологов. Сегодня все еще около 70% больных инвазивными формами умирают в течение 3 лет после хирургического вмешательства. Более чем у половины пациентов в течение 3—5 лет после выполнения органосохраняющих операций возникают рецидивы [2].
Методы замещения мочевого пузыря являются весьма важными для повышения качества жизни пациентов в послеоперационном периоде. Поиски оптимальных вариантов реконструктивных операций после цистэктомии предпринимались еще в начале прошлого века, но и сегодня выбор наиболее оптимального метода отведения мочи остается одной из актуальных проблем урологии. Для реконструкции нижних мочевых путей после цистэктомии используются различные сегменты желудочно-кишечного тракта, однако пока не найдено идеальной замены естественному мочевому пузырю [3—9].
В конце прошлого века были сформулированы основные требования к мочевым резервуарам: низкое внутрипросветное давление, не превышающее 20 см вод. ст., емкость не менее 400—500 мл, отсутствие ретроградных току мочи перистальтических сокращений, удержание мочи, функциональная и
морфологическая адаптация, защита верхних мочевыводящих путей с помощью адекватного антиреф-люксного механизма, минимальный риск опухолевой инвазии. Таким требованиям удовлетворяло создание мочевых резервуаров из детубуляризованных (рассечение кишки по антибрыжеечному краю) сегментов тонкой кишки [6, 7, 10, 11].
Не более 50% пациентов с инвазивным РМП можно выполнить кишечную пластику. Важное значение имеют не только стадия и распространенность опухолевого процесса, но и возраст, функциональное состояние органов мочевыделительной системы, наличие сопутствующей патологии, психологическая подготовка больных к такого рода операциям.
Материалы и методы
За период с 1997 по 2005 г. в 3-м ЦВКГ им. А.А. Вишневского и ГВКГ им. Н.Н. Бурденко радикальная цистэктомия с последующей пластикой мочевого пузыря из изолированного сегмента подвздошной кишки выполнена 79 пациентам с инвазивным РМП. Мужчин было 67 (85%), женщин — 12 (15%). Возраст больных составил от 37 до 69 лет (средний возраст 57,0 ± 1,5 года). Использовались следующие варианты отведения мочи:
• создание артифициального мочевого пузыря по методу Studer — 60 пациентов;
• создание мочевого резервуара по методу Коек —
В контрольную группу были включены больные, которым выполнялась операция Брикера или уретерокутанеостомия.
В ходе исследования изучены отдаленные результаты в сроки до 8 лет. В настоящее исследование вошли больные с рТ2а—рТ4а при отсутствии метастазов. Больных с рТ2а-стадией было 15 (19,0%), рТ2б - 17 (21,5%), при рТЗа - 25 (31,6%), рТ3б - 18 (22,8%), рТ4а - 4 (5,1%).
Осложнения в послеоперационном периоде
Осложнение Ранний Поздний
Тромбоэмболия легочной артерии 1 1,3 0 0
Рефлюкс 0 0 4 5,1
Пиелонефрит 2 2,6 5 6,1
Эвентрация 1 1,3 0 0
Нагноение послеоперационной раны 2 3,8 3 3,8
Несостоятельность швов резервуара 1 1,3 1 1,3
Пневмония 1 1,3 0 0
Стриктура пузырно-уретрального анастомоза 0 0 2 3,3
Камни резервуара 0 0 4 5,1
Недержание мочи 0 0 7 11,7
У 91,0% больных был переходноклеточный рак, у 5,3% — плоскоклеточный рак, у 2,4% — аденокарцинома, у 1,3% — железисто-плоскоклеточный рак. Уре-терогидронефроз наблюдался у 33 пациентов, из них у 7 больных был двусторонний уретерогидронефроз.
При выборе метода деривации мочи необходимо соблюдать онкологические принципы. С этой целью всем больным выполнялась цистоскопия с одновременной ТУР-биопсией опухоли мочевого пузыря и слизистой простатического отдела уретры. Во время проведения операции выполняли гистологическое исследование края резецированной уретры.
Показания к выполнению пластики мочевого пузыря мы определяли по следующим критериям:
• опухоли в стадии Т2а—Т4а;
• отсутствие имплантационных метастазов в уретре;
• предполагаемая продолжительность жизни не менее 10 лет;
• отсутствие в анамнезе неоадъювантной лучевой и химиотерапии;
• достаточная длина брыжейки подвздошной кишки.
Особое внимание уделялось предоперационной подготовке. За 3 дня до операции исключается грубая пища (мучные изделия, овощи, фрукты, цельное молоко). Диета 1, последний день — диета 0. Ежедневно больной выпивает 4 л 0,9% раствора №С1 или раствор Рингера. В эти дни принимается слабительное. Вечером и утром перед операцией очистительные клизмы. В течение 3 сут антибиотики широкого спектра действия и нистатин 400 мг 4 раза в сутки.
Для профилактики осложнений со стороны верхних дыхательных путей и уменьшения риска
развития пареза кишечника и кишечной непроходимости в послеоперационном периоде мы выполняли гастростомию. Гастро-стому удаляли на 6—7-е сутки. Мочеточниковые дренажи удаляли на 10— 12-е сутки после выполнения выделительной урографии. Уретральный катетер удаляли на 21-й день после выполнения ретроградной резервуару урографии.
В послеоперационном периоде проводили интенсивную терапию, включающую гемокомпо-нентную терапию, заместительную, инфузионнную, антибактериальную, дезинтоксикационную. С 3-х суток больным разрешали пить и начинали промывать мочевой резервуар: 60 мл изотонического раствора №С1 + 1,0 г антибиотика цефалоспоринового ряда — порциями по
20 мл. С первого дня в течение 6 мес назначали по 500 МЕ витамина В12. В течение 3 сут постельный режим, в течение 10 сут — полупостельный режим. После выписки пациента из стационара с целью уменьшения слизеобразования и застойных явлений ежемесячно проводили катетеризацию и промывание мочевого резервуара растворами уроантисептиков.
После пластики мочевого пузыря из изолированного сегмента подвздошной кишки ранние осложнения развились у 10 (12,7%) больных.
Послеоперационная летальность была невысокой и составила 2,5% (2 больных). Один пациент умер от острой сердечно-сосудистой недостаточности, второй — от инфаркта головного мозга на фоне прогрессирования атеросклероза сосудов головного мозга.
Осложнения в позднем послеоперационном периоде развились у 12 (15,1%) больных (см. таблицу).
Как видно из таблицы, одним из наиболее частых осложнений является пиелонефрит. Микрофлору мочи анализировали у пациентов только с истинной бак-териурией (микробное число более 105/мл). При бактериологических исследованиях мочи выделялась E. Coli у 3 (50%) человек, P. staphylococcus — у 2 (33,3%), Proteus — у 1 (16,7%). Данным пациентам проводилась антибактериальная терапия с учетом чувствительности выявленной микрофлоры. Чаще всего микрофлора была чувствительна к фторхинолонам и цефалоспоринам III—IV поколения. Самым опасным осложнением в раннем послеоперационном периоде является тромбоэмболия легочной артерии. В нашем исследовании оно развилось у 1 пациента и не привело к летальному исходу. Данный пациент был переведен в реанимаци-
онное отделение и после адекватно проведенной заместительной и тромболитической терапии тромбы в легочной артерии лизировались.
Осложнения позднего послеоперационного периода чаще всего приводят к функциональным нарушениям почек и мочевых путей, имеют затяжной, хронический характер и требуют как консервативного, так и оперативного лечения. Для их профилактики необходимо проводить динамическое наблюдение за пациентами.
Инвазия опухоли за пределы стенки мочевого пузыря, наличие имплантационных метастазов в уретре, не выявленных в дооперационном периоде, инвазия мочеточников, наличие метастазов в регионарных лимфатических узлах приводят к неудовлетворительным результатам цистэктомии. Пятилетняя выживаемость больных РМП после цистэкто-мии составила: при стадии Т2 — 87,5%, Т3а — 76,0%, Т3б — 66,7%, Т4а — 50%. Метастазы выявлены в среднем через 12—24 мес после оперативного лечения у 19 (24,1%) человек.
С целью изучения морфологических изменений, развивающихся в стенке артифициального мочевого пузыря, сформированного из сегмента подвздошной кишки, проведены гистологические исследования стенки мочевого резервуара [12]. Морфологические изменения изучались через 1—8 лет после операции. Анализу подвергнуты результаты гистологического исследования у 24 пациентов. Через 3 мес после операции отмечалась метаплазия кишечного эпителия в покровно-ямочный эпителий, представленный цилиндрическими и бокаловидными клетками. Если в эпителии неизмененной стенки кишки преобладают цилиндрические клетки (до 90%) над бокаловидными, то в стенке мочевого резервуара уменьшается количество цилиндрических клеток, а в процентном соотношении увеличивается количество бокаловидных клеток, что создает поверхность, защищающую стенки резервуара от компонентов мочи. Определяется выраженная атрофия слизистой оболочки подвздошной кишки за счет истончения собственного слоя слизистой оболочки. Установлена зависимость между длительностью существования мочевого пузыря и изменениями слизистой подвздошной кишки. В сроки от 3 до 6 мес отмечаются укорочение и утолщение ворсин, сглаживание ворсин собственного слоя, расширение кишечных крипт, неравномерное распределение их в собственном слое слизистой оболочки, что приводит к уменьшению слизеоб-разования. Толщина мышечной пластинки слизистой оболочки находится в прямой зависимости от длительности существования артифициального мочевого пузыря: чем больше срок существования, тем толще мышечная пластинка. Морфологические изменения слизистой подвздошной кишки можно разделить на
I фазу, продолжающуюся до 1—2 лет, когда преобладают воспалительные изменения слизистой кишки (воспалительная фаза), и II фазу, когда преобладают атрофические изменения слизистой кишки (атрофическая фаза). II фаза продолжается до 4 лет. Незначительность микроворсин в отдаленные сроки после операции определяет картину примитивного эпителия мочевых путей. О подобии железистого эпителия позволяет говорить преобладание бокаловидных клеток. Морфологически данная картина приближена к свойствам уротелия и характеризует защитную поверхность внутренней сферы мочевого резервуара. Данное строение уменьшает абсорбционную функцию слизистой подвздошной кишки. Подобные изменения приводят к минимуму метаболических осложнений. За время наблюдения за пациентами мы не обнаружили канцерогенеза резервуара.
Наряду с морфологическими изменениями кишечной стенки происходят и физиологические изменения. Патофизиологические изменения наиболее выражены в раннем послеоперационном периоде. Резорбция большой поверхностью слизистой стенки кишки компонентов мочи, а именно аммония и хлоридов, вызывает значительные электролитные изменения у больных, которые проявляются ацидозом и развитием почечной недостаточности. Резорбция компонентов мочи может создавать видимость тяжелых почечных нарушений, которые не соответствуют реальной почечной функции. Собственная пластинка слизистой играет важную роль в защитной функции. Лимфоциты и плазматические клетки образуют вторую защитную линию, направленную против бактерий и других антигенов, проникающих в ткани через эпителиальный слой. После попадания антигена плазматические клетки вырабатывают ^А, который воздействует на этот антиген. IgA обладает способностью попадать в эпителиальные клетки и выделяться ими в просвет кишки. Выключение из пищеварительного процесса сегмента подвздошной кишки приводит к нарушению защитных свойств организма, что может способствовать развитию инфекционных осложнений. При кишечной пластике мочевого пузыря происходят значительные патофизиологические изменения кишечной стенки, требующие медикаментозной коррекции.
Качество мочеиспускания мы оценивали посредством урофлоуметрии. Через 1 год после операции максимальная скорость мочеиспускания составляет 18,1±6,2 мл/с, средняя скорость мочеиспускания 9,5±3,0 мл/с. В дальнейшем максимальная скорость потока мочи достигает 21,0+5,5 мл/с, средняя скорость потока мочи 10,9+2,7 мл/с (^ Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
2. Лопаткин Н.А., Даренков С.П., Чернышев И.В. и др. Радикальное лечение инвазивного рака мочевого пузыря. Урология 2003; 4: 3-8.
3. Комяков Б.К., Горелов С.И., Новиков А.И. и др. Ближайшие результаты радикальных цистэктомий. Урология 2003; 4: 15-7.
4. Комяков Б.К., Горелов С.И., Новиков А.И. и др. Ортотопическая пластика мочевого пузыря сегментом желудка. Урология 2004; 3: 32-5.
5. Комяков Б.К., Новиков А.И., Гулиев Б.Г. и др. Восстановление мочевыводящих путей различными отделами желудочно-кишечного тракта. Урология 2005; 5: 12-7.
6. Hautmann R.E., De Pertriconi R., Gottfried H.-W. et al. The ileal neobladder: complications and functional results in 363 patients after 11 years of followup. J Urol 1999; 161 (2): 422-8.
7. Stein J.P., Lieskovsky G., Groshen S. et al. Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1054 patients. J Clin Oncol 2001; 19(3): 666-75.
8. Studer U.E., Zingg E.J. Ileal orthotopic bladder substitutes. What we vave learned from 12 years experience with 200 patients. Urol Clin North Am 1997; 24: 780-93.
9. Studer U.E., Stenzl A., Mansson W., Mills R. Bladder replacement and urinary diversion. Eur Urol 2000; 8: 1-11.
10. Морозов А.В., Антонов М.И., Павленко К.А. Замещение мочевого пузыря сегментом кишечника (ортотопическая
реконструкция мочевого пузыря). Урология 2000; 3: 17-22.
11. Шаплыгин Л.В., Ситников Н.В., Фурашов Д.В. и др. Радикальная цистэ-ктомия в лечении инвазивного рака мочевого пузыря. Воен-мед журн 2003; 12: 43-6.
12. Немытин Ю.В., Ситников Н.В., Дронов В.И. и др. Морфо-функцио-нальные особенности кишечного мочевого резервуара. Воен-мед журн 2004;
13. Сидоров В.А. Инвазивный рак мочевого пузыря. Хирургическое лечение: Автореф. дис. докт. мед. наук. М.,
14. Сидоров В.А., Шаплыгин Л.В., Ситников Н.В. и др. Функция почек после кишечной пластики при раке мочевого пузыря. Урология 2005; 2: 32-5.
Читайте также:

