Рак это заболевание генома
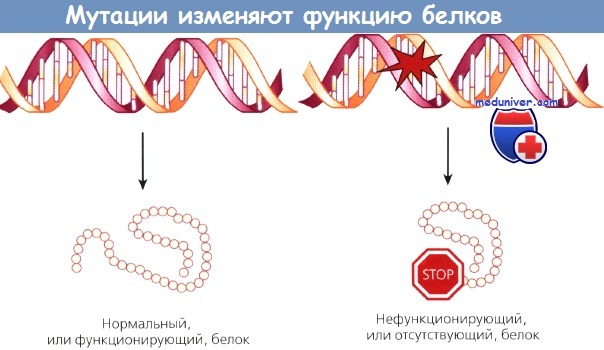
Рак — генетическое заболевание, развивающееся вследствие нарушений в ДНК, называемых мутациями. Возникая в генах, ответственных за рост клеток, мутации приводят к неконтролируемому размножению поврежденных клеток. Такой неконтролируемый рост клеток или ткани известен как рак. Изредка злокачественная опухоль развивается вследствие одной единственной мутации, но чаще необратимые и неконтролируемые изменения клеточной функции — следствие нескольких нарушений во многих разных генах.
Представление о генетических мутациях как единственной причине злокачественных опухолей сложилось относительно недавно, в течение последних 25 лет исследований. До 1970-х годов причины рака оставались совершенно неизвестными. Окончательно они не изучены до сих пор, однако уже ясно, что дефекты в иммунной системе, вирусы и метаболические расстройства сами по себе рак не вызывают. Эти факторы могут влиять на развитие злокачественных опухолей, но первопричина кроется в ДНК больного и способности генетического аппарата конкретного организма к нормальному функционированию.
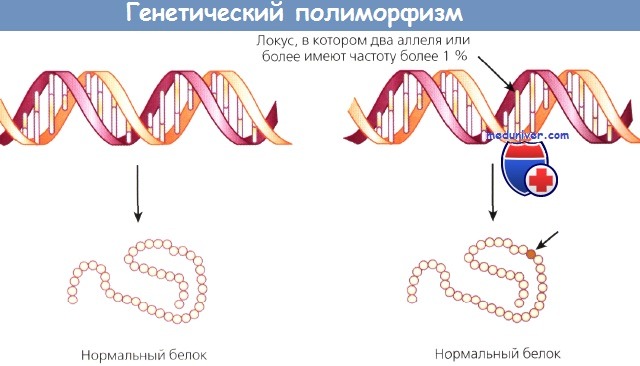
Индивидуальные особенности генома складываются из унаследованных и измененных на протяжении жизни последовательностей ДНК. Таким образом, рак — болезнь нарушенной экспрессии ДНК. Нарушения или различия в структуре ДНК могут быть следствием мутаций — изменений в ДНК, ведущих к нарушениям соответствующих белков, или полиморфизма — изменения ДНК, ведущего к тонким нарушениям функции гена и структуры белка. Граница, разделяющая мутацию и полиморфизм, едва уловима.
Известно, что в развитии ИБС определенную роль играет наследственный фактор. Человек может унаследовать дефектные гены, вызывающие нарушения жирового обмена, вследствие чего у него повышен риск атеросклероза и, соответственно, смерти от инфаркта миокарда или инсульта. Также хорошо известно, что носитель дефектных генов может значительно повлиять на течение болезни, изменив образ жизни или воздействуя на факторы внешней среды.
Например, человек, склонный к ИБС, может снизить риск смерти, занимаясь физическими упражнениями, борясь с избыточной массой тела, придерживаясь диеты с низком содержанием жиров. Этот пример показывает, что развитие злокачественных опухолей имеет много общего с атеросклерозом: индивидуум может иметь врожденные генетические мутации или сталкиваться с факторами внешней среды, предрасполагающими к развитию онкологического процесса.
Последние встречаются в повседневной жизни; к ним относятся курение и воздействие веществ, способных повреждать ДНК. Кроме того, любой процесс, вызывающий деление клеток, например овуляция, также повышает риск появления ошибок при репликации ДНК. Однако индивидуальная предрасположенность к развитию РЯ может быть снижена приемом пероральных контрацептивов, подавляющих овуляцию и тем самым снижающих риск повреждения эпителия яичников, во время которого могут появляться мутации.
Многие заболевания с наследственной этиологией, включая описанный выше атеросклероз, развиваются вследствие одной единственной мутации; в отличие от них, развитие злокачественной опухоли требует накопления нескольких генетических нарушений. Этим рак отличается от большинства врожденных заболеваний, сопровождающихся нарушениями метаболизма, т. к. для его возникновения требуется более одного генетического события. Человек не появляется на свет с врожденным раком, как, например, с муковисцидозом или серповидноклеточиой анемией.
Можно родиться с мутацией гена, предрасполагающей к развитию рака, но большинство злокачественных опухолей развивается вследствие накопления соматических мутаций в процессе нормальной жизнедеятельности. Эти мутации возникают под влиянием вирусов, курения, употребления мяса, жареного на углях, или простых случайных ошибок, происходящих во время репликации ДНК: в делящейся клетке копируется ,'5 млрд нуклеотидпых пар, и при каждом делении происходят ошибки.
Трансформация клетки из нормальной в злокачественную в результате накопления ряда мутаций наиболее удачно была продемонстрирована при раке толстой кишки в работе Burt Vogelstein и соавт.. Согласно этой модели, требуется развитие ряда критических мутаций, поражающих гены, включая опухолевые супрессоры и онкогены; трансформация доброкачественной опухоли в злокачественную происходит длительно, без четких временных границ.
В развитие злокачественных опухолей вовлечено три больших группы генов: опухолевые супрессоры, онкогены и гены, ответственные за репарацию ДНК. Опухолевые супрессоры ответственны за синтез белков, подавляющих клеточный рост; они экспрессируются по рецессивному типу, и поэтому для развития опухолевого фенотипа необходима утрата обоих аллелей. Онкогены экспрессируются доминантно, их продукты обычно ответственны за стимуляцию клеточного роста; неконтролируемая экспрессия этих генов ведет к неконтролируемому росту клеток. Гены репарации ДНК ответственны за восстановление дефектов ДНК, происходящих при нарушениях точности ее нормальной репликации.
Даже при нарушении функции одного из них возможно накопление ошибок в ДНК, что в конце концов также приведет к ошибкам в генах, ответственных за рост клетки, с последующей утратой контроля над клеточным делением. Таким образом, развитие злокачественной опухоли — не результат отдельной ошибки или какого-то воздействия, а следствие накопления многих ошибок в течение определенного времени. В то же время появление мутаций служит инструментом эволюции.
Парадокс жизни заключается в том, что одни и те же мутации, ведущие к развитию злокачественных опухолей, метаболическим нарушениям и гибели отдельных организмов, отвечают и за эволюцию видов. По своей значимости для организма мутации могут быть благоприятными, вредными и нейтральными.
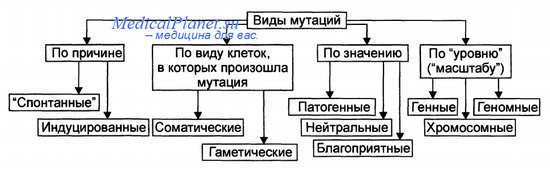
Классификация мутаций - их виды

Онкозаболевание – это болезнь генома соматической клетки, которая приводит к развитию доброкачественной или злокачественной опухоли. По роли участия генов все опухоли делятся на три типа: наследственные, семейные и спорадические.
Наследственные опухоли передаются от родителей к ребенку по доминантному типу – до 5% случаев. Семейные опухоли тоже передаются по наследству, но вероятность их проявления гораздо ниже. Это считается предрасположенностью к онкологическому заболеванию. Их встречаемость – до 30 %. Это так называемый отягощенный семейный анамнез – диагностирование онкозаболевания у близких родственников повышает вероятность возникновения заболевания.
Спорадические опухоли провоцируются средой и образом жизни. В этом случае мутация в клетке происходит случайно, она начинает неправильно делиться, в случае нарушения регуляции ее функционирования со стороны гена-супрессора или протоонкогена, это приведет к развитию рака.
Рак – это болезнь генома клетки, он всегда провоцируется изменениями в ДНК.
Методы лечения рака
Наряду с широко исплользуемыми методами лечения рака такими как хирургия, радиотерапия, и химиотерапия, существует три очень эффективныхновых направления: иммунотерапия, генная терапия и таргетная терапия.
Самые большие научные исследования проводятся в направлении онкотерапии наследственных опухолей. Мы знаем, что это болезнь генома. Казалось бы, надо ввести правильный ген, он заработает, и клетка сама себя вылечит. Проблема в том, что необходимо, чтобы нужный нам ген встроился в геном всех опухолевых клеток с помощью переносчика и начал активно функционировать, но пока не создано надежных систем-переносчиков для этого метода.
Один из методов – внедрения специального вируса с нужным геном или геном-супрессором, который способен остановить деление раковых клеток. Но организм человека – сложная система, которая пропускает далеко не все, что мы ей направляем.
Таргетная терапия – это метод подбора химиопрепаратов в зависимости от генетических изменений в клетках. Такая терапия прекращает рост раковых клеток, путем вмешательства в механизм действия конкретных молекул.
Когда нужно проходить ДНК-исследование?
ДНК-исследование имеет смысл проводить здоровым людям, чтобы узнать свою собственную генетическую предрасположенность к онкологическим и другим серьезным заболеваниям. Это называется превентивной медициной. Зная свою высокую предрасположенность, например, к раку молочной железы, вы будете регулярно проходить медицинское обследование, а это поможет диагностировать заболевание на ранней стадии.
Если онкологическое заболевание уже диагностировано, имеет смысл делать ДНК- исследование для того, чтобы выяснить генетическую природу болезни для таргетной терапии или для выделения группы риска по конкретному опухолевому маркеру, чтобы предотвратить развитие заболевания у близких членов семьи пациента.












25 апреля отмечается Всемирный день ДНК. Этот праздник установлен в честь признания важности генетики и научных открытий, сделанных в этой области. Наша ДНК, хранит в себе генетические данные, передающиеся нам от родителей, всю информацию о человеке и, в том числе, о болезнях.
Онкология и генетика
Например, человеку достались генные изменения, которые затрудняют вывод токсинов из организма. В этом случае, если он курит или работает на токсичном производстве, вероятность заболеть раком у него выше, чем у тех, кто не имеет такой генетической программы, так как организм не в силах справиться с выводом канцерогенов.
Некоторые из распространенных видов рака могут быть вызваны наследственными генетическими мутациями. В разных поколениях одной семьи могут появляться онкологические заболевания в определенной локализации. Самые распространенные из них — рак молочной железы (РМЖ) и яичников, рак предстательной железы.
Обычно РМЖ или рак яичников возникает у женщин в возрасте старше 50 лет. Если женщина заболевает в более раннем возрасте, это может означать, что она является носителем одной из мутации генов BRCA1 или BRCA2. В нормальном состоянии эти гены участвуют в восстановлении ДНК после различных повреждений, тем самым защищая клетки от злокачественного перерождения. Нарушение работы BRCA1/BRCA2 приводит к нарастанию ошибок в процессе репарации ДНК, что влечет за собой увеличение риска развития рака в этих локализациях.
Неблагоприятную наследственность не надо воспринимать как фатальную, поскольку существует большая вероятность избежать возникновения рака. Для этого нужно изучить свою медицинскую родословную. Если в вашей семье встречалось более одного случая рака в определенной локализации, заболевание в каждом из парных органов (почки, грудные железы) или несколько типов рака у родственников, то вам стоит обратиться к специалисту и сдать генетический тест. Он поможет выявить индивидуальную раковую предрасположенность, снизить риск развития патологии и своевременно принять профилактические меры, или диагностировать заболевание на ранней стадии и составить эффективный план лечения.
Не следует расслабляться и при отсутствии генетических мутаций, поскольку такой факт не дает 100% гарантии отсутствия риска.Даже если у вас нет тревожных симптомов, онкологи рекомендуют ежегодно проходить плановые осмотры у основных специалистов и проводить базовые исследования, такие как анализы мочи и крови, флюорография и другие. Комплексную проверку своего здоровья можно провести, например, в рамках диспансеризации. Существуют графики таких обследований в зависимости от возраста.
Внимание к собственному здоровью позволит обнаружить на ранней стадии или даже избежать развития не только рака, но и других заболеваний. Регулярные обследования позволяют выявить злокачественные новообразования на самом раннем этапе в 95% случаев. А это значительно повышает шансы на полное выздоровление.
Наша ДНК может изменяться вследствие многих факторов, поэтому важно заботиться о своем организме. Придерживайтесь здорового образа жизни, правильно и разнообразно питайтесь, контролируйте массу тела. Поддержание этих факторов в норме существенно снижает риск развития онкологических заболеваний. Отказ от вредных привычек и профилактика инфекционных заболеваний позволяют предотвратить поломки в генах и повышают вероятность сохранить свое здоровье как можно дольше.
Рак часто наблюдается у членов одной семьи, объективно подтверждена наследственная природа некоторых злокачественных опухолей. Есть точка зрения, что наследственная предрасположенность — самая вероятная причина всех онкологических заболеваний, и только дело времени, чтобы наука точно установила, мутация какого гена за какой конкретный рак отвечает. Но уже сейчас наследственную передачу рака можно прервать.
Если у человека возникло онкологическое заболевание, очень важно выяснить, есть ли в его роду другие случаи злокачественных новообразований. Семьям, в которых имеется более одного такого случая, нужно пройти консультацию врача-генетика, чтобы понять, есть ли в семейной истории основания для подозрений на наследственный характер патологии. Особенно настораживающим признаком будет онкологическое заболевание в нескольких поколениях семьи. Одним из основных методов работы врача-генетика является составление родословных. Другая важная часть медико-генетической консультации — осмотр и опрос пациента: наследственные заболевания нередко проявляются специфическими признаками.
Принципиальным отличием наследственного рака является возможность его прогнозировать путем выявления патогенных мутаций. На первом этапе семьям, в которых имеется более одного случая развития рака, рекомендуется пройти консультацию врача-генетика, по результатам которого можно будет понять, есть ли в семейной истории основания для подозрения на наследственный характер патологии.
Если в процессе консультации возникают подозрения на наследственную природу заболевания, то следующий этап — целенаправленное генетическое тестирование, поиск мутаций, которые могут вызывать конкретное заболевание. Одни исследования позволяют обнаружить изменения в самом гене, другие — в белке, который кодируется измененным геном. Один ген может претерпеть до 300 мутаций.
В последние годы найдены мутации, ответственные за возникновение и развитие рака молочной железы, яичников, толстой кишки и др. Цель генетического тестирования, или скрининга,— выявить риск возникновения заболевания до появления симптомов. Это дает возможность в одних случаях провести своевременное лечение, в других — рекомендовать меры, позволяющие избежать передачи наследственного заболевания потомству. Мутации генов найдены для нескольких видов рака, тесты на некоторые из них уже используют в клинике — например, тесты на рак груди и кишечника.
От предков или не от предков
Все онкологические заболевания имеют генетическую природу, поскольку при раке гены, отвечающие за правильное деление клетки, повреждены. Но в одних случаях имеют место наследственные мутации, а в других — приобретенные. Результатом повреждения (мутации) гена во всех случаях является бесконтрольное неограниченное деление клеток, что и является сутью ракового процесса.
Несмотря на то что онкологические заболевания имеют генетическую природу, только 10–15% из них передаются по наследству. Почему важно знать, наследственный или ненаследственный рак? Потому что если установлена его наследственная природа, то есть выявлена мутация, вызвавшая его, то известен прогноз и понятна тактика в отношении самого больного и его родственников. Особенно отчетливо наследование мутации прослеживается в случаях так называемого семейного рака молочной железы и яичников, при семейном аденоматозном полипозе и различных опухолевых синдромах (Линча — рак толстой кишки, Ли-Фраумени — разнообразные саркомы и др.). Многие люди, сами будучи здоровыми, являются носителями мутаций, приводящих к наследственным заболеваниям. Если носители одной и той же мутации — оба родителя, заболевание становится неизбежным. Генетическое тестирование позволяет это выявить.
Следует подчеркнуть, что наличие мутации не означает заболевания. Мутация может сидеть в гене много лет до того, как начнет развиваться опухоль. Но, зная про мутацию, врачи могут назначить рациональный режим обследования и профилактического лечения.
Например, у женщин—носительниц гена BRCA1 в 95% случаев в течение жизни разовьется рак груди и в 65% — рак яичников, причем часто рак развивается в молодом возрасте, до 50 лет. Это означает, что носительница должна все время находиться под наблюдением, а в некоторых случаях целесообразно ставить вопрос о профилактическом удалении груди и (или) яичников. У всех на слуху история Анджелины Джоли, которая настояла на удалении обеих молочных желез, поскольку у нее обнаружили мутацию гена BRCA1.
Специалисты знают результаты исследования ткани удаленных молочных желез у 54 шведских женщин—носительниц этого гена в возрасте до 51 года. Ни у одной из них обследование не показывало опухоли груди до операции, но гистологическое изучение удаленной ткани выявило наличие раковых клеток у пяти (10%!) из них.
К профилактической хирургии прибегают и при семейном аденоматозном полипозе, при котором вероятность развития рака толстой кишки после 40 лет достигает 100%, и при других онкологических заболеваниях, если установлена онкогенная мутация.
Понятно, что женщины с отрицательным результатом теста на мутации генов BRCA1 и BRCA2 не застрахованы от спорадического рака груди и яичников. Однако вероятность его возникновения несопоставимо ниже, чем у женщин с положительным тестом.
Женщине следует заподозрить у себя предрасположенность к наследственному раку груди, пройти консультацию врача и генетика и генетическое тестирование, если в семье:
— было более одного случая рака груди или яичников по женской линии (у матери, бабушки, тетки, сестер и т. д.);
— заболевание было диагностировано в молодом возрасте (до наступления климакса);
— были случаи рака груди у мужчины;
— были больные c множественными опухолями (например, у одного человека — рак груди, толстой кишки, матки, рак поджелудочной железы и т. д.);
— были случаи двустороннего рака обеих молочных желез или обоих яичников.
Тестирование и его последствия
Генетическое тестирование имеет несколько преимуществ. Отрицательный результат может принести человеку облегчение, избавить от страха ожидания тяжелой болезни, от которой, возможно, погибли его близкие, а также от регулярных обследований, которые должны быть обязательны в семьях с высоким онкологическим риском. Положительный результат дает человеку возможность принимать обдуманные решения о будущем своем и своего потомства.
Сегодня возможна профилактика наследственного рака, то есть возможность не передать от родителей потомству ген, несущий опасную мутацию. Метод, который позволяет это сделать, называется преимплантационная генетическая диагностика (ПГД). Он заключается в следующем: для пары выполняют ЭКО, проводят генетическую диагностику полученных эмбрионов и переносят в матку женщины только те из них, в которых нет онкогенных мутаций. У родившегося ребенка их не будет, а значит, не будет и наследственного рака.
Открытое письмо Анджелины Джоли, New York Times, 14 мая 2013 года
ПГД проводится не на всем эмбрионе, а на нескольких клетках, которые получают путем его биопсии. Доказано, что биопсия не оказывает влияния на здоровье и состояние ребенка. Другими словами, ПГД не снижает частоту наступления беременности и безопасна для будущего ребенка.
Кроме мутаций, отвечающих за развитие рака груди и яичников, установлены мутации, несущие предрасположенность к меланоме, раку желудка, матки, предстательной, поджелудочной и щитовидной железы, толстой и прямой кишки. Если мутация определена и в семье есть люди, которые хотят иметь ребенка, важно, чтобы они знали о возможности предотвратить передачу следующим поколениям этой мутации и связанного с ней рака с помощью ЭКО и ПГД.
Краткий очерк развития генетики рака
В настоящее время не вызывает сомнения тот факт, что рак - это генетическая болезнь, в основе которой лежат изменения в геноме клетки. То есть это болезнь, связанная с потерей, повреждением, активацией, или, наконец, привнесением извне определенных генов.
Развитие теории канцерогенеза проходило длительное время, в несколько этапов, и характеризовалось прогрессирующим усилением генетического паттерна. Развитие наиболее значимых концепций канцерогенеза – гормонально метаболической, иммунологической, вирусной и др., закономерно привело к пониманию того, что рак является, по существу, генетической болезнью. Именно генетическая методология позволила придать теоретическую форму представлениям об опухолевом росте. Хотя, несмотря на все успехи, полнота этих представлений весьма относительна.
Более полный вариант мутационной теории рака был сформулирован Бауером К.Х. в 1928 году, фактически на заре генетики (Bauer,1928) Согласно Бауеру, "не существует наследственной передачи рака в точном смысле этого выражения. … Речь идет о наследовании склонности тканей образовывать опухоли при определенных внешних условиях". Эта склонность появляется вследствие возникновения в тканях соматических мутаций, которые могут быть очень разнообразными и включают как генные, так и хромосомные изменения" (Горбунова, Имянитов, 2007). Несмотря на то, что в 1929 году было показано, что в раковых клетках значительно выше частота аномалий кариотипа, эти представления отошли на второй план и на десятки лет уступили место другим гипотезам.
В 70-е годы прошлого века было показано, что способность вируса к злокачественной трансформации определяется наличием всего одного гена, названного онкогена src. Позже установили, что аналогичный характер наследования характерен для большинства онкогенных вирусов.
Появилась возможность искать аналоги вирусных онкогенов в геномах других организмов. Оказалось, что они встречаются достаточно часто. В геноме человека присутствуют гомологи всех вирусных онкогенов. Дальнейшие исследования показали, что эти гомологи контролируют важнейшие этапы жизни клетки, такие как пролиферация, дифференцировка, клеточный цикл и др. В клетках человека присутствуют десятки онкогенов, не все из которых связаны с вирусными онкогенами. Безусловным достижением стало открытие факта активации онкогенов в опухолях. Оказалось также, что вирусные онкогены не являются точными копиями клеточных онкогенов. Они несут многочисленные мутации, в том числе и довольно протяженные хромосомные перестройки. Именно эти изменения определяют трансформирующую способность вирусных онкогенов.
Таким образом, в результате разработки метода гибридизации нуклеиновых кислот было открыто, что все вирусные онкогены имеют гомологи в составе генома человека. Они ответственны за пролиферацию, дифференцировку, контроль клеточного цикла.
Доказательство определяющей роли мутагенеза в формировании онкогенности стало важной вехой мутационной теории рака. Именно эти представления послужили основой открытия антионкогенов. В 80-е годы XX века было установлено, что практически каждая опухоль, кроме мутаций в онкогенах, содержит множественные мутации в так называемых антионкогенах. Эти мутации могут быть как точковыми, так и делеционной природы. Предполагается, что инактивирующие мутации в генах супрессирующих развитие опухолей встречаются гораздо чаще, чем доминантные мутации, активирующие онкогены.
Открытие протоонкогенов и генов-супрессоров послужило прямым доказательством мутационной природы рака. Было показано, что изменение их структуры и экспрессии за счет различных мутационных процессов приводит к злокачественной трансформации (Rayter et al., 1989).
Благодаря развитию молекулярной медицины в 90-х гг. было доказано, что рак относится к генетическим мультифакторным заболеваниям. Было накоплено огромное количество фактов, которые свидетельствовали о мутационной природе рака. Прежде всего, это мутагенность практически всех известных физических и химических канцерогенов (Ауэрбах, 1978).
Был осуществлен перенос трансформированного фенотипа с помощью ДНК от злокачественных клеток (спонтанно и химически трансформированных) и опухолей в нормальные (Perucho et al., 1981; Shin et al., 1979). Существование тесной взаимосвязи темпов спонтанного возникновения генных мутаций и отдельных признаков злокачественнной трансформации стало доказательством мутационного происхождения последних (Varshaver et al., 1983; Bellett et al., 1979).
К началу 90-х гг. в онкологии сложилась точка зрения, согласно которой причиной возникновения большинства опухолей считается сочетание мутаций в онкогенах и антионкогенах. Как полагает современная наука, минимум 5-9 мутаций необходимо в различных онкогенах и антионкогенах, чтобы возник трансформированный клеточный клон (Kinzler, Vogelstein, 1997). При частоте мутирования, равной 10-6-10-5, характерной для нормальных соматических клеток, злокачественная трансформация была бы практически невероятным событием. Очевидно, чаще всего подобные мутации возникают последовательно и вне зависимости друг от друга. Это предопределяет путь развития заболевания и приводит к завершению процесса начавшейся неоплазии. По всей видимости, на каком-то этапе трансформации опухолевый клон приобретает свойство геномной нестабильности, т.е. способность к ускоренному мутагенезу. При этом с каждой новой мутацией происходит как бы последовательное "клонирование" трансформированных клеток с наращиванием потенциала их канцерогенности.
Проверка достаточно логичного предположения о том, что на каком-то этапе трансформации опухолевый клон приобретает гипермутабильный фенотип, стала одним из основных направлений молекулярной генетики рака в 90-е годы прошлого века. Исследования подтвердили существование генетической нестабильности опухолей - этот феномен продолжает интенсивно изучаться и в настоящее время.
Таким образом, во многом благодаря успехам генетики, молекулярная онкология вошла в XXI век вооруженная достаточно четкими представлениями о патогенезе новообразований. Молекулярно-генетические изменения, ведущие к развитию неоплазм, сводятся к трем последовательно реализующимся компонентам: 1) активация онкогенов; 2) инактивация опухолевых супрессоров; 3) развитие геномной нестабильности. Такое развитие событий определяет характерное для опухолей разнообразие генетических повреждений.
Семейные случаи рака
В большинстве случаев хромосомные мутации возникают в одной клетке спонтанно, под влиянием факторов внешней среды. Дальнейшее бесконтрольное деление этой клетки приводит к возникновению раковой опухоли. Случаи такого рака называются спорадическими, они не связаны с наследственностью. Спорадические формы рака встречаются с существенно большей частотой.
Известно, что некоторые формы злокачественных опухолей могут изредка возникать у нескольких членов одной семьи. Это касается и раковых опухолей плотных тканей и опухолевых заболеваний кроветворной системы. Когда измененные хромосомы унаследованы при рождении и присутствуют в каждой клетке тела человека, такая форма рака называется наследственной.
Семейная форма рака обнаруживается у членов одной семьи и вероятность возникновения заболевания у здоровых членов семьи в несколько раз выше, чем в случае спорадического рака. Заболевание показывает четкую наследственную картину.
Заранее узнать, кто из родственников – носитель мутантных генов, невозможно, - только половина родственников являются носителями мутаций того или иного гена. Все члены таких семей составляют группу повышенного риска. Ранее "семейную онкологию" связывали с многочисленными факторами, включающими канцерогены, ионизирующее облучение, экологические воздействия или вирусы, вызывающими опухоли. Однако научно-экспериментального подтверждения теории, связанные с этими факторами, не взирая на длительное и кропотливое обследование членов таких семей, не получили.
Достижения молекулярной биологии привели к открытию наследственных генетических дефектов, которые приводят к развитию рака.
К наследственным опухолевым синдромам относятся те заболевания, которые характеризуются 80-100% риском появления новообразований. К характерным особенностям наследственных злокачественных опухолей относится вероятность их возникновения в раннем периоде онтогенетического развития. Семейные случаи заболевания раком составляют всего лишь несколько процентов от всех пациентов онкологических клиник.
Наследственные опухолевые синдромы можно условно отнести к двум группам. Это редкие болезни, при которых опухоли не являются главными клиническими проявлениями; и "семейные раки" с довольно высокой встречаемостью. При этом развитие опухолей в каждом случае идет одинаковым путем и обусловлено наследованием гетерозиготных инактивирующих мутаций в супрессорных генах.
Семейные случаи злокачественных заболеваний однородны по составу мутаций, повреждающих гены-супрессоры. В связи с этим они легко поддаются ранней диагностике и даже профилактическому лечению.
Каковы же механизмы передачи предрасположенности к определенному виду опухолей? Все дело в существовании рецессивных онкогенов. Если в соматической клетке поврежден один аллель подобного гена, клетка остается фенотипически нормальной. Если же произошла мутация и в материнской и в отцовской копии, клетка приобретает черты злокачественной трансформации. Что произойдет, если мутация одного из аллелей рецессивного онкогена передастся пациенту через гаметы? Все соматические клетки будут иметь лишь одну "здоровую" копию. Повреждение оставшегося интактного аллеля всего лишь в одной из миллионов клеток органа-мишени приведет к возникновению клона с потенциями к злокачественному росту.
Важно то, что если на уровне клетки подобные нарушения носят рецессивный характер, то на уровне организма наследование происходит по доминантному типу. Носительство зародышевых раковых мутаций бывает лишь гетерозиготным. По всей видимости, аналогичные гомозиготные состояния и нормальное развитие эмбриона попросту несовместимы (Имянитов и др., 1993, Имянитов, Хансон, 2007; Caldas, Ponder, 1997).
Таким образом, из вышесказанного можно вывести клинико-генетические характеристики наследственных опухолевых синдромов:
- доминантный тип наследования (гетерозиготы, то есть лица с врожденным поражением только одного из двух аллелей антионкогена, являются "больными");
- высокая встречаемость онкологической патологии среди кровных родственников больного;
- необычно ранний возраст появления неоплазм (вполне достаточно мутации в одном аллеле антионкогена, а не в двух; в результате чего функциональная инактивация последнего у носителей происходит намного быстрее, чем у здоровых);
- множественность опухолей (т.е. вероятнее возможность того, что блокировка супрессорного гена произойдет в двух независимых клонах (Quesnel, Malkin, 1997; Caldas, Ponder, 1997; Имянитов, Хансон, 2007).
В настоящее время все основные типы семейных раков и соответствующие им мутации идентифицированы.
Таким образом, как мы уже упоминали выше, рак - заболевание с ярко выраженной наследственной компонентой. Тем не менее, это не значит, что заболеет каждый, у кого имеется онкологически больной родственник. Целый ряд генов-супрессоров опухолевого роста препятствует неконтролируемому клеточному делению, и направляет сильно поврежденные клетки на путь апоптоза - запрограммированной клеточной смерти.
Недавно было установлено, что предрасположенность к возникновению семейных раковых опухолей создается специфическими изменениями гена, расположенного в 13-й хромосоме, который имеет свойства супрессора опухолей.
Например, при некоторых видах рака наблюдается мутация в 13-й хромосоме, в которой находится ген ARLTS1, который, как предположили, участвует в супрессии роста опухолей. Calin с соавт. (2005) исследовали участок 13-й хромосомы, содержащей данный ген. Анализу подверглись 216 образцов ДНК клеток спорадических опухолей лёгких, щитовидной железы, кишечника, молочных желёз, а также кровь 109 пациентов с семейными опухолями различной локализации. Контролем служили образцы крови 475 здоровых людей или больных с заболеваниями, неопухолевой природы
Анализ образцов ДНК опухолей и клеток крови онкологических больных показал, что во всех видах злокачественных опухолей ген ARLTS1 заторможен.
Дополнительное экспериментальное исследование на животных позволило установить, что искусственное блокирование гена ARLTS1 действительно способствует активному появлению и развитию опухолей в различных тканях организма.
Таким образом, было установлено, что ген ARLTS1 в 13-й хромосоме имеет свойства супрессора опухолей. Специфические изменения в нём предрасполагают к возникновению семейных раковых опухолей.
Спорадическая форма рака также имеет генетическую компоненту, но она намного сложнее. Опухоль в этом случае развивается под воздействием не одной, а целой группы мутаций. Исследования полиморфизма генов, вовлеченных в канцерогенез, позволили выявить такие сочетания мутантных аллелей генов, которые существенно повышают риск возникновения рака. Спорадические опухоли не так просто обнаружить. Для большинства таких опухолей не найдено никакого генетического изменения, однозначно указывающего на то, что процесс злокачественного роста запущен. Генетическая сложность в этих случаях не позволяет провести раннюю диагностику, либо подобрать специфическое лечение.
Благодаря комбинационной изменчивости такие сложные генотипы распадаются уже в следующем поколении. Этим и объясняется отсутствие больных родственников у пациентов со спорадическим раком.
В случае подозрения наследственного опухолевого синдрома проводят генетическое исследование. Составляют родословные, которые помогают выявить наследственные патологию. Анализ ДНК позволяет установить, имеются ли в генотипе больного и его родственников подозреваемые мутации. Выявление и диагностика наследственных раковых болезней – весьма сложный процесс. К тому же полученная информация приносит свои положительные результаты только в том случае, когда уже имеются эффективные меры профилактики и лечения выявленных новообразований.
Читайте также:

