Радиочастотная абляция при раке легких

Онкологическое заболевания легких диагностируется с каждым годом все чаще. На возникновение рака влияет много причин, но ученые до сих пор не определили с точностью, почему оно появляется. Метод радиочастотной абляции зарекомендовал себя как высокоэффективное средство борьбы с метастазами в разных органах, в частности и легких.
Что собой являет опухоль в легких и метастазы
Онкология легких являет собой злокачественное новообразование, что на первой и второй стадии развития никак о себе не дает знать. Только на более поздних стадиях проявляются такие симптомы, как:
- боль в грудине, одышка;
- затяжной кашель;
- кровохарканье;
- значительная и стремительная утрата веса;
- отсутствие аппетита;
- высокая температура тела в вечернее и ночное время.
Все эти симптомы могут говорить и о распространение метастаз, которое требует немедленных действий и правильно подобранной терапии.
Что такое радиочастотная абляция
Одним с наиболее распространенных и эффективных вспомогательных средств в лечении метастаз при онкологии дыхательных путей является радиочастотная абляция (РЧА). Она являет с собой воздействие тока высокой частоты непосредственно на метастаз. Раковые клетки очень чувствительны к радиочастотному воздействию, что нагревает ткани опухоли, не выдерживают его влияния и гинут. На жизнедеятельность здоровых клеток этот метод не влияет губительно, они менее восприимчивы к нагреванию.
Много людей не знают, что такое радиочастотная абляция при метастазах легких и представляют себе эту процедуру как что-то страшное и безумно опасное. На самом деле это не так.
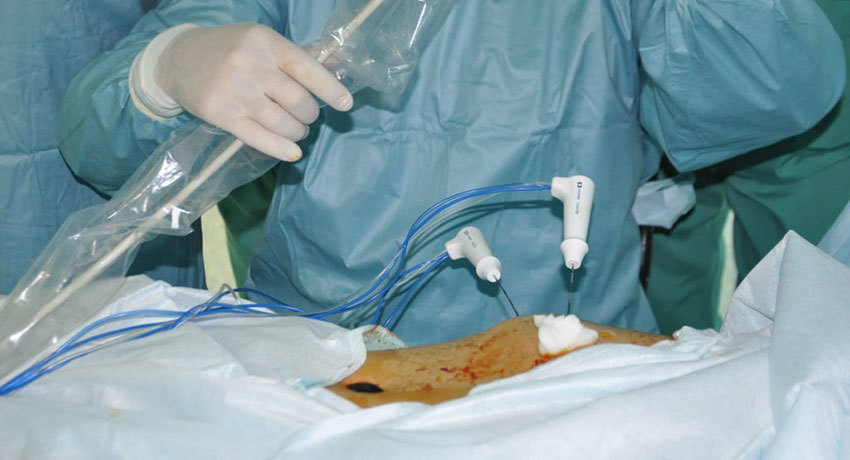
Эту процедуру проводят под строгим наблюдением аппаратов КТ, МРТ и УЗ, перед этим пациент должен пройти полную диагностику и подготовку к процедуре. Перед ее началом больной не должен употреблять пищу как минимум 5 часов до проведения.
Абляция проводится под общей или местной анестезией (это зависит от величины и количества злокачественных новообразований), специальный зонд с электродами наводится на очаг рака и подается напряжение. Длительность электромагнитного излучения определяет врач.
Что лучше радиочастотная или лазерная абляция?
Люди, что столкнулись впервые с проблемой злокачественной опухоли и никогда раньше не слышали о методах лечения, не могут определить, что собой представляют разные методы и какие из них лучшие.
Каждый метод имеет свои положительные и негативные стороны, трудно сказать какой лучше. В каждом определенном случае только врач может определить, какой способ лечения подходит больному.
Разница между двумя методами обстоит в следующем: лазерное воздействие намного короче и имеет более высокие температуры, радиочастотное происходит дольше, но нагревает ткани с меньшей интенсивностью, проще говоря, здоровые клетки в организме человека получают намного меньший стресс и не повреждаются.
В случае лечения рака легких на поздних стадиях более часто применяют радиочастотную абляцию метастазов.
Противопоказания к применению метода
Делать радиочастотную аблацию при лечении метастазов легких не рекомендуется в следующих случаях:
- при тромбозах и заболеваниях сердца;
- острые инфекционные заболевания организма;
- при аневризмах сосудов;
- индивидуальная непереносимость йода.
Показания и точные противопоказания может только определить лечащий врач онколог, после полного обследования, когда он увидит общую картину болезни. Сам метод является достаточно безопасным для здоровья и жизни больного.
Осложнения после применения метода случаются крайне редко, но все же в некоторых случаях могут наблюдаться такие симптомы:
- кровотечение – причиной может стать самостоятельное передвижение пациента на протяжении первого часа-двух после манипуляций;
- инфекция – может попадать внутрь в месте введения зонда и внести ее может сам больной или медицинский персонал;
- повреждение соседних органов – случается, когда опухоль очень большая или же метастазы распространяются на большое расстояние от очага;
- пневмоторакс – может случаться крайне редко, это сжатие легкого, что проявляется трудностями в дыхании.
Именно по этой причине после проведения таких манипуляций больной должен провести в больнице под наблюдением врачей не меньше 24 часов с момента операции. На протяжении 12 часов крайне не рекомендуется самостоятельно передвигаться, это может привести к негативным последствиям.
Нормой после манипуляций считается не интенсивная боль, что проходит на протяжении недели, повышенная температура тела первые три-пять дней, общее недомогание.
Если после проведения радиочастотной абляции легкого возникли любые усложнения или интенсивная боль не проходит, об этом нужно обязательно сообщить врачу.
В последнее время многие клиники за рубежом применяют методику радиочастотной абляции для лечения первичного рака легких и рака с метастазами. В Онкологическом центре данная методика применялась 18 пациентам с опухолевыми новообразованиями диаметром от 1 до 3.5 см. За полгода наблюдений у 6 больных продолжился рост метастаз. Однако у остальных была отмечена положительная динамика.
Лечение метастаз в легких с использованием метода абляции достаточно эффективно, так как находящийся вокруг патологических участков кислород помогает направить энергию излучения непосредственно в опухоль, не затрагивая при этом легочную ткань.
Метастазы злокачественных опухолей в легкие редко бывают изолированными. Основным показанием к оперативному удалению метастазов является отсутствие рецидива первичного онкологического образования. Как правило, после удаления метастаз пациенты живут еще 5 лет (в 45% случаев), тогда как летальные исходы после вмешательства наблюдаются только в 2% случаев. Из всего этого можно сделать вывод, что радиочастотная абляция является весьма эффективным методов по лечению рака легкого с множественными метастазами.
В чем заключается методика?
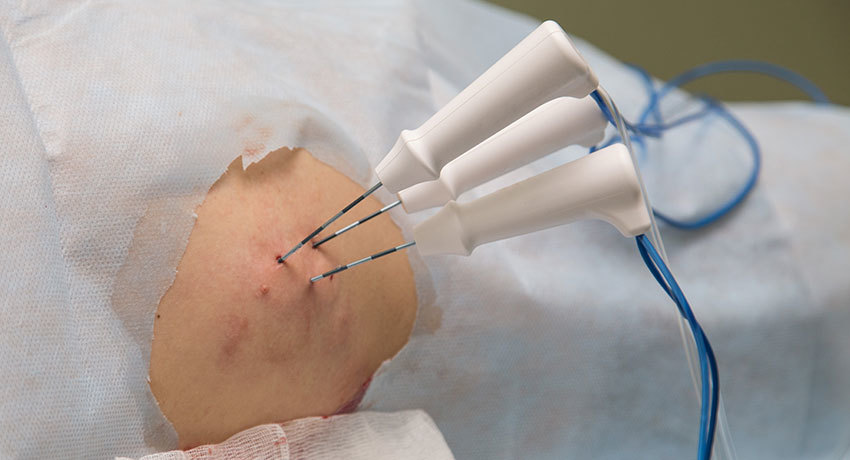
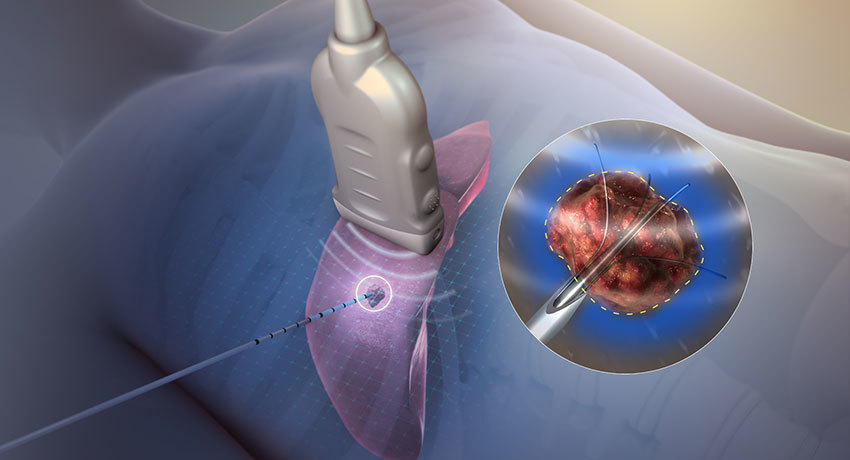
Метод радиочастотной абляции проводится тем пациентам, которые не могут лечиться никакими другими методами из-за наличия противопоказаний. Пациенту через межреберный промежуток вводят тонкую иглу-электрод. Процедура введения иглы контролируется аппаратом УЗИ или КТ. Температура мишени новообразования составляет 90 градусов и поддерживается до получаса, в зависимости от ее размера. Если есть такая возможность, зона облучения должна включать в себя весь патологический участок и плюс 1 см здоровой легочной ткани. За счет высокой электропроводной окружающей ткани легкого при малых размерах патологического новообразования общее время процедуры несколько меньше, чем при радиочастотной абляции такого же размера опухоли в печени.

Перед началом процедуры пациенту проводят обезболивание, чтобы он переносил лечение комфортно. Если патологический очаг локализуется близко к висцеральному листку плевры и крупных бронхов, то при кашле, чихании у пациента болевой рефлекс может быть значительно сильнее. В некоторых случаях для проведения процедуры приходится применять эндотрахеальный наркоз.
После проведения процедуры пациенту повторно назначают КТ. Успешно проведенное лечение оставляет отек легочной ткани на 0,5-1 см от предполагаемой зоны абляции.
Эффективность лечения
К радиочастотной абляции прибегают в следующих случаях:
• Пациент не способен перенести хирургическое вмешательство;
• У пациента многочисленные метастазы в легких.
Данный метод лечения используют для:
• Уменьшения размеров опухоли;
• Облегчение состояния больного при пенетрации опухоли в стенку грудной клетки.
Метод РЧА не является заменителем лучевой или химиотерапии, но может быть эффективным в сочетании с данными методами.
Для подбора эффективного метода лечения вы можете обратиться за
- методы инновационной терапии;
- возможности участия в экспериментальной терапии;
- как получить квоту на бесплатное лечение в онкоцентр;
- организационные вопросы.
После консультации пациенту назначается день и время прибытия на лечение, отделение терапии, по возможности назначается лечащий доктор.
Радиочастотная абляция при опухолях легкого
В последние годы значительно возросло количество больных 4 стадией рака с метастазами в печень, легкие, почки, кости, среди них потенциально нуждающихся в оперативном лечении только по поводу первичного и метастатического рака печени в России более 10000 человек в год. Перспективным направлением лечения данной группы больных является метод радиочастотной аблации (РЧА). При ранних стадиях рака легких как альтернатива хирургическому лечению рассматривается радиочастотная абляция (РЧА). При данном способе лечения под контролем КТ через кожу в раковую опухоль вводится игла. Затем на кончик иглы передается высокочастотная энергия. Это приводит к нагреванию тканей, гибели клеток раковой опухоли и закрытию мелких сосудов, снабжающих опухоль кровью. РЧА является безболезненной процедурой.
Исследования показали, что при использовании данного вида лечения на ранних стадиях рака легких выживаемость пациентов такая же, как и при хирургическом лечении. К тому же отсутствуют риски, связанные с операцией и длительным временем восстановления. К преимуществам метода относят:
- Малую травматичность и низкий процент осложнений.
- Низкую послеоперационную летальность.
- Уменьшение сроков пребывания в стационаре.
- Возможность повторных вмешательств.
- Этапное воздействие при множественных очагах.
- Первичный рак и/или МТС поражение печени;
- Периферический рак легких и/или МТС поражение легких;
- Первичный рак почки и/или МТС поражение почек.
- Чрезкожно пункционно под контролем УЗИ;
- Резекция печени (так называемая бескровная резекция печени);
- Циторедуктивные операции с одномоментным удалением первичного очага и МТС c применением аппарата Cool-tip;
- Лапароскопические операции.
- Диагностика рака легких
- Лечение рака легких
- Прогноз лечения рака легких
- Лечение рецидива рака легких
- Экспериментальное лечение рака легких
- Рак легких - хирургическое лечение
- Рак легких - химиотерапия
- Рак легких - лучевая терапия
- Рак легких - прицельная терапия
- Рак легких - РЧА
- Рак легких - фотодинамическая терапия
- Рак легких - профилактика
- Рак легких – Лечение в Израиле
- Лечение рака легких в клинике Ихилов
- Лечение рака легких в клинике Ассута
- Лечение рака легких в клинике Герцлия
- Лечение рака легких в клинике Шиба
- Лечение рака легких в клинике Рамбам
- Рак легких – Лечение в Германии
- РЧА рака легких в клиниках Германии
- Лечение рака легких в клинике Вивантес
- Лечение рака легких в клинике Шарите
- Лечение рака легких в Униклинике Тюбингена
- Рак легких – Лечение в Швейцарии
- Методы лечения рака легких
- Лечение рака легких в Берлине
Предложения клиник
FUS-абляция миомы матки в центре Нордвест
Уникальный неинвазивный метод лечения миомы в клинике Нордвест. Ведущие специалисты и профессора.
Терапия HIPEC в немецких клиниках
Терапия HIPEC - это сочетание хирургического вмешательства, гипертермии и химиотерапии. Повышенная концентрация химии без лишнего вреда организму.
Полный онкологический чек-ап в Москве
Онкоцентр "София" предлагает различные методы диагностики рака на любой стадии.
- В России
- В Израиле
- В Германии
- В Швейцарии
РЦРЗ (Республиканский центр развития здравоохранения МЗ РК)
Версия: Клинические протоколы МЗ РК - 2016
Общая информация
Приложение 1
к клиническому протоколу диагностики и лечения
Лечение
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Цель проведения процедуры/вмешательства: целью радиочастотной абляции (РЧА) является полный некроз злокачественного новообразования легких с возможностью длительной безрецидивной выживаемости.
Радиочастотная абляция – это метод разрушения опухолевой ткани с помощью высокоэнергетических радиоволн, в процессе которого происходит нагревание клеток опухоли до высоких температур и, как следствие, их гибель. Радиочастотная абляция способствует как частичному, так и полному удалению опухоли.
Показания и противопоказания для проведения процедуры/ вмешательства:
Показания к проведению РЧА злокачественных опухолей легких:
· больные НМРЛ I–II стадий, не подлежащие хирургическому лечению по следующим причинам:
- сопутствующие заболевания;
- отказ пациента от хирургического лечения.
· отсутствие внелегочных проявлений заболевания;
· рецидив опухоли менее чем через 6 мес. после резекции легкого;
· удаленная первичная опухоль (при метастазах в легких);
· больные, имеющие несколько метастазов (всего не более 6) в разных долях легких;
· менее 3 метастазов в каждом легком;
· диаметр опухоли до 4 см;
· опухоли, визуализируемые при РКТ;
· локализация опухоли не ближе 1 см от прикорневых структур;
· согласие больного на проведение лечения.
Противопоказания к РЧА злокачественных опухолей легких:
Абсолютные:
· некоррегируемая коагулопатия;
· сепсис;
· метастатический плеврит.
Относительные:
· наличие у пациента искусственного водителя ритма;
· опухолевые узлы прилежат к диафрагме либо располагаются ближе 1 см к прикорневым структурам;
· расположение опухоли рядом с крупными сосудами (аорта, легочные артерии), пищеводом, грудной стенкой, диафрагмой;
· близость сосудов > 3 мм в диаметре;
· первичная опухоль не удалена;
· более 3 метастазов в каждом легком;
· общее количество метастазов более 6.
Перечень основных и дополнительных диагностических мероприятий (отдельно перечислить основные/обязательные и дополнительные обследования, консультации специалистов с указанием цели и показаний):
Основные (обязательные) диагностические обследования:
· ОАК с тромбоцитами;
· ОАМ;
· группа крови и резус-фактор;
· биохимический анализ крови: общий белок с фракциями, АЛТ, АСТ, общий/прямой билирубин, ЩФ, ГГТП, ЛДГ, креатинин, мочевина, амилаза, глюкоза;
· электролиты: калий, натрий;
· микрореакция;
· коагулограмма: протромбиновое время, МНО, АЧТВ, фибриноген;
· маркеры вирусных гепатитов: HBsAg, anti-HCV, ВИЧ;
· альфа-фетопротеин, специфические опухолевые маркеры;
· ЭКГ, спирометрия;
· УЗИ органов брюшной полости;
· рентгенография органов грудной клетки;
· КТ/МРТ торакального сегмента с контрастированием;
· биопсия до РЧА: морфологическое подтверждение злокачественного характера опухоли легкого является обязательным до ее термодеструкции. Биопсия может выполняться непосредственно перед РЧА, однако предпочтительнее проводить ее заранее, чтобы избежать возможных связанных с ней осложнений и сдвинуть сроки проведения РЧА. Кроме того, могут быть выявлены особенности при морфологическом исследовании, способные повлиять на тактику лечения.
Дополнительные диагностические обследования:
· anti-HAV, anti-HEV, anti-HDV IgG;
· ПЦР HBV DNA и HCV RNA качественный тест, при положительном результате anti-HDV IgG – ПЦР РНК HDV;
· у мужчин - РЭА, СА 19-9;
· у женщин - ХГЧ, СА-125;
· УЗИ периферических лимфатических узлов, пальцевое исследование прямой кишки, осмотр гинеколога (у женщин);
· сцинтиграфия костей для исключения костных метастазов;
· ПЭТ/КТ.
Особенности подготовки больного к РЧА злокачественных опухолей легких:
· решение о проведении РЧА как первичных, так и метастатических опухолей легких должна принимать мультидисциплинарная комиссия;
· при сборе анамнеза необходимо уточнить:
− наличие геморрагического диатеза;
− наличие бронхолегочных заболеваний и/или ранее перенесенные хирургические вмешательства на легких, в том числе пульмонэктомии (описаны единичные клинические наблюдения РЧАопухолей в единственном легком);
− наличие пэйсмейкера сегодня не является абсолютным противопоказанием к выполнению РЧА, однако рекомендуется его деактивировать перед вмешательством либо располагать электрод не ближе 5 см от водителя ритма;
− следует иметь в виду, что имплантированные мелкие металлические фрагменты могут нагреваться во время РЧА.
· факторы, оказывающие влияние на эффективность воздействия:
− размеры узлов [при размерах опухолевых узлов менее 3 см отмечены лучшие результаты как для первичных (в виде увеличения частоты полных некрозов и локальной безрецидивной выживаемости), так и для метастатических опухолей легких (увеличение общей выживаемости);
− локализация узлов (ограниченная возможность выполнения РЧА опухолей прикорневой зоны, опухолей, прилежащих к крупным сосудам, бронхам).
Требования к техническому оснащению:
· наличие всех инструментов/оборудования, необходимых для радиочастотной абляции -генератора, системы охлаждения;
· помещение должно быть оснащено системой вентиляции, обеспечивающей оптимальные условия для профилактики хирургической инфекции и работы с газами, используемыми при анестезии;
· наличие инструментов, расходных материалов и оборудования для проведения анестезиологического пособия. Инструменты и оборудование должны находиться непосредственно в операционной или смежных помещениях и быть доступны в любое время.
Требования к оснащению, расходным материалам, медикаментам:
· любая сертифицированная система для РЧА опухолей: одноигольчатые электроды с максимальным диаметром воздействия 3 см, выдвигающиеся электроды с максимальным диаметром воздействия 5см и др.;
· система лучевой навигации: РКТ,УЗИ, МРТ;
· анестезиологическое оборудование (аппарат для искусственной вентиляции легких, монитор для контроля сердечной деятельности, артериального давления, сатурации и др.);
· динамический контроль: КТ с внутривенным контрастным усилением, ПЭТ/КТ, МРТ с внутривенным контрастным усилением. Критерии оценки результатов: mRECIST, EASL.
Основные расходные материалы:
· набор белья для инвазивных процедур;
· комплект кластерных или 1-3 одиночных электродов для РЧА;
· генератор;
· насос и система охлаждения;
· емкость для воды;
· ножной выключатель;
· ультразвуковой аппарат.
Дополнительные расходные материалы:
· внутривенные катетеры;
· система одноразовая для инфузий;
· скальпель одноразовый;
· марля медицинская;
· шприцы 20 мл;
· шприцы 10 мл;
· перчатки стерильные;
· перчатки нестерильные;
· шапочки одноразовые;
· маски хирургические;
· бахилы одноразовые;
· одноразовые электроды для ЭКГ.
Требования к подготовке пациента:
· вечером накануне операции легкий ужин до 20:00 часов;
· в день операции – голод;
· побрить операционное поле накануне операции;
· провести перед операцией все гигиенические процедуры: прополоскать полость рта, почистить зубы, снять съемные зубные протезы, очистить полость носа, мужчинам побриться;
· обработка операционного поля препаратами бактерицидного действия;
Индикаторы эффективности процедуры/вмешательства:
· отсутствие в послеоперационный период выявляемого всеми доступными визуализационными методами роста резидуальных опухолевых очагов в зоне выполненной абляции;
· отсутствие послеоперационных осложнений (осложнений, связанных с доступом и процедурой);
· снижение количества инвалидизирующих оперативных вмешательств;
· возможность многократного миниинвазивного проведения РЧА деструкции;
· повышение ожидаемой продолжительности жизни;
· повышение качества жизни.
Информация
- Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗСР РК, 2016
- 1) American Cancer Society. What are the key statistics for lung cancer? 12 November. – 2005. 2004.http://www.cancer. 2) Ковалёв В.Н., Старинский В.В. Современные тенденции в эпидемиологии рака лёгкого в России. Клиника,диагностика и лечение новообразований лёгких, средостения и плевры // Материалы IX Республиканской конференции. – Казань. – 2002. – С. 57-61. 3) Radiofrequency ablation of advanced lung tumors: imaging features, local control, and follow-up protocol. Ying Wang,Guodong Li, Wentao Li, Xinhong He, Lichao Xu. 2015; 8(10): 18137–18143.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4694311/ 4) Dienemann H. Principles of surgical treatment in localized non-small cell lung cancer // Lung cancer 33. – 2001, (Suppl.1).– P.3-8. 5) Farrell M.A., Di Marco D.C. Imaging-guided radiofrequency ablation of solid renal tumors // AJR Amer. J. Roentgenol. –2003. – Vol.180. – P.1509. 6) Gadaleta C., Mattioli V., Colucci G. et al. Radiofrequency ablation of 40 lung neoplasms: preliminary results // AJR Amer. J. Roentgenol. – 2004. – Vol.183. – P.361-368. 7) Gervais D.A., McGovern F.J., Arellano R.S. et al. Radiofrequency ablation of renal cell carcinoma: part 1. Indications, results,and role in patient management over a 6-year period and ablation of 100 tumors // AJR Amer. J. Roentgenol. – 2005.– Vol.185. – P.64-71. 8) Gervais D.A., Arellano R.S., Mueller P.R. Percutaneous radiofrequency ablation of renal cell carcinoma // Europ. Radiol. – 2005. – Vol.15(5) . – P.960-967. 9) Gervais D.A., Arellano R.S., McGovern F.J. et al. Radiofrequency ablation of renal cell carcinoma: part 2. Lessons learned with ablation of 100 tumors // AJR Amer. J. Roentgenol. – 2005. – Vol.185. – P.72-80. 10) Gillams A.R. The use of radiofrequency in cancer // Brit. J. of Cancer. – 2005. – Vol.92. – P.1825-1829. 11) Godley P., Kim S.W. Renal cell carcinoma // Curr. Opin. Oncol. – 2002. – Vol.14. – P.280-285. 12) Lee M.E., Curley S.A., Tanabe K.K. Radiofrequence ablation for cancer // Springer-Verlag New York, Inc. – 2004. – 307 p. 13) Licker M., Spiliopopulos A., Frey J.G. et al. Risk factors for early mortality and major complications following pneumonectomy for non-small cell lung carcinoma of the lung // Chest. – 2002. – Vol.121. – P.1890-1897. 14) Luis J. Herrera. Radiofrequency ablation of pulmonary malignancies. Radiofrequency ablation for cancer // Springer.– 2003. – P.193-211. 15) Mahnken A.H., Gunther R.W., Tacke J. Radiofrequency ablation of renal Tumors // Europ. Radiol. – 2004. – Vol.14(8) . – P.1449-1455. 16) Mahnken A.H., Rohde D., Brkovic D. et al. Percutaneous radiofrequency ablation of renal cell carcinoma: preliminary results // Acta Radiol. – 2005. – Vol.46(2) . – P.208-214. 17) Matsumoto E.D., Johnson D.B., Ogan K. et al. Short-term efficacy of temperature-based radiofrequency ablation of small renal tumors // Urology. – 2005. – Vol.65. – P.877–881. 18) Mayo-Smith W.W., Dupuy D.E., Parikh P.M. et al. Imaging-guided percutaneous radiofrequency ablation of solid renal masses: techniques and outcomes of 38 treatment sessions in 32 consecutive patients // AJR Amer. J. Roentgenol. – 2003. –Vol.180 (6) . – P.1503-1508. 19) Mickisch G., Carballido J., Hellsten S. et al. Guidelines on renal cell cancer // Europ. Urol. – 2001. – Vol.40. – P.252-255. 20) Ni Y., Miao Y., Mulier S. et al. A novel cooled-wet electrode for radiofrequency ablation // Europ. Radiol. – 2000. – Vol.10.– P.852-854. 21) Novick A.C. Nephron-sparing surgery for renal cell carcinoma // Ann. Rev. Med. – 2002. – Vol.53. – P.393-407. 22) Pavlovich C.P., Walther M.M., Choyke P.L. et al. Percutaneous radio frequency ablation of small renal tumors: initial results // J. Urol. – 2002. – Vol.167. – P.10-15. 23) Sakamoto T., Tsubota N., Iwanaga K. et al. Pulmonary resection for metastases from colorectal cancer // Chest. – 2001.– Vol.119. – P.1069-1072. 24) Traver M.A., Werle D.M., Clark P.E. et al. Oncological efficacy and factors influencing the success of computerized tomography (CT)-guided percutaneous radiofrequency ablation (RFA) on renal neoplasm // J. Urol. – 2006. – Vol.175 (Suppl).– P.360. 25) Van Sonnenberg E., McMullen W., Solbiati L. Tumor ablation // Springer Science + Business Media, Inc. – 2005. –543 p. 26) Wehle M.J., Thiel D.D., Petrou S.P. et al. Conservative management of incidental contrast-enhancing renal masses as safe alternative to invasive therapy // Urology. – 2004. – Vol.64. – P.49-52
Указание на отсутствие конфликта интересов: нет
Указание условий пересмотра протокола: пересмотр протокола через 3 года после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Применение радиочастотной абляции для лечения нарушений ритма сердца началось только в годах. Первые же публикации относительно объема коагулируемой ткани в печени относятся к началу годов ХХ века.
В годах опубликованы и другие экспериментальные данные о применении радиочастотной абляции печени. В середине годов ХХ века появились первые сообщения о паллиативном лечении метастатического поражения печени с использованием радиочастотной абляции. А вскоре и лечения опухолей легких и почек.
В настоящее время в России не более 10 центров, занимающихся проблемой лечения метастатического рака печени. В основном они располагаются в крупных городах, областных центрах с сильной медицинской школой — Москве, , Новосибирске, Томске. Таким образом, потребность в данной высокотехнологичной медицинской помощи удовлетворяется не более чем на 15%. Другой проблемой, сдерживающей развитие данной методики, является дороговизна аппаратного обеспечения. Так, стоимость одноразового набора для радиочастотной абляции составляет до 1000 долларов США, стоимость одного сеанса криоабляции может составлять до 5000 долларов США.
Методика термоабляции новообразований (физические основы абляции тканей)
Основным элементом электрохирургической системы является электрогенератор. Высокочастотный ток передается на электроды. Аппарат нагревает прилегающие к электроду мягкие ткани высокочастотным током специальной формы. В процессе разогрева с периодичностью 2 мс контролируется импеданс тканей. Высокочастотный ток может подаваться однократно или циклически в течение заданного времени. При однократной подаче высокочастотный ток разогревает прилегающие к электроду ткани до температуры (95–110 С) и в момент полного высушивания тканей подача тока автоматически прекращается. При циклической подаче аппарат в течение установленного времени повторяет следующие циклы: подача высокочастотного тока до разогрева (95–110 С) и полного высушивания тканей, выдержка паузы для увлажнения (уменьшения импеданса), возобновление подачи высокочастотного тока. Циклический процесс подачи тока, разогрева и высушивания, повторяющийся многократно, позволяет поддерживать высокую температуру в зоне абляции длительное время и достигать большого объёма коагулированной ткани.
Форма и объём зоны абляции зависят от выбранного электрода и режима работы. Зона абляции делится на три области по степени поражения ткани:
- ближе к электроду расположена область высушивания (дессикации) мягких тканей;
- далее располагается область коагуляции мягких тканей;
- область девитализации располагается вокруг зоны коагуляции.
При увеличении длительности (экспозиции) процедуры абляции общая зона абляции растёт незначительно, однако область дессикации увеличивается.
Показания и противопоказания
Абляцию опухолей применяют в тех случаях, когда невозможно выполнить радикальное оперативное лечение. Это может быть неоперабельность первичной опухоли или сопутствующая патология, которая делает невозможным выполнение радикальной операции в силу её объема и тяжести, но не препятствует выполнению абляции.
Согласно национальным рекомендациям, имеются следующие показания и противопоказания к радиочастотной абляции опухолей печени:
При чрескожном доступе:
- Предшествующее радикальное хирургическое лечение первичной опухоли;
- Отсутствие внепеченочных проявлений заболевания (при колоректальных метастазах);
- Наличие в печени 5 и менее опухолевых узлов (при метастазах нейроэндокринного рака допускается большее количество узлов);
- Диаметр узлов не более 5 см каждый (допустимо подвергать воздействию узлы исходно большего диаметра, но регрессировавшие в объеме под воздействием химиотерапии и других методов лечения);
- Остаточная опухоль после ранее проведенной РЧА либо другого метода лечения;
- Местный рецидив после ранее проведенной РЧА, резекции печени либо другого метода лечения;
- Метахронные метастазы после ранее проведенной РЧА, резекции печени либо другого метода лечения.
Показания к проведению РЧА лапароскопическим доступом:
- Отсутствие выраженных сращений;
- Отсутствие стандартных противопоказаний для всех лапароскопических вмешательств;
- Расположение очага в зонах, доступных лапароскопии;
- Подкапсульное расположение с возможным прилежанием к органам, которые в ходе вмешательства возможно отведением обезопасить от термического воздействия;
- При билобарном поражении печени наличие единичных небольших (до 5 см) узлов в правой доле, в то время как образование левой доли может быть удалено лапароскопически.
Показания к проведению РЧА в ходе открытого вмешательства:
- Билобарное поражение, при котором возможно удалить большую часть пораженной печени и подвергнуть РЧА остающиеся очаги;
- Прилежание к органам брюшной полости и забрюшинного пространства, магистральным сосудам и диафрагме, когда возможно отделение (резекция) этих участков;
- Заранее планируемое сочетанное вмешательство;
- Выраженные сращения, процесс в брюшной полости, особенно после ранее произведенных операциях на печени, когда патологический очаг расположен непосредственно по краю резекции;
- Наличие кроме внутрипеченочного еще и экстраорганного, но удалимого опухолевого узла; общее операбельное состояние пациента; согласие больного на выполнение данного вида лечения.
Противопоказания к проведению РЧА:
Показания к проведению радиочастотной абляции опухолей легких (по Herrera L.J. et al.):
- Больные НМКРЛст., не подлежащие хирургическому лечению по следующим причинам: сопутствующие заболевания, отказ пациента от хирургического лечения.
- Больные, имеющие несколько метастазов в разных долях легких.
- Рецидив опухоли менее чем через 6 месяцев после резекции легкого.
- Диаметр опухоли до 4 см.
- Согласие больного на проведение лечения.
Противопоказания к проведению гипертермической абляции опухолей печени (по et al.):
- Расположение опухоли ближе 3 см от прикорневых структур.
- Первичная опухоль не удалена.
- Более 3 метастазов в каждом легком.
- Общее количество метастазов более 5.
- Имеется метастатический плеврит.
Показания к абляции первичного рака почки:
- Пациентов с тяжелой сопутствующей патологией, либо отказавшихся от хирургического лечения.
- Наличие опухолевого узла до 5 см в диаметре (лучшие результаты при РЧА экзофитно расположенных опухолей до 3 см в диаметре).
- Опухоль единственной почки.
Выполнение РЧА чрескожным или лапароскопическим доступом требует соблюдения ряда условий:
При чрескожном доступе:
- Четкая визуализация патологических очагов при УЗИ и КТ/МРТ (в зависимости от способа навигации);
- Возможность достаточно безопасного доступа к опухолевому узлу (достаточная отдаленность от магистральных печеночных сосудов и желчных протоков);
- Отсутствие прорастания (тесного контакта) диафрагмы, почки, желудка, кишки, желчного пузыря;
- Невозможность выполнения оперативного вмешательства в силу соматического состояния;
- Полная обеспеченность возможности экстренной лапаротомии и адекватности традиционного вмешательства;
- Согласие больного на выполнение данного вида лечения;
При лапароскопическом доступе:
- возможность обеспечения достаточно полноценного со стороны брюшной полости;
- полная обеспеченность возможности экстренной лапаротомии и адекватности традиционного вмешательства;
- согласие больного на выполнение данного вида лечения.
Используемое оборудование и инструментарий
В настоящее время на рынке имеется множество приспособлений для выполнения радиочастотной абляции тканей. Пожалуй, наиболее известным является аппарат Radionics ® Ablation System и набор водоохлаждаемых электродов RITA ® Medical Systems (Angiodynamics, США).
Эта система комплектуется тремя моделями многозубцовых электродов:
Доступы для проведения процедуры абляции
На сегодняшний день нет единого мнения о выборе доступа для проведения абляции. Для позиционирования электрода используется чреcкожный доступ под УЗИ, КТ- или . И интраоперационные доступы при лапаротомии под УЗИ наведением и чреcкожный доступ под контролем лапароскопии.
Методики РЧА
Наиболее часто прибегают к чреcкожным методам позиционирования электрода. В качестве метода контроля над движением электрода наиболее часто используется ультразвуковая навигация.
Преимущества ультразвуковых методов заключаются в простоте проведения процедуры, отсутствии вредных воздействий на пациента в виде лучевой нагрузки, контроль над происходящими процессами в реальном времени, возможность визуализации сосудистых структур органа, а также наличие направляющих адаптеров на рукоятке ультразвукового датчика.
При выборе направления движения электрода необходимо учитывать расстояние от кожи до места проведения абляции, наличие на пути электрода полых органов, таких как кишка, желудок, желчный пузырь, крупных сосудов, синусов плевры.
Также необходимо учесть угол, под которым будет осуществляться ультразвуковой контроль, дыхательную экскурсию, что особенно важно при поддиафрагмальном расположении опухолевых узлов. Немаловажным является и расположение опухолевых узлов относительно правой или левой долей печени. Так, при расположении опухоли в левой доли печени наиболее целесообразным будет выбор эпигастральной области в качестве места проведения электрода.
При локализации опухолевого узла в правых сегментах печени более целесообразным представляется установка электродов в межреберьях. В этих случаях необходима четкая визуализация расположения плеврального синуса.
В целом выбор области для проведения чрескожной абляции аналогичен таковому при проведении пункционных биопсий очаговых образований печени.
В ряде случаев выполнение абляции под ультразвуковым наведением может оказаться затруднительным или даже невозможным. Это может быть связано с изоэхогенной структурой опухоли, когда выполнить её четкую визуализацию не представляется возможным, наличием выраженной гиперэхогенной зоны при неоднократном проведении процедуры абляции, а также наличием костей или заполненных газами полых органов на предполагаемом пути установки электрода. В таких случаях для позиционирования электрода можно воспользоваться компьютерной томографией.
Выделяются 5 этапов абляции:
- Планирование;
- Прицеливание;
- Мониторинг;
- Контроль эффективности;
- Оценка эффективности.
Сначала определяют точку введения электрода путем размещения пациента на столе в наиболее удобном для доступа к опухоли положении, установки стола на уровне среза, выбранного для доступа, и маркировки точки введения электрода.
После установки электрода и его продвижения производят контроль его положения путем последовательного сканирования, при этом дистальная тень позволяет контролировать положение кончика электрода.
В тех случаях, когда опухоль не визуализируется ни при УЗИ, ни при КТ без контрастного усиления, можно выполнить предварительную жировую эмболизацию.
Преимуществом МРТ перед КТ является отсутствие ионизирующего излучения, хорошая контрастность мягких тканей, возможность мультипланарной реконструкции, возможность отображать функциональность и температуру ткани.
Лапаротомия или торакотомия, которые выполняют для проведения абляции, имеют ряд преимуществ по сравнению с чрескожными методами. К ним относятся возможность интраоперационной ревизии органов, выполнение ИОУЗИ печени, уточнение распространения опухоли, стадии онкологического процесса, выявления необнаруженных на дооперационном этапе отсевов опухоли.
Кроме того, возможно выполнить освобождение предполагаемой области вмешательства от прилегающих петель кишки, выполнить абляцию на участках, прилегающих к желчному пузырю, куполу диафрагмы, сосудам.
Читайте также:





