Протокол flag в онкологии
Огнеупорное и стойкое заболевание к обычной индукционной химиотерапии и рецидиву заболеванию рассматривается как наиболее важными неблагоприятные прогностические факторы острого миелоидного лейкоза (ОМЛ). Шестьдесят один пациент (средний возраст, 33,6 года) с рецидивирующим или рефрактерным AML лечился режимом FLAG, который состоял из флударабина (30 мг / м2, дней 1-5), цитарабина (2,0 г / м2, дней 1-5) и гранулоцитарный колониестимулирующий фактор. Из обработанных пациентов 29 пациентов (47,5%) достигли полной ремиссии (CR). Более высокие показатели CR наблюдались у пациентов с первым или вторым рецидивом по сравнению с пациентами с первичным рефрактерным ответом или рецидивом после трансплантации стволовых клеток (HSCT). Существовала значительная разница в частоте ответов в зависимости от продолжительности выживаемости без лейкемии (pre-LFS) до химиотерапии (P = 0,05). Время восстановления обоих нейтрофилов (≥500 / мкл) и тромбоцитов (≥20 000 / мкл) требовало медианы в 21 и 18 дней, соответственно. Лечебная смертность (TRM) имела место у семи пациентов (11,4%), из которых 71,4% TRM было вызвано инвазивной аспергиллезной инфекцией. После достижения CR 18 пациентов прошли химиотерапию консолидации, а шесть пациентов подверглись аллогенной HSCT. В заключение, химиотерапия FLAG без идаруцицина является относительно эффективным и хорошо переносимым режимом для рецидивирующего или рефрактерного AML, а использование химиотерапии FLAG позволило провести интенсивную терапию после ремиссии, включая HSCT.
Несмотря на улучшение показателей лечения и ремиссии у пациентов с острой миелоидной лейкемией (AML), только 30-40% пациентов демонстрируют долгосрочную выживаемость (1). Современная индукционная химиотерапия приведет к полной ремиссии у 50-90% пациентов с заболеванием de novo, но у 10 и 25% пациентов будет первичное рефрактерное заболевание, и большинство из тех, кто получает ремиссию, будут рецидивы в течение 3 лет после диагноза (2 ). Лечение рецидивирующего лейкоза затруднено, и хорошо контролируемые исследования в этой группе пациентов являются необычными.
Комбинированную терапию флударабинфосфатом (F-AMP) и цитарабином (ara-C) пропагандировали как потенциально полезный химиотерапевтический режим лечения рецидивирующего AML. Эта рекомендация возникает из наблюдения, что F-AMP потенцирует внутриклеточное накопление активного метаболита, ara-C 5′-трифосфата (ara-CTP) в лейкозных клетках (3), тем самым увеличивая цитотоксическое действие высокодозной ара-C, один из самых полезных средств для лечения AML (4, 5). Gandhi et al. (3, 6) продемонстрировали, что комбинация флударабина и ара-С приводит к значительному увеличению внутриклеточного удержания ara-CTP. До лечения флударабином гранулоцитарный колониестимулирующий фактор (G-CSF) увеличивает долю клеток в цикле, когда они наиболее уязвимы к ара-С и усиливает включение ara-C в ДНК (7,8). Режим FLAG, который сочетает флударабин, высокую дозу ara-C и G-CSF, недавно был использован с обнадеживающими результатами в отношении слабого риска AML, миелодиспластического синдрома и рефрактерной или рецидивирующей острой лимфобластной лейкемии (ALL). Кроме того, токсичность комбинации была также низкой (9-15).
В этом исследовании мы сообщаем о клинической эффективности и токсичности химиотерапии ФЛАГ у 61 пациента с рецидивирующим или рефрактерным AML.
Шестьдесят один из пациентов с рефрактерным и рецидивирующим AML лечились химиотерапией FLAG без идаруцицина в период с ноября 2003 года по сентябрь 2007 года. Чтобы иметь право на лечение с режимом FLAG, пациенты должны были иметь уровень билирубина в сыворотке ≤2 мг / дл, креатинин ≤2 мг / дл, а также никаких признаков сердечной дисфункции. Пациенты были набраны из трех национальных университетских больниц и получили информированное согласие на это лечение.
Диагноз и классификация AML определялись в соответствии с классификацией франко-американо-британских (FAB) и были подтверждены цитохимическим окрашиванием и иммунофенотипированием костного мозга для предварительной обработки или образцов крови. Кроме того, у всех пациентов были проведены цитогенетические и молекулярные исследования. Зачисленные пациенты состояли из пациентов с M0 (n = 1), M1 (n = 6), M2 (n = 19), M4 (n = 9), M5 (n = 10), M6 (n = 5), M7 (n = 1), смешанный (n = 4) и вторичный (n = 6) AML. Шесть пациентов были идентифицированы как имеющие благоприятные цитогенетические аномалии, ограниченные t (8; 21) и inv (16), независимо от других аномалий. Напротив, 15 пациентов были идентифицированы как имеющие плохие цитогенетические аномалии, ограниченные t (11p, 12q), del (8), t (1:16), трисомией 8 и Ph-хромосомой или другими комплексными кариотипами. Кроме того, у 38 пациентов были нормальные кариотипы, классифицированные как промежуточный риск. Статус эффективности (ПС) определялся для каждого пациента в соответствии с критериями Всемирной организации здравоохранения (ВОЗ); 40 пациентов были PS 0 или 1, 19 пациентов были PS 2, а 2 пациента были в PS 3.
Первичный индукционный режим ремиссии состоял из идаруцицина (IDA) (12 мг / м2 / день IV в течение 30 мин в 1-3 дня) в сочетании с ара-С (100 или 200 мг / м2 / день IV непрерывно в дни 1 -7) или N4-бееноил-1-D-арабинофуранозилцитозин (BH-AC) (16) (возраст ≤40 лет, 300 мг / м2 / день IV в течение 4 часов в дни 1-7, возраст> 40 лет, 200 мг / м2 / день). Пациентов, достигших ремиссии, лечили химиотерапией после ремиссии, которая включала высокую дозу ara-C (3 г / м2 IV каждые 12 часов в дни 1, 3 и 5) в качестве консолидации. Пациенты, у которых был подобранный донор, подверглись аллогенной трансплантации гемопоэтических стволовых клеток (HSCT).
Режим ФЛАГ состоял из флударабина (30 мг / м2 / день IV в течение 30 мин в дни 1-5) в сочетании с ара-С (2 г / м2 / день IV в течение 4 ч в дни 1-5, возраст от 50 до 60 лет или для тех> 60 лет стандартные инфузионные дозы флударабина и ара-С были уменьшены на одну треть). G-CSF вводили при 5 мкг / кг с 0-го дня до восстановления нейтрофилов (≥ нейтрофилов в 500 мккл).
Мы считали, что полная ремиссия (CR) является морфологически нормальным костным мозгом с ≤5% взрывами, связанными с нормальным периферическим и дифференциальным подсчетами, включая количество нейтрофилов ≥1 × 109 / L и количество тромбоцитов ≥100 × 109 / L. Пациенты, которые не реагировали на индукционную терапию, считались невосприимчивыми (NR), тогда как пациенты, чей ответ не мог быть измерен, считались неизмеримыми (NM).
Гематологическую и негематологическую токсичность измеряли и оценивали в соответствии с критериями ВОЗ. Были зафиксированы дополнительные побочные эффекты и другие побочные эффекты, не охваченные системой токсичности ВОЗ, включая оценку тяжести реакции на терапию. Пост-химиотерапию цитопению контролировали гематологическими оценками ≥ три раза в неделю, пока количество нейтрофилов и тромбоцитов не восстановилось. Смертность, связанная с лечением (TRM), была определена как смерть, вызванная осложнением, развивающимся до восстановления после химиотерапии.
Периоперационная химиотерапия по схеме FLOT увеличивает общую выживаемость у больных раком желудка. Результаты исследования FLOT4
По данным исследования 2-3 фазы, опубликованного в The Lancet, периоперационная химиотерапия с включением доцетаксела, лейковорина, оксалиплатина и 5-фторурацила, на 20% увеличивает общую выживаемость (ОВ) у больных резектабельным местнораспространенным раком желудка или пищеводно-желудочного перехода по сравнению с режимом на основе эпирубицина, цисплатина и фторпиримидинов.
В этом открытом исследовании приняли участие 716 больных резектабельным местнораспространенным раком желудка (cT2 и более) и/или с метастазами в регионарные лимфоузлы (cN+). Пациенты были рандомизированы в две группы. Больные в первой группе получали периоперационную химиотерапию по схеме FLOT (n=356), больные во второй группе получали ECF/ECX (n=360). FLOT проводили в следующем режиме: 4 курса до операции, 4 – после (доцетаксел 50 мг/м 2 + оксалиплатин 85 мг/м 2 + лейковорин 200 мг/м 2 в/в кап д.1 + 5-фторурацил 2600 мг/м 2 инфузия 24 часа – 1 день 1 раз в 14 дней). Режим ECF/ECX состоял из 3 курсов перед операцией и 3 – после (эпирубицин 50 мг/м 2 + цисплатин 60 мг/м 2 в/в кап д.1 + 5-фторурацил 200 мг/м 2 внутривенная инфузия или капецитабин внутрь дни 1-21). Первичной конечной точкой была ОВ.
Медиана наблюдения составила 43 мес. Медиана ОВ в группе FLOT составила 50 мес., в группе ECF/ECX – 35 мес. (отношение рисков 0,77; P=0,012).Установленная медиана ОВ через 2 года составила 68% и 59% соответственно, через 3 года – 57% и 48% соответственно, через 5 лет – 45% и 36% соответственно. Медиана БВ составила 30 мес. против 18 мес. соответственно (ОР 0,75; P=0,0036).
Что касается нежелательных явлений 3-4 ст., то в группе FLOT чаще встречались инфекционные осложнения (18% против 9%), нейтропении (51% против 39%), диарея (10% против 4%) и полинейропатия (7% против 2%). В группе ECF/ECX чаще встречались тошнота (16% против 7%), рвота (8% против 2%), тромбоэмболические осложнения (6% против 3%), анемии (6% против 3%). Серьезные нежелательные явления, имеющие отношение к лечению, одинаково часто встречались в обеих группах (27%). Нежелательные явления, потребовавшие срочной госпитализации больных, также одинаково часто наблюдали в обеих группах (25% и 26%). Двое больных в каждой группе погибли от осложнений лечения.
Несмотря на многообещающие выводы, эксперты Asan Medical Center, University of Ulsan College of Medicine (Сеул, Южная Корея) сомневаются, что FLOT может стать новым стандартом лечения. Во-первых, этот режим подходит не всем. Почти половина больных в этом исследовании страдали от нейтропении 3-4 ст., пишут эксперты. Что же тогда, например, будет с азиатской популяцией больных, которые сами по себе более склонны к гематологической токсичности? Впрочем, на этот вопрос могут ответить результаты исследования PRODIGY, в котором у азиатской популяции больных изучают триплеты на основе доцетаксела в неоадъювантном режиме.
Во-вторых, продолжают эксперты, в группе FLOT 90% завершили весь объем предоперационного лечения, но только 60% больных начали послеоперационный этап лечения. Наконец, весь запланированный объем (4+4) получили менее половины больных – 46%. По мнению Yoon-Koo Kang и Hyung woo Cho, это может быть поводом для пересмотра интенсивности доз или поиска индивидуального подхода: например, для этих целей можно использовать степень регрессии опухоли.
Наконец, заключают эксперты, уровень пятилетней выживаемости даже при таком интенсивном режиме остается менее 50%, а это значит, что поиски эффективного лечения все еще продолжаются. Одним из перспективных, по мнению экспертов, вариантов может включение лучевой терапии в периоперационном режиме (исследование 3 фазы TOPGEAR). Другие варианты – предоперационная анти-HER2-терапия при HER2-положительном варианте заболевания (исследование INNOVATION) или комбинация на основе иммуно- и химиотерапии (на основе многообещающих результатов ATTRACTION-04 у больных метастатическим раком).
- Медиана ОВ составила 50 мес. в группе FLOT и 35 мес. в группе ECF/ECX (ОР 0,77; P=0,012).
Химиотерапия в широком смысле — это воздействие токсичными препаратами на причину заболевания, коей могут являться болезнетворные микроорганизмы, паразиты или раковые клетки. Антибиотики и противоглистные препараты — это тоже химиотерапия. Но чаще всего этот термин применяют по отношению к препаратам, предназначенным для борьбы со злокачественными опухолями.
Химиотерапия вместе с хирургией и лучевой терапией входит в классическую тройку лечения онкологических заболеваний.
Как работают химиопрепараты?
Раковые клетки отличаются от здоровых способностью к бесконтрольному делению. Существуют разные группы химиопрепаратов с разными механизмами действия, но суть их работы всегда сводится к тому, что они поражают быстро размножающие клетки — не только раковые, но и здоровые, поэтому для химиотерапии зачастую характерны серьезные побочные эффекты.
Все химиопрепараты делят на две большие группы. Цитостатические (цитостатики) останавливают клеточное деление. Раковые клетки не могут размножаться, в них запускается механизм запрограммированной клеточной гибели — апоптоз. Цитотоксические препараты непосредственно вызывают гибель опухолевых клеток.
Назначением химиотерапии занимается онколог или более узкоспециализированный врач — химиотерапевт. Выбор препаратов зависит от некоторых факторов:
- Тип рака и его молекулярно-генетические характеристики. Разные опухоли чувствительны к разным лекарствам.
- Стадия рака.
- Виды лечения, которые применялись прежде.
- Возраст и общее состояние здоровья больного.
- Наличие сопутствующих заболеваний.
Можно назначать монотерапию одним препаратом, но лучшего эффекта обычно удается достичь, когда пациент получает комбинацию химиопрепаратов с разными механизмами действия. Нередко химиотерапию сочетают с другими видами лечения.
Классификация
Выделяют следующие основные разновидности химиотерапии:
- Неоадъювантная. Проводится до хирургического вмешательства. В данном случае ее основная цель — уменьшить размеры опухоли, чтобы хирургу было проще ее удалить.
- Адъювантная. Проводится после хирургического лечения. Опухоль удалена, но в организме пациента могли остаться раковые клетки. Химиотерапия помогает уничтожить их и предотвратить рецидив.
- В качестве основного вида лечения. Химиопрепараты могут стать основным методом лечения рака, когда операция противопоказана или неэффективна (на поздних стадиях).
- Химиолучевая терапия. Термин, который обозначает сочетание химиотерапии и лучевой терапии. При этом повышается эффективность, но возрастает риск побочных эффектов.
- Химиоэмболизация. Специфическая разновидность лечения, когда в артерию, питающую опухоль, вводят эмболизирующий препарат в сочетании с химиопрепаратом. Частички эмболизирующего препарата перекрывают просвет сосудов, лишая опухоль кислорода и питательных веществ, а химиопрепарат атакует раковые клетки.
Химиотерапия применяется как для радикального (с целью полного уничтожения опухоли и наступления ремиссии), так и для паллиативного (сокращение размеров опухоли, борьба с симптомами, продление жизни пациента) лечения.
Как вводят химиопрепараты?
Чаще всего химиопрепараты вводят в виде растворов внутривенно, через иглу, катетер или имплантируемые порт-системы. Иногда их принимают в виде таблеток. Такая химиотерапия называется системной, потому что лекарство поступает в системный кровоток и разносится по всему организму.
В отдельных случаях проводят местную химиотерапию: препарат вводят непосредственно в место, где находится опухоль:
- Интраартериально — в питающую опухоль артерию.
- В брюшную полость.
- В плевральную полость.
- Под оболочки головного и спинного мозга.
- В желудочки головного мозга.
- В мочевой пузырь.
- Существуют препараты для втирания в кожу.
Местное введение препарата помогает предотвратить его воздействие на здоровые органы и избежать серьезных побочных эффектов.
Как подбирают дозировки?
Правильный подбор доз химиопрепаратов — ответственная задача. Если дозировка будет слишком маленькой, это снизит шансы на успешное лечение, а если слишком большой — сильно возрастут риски тяжелых побочных эффектов. Коридор между эффективностью и безопасностью, в котором приходится лавировать врачу-химиотерапевту, зачастую очень узкий.
Существуют два основных метода расчета доз химиопрепаратов: по весу пациента и по площади его тела. Для отдельных групп онкобольных дозировки нужно подбирать индивидуально:
- Пожилые люди.
- Пациенты, у которых нарушено питание, в состоянии истощения.
- Пациенты, имеющие избыточную массу тела или ожирение.
- Пациенты, которые имеют сопутствующие проблемы со здоровьем и, помимо химиопрепаратов, вынуждены принимать другие лекарства.
- Люди, страдающие анемией, иммунодефицитными состояниями, нарушением свертываемости крови, болезнями почек и печени.
- Дети.
- Пациенты, у которых химиотерапия сочетается с лучевой терапией.
Как долго длится курс лечения?
На этот вопрос сложно дать однозначный ответ. Это индивидуально. Курсы могут иметь разную продолжительность. Некоторым больным достаточно одного курса лечения, другим требуется несколько. В первую очередь это определяется типом и стадией рака, его молекулярно-генетическими характеристиками, общим состоянием здоровья пациента, разновидностью химиопрепаратов, которые было решено использовать, протоколами химиотерапии.
Что такое циклы химиотерапии?
Так как химиопрепараты атакуют все быстро размножающиеся клетки без разбора, все они в той или иной степени токсичны для организма. Поэтому их нельзя вводить постоянно в течение длительного времени. Организму нужны передышки, чтобы восстановиться.
Химиотерапию проводят циклами. Лекарство вводят однократно, либо в течение нескольких дней подряд, либо в течение нескольких дней через день, после чего следует перерыв. Продолжительность циклов бывает разной. Обычно она измеряется неделями и составляет 7, 14, 21, 28 дней.
Курс лечения может включать несколько циклов. Врач выбирает оптимальный график введения препаратов, который, с одной стороны, помогает добиться максимальной эффективности, в то же время обеспечивает минимальный риск побочных эффектов.
Что такое протоколы химиотерапии?
Правильный подбор химиопрепаратов, их комбинаций и доз — сложная задача. Для того чтобы ее эффективно решить, опыта одного врача не хватит. По всему миру проведены многочисленные исследования с участием тысяч пациентов, их результаты легли в основу протоколов химиотерапии. В этих документах подробно прописаны все нюансы назначения химиотерапии при разных типах и стадиях рака.
В разных странах врачи могут руководствоваться разными протоколами химиотерапии. Некоторые из них полностью или частично устарели, другие учитывают наиболее современные достижения в области онкологии.

Какими побочными эффектами обладают химиопрепараты?
За счет того, что химиопрепараты атакуют не только опухолевые, но и активно размножающиеся здоровые клетки, они обладают многочисленными побочными эффектами. Пациент может испытывать:
- Боли в разных частях тела.
- Тошноту и рвоту.
- Выпадение волос, изменение ногтей.
- Нарушение аппетита и извращение вкуса.
- Диарею или запоры.
- Повышенную утомляемость.

Химиотерапия может приводить к изменениям со стороны крови: повышенной кровоточивости, анемии, снижению иммунитета, при этом повышается риск инфекционных осложнений. Разные сочетания химиопрепаратов токсичны в разной степени.
Можно ли справиться с побочными эффектами химиотерапии? Существуют некоторые эффективные способы:
- В первую очередь врач даст некоторые рекомендации по поводу образа жизни, питания.
- Для защиты волос и ногтей во время введения препаратов используют охлаждающие шапочки, специальные охлаждающие пакеты для рук и ног.
- Поддерживающая терапия помогает справиться с неприятными симптомами и перенести курс химиотерапии более комфортно.
- Если эти меры не помогают, приходится снижать дозы химиопрепаратов, заменять их более безопасными. Это может негативно повлиять на эффективность лечения.
Выберите химиотерапевта и запишитесь на приём

Главный врач Европейской клиники, онколог, к.м.н.
Протокол химиотерапии
Химиотерапия – это тип медикаментозного лечения злокачественных новообразований.
Препараты химиотерапии вводят в кровяное русло, где они циркулируют по всему организму человека. Именно это является огромным преимуществом такого системного лечения, как химиотерапия.
Некоторое число клеток может отсоединиться от первичного новообразования и по кровотоку попасть в ту или иную часть организма. Там такие клетки начинают расти, образуя вторичную опухоль или метастаз.
Химиотерапевтические препараты перемещаются тем же путем. Они могут поразить вторичные опухоли и эти отдаленные клетки в любом участке организма.
Первым опытом применения методов химиотерапии была терапия антибиотиками при инфекции. Антибиотики оказывают разрушающее действие на бактерии, вызывающие инфекцию, где бы в организме они бы не находились. Но есть существенное различие между антибиотикотерапией и химиотерапией. Бактерии сильно отличаются от нормальных клеток организма – это дает возможность создать антибактериальные препараты, целенаправленно воздействующие на бактерии, не нанося вреда здоровым клеткам. Раковые клетки отличаются от нормальных очень незначительно. Поэтому нормальные клетки могут быть повреждены в ходе химиотерапии. Этим объясняются побочные эффекты химиотерапии.
В крупнейших научных центрах мира исследователи и врачи разработали стандарты и протоколы лечения онкологических больных. Раковые клетки имеют много общих черт с бактериями: часть из них очень чувствительна к конкретным химиотерапевтическим препаратам, другие являются менее чувствительными (и все это у одного человека).
При бессистемном назначении препаратов химиотерапии результатом станет прогрессирование того вида злокачественных клеток, на которые не воздействует ни один препарат. Именно это стало причиной разработки стандартов и протоколов химиотерапии.
Организм и сама злокачественная опухоль обладают уникальными особенностями, которые во многом определяют исход химиотерапевтического лечения. Для того, чтобы подобрать оптимальную схем лечения, врачи Европейской клиники рекомендуют провести анализ на биомаркеры опухоли.
Индивидуальный подход, сочетающийся со строгим следованием стандартам, позволяет добиться чрезвычайно высокой эффективности терапии. Это позволяет сократить общее количество курсов лечения, необходимых для достижения результата.
В организм попадает меньшее количество вредных веществ, содержащихся в химиотерапевтических препаратах. Как следствие, уменьшается выраженность и количество побочных эффектов.
Некоторые виды рака можно вылечить только с помощью химиотерапии. Однако для большинства злокачественных патологий это пока невозможно, и медикаментозное лечение проводится с целью облегчения симптомов заболевания и контроля за его развитием. Чем крупнее опухоль, тем более она устойчива к препаратам.
Сразу после операции приступают к химиотерапии, если первичная опухоль уже удалена хирургически и существует вероятность, что определенная часть раковых клеток уже распространилась за пределы органа.
Если у пациента имеется протокол химиотерапии, рекомендованный лечащими врачами других стран (например, после проведения первичной онкологической операции, гамма-терапии или облучения в Швейцарии, Германии, Израиле), мы также готовы провести необходимое лечение.
Разумеется, если ранее назначенная зарубежными онкологами схема химиотерапии вписывается в каноны доказательной медицины, а также соответствует состоянию пациента на момент планируемого проведения курса химиотерапии.
Каждый пациент индивидуален в силу различного состояния организма и наличия сопутствующих соматических заболеваний, его опухолевые клетки чувствительны к различным препаратам. Поэтому для каждого вида рака разработано от 1 до 10-15 различных протоколов химиотерапии. И ключевым фактором успешного лечения с минимальным осложнениями является грамотная оценка состояния пациента и подбор соответствующей схемы лечения, протоколов 1-й, 2-й или 3-й линии.
Химиотерапия — это первая отрасль медицины, наряду с инфекционными болезнями, где были законодательно в разных странах внедрены стандарты и протоколы лечения онкологических больных.
Суть протокола можно описать следующим примером: в ходе многолетних двойных-слепых плацебо-контролируемых исследований показано, что, если при определенном виде рака легких на определенной стадии проводить 3 курса химиотерапии, то 5-летняя выживаемость пациентов составит 5%, при 5 курсах химиотерапии — 25%, при 7 курсах — 80%.
Суть протокола химиотерапии — обобщенный огромный опыт тысяч пациентов в стандартизованных условиях, который невозможно прожить и за всю человеческую жизнь одного врача. Более того, современные принципы доказательной медицины требуют настолько чёткого соблюдения подбора пациентов для выявления реальной эффективности лекарств, что далеко не все врачебные коллективы входят в многоцентровые исследования.
С другой стороны, протокол химиотерапии рака — это не догма. В зависимости от индивидуальной переносимости (это не только самочувствие, но и состояние крови, функции других органов и систем), а также чувствительности опухоли к химиопрепаратами проводимой терапии, может требоваться коррекция проводимого химиотерапевтического лечения.
Помимо собственно химиотерапии, её важнейшим компонентом является сопутствующая терапия, направленная на коррекцию возможных осложнений и на профилактику индивидуальной непереносимости.
- по телефону: +7(925)191-50-55
- заполнить: ЗАПРОС В КЛИНИКУ
- по электронной почте: oncoclinic@rusmedserv.com
- адрес клиники: г. Москва, ул. Духовской пер., 22б
+7 (925) 66-44-315 - бесплатная консультация по лечению в Москве и за рубежом
Онкологические заболевания в современном мире встречаются все чаще. Это связано с особенностями экологии, множеством новых вирусов, а также с большим количеством канцерогенов. Ежегодно ученые вводят новые методы борьбы с раком. Однако прежние способы лечения применяются до сих пор. Одним из них является ПХТ. Расшифровка этой аббревиатуры – полихимиотерапия. Системное введение цитостатических препаратов помогает устранить атипичные клетки, из которых состоит опухоль. Несмотря на то что данный вид лечения нелегко переносится пациентами, он является одним из самых эффективных методов.
ПХТ в онкологии: расшифровка аббревиатуры
В медицинской документации людей, страдающих от раковых заболеваний, часто встречается такое понятие, как химиотерапия. Сокращенно ее называют ПХТ. В онкологии расшифровка данной аббревиатуры - полихимиотерапия, что означает сочетанное воздействие сразу нескольких цитостатических средств. Данный вид лечения направлен на полное устранение опухоли или ее уменьшение.
В большинстве случаев ПХТ сочетают с другими методами лечения. Среди них – хирургическое удаление патологического образования и лучевая терапия. Иногда полихимиотерапия является самостоятельным методом лечения. Выбор ПХТ зависит от расположения и стадии рака, а также от состояния больного. Назначать цитостатические препараты может только врач-онколог.
Виды химиотерапии в онкологии

Противоположным понятием является адъювантная ПХТ в онкологии. Расшифровка аббревиатуры проста. АПХТ – это профилактическое лечение рака после операции. Имеется в виду, что саму опухоль полностью удалили, однако для предотвращения рецидива требуется цитостатическая терапия. Перечисленные виды ПХТ относятся к комбинированному или комплексному лечению злокачественных опухолей. То есть, помимо назначения препаратов, пациенту проводится операция, а иногда – и облучение.
Отдельным видом терапии является самостоятельный (лечебный) курс ПХТ в онкологии. Расшифровка подобного медицинского термина понятна не каждому врачу. Зачастую отличить лечебный курс от профилактической терапии может только онколог. Самостоятельная ПХТ проводится в тех случаях, когда другие методы оздоровления не показаны. Например, при мелкоклеточном раке легкого или наличии метастазов в отдаленные органы.
Показания к проведению терапии
Стоит отметить, что каждая злокачественная опухоль лечится по-разному. Иногда достаточно только оперативного лечения или облучения, в других случаях – требуется химиотерапия. ПХТ назначают лишь по специальным медицинским показаниям, когда это необходимо. Если подобное лечение не было предложено после операции врачом, значит злокачественный процесс был ограничен небольшим участком и не поразил глубокие слои органа. Кроме того, некоторые типы опухолей не поддаются химиотерапии. Выделяют следующие показания для ПХТ в онкологии:
- Злокачественные образования лимфоидной ткани.
- Рак крови.
- Опухоли пищеварительного тракта.
- Мелко- и крупноклеточный рак легкого.
- Новообразования головы и шеи.
Следует отметить, что эффективность химиотерапии зависит от гистологического типа опухоли. К примеру, железистый рак поддается цитостатическому лечению лучше, чем плоскоклеточная карцинома или саркома. Зачастую ПХТ не назначают на первых стадиях болезни, если опухоль можно удалить оперативным путем. Адъювантная терапия показана пациентам, у которых после хирургического лечения была обнаружена 2 или 3 стадия рака. Если опухоль имеет большой размер и проросла в соседние органы, назначают самостоятельный курс ПХТ. Иногда данный вид лечения применяется на поздней стадии рака, когда другие методы бессильны.
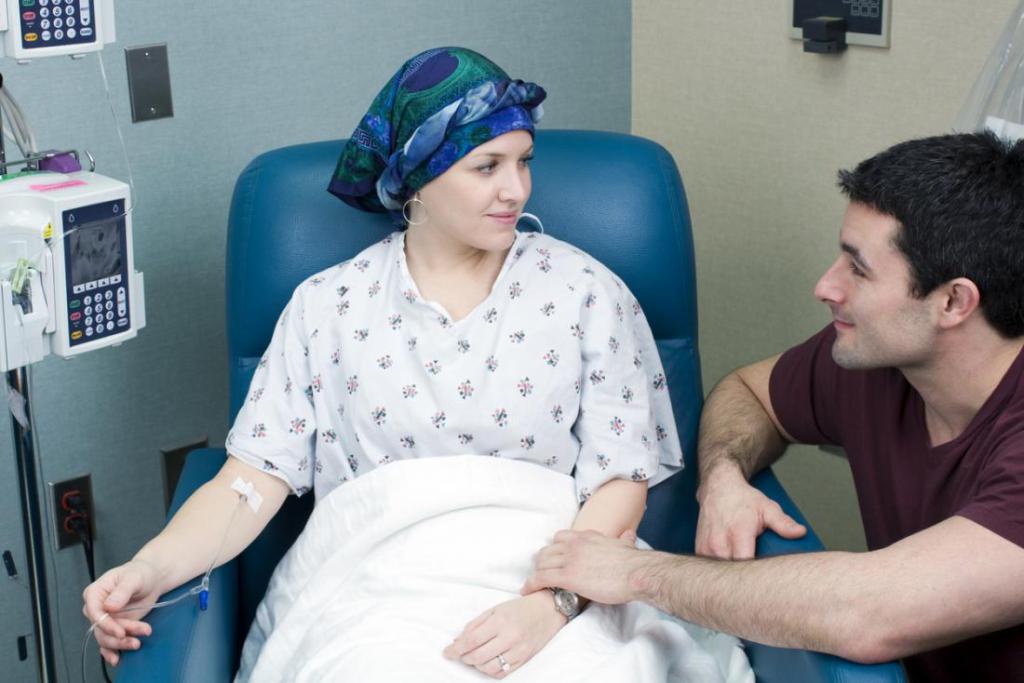
Что такое курс химиотерапии?
Большинство людей знает, что химиотерапию принято назначать курсами. Это означает, что цитостатические средства вводятся в организм неоднократно, а на протяжении длительного времени - с определенными промежутками. Подобная схема лечения необходима, потому что препараты разрушают не только саму опухоль, но и другие клетки организма. Введение большой дозы единовременно невозможно, так как цитостатики обладают кардио-, нефро- и гепатотоксичным действием. Чтобы организм восстановился после курса ПХТ, требуется время. В среднем это занимает 2-4 недели. За этот период клетки крови успевают обновиться, и общее самочувствие пациента приходит в норму.
Количество курсов ПХТ в онкологии может быть различным. Оно зависит от переносимости препаратов, состояния больного и эффективности лечения. После 3 курсов проводится обследование, благодаря которому врач делает соответствующее заключение. Если опухоль полностью исчезла или частично уменьшилась, химиотерапию продолжают. В случаях, когда имеется прогрессирование злокачественного процесса, схему ПХТ меняют. При этом отсчет курсов начинается заново.
Подготовка и сопроводительная терапия
Противопоказания к назначению химиотерапии
Несмотря на то что химиотерапия относится к одним из самых эффективных методов лечения рака, ее проведение не всегда необходимо. В некоторых случаях цитостатические средства приносят больше вреда, чем пользы. Проведение ПХТ противопоказано в следующих случаях:
- Старческий возраст (от 70 лет).
- Непереносимость цитостатических средств.
- Наличие тяжелых патологий со стороны сердца.
- Почечная и печеночная недостаточность.
- Прогрессирование заболевания, несмотря на проводимую терапию.
- Наличие множественных метастазов.
- Кахексия.
Перед тем как назначить ПХТ, проводится комплекс обследований. К ним относятся: общий и биохимический анализ крови, ЭКГ, ОАМ, коагулограмма, УЗИ сердца. При выявлении декомпенсированных заболеваний лечение цитостатиками нецелесообразно.
Возможные результаты химиотерапии
Для контроля эффективности ПХТ проводится повторное обследование. Благодаря этому оценивается результат терапии. К благоприятным исходам лечения относятся: полный и частичный регресс опухоли, а также стабилизация. В первом случае новообразование исчезает или уменьшается в размере в 2 раза и более. Стабилизация процесса означает, что опухоль осталась прежней. Однако это расценивается как положительный результат, ведь без лечения рак быстро прогрессирует.
Если при обследовании выявлено, что злокачественное образование растет, или появились метастазы, схему лечения меняют. При удовлетворительном состоянии пациента количество курсов химиотерапии неограниченно. Однако постоянное прогрессирование служит показателем того, что лечение не приносит результата, а только вредит организму. Это служит противопоказанием для назначения ПХТ.

Список лекарственных средств
Читайте также:

