Прорастание опухоли в воротную вену
Симптомы рака поджелудочной железы
Рак тела или хвоста поджелудочной железы обнаруживают реже чем рак головки поджелудочной железы, и проявляется он на поздних стадиях, поскольку опухоли такой локализации вызывают механическую желтуху только в 10% случаев.
Рак тела железы быстро прорастает в верхние брыжеечные вены и артерии, воротную вену.
Иногда (10-20%) в связи с деструкцией клеток вырабатывающих инсулин развивается сахарный диабет.
Опухоль хвоста поджелудочной железы часто прорастает воротную вену и селезеночные сосуды, что приводит к развитию портальной гипертензии с увеличением селезенки и другими характерными симптомами. При локализации опухоли в хвосте и теле железы особенно выражен болевой синдром в связи с прорастанием опухолью окружающих железу многочисленных нервных сплетений.
Некоторые редкие формы опухолей исходящие из клеток островкового аппарата поджелудочной железы характеризуются эндокринной секрецией, что в значительной степени определяет клиническую картину болезни. Клиническое течение опухолей островков медленное, при этом уровень эндокринной секреции от размера опухоли не зависит. Таким образом, секретирующие аденомы могут быть диагностированы рано. Опухоли островков имеют различные клинические характеристики в зависимости от клеточного источника опухоли. Так, опухоль выделяющая глюкагон приводит к гипергликемии и дерматиту. Опухоль выделяющая инсулин и привадит к тяжелым гипогликемическим кризам. В других случаях может развивается синдромы Золлингера-Эллисона, Иценко-Кушинга, Вернера-Моррисона, карциноидный синдром.
Метастазирует рак поджелудочной железы рано, чаще в регионарные лимфатические узлы и печень. Возможно также метастазирование в легкие, кости, брюшину, плевру, надпочечники и др.
Лечение
Лечение рака головки и тела поджелудочной железы
При этом типе рака, а также диффузном раке железы показана тотальная панкреатодуоденэктомия. Операция заключается в удалении:
- всей поджелудочной железы,
- двенадцатиперстной кишки,
- антрального отдела желудка,
- дистальной части общего желчного протока,
- селезенки и регионарных лимфатических узлов.
Лечение рака тела и хвоста поджелудочной железы
При раке тела и хвоста органа выполняют левостороннюю (дистальную) резекцию органа в сочетании со спленэктомией. Культю проксимальной части поджелудочной железы ушивают наглухо. К сожалению, симптомы рака поджелудочной железы этой локализации обычно выявляют в запущенной стадии, когда радикальное хирургическое лечение невыполнимо. Отдаленные результаты дистальной резекции поджелудочной железы также малоутешительны. Средняя продолжительность жизни оперированных больных - около 10 мес, 5-летняя переживаемость - 5 - 8%.
Альтернативные методы терапии рака поджелудочной железы
Рентгенотерапия в комбинации с химиотерапией несущественно продлевает жизнь как оперированных пациентов, так и при их изолированном применении у неоперабельных больных.
Паллиативное лечение рака поджелудочной железы при неоперабельных формах рака поджелудочной железы применяют для устранения обтурационной желтухи и непроходимости двенадцатиперстной кишки. Наиболее распространенными паллиативными билиодигестивными операциями являются операции холецисто- и холедохоеюностомии.
При резком сужении опухолью просвета двенадцатиперстной кишки может возникнуть необходимость в гастроэнтеростомии для обеспечения эвакуации желудочного содержимого в тонкую кишку.
Не менее эффективным, но менее травматичным способом декомпрессии желчных путей в лечении рака поджелудочной железы является наружная холангиостомия, выполняемая под контролем УЗИ или КТ, а также эндопротезирование терминального отдела общего желчного протока с помощью пластиковых или металлических протезов, вводимых чреспеченочно в просвет общего желчного протока и далее через его суженный участок в двенадцатиперстную кишку. Средняя продолжительность жизни больных после паллиативного лечения рака поджелудочной железы составляет около 7 мес.
Современные методы полихимиотерапии и лучевое лечение лишь незначительно увеличивают продолжительность жизни пациентов.
Никакая информация, размещенная на этой или любой другой странице нашего сайта, не может служить заменой личного обращения к специалисту. Информация не должна использоваться для самолечения и приведена только для ознакомления.
а) Желтуха без болей (у 40% больных).
б) Боль (в эпигастрии, правом подреберье, спине) с желтухой (40%).
в) Проявления метастазирования (например, гепатомегалия, асцит, узлы в легких) с желтухой или без нее.
Поджелудочная железа расположена в забрюшинном пространстве и является относительно нечувствительным органом, поэтому первые проявления болезни обычно связаны с обструкцией панкреатического или желчного протока или распространением процесса (панкреатит, рак) за пределы поджелудочной железы.
а) Желчнокаменной болезнью.
б) Раком внепеченочных желчных протоков.
в) Раком поджелудочной железы.
г) Гепатитом.
С исследования функции печени и УЗИ. Тесты функции печени показывают степень желтухи и нарушения функции печени. УЗИ позволяет выявить расширение внепеченочных желчных протоков и камни в желчном пузыре или общем желчном протоке с точностью около 95%, очаговое образование в головке поджелудочной железы с точностью 80%.
Отсутствие расширения желчных протоков в сочетании с повышением активности щелочной фосфатазы, аспартатаминотрансферазы и аланинаминотрансферазы говорит о внутрипеченочном холестазе, возможно, вследствие гепатита.
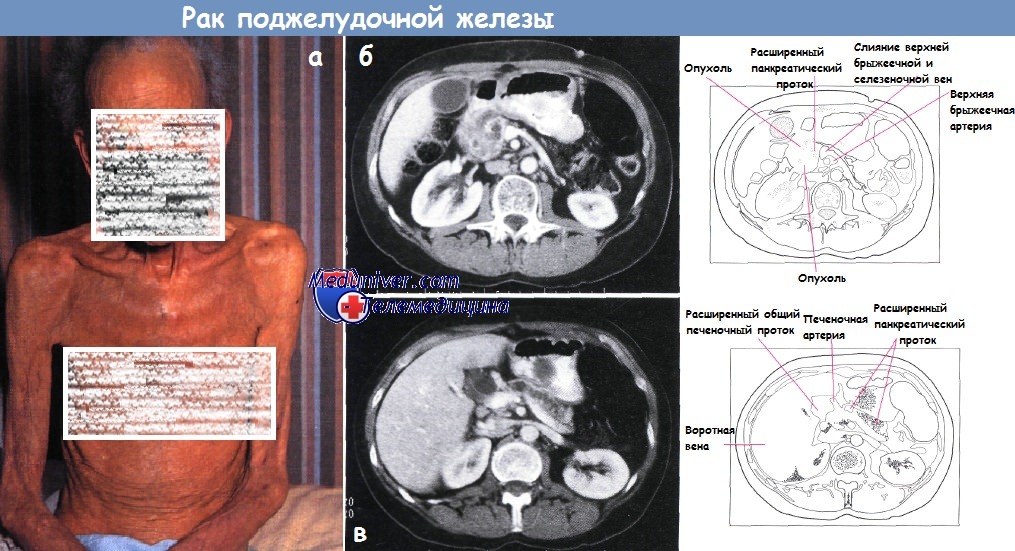
а - Кахексия и желтуха у пациента с раком поджелудочной железы.
б,в - Рак поджелудочной железы с билиарной обструкцией б). Более каудальный срез (компьютерная томография) позволяет увидеть увеличенную головку поджелудочной железы с неровной зоной опухоли низкого усиления.
Главный панкреатический проток расширен. Опухоль распространяется в жировую клетчатку кпереди от головки поджелудочной железы.
Инвазии в верхнюю брыжеечную артерию или вену не видно (в). Срез краниальный (б) демонстрирует расширение панкреатического протока и атрофию паренхимы тела и хвоста поджелудочной железы.
Общий желчный проток слегка расширен.
Выполнить эндоскопическую ретроградную холангиопанкреатографию (ЭРХПГ) или чреспеченочную холангиографию для определения уровня обструкции общего желчного протока и ее вероятной причины (стриктура, камень, опухоль). Во время этих процедур можно установить внутренний стент в суженный желчный проток, что позволяет улучшить функцию печени перед большой операцией.
При наличии камней следует выполнить эндоскопическую папиллосфинктеротомию, способствующую выходу камней, тем самым облегчая будущую операцию.
ЭРХПГ имеет большую диагностическую ценность. При камне выявляется дефект наполнения протока; постепенное сужение — при стриктуре, а резкий обрыв контрастированного протока — при опухоли. КТ предоставляет информацию другого рода, например, о размере опухоли (если она есть), ее отношении к другим структурам (например, воротной вене) и о наличии или отсутствии метастазов в печени.
Если риск операции у больного высок, то следует подумать о чрескожной тонкоигольной аспирационной биопсии, позволяющей подтвердить наличие рака и избежать операции. Если больной в состоянии перенести операцию, то тонкоигольная аспирация не принесет пользы, поскольку отрицательный результат исследования (обычно картина воспаления, которая характерна для окружающей опухоль ткани) не позволяет исключить рак и снять показания к операции.
Кроме того, тонкоигольпая аспирация часто сопровождается кровотечением в поджелудочную железу, что делает ее удаление еще более трудным. В нашем случае больной отправлен в операционную.
Данная операция включает в себя удаление желчного пузыря, дистального отдела общего желчного протока, двенадцатиперстной кишки и части поджелудочной железы, которая находится правее воротной вены — в сущности, это проксимальная резекция поджелудочной железы. В некоторых центрах удаляют также антральный отдел желудка, с ваготомией или без нее.
При дистальной резекции поджелудочной железы удаляют часть железы, находящуюся левее воротной вены, вместе с селезенкой. Тотальная панкреатэктомия представляет собой сочетание этих операций. В некоторых центрах ее также выполняют с антрумэктомией.
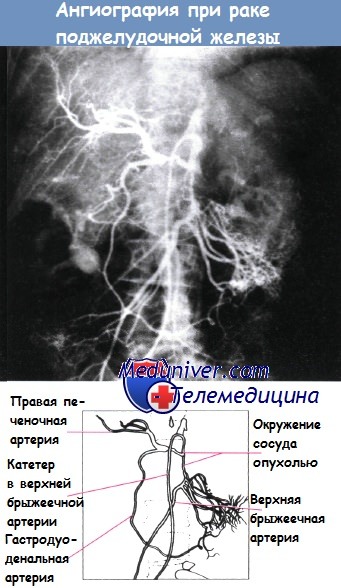
Окружение сосуда опухолью у пациента с раком поджелудочной железы.
Ангиограмма
Поскольку удаляется фатеров сосочек, то желчный пузырь не будет нормально работать, и в нем образуются камни. Второй и третий отделы двенадцатиперстной кишки имеют общее с поджелудочной железой кровоснабжение, которое нарушается при удалении поджелудочной железы. Для повышения радикальности операции было примято также удалять антральный отдел желудка.
Ваготомию выполняли, чтобы уменьшить вероятность образования язв желудочно-тонкокишечного анастомоза. Однако удаление антрального отдела желудка незначительно повышает радикальность операции; изъязвление гастроэнтероанастомоза можно предотвратить, сформировав его ниже зоны сброса в кишечник желчи и панкреатического секрета.
Таким образом, многие хирурги сейчас при возможности стараются выполнять операцию Уиппла с сохранением привратника/блуждающего нерва; при этом выживаемость не отличается от выживаемости после более радикального вмешательства, а качество жизни относительно выше.
Операцию Уиппла выполняют при подвижных опухолях, ограниченных головкой поджелудочной железы, без признаков метастазов в лимфатические узлы области чревного ствола или корня брыжейки. Дистальная резекция показана при подвижных опухолях хвоста поджелудочной железы без признаков диссеминации. Панкреатэктомию оставляют для случаев, когда рак поражает большую часть железы, также без признаков генерализации.
Больного нельзя вылечить с помощью операции, поэтому она носит паллиативный характер. При наличии механической желтухи следует сформировать обходной желчеотводящий анастомоз. Некоторые хирурги считают, что надо также выполнить гастроэнтеростомию, поскольку вероятность развития в будущем дуоденальной непроходимости составляет 30%.
Большинство опухолей поджелудочной железы расположены рядом с воротной веной, поэтому могут прирастать к ней или врастать в нее. Большинство хирургов считают вовлечение в процесс воротной вены признаком неоперабельности, однако некоторые специалисты, если других признаков неоперабельности нет, удаляют пораженный участок вены с пластикой дефекта трансплантатом.
Выживаемость в течение 5 лет составляет около 20%. В РФ 5-летняя выживаемость после радикальной операции по поводу рака головки поджелудочной железы менее 5%.
К сожалению, эта операция представляет единственную возможность излечения. Больные с нерезектабельной опухолью живут в среднем 8-12 месяцев, независимо от того, проводится ли им химиотерапия и/или облучение. Пять лет не проживает никто. Таким образом, хотя выживаемость при хирургическом лечении не впечатляет, она все равно значительно выше, чем при любом другом виде лечения.
Ниже дан краткий обзор радикальных и паллиативных вмешательств при раке ПЖ.
В настоящее время хирургическое лечение остается единственно эффективным методом, однако опухоль можно удалить только на ранних стадиях (до 15% опухолей головки ПЖ), а операционный риск чрезвычайно высок. Радикальную операцию можно выполнить всего лишь у 1 — 5% больных, что обусловлено, в первую очередь, поздней диагностикой.
Выделяют следующие радикальные операции: гастропанкреатодуоденальная резекция, панкреатэктомия, дистальные комбинированные резекции ПЖ, расширенная субтотальная и тотальная панкреатодуоденэктомия. Радикальные операции технически очень сложны, их могут выполнить только высококвалифицированные хирурги в крупных центрах. Летальность после этих операций составляет от 27% при дистальной резекции ПЖ — до 17—39% при расширенной панкреатэктомии, пятилетняя выживаемость не превышает 8%. Последний факт обусловлен, прежде всего, тем, что у 50% больных в послеоперационном периоде возникает рецидив опухоли и в 90—95% случаев на первом году после операции развиваются отдалённые метастазы.
Существует мнение, что панкреатодуоденальную резекцию необходимо выполнять во всех случаях при подозрении на рак ПЖ даже без гистологической или цитологической верификации. Данное мнение отчасти обусловлено тем, что даже при лапаротомии и интраоперационном гистологическом исследовании частота ложноотрицательных ответов превышает 10%.
Перед операцией можно лишь предварительно судить о возможности удаления опухоли. Окончательное решение принимают после интраоперационного осмотра органов брюшной полости при исключении отдалённых метастазов и местной распространённости процесса. Наиболее часто во время операции обнаруживают такую причину нерезектабельности опухоли, как опухолевая инфильтрация забрюшинной клетчатки, включая нервные сплетения и поражение метастазами регионарных лимфатических узлов.
Панкреатодуоденальная резекция — основной тип радикальной операции при расположении опухоли в головке ПЖ. Нельзя её выполнить при прорастании опухолью нижней полой вены, аорты, верхней брыжеечной артерии и воротной вены. Для принятия окончательного решения следует отделить ДПК и головку ПЖ от подлежащих нижней полой вены и аорты, что позволяет судить и о вовлечённости верхней брыжеечной артерии; важна также оценка возможности диссекции воротной вены и верхней брыжеечной вены.
Удалённый при панкреатодуоденальной резекции анатомический препарат состоит из общего желчного протока, жёлчного пузыря, головки, шейки и секреторной части ПЖ, ДПК, проксимальной части тощей кишки, малого и части большого сальника, дистальной половины желудка. Кроме тою, иссечению подлежит паракавальная клетчатка, удаляют супрапилорические, инфрапилорические, передние и задние панкреатодуоденальные лимфатические узлы, лимфатические узлы гепатодуоденальной связки и по ходу общей печёночной артерии. Иссекают верхнюю брыжеечную вену (при изолированном опухолевом её поражении) или место се слияния с воротной веной. Такая лимфодиссекция улучшает прогноз, в то время как травматичность вмешательства увеличивается незначительно.
Простое перечисление удалённых органов свидетельствует о сложнейшей технике вмешательства. Ведь хирургу ещё предстоит выполнить серию восстановительных манипуляций — панкреатоностомию, билиодигестивный анастомоз (см. рис. 5-21), гастроеюностомию и межкишечный анастомоз. Средняя продолжительность операции составляет 6,5—7 ч.
Важны три технических приёма во время выполнения панкреатодуоденальной резекции — объём резекции паракавальной клетчатки и забрюшинной сосудистой диссекции, а также сохранение пилорического отдела желудка.
Особое внимание резекции паракавальной клетчатки уделяют потому, что именно в этой зоне чаще всего возникают рецидивы опухоли. Резекцию сосудов осуществляют при изолированном опухолевом поражении верхней брыжеечной вены или места её соединения с воротной веной. Прорастание верхней брыжеечной артерии чаще всего сопровождается обширным метастазированием в забрюшинные лимфатические узлы, что исключает возможность удаления опухоли.
Существуют мнения, что необходимо удалять узлы чревного сплетения, что позволяет существенно уменьшить выраженность болевого абдоминального синдрома в послеоперационном периоде, особенно в поздние сроки, когда заболевание прогрессирует.
Сохранение пилородуоденального сегмента при панкреатодуоденальной резекции улучшает пищеварительные функции и способствует более быстрому восстановлению массы тела больных.
Важно выявить зону первичного расположения опухоли в ПЖ, в первую очередь для исключения периампуллярных и ампулярных аденокарционом, имеющих значительно лучший прогноз.
Результаты стандартной панкреатодуоденальной резекции во многих больницах неудовлетворительные.
Послеоперационная летальность состав.ляет 12,3%, 1 год проживает 43,1% больных, средняя выживаемость больных составляет 15,5 мес, пятилетняя выживаемость не превышает 3,5—16.7%.
Неудовлетворительные отдалённые результаты, высокая послеоперационная смертность и техническая сложность панкреатодуоденальной резекции послужили основанием для отказа от радикальных вмешательств при раке ПЖ. Однако следует помнить, что репрезентативность результатов сравнительных исследований, проводимых в разных странах, может быть неодинаковой ввиду различий в диагностических критериях и подходах к стадированию рака ПЖ. В частности, в Японии применяют собственную классификацию опухолей ПЖ, отличающуюся от применяемых в США и Европе.
Выживают после гастропанкреатодуоденальной резекции лишь те больные, у которых по данным гистологического исследования послеоперационного материала по краям резекции нет опухолевых клеток. Напротив, в случаях их обнаружения больные живут приблизительно столько же, сколько больные после химиолучевого лечения.
При подтверждённом раке ПЖ выполняют ещё более объёмные операции — тотальную панкреатэктомию и расширенную панкреато-дуоденалъную резекцию. Необходимость в панкреатэктомии обусловлена важностью удаления мультифокальных очагов рака в ПЖ и более радикальным иссечением регионарных лимфоузлов (лимфатических узлов корня селезёнки, вокруг хвоста ПЖ). Несмотря на расширенный объём операции, показатели послеоперационной летальности сократились, однако отдалённые результаты от расширения объёма операции не улучшились, преимущественно за счёт развития тяжёлого сахарного диабета.
Расширенная панкреатодуоденальная резекция предусматривает удаление сегмента воротной вены и вовлечённых в опухолевый процесс артерий с реконструкцией сосудов. Кроме того, удаляют забрюшинные лимфатические узлы от чревной артерии до бифуркации подвздошных артерий. Разработчик техники этой операции Фортнер добился уровня отдалённой выживаемости 20% при послеоперационной летальности 23%.
При нерезектабельной опухоли, наличии или угрозе возникновения желтухи, гастродуоденальной непроходимости, если предполагаемая продолжительность жизни больного составляет более 6—7 мес, производят паллиативные вмешательства, в частности наложение билиодигестивного и гастроеюнального шунта (см. рис. 5-22).
При предполагаемой продолжительности жизни 1-2 мес показано эндоскопическое введение стента в жёлчные протоки. Установка эндопротеза вместо хирургического шунтирования (холедоходуоденостомии и гастроэнтеростомии) подходит больным с тяжёлыми сопутствующими заболеваниями и липам старческого возраста. Она позволяет уменьшить число осложнений и смертность. Использование новых стентов из металлической сетки даст возможность увеличить продолжительность их нахождения в протоках и снизить частоту возникновения холангита. Рецидивирование желтухи после установления стента чаще всего связано с его обтурацией вследствие сладжа жёлчи; в этом случае проводят замену стента.
Предоперационное дренирование жёлчных протоков с целью уменьшения холестаза не приводит к увеличению продолжительности жизни больных. Недавно описана методика дренирующих малоинвазивных операций с целью декомпрессии жёлчевыводяших путей с помощью ЭУС, позволяющей более точно произвести стентирование.
Пример паллиативной операции — введение спирта (50 мл) или фенола в зону чревного сплетения дая купирования болевого абдоминального синдрома. Такой подход позволяет уменьшить боли или даже купировать их на короткое время, однако у 2/3 пациентов болевой синдром рецидивирует в течение месяца. Блокаду чревного сплетения можно выполнять повторно, однако эффективность следующих процедур более низкая. Тем не менее блокада чревного сплетения более эффективна, чем применение наркотических анальгетиков в сроки до 6 нед.
Появление методики нейролизиса чревного сплетения с использованием ЭУС повысило эффективность вмешательства ввиду большой точности определения зоны введения спирта. Боль проходит у 52% пациентов, а у 30% удаётся уменьшить суточные дозы наркотических анальгетиков.
Существуют указания об эффективности торакоскопической сплапхнэктомии в лечении болевого абдоминального синдрома. Для улучшения результатов хирургического лечения его дополняют химио-и лучевой терапией. Применяют эти методы не только после операции, но и интраоперапионно (введение в воротную вену или печёночную артерию фторурацила, митомицина). Возможны различные схемы комбинации лучевой, химиотерапии и хирургического лечения, введение препаратов в ткань опухоли под контролем ЭУС.
В последние годы всё чаще применяют трансплантацию ПЖ, селективную трансплантацию островковых и ацинарных клеток, что позволяет существенно улучшить качество жизни больных после панкреатэктомии по поводу ранних стадий негенерализованного рака ПЖ.
Злокачественные опухоли печени встречаются гораздо чаще доброкачественных, причем частота метастатических опухолей в 30 раз выше, чем первичных.
Выделяют следующие первичные злокачественные опухоли печени: гепатоцеллюлярные — гепатоцеллюлярная карцинома, фиброламеллярная карцинома, гепатобластома; билиарные — холангиокарцинома, смешанная гепатохолангиоцеллюлярная карцинома, цистаденокарцинома; мезодермальные — ангиосаркома (гемангиоэндотелиома), эпителиоидная гемангиоэндотелиома, саркома.
Гепатоцеллюлярная карцинома. Ежегодно от гепатоцеллюлярной карциномы в мире погибают 1250000 человек. Среди опухолей, поражающих человека, она стоит на седьмом месте.
Распространенность заболевания зависит от географической зоны. Наиболее часто оно встречается у жителей Африки и Азии, у которых почти всегда развивается на фоне цирроза печени. В странах Юго-Восточной Азии это вторая по распространенности злокачественная опухоль. Частота случаев заболевания возрастает и в западных странах, что, вероятно, связано с распространенностью вирусного гепатита В и С, который является наиболее частой причиной развития гепатоцеллюлярной карциномы.
Определенную роль могут играть экзогенные канцерогены; например, ряд ученых считает, что высокая частота гепатокарциномы в субтропических регионах обусловлена употреблением пищи, зараженной грибковыми афлатоксинами. В Северной Америке, Европе и других регионах, где заболеваемость низкая, у большинства больных опухоль развивается на фоне цирроза. Алкогольному, постнекротическому и особенно пигментному циррозу печени свойственна предрасположенность к злокачественному перерождению.
Международная классификация по системе TNM
Применима только для первичного гепатоцеллюлярного рака и холангиокарциномы печени (опухоль желчных внутрипеченочных протоков). Диагноз должен быть подтвержден гистологически.
Анатомические области:
Внутрипеченочный желчный проток.
Т — первичная опухоль:
Тх — недостаточно данных для оценки первичной опухоли,
Т0 — первичная опухоль не определяется,
Т1 — солитарная опухоль до 2 см в наибольшем измерении без инвазии сосудов,
Т2 — солитарная опухоль до 2 см в наибольшем измерении с инвазией сосудов, или множественные опухоли до 2 см в наибольшем измерении без инвазии сосудов, ограниченные одной долей, или солитарная опухоль более 2 см в наибольшем измерении без инвазии сосудов.
ТЗ — солитарная опухоль более 2 см в наибольшем измерении с инвазией сосудов, или множественные опухоли не более 2 см в наибольшем измерении с инвазией сосудов, ограниченные одной долей, или ограниченные одной долей множественные опухоли, каждая из которых имеет более 2 см в наибольшем измерении, с инвазией сосудов или без нее,
Т4 — множественные опухоли в обеих долях, или опухоль(и), поражающая основную ветвь портальной или печеночной вен, ИЛИ опухоль(и) с распространением на прилежащие органы (кроме желчного пузыря), или опухоль(и) с прорастанием висцеральной брюшины.
Примечание. Для классификации плоскость, проецируемая между ложем желчного пузыря и нижней полой веной, делит печень на две доли.
N — регионарные лимфатические узлы. Регионарными лимфатическими узлами являются лимфатические узлы ворот печени (расположенные в печеночно-двенадцатиперстной связке).
Nx — недостаточно данных для оценки состояния регионарных лимфатических узлов,
N0 — нет признаков метастатического поражения регионарных лимфатических узлов,
N1 — имеется поражение регионарных лимфатических узлов метастазами.
Мх — недостаточно данных для определения отдаленных метастазов,
М0 — нет признаков отдаленных метастазов, M1 — имеются отдаленные метастазы.
PTNM — патогистологическая классификация. Требования к определению категорий рТ, pN, рМ соответствуют требованиям к определению категорий Т, N, М.
G — гистопатологическая дифференцировка:
Gx — степень дифференцировки не может быть установлена,
G1 — высокая степень дифференцировки,
G2 — средняя степень дифференцировки,
G3 — низкая степень дифференцировки,
G4 — недифференцированные опухоли.
Группировка по стадиям
Клиника. Наиболее частые клинические симптомы — боль в животе, потеря массы тела, гепатомегалия. Боль чаще локализуется в правом подреберье или в эпигастральной области, носит постоянный характер и не зависит от приема пищи; со временем боль постепенно усиливается, что заставляет применять наркотические средства. Важными симптомами заболевания являются нарастающая слабость, потеря аппетита, снижение массы тела, в терминальных стадиях — кахексия. Постоянным клиническим признаком рака печени является гепатомегалия. Увеличенная печень бугристая, выступает из-под края реберной дуги. Повышенная температура тела бывает довольно часто и может имитировать инфекцию. У 1/3 больных рак печени сопровождается желтухой, которая редко бывает интенсивной, как правило, не зависит от размеров опухоли, возникает в результате сдавления желчных протоков метастазами в перипортальных лимфатических узлах, реже — первичной опухолью. Асцит обнаруживают приблизительно у половины больных, чаще при сопутствующем циррозе печени. У некоторых больных, страдающих раком печени, накопление жидкости в брюшной полости связано с диссеминацией опухоли по серозному покрову либо сдавлением метастатическими узлами воротной вены. Тромбоз воротной вены усугубляет асцит. Может развиться окклюзия печеночных вен. Возможно прорастание опухоли в правое предсердие и венозные сплетения пищевода. Кровотечение из варикозно расширенных вен пищевода — частое и, как правило, смертельное осложнение. Невозможность остановить кровотечение из варикозно расширенных вен у больного циррозом печени часто обусловливается гепатоцеллюлярной карциномой, прорастающей в воротную вену.
Диагностика. Биохимические пробы практически не имеют значения для диагностики, за исключением обнаружения в сыворотке крови а-фетопротеина. Этот белок в норме исчезает через 10 днейПослеРождения; его присутствие в крови взрослых указывает на наличие дифференцировки гепатоцитов и, следовательно, может свидетельствовать о гепатоцеллюлярной карциноме. Типичными являются значения, превышающие 400 мкг/л; более низкие значения а-фетопротеина менее специфичны и встречаются при гепатите.
УЗИ и КТ-сканирование брюшной полости являются весьма важными для диагностики вспомогательными методами исследования, иногда с их помощью удается обнаружить субклинические карциномы. Важную информацию можно получить при выполнении печеночной артериографии.
Биопсия печени, осуществленная под УЗ-контролем, позволяет получить цитологическое и гистологическое подтверждение диагноза. В ряде случаев опухолевая природа заболевания печени окончательно устанавливается с помощью лапаротомии или лапароскопии и интраоперационной биопсии.
Лечение. По данным мировой литературы, с 1963 г. трансплантация печени по поводу гепатоцеллюлярной карциномы была выполнена более чем у 300 больных. Годичная и пятилетняя выживаемость при этом составила соответственно 42-71% и 20-45%. Частота рецидивов — 65%. Выживаемость зависит от размеров опухоли. При опухолях диаметром менее 5 см продолжительность жизни составляет 55±8 мес, при более крупных опухолях — 24±6 мес.
К воздействию ионизирующего излучения гепатоцеллюлярная карцинома нечувствительна. Результаты химиотерапии также неудовлетворительны, даже при введении химиопрепаратов через печеночную артерию. Препаратом выбора является митоксантрон, который вводят внутривенно каждые 3 нед. Однако положительные результаты отмечены лишь у 27,3% больных. Результаты эмболизации химиопрепаратами питающих опухоль сосудов неоднозначны. У одних больных она не дает существенного эффекта, у других позволяет продлить жизнь. Прогноз зависит от формы опухоли, ее размеров, прорастания в воротную вену, наличия асцита и желтухи. Опухоли, не имеющие капсулы, устойчивы к эмболизации. Этот метод наиболее эффективен при карциноидных опухолях печени.
Прогноз обычно плохой, и лечение, как правило, неэффективно. Наибольший успех приносит хирургический метод лечения, который заключается в резекции или трансплантации печени, но он возможен у небольшого числа больных. Операбельность невелика и колеблется в пределах 3—30%. Результаты последних исследований свидетельствуют о том, что выживаемость в течение года после резекции печени составляет 55-80%, пяти лет — 25-39%. Результаты трансплантации печени обычно неудовлетворительны.
Фиброламеллярная карцинома — особый вариант гепатоцеллюлярной карциномы с характерной морфологией злокачественно измененных гепатоцитов, окруженных ламеллярной фиброзной тканью. Опухоль обычно поражает молодых людей и не имеет никакой связи с предшествующим циррозом, носительством вируса гепатита В или другими известными факторами риска. Уровень а-фетопротеина лишь изредка повышен. Прогноз лучше, чем при обычной гепатоцеллюлярной карциноме, некоторые больные живут несколько лет после резекции опухоли.
Холангиокарцинома — опухоль, исходящая из эпителия желчных внутрипеченочных путей. Причиной ее является поражение, связанное с инвазией печеночной двуусткой. Иногда развивается у больных с длительно протекающим неспецифическим язвенным колитом и склерозирующим холангитом.
Гепатобластома — одна из наиболее распространенных опухолей детского возраста, иногда проявляется преждевременным половым созреванием из-за эктопической продукции гонадотропина.
Ангиосаркома — встречается редко, развивается у людей, работающих в производстве, где имеется воздействие винилхлорида.
Диагноз для этих трех видов опухолей базируется на данных гистологического исследования материала, взятого из новообразования путем биопсии.
Лечение практически неэффективно и прогноз плохой.
Читайте также:

