Пропионовый альдегид взаимодействует с хлором
Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:

Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
| Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода. |
Структурная формула альдегидов:

| Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами . |
Структурная формула кетонов:

1. Реакции присоединения
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:


При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре.

При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали.
В качестве катализаторов процесса используют кислоты или основания.
Полуацетали существует только при низкой температуре.

| Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами. |
Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:

Карбонильные соединения присоединяют синильную кислоту HCN. При этом образуется гидроксинитрил (циангидрин):

2. Окисление альдегидов и кетонов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Альдегид → карбоновая кислота
Формальдегид→ муравьиная кислота→ углекислый газ
в торичные спирты → кетоны
Типичные окислители — гидроксид меди (II), перманганат калия KMnO4, K2Cr2O7, аммиачный раствор оксида серебра (I).
Кетоны окисляются только при действии сильных окислителей и нагревании.
Происходит при нагревании альдегидов со свежеосажденным гидроксидом меди, при этом образуется красно-кирпичный осадок оксида меди (I) Cu2O. Это — одна из качественных реакций на альдегиды.

| Например, муравьиный альдегид окисляется гидроксидом меди (II) |
HCHO + Cu(OH)2 = Cu + HCOOH + H2O
Чаще в этой реакции образуется оксид меди (I):
HCHO + 2Cu(OH)2 = Cu2O + HCOOH + 2H2O

Поскольку раствор содержит избыток аммиака, продуктом окисления альдегида будет соль аммония карбоновой кислоты.
| Например, при окислении муравьиного альдегида аммиачным раствором оксида серебра (I) образуется карбонат аммония |

| Например, при окислении уксусного альдегида аммиачным раствором оксида серебра образуется ацетат аммония |
Образование осадка серебра при взаимодействии с аммиачным раствором оксида серебра — качественная реакция на альдегиды.
Упрощенный вариант реакции:

При окислении под действием перманганатов или соединений хрома (VI) альдегиды окисляются до карбоновых кислот или до солей карбоновых кислот (в нейтральной среде). Муравьиный альдегид окисляется до углекислого газа или до солей угольной кислоты (в нейтральной среде).
| Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота |

Кетоны окисляются только в очень жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов.
Реакция протекает с разрывом С–С-связей (соседних с карбонильной группой) и с образованием смеси карбоновых кислот с меньшей молекулярной массой или СО2.
| Карбонильное соединение/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метаналь СН2О | CO2 | K2CO3 |
| Альдегид R-СНО | R-COOH | R-COOK |
| Кетон | R-COOH/ СО2 | R-COOK/ K2СО3 |

При горении карбонильных соединений образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания метаналя: |
3. Замещение водорода у атома углерода, соседнего с карбонильной группой
Карбонильные соединения вступают в реакцию с галогенами, в результате которой получается хлорзамещенный (у ближайшего к карбонильной группе атома углерода) альдегид или кетон.
| Например, при хлорировании уксусного альдегида образуется хлорпроизводное этаналя |

Полученное из ацетальдегида вещество называется хлораль. Продукт присоединения воды к хлоралю (хлоральгидрат) устойчив и используется как лекарство.
4. Конденсация с фенолами
Формальдегид может взаимодействовать с фенолом. Катализатором процесса выступают кислоты или основания:

Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол и воды:

Фенол и формальдегид вступают в реакцию поликонденсации.
Поликонденсация — это процесс соединения молекул в длинную цепь (полимер) с образованием побочных продуктов с низкой молекулярной массой (вода или др.).
5. Полимеризация альдегидов
Полимеризация характерна в основном для легких альдегидов. Для альдегидов характерна линейная и циклическая полимеризация.
Например, в растворе формалина (40 %-ного водного раствора формальдегида) образуется белый осадок полимера формальдегида, который называется полиформальдегид или параформ:

Этот сайт использует Akismet для борьбы со спамом. Узнайте как обрабатываются ваши данные комментариев.
ПРОПИОНОВЫЙ АЛЬДЕГИД (пропаналь) CH3CH2CHO
мол. м. 58,1; бесцветная жидкость с характерным запахом; т. пл. −81 °C, т. кип. 48,8 °C; 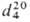
0,8058; 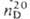
1,3636; μ 8,47∙10 −30 Кл∙м; раств. в воде (16,7 г в 100 г при 20 С С), с водой образует азеотропную смесь ( т. кип. 47,8 °C, 98,1% П.а.), смешивается со мн. орг. растворителями.
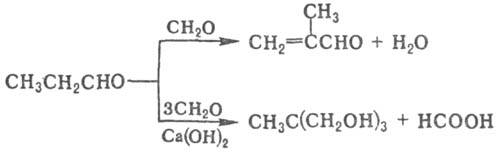
По химическим свойствам — типичный представитель насыщ. альдегидов. При окислении П. а. в присутствии катализаторов образуется пропионовая кислота, при гидрогенизации — пропанол; конденсация эквимолярных количеств П. а. и CH2O приводит к метакролеину, использование 3-кратного избытка CH2O в присут Ca(OH)2 к 1,1,1-трис-(гидроксиметил)этану (метриол):
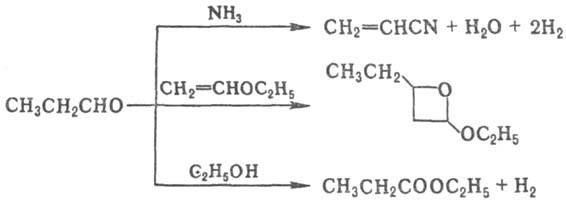
При взаимодействии П.а. с избытком NH3 в газовой фазе образуется акрилонитрил, при фотохим. циклоприсоединении к олефинам — производные оксетана, при реакции с этанолом ( кат. Ag-Cd-Zn-Zr, 225–235 °C)-этилпропионат, напр.:
В промышленности П.а. получают оксосинтезом из этилена, CO и H2 в присутствии Со(CO)4 при 190–210 °C и давлении 25 МПа; он м. б. синтезирован также дегидрированием пропанола в присутствии Ag при 400 °C:
CH2=CH2 + CO + H2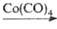
CH3CH2CHO
CH3CH2CH2OH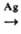
CH3CH2СНO+H2
Идентифицируют П. а. по его производным по карбонильной группе, напр. диэтилацеталь CH3CH2CH(OC2H5)2, т. кип. 122,8 °C, 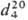
0,8273, 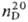
1,3894; 2,4-динитрофенилгидразон 2,4-(NO2)2C6H3NHN==CHC2H5, т. пл. 156 °C; 3-нитробензоилгидразон 3-NO2C6H4CONHN= =CHC2H5, т. пл. 156,5–158,5 °C; оксим C2H5CH=NOH, т. пл. 40 °C.
П. а. применяют в производстве пропионовой кислоты и ее эфиров, метакролеина, метриола (последний используют при изготовлении смазок), фотоматериалов, в синтезе антибиотиков, прир. соед. (макролидов), душистых веществ ( напр., цикламенальдегида).
П. а. хранят без доступа воздуха при 20 °C.
1. Межклассовым изомером для бутаналя является:
а) 2-метилпропаналь; б) этаналь; в) бутанон г) 2-метилбутаналь
2. Изомером углеродного скелета для бутаналя является:
б) этаналь; в) бутанон г) 2-метилбутаналь
3. Гомологом для пропионового альдегида не является:
1) бутаналь 2) формальдегид 3) бутанол-1 4) 2-метилпропаналь
4. Состав CnH2nO имеют
1) карбоновые кислоты и сложные эфиры 2) сложные эфиры и простые эфиры
3) простые эфиры и альдегиды 4) альдегиды и кетоны
5. Молекула вещества 2-метилпропен-2-аль содержит
1) три атома углерода и одну двойную связь 2) четыре атома углерода и одну двойную связь
3) три атома углерода и две двойные связи 4) четыре атома углерода и две двойные связи
Свойства
6. Выберите неверное утверждение:
а) альдегиды являются хорошими восстановителями;
б) альдегиды характеризуются низкой реакционной способностью;
в) альдегиды легко вступают в реакции замещения;
г) альдегиды легко вступают в реакции конденсации и полимеризации.
7. Уксусный альдегид реагирует с каждым из двух веществ
1) аммиачным раствором оксида серебра(I) и кислородом
2) гидроксидом меди (II) и оксидом кальция
3) соляной кислотой и серебром
4) гидроксидом натрия и водородом
1) связи С—Н 2) связи С—С 3) связи С=О 4) углеводородному радикалу
9. При взаимодействии ацетальдегида с гидроксидом меди (II) образуется
1)этилацетат 2) уксусная кислота 3) этиловый спирт 4) этилат меди
10. В результате реакции альдегида с водородом образуется
1) спирт 2) простой эфир 3) сложный эфир 4) кислота
11. Уксусный альдегид вступает во взаимодействии каждым из двух веществ
12. Муравьиный альдегид реагирует с каждым из веществ
13. При окислении альдегидов образуются:
1) карбоновые кислоты 2) кетоны 3) первичные спирты 4) вторичные спирты
14. При восстановлении альдегидов образуются:
1) карбоновые кислоты 2) кетоны 3) первичные спирты 4) вторичные спирты
15. Альдегид нельзя окислить с помощью:
16. Уксусный альдегид реагирует с каждым из двух веществ
1) аммиачным раствором оксида серебра(I) и кислородом
2) гидроксидом меди (II) и оксидом кальция
3) соляной кислотой и серебром
4) гидроксидом натрия и водородом
17. При взаимодействии альдегида и водорода образуется:
1) кетон 2) карбоновая кислота 3) спирт 4) алкен
1) RСНО + [О] àRСООН
2) RСНО + Аg2О àRСООН + 2Аg
19. Качественной реакцией на формальдегид является его взаимодействие с
1) водородом 2) бромной водой 3) хлороводородом 4) аммиачным раствором оксида серебра
20. Качественной реакцией на альдегиды является взаимодействие с:
21. Какое вещество образуется при окислении пропаналя?
1) пропанол 2) пропиловый эфир уксусной кислоты
3) пропионовая кислота 4) метилэтиловый эфир
22. Ацетальдегид взаимодействует с веществами:
4) гидроксид меди (II)
23. Формальдегид взаимодействует с
24. Пропионовый альдегид взаимодействует с веществами:
4) оксид серебра (NH3 р-р)
Получение
25. Уксусный альдегид может быть получен окислением. . .
1) уксусной кислоты 2) уксусного ангидрид 3)ацетатного волокна 4) этанола
26. При гидратации ацетилена получают промежуточное вещество А, которое окисляют в уксусную кислоту. Определите вещество А:
27. Ацетальдегид не может быть получен в реакции
1) дегидрирования этанола 2) гидратации ацетилена
3) дегидратации уксусной кислоты 4) 1,1-дихлорэтана со спиртовым раствором щелочи
28. Получить альдегид из первичного спирта можно при помощи окисления:
29. Пентаналь нельзя получить из:
1) пентанола-1 2) пентина-1 3)1,1-дихлорпентана 4) 1,1-дибромпентана
30. В результате взаимодействия ацетилена с водой в присутствии солей двухвалентной ртути образуется: 1)CH3COH; 2)C2H5OH; 3)C2H4; 4)CH3COOH.
31. При взаимодействии пропина и воды образуется
1) альдегид 2) кетон 3) спирт 4) карбоновая кислота
32. Ацетальдегид не может быть получен в реакции
1) дегидрирования этанола 2) гидратации ацетилена
3) дегидратации уксусной кислоты 4) 1,1-дихлорэтана со спиртовым раствором щёлочи
33. Пропусканием паров пропанола-1 через раскаленную медную сетку можно получить:
1) пропаналь 2) пропанон 3) пропен 4)пропионовую кислоту
Кетоны
34. С аммиачным раствором оксида серебра не будет взаимодействовать:
1) пропанон 2) муравьиная кислота; 3) бутин-1 4) формальдегид
35. С аммиачным раствором оксида серебра не будет взаимодействовать:
1) бутаналь 2) муравьиная кислота; 3) пропин 4) бутанон
36. При нагревании бутанола-2 с нейтральным раствором перманганата калия образуется:
1) бутаналь; 2) бутанон 3) бутаноат калия 4) бутановая кислота
37. Чему равна степень окисления атома углерода карбонильной группы в кетонах?
1)0 2) +2 3) -2 4) Она зависит от состава кетона
38. Диметилкетон – это: 1) этаналь; 2) пропаналь; 3) пропанон-1 4) ацетон.
39. При восстановлении кетонов образуются:
1) карбоновые кислоты 2) первичные спирты 3) вторичные спирты 4) альдегиды
Карбонильные соединения.
40. Выберите неверное утверждение:
1) карбонильная группа кетонов менее полярна, чем в альдегидах;
2) низшие кетоны являются плохими растворителями;
3) кетоны труднее, чем альдегиды, окисляются;
4) кетоны труднее, чем альдегиды, восстанавливаются.
41. Ацетон можно отличить от изомерного ему альдегида с помощью
1) реакции присоединения HCN, 2) реакции гидрирования 3) индикатора 4) реакции с Сu(ОН)2.
42. С водородом (в присутствии катализатора) реагируют
5) уксусная кислота
43. Сколько альдегидов и кетонов отвечает формуле С3Н6О? 1)Один 2) Два 3)Три 4) Пять
44. Какая из молекул содержит 2π-связи и 8 σ-связей:
1) бутандион-2,3 2) пропандиаль 3) пентандиаль 4) пентанон-3
45. Альдегид и кетон, имеющие одинаковую молекулярную формулу являются изомерами:
1)положения функциональной группы; 2)геометрическими;
46. Минимальное количество атомов углерода в молекулах кетона и ароматического альдегида равны соответственно: 1)3 и 6; 2)3 и 7; 3)4 и 6; 4)4 и 7.
Т. С. Боротюк, МКОУ СОШ №14, Тайшет, Иркутская область
- Назад
- Вперед
Подпишитесь на рассылку информационных писем о возможности бесплатного опубликования статей в журналах входящих в список ВАК.
Опубликовать статью в журнале из списка ВАК - бесплатно без регистрации
- Агрономия, лесное и водное хозяйство
- Администрирование школы
- Астрономия
- Биология
- Ветеринария и зоотехния
- Внеклассная работа
- Высшее образование
- География
- Гуманитарные исследования
- Дополнительное образование
- Естественные и технические науки
- Инженерия
- Иностранный язык
- Информатика
- Информационный раздел
- Искусствоведение
- История и обществознание
- Классное руководство
- Красота и здоровье
- Литература
- Математика
- Менеджеру школы
- Методический кабинет
- Начальная школа
- Общая биология
- Общепедагогические технологии
- Опыт профессионалов
- Организация учебного процесса
- Особое мнение
- Педагогическая инноватика
- Политология
- Правоведение и Обществоведение
- Психология
- Работа с дошкольниками
- Работа с родителями
- Русский язык
- Сельское и лесное хозяйство
- Социальная педагогика
- Спорт и здоровье
- Специальная педагогика
- Строительство. Архитектура
- Строительство и ремонт
- Технология
- Транспорт
- Физика
- Физическая культура
- Философия
- Химия
- Школьная психологическая служба
- Экономика и финансы в школе
- Экономика. Экономические науки
Вам нужен сайт и клиенты? Разработка и продвижение сайтов с Гарантией.
Альдегиды - летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов CnH2nO.
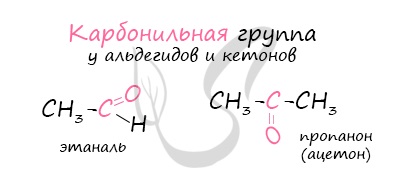
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.

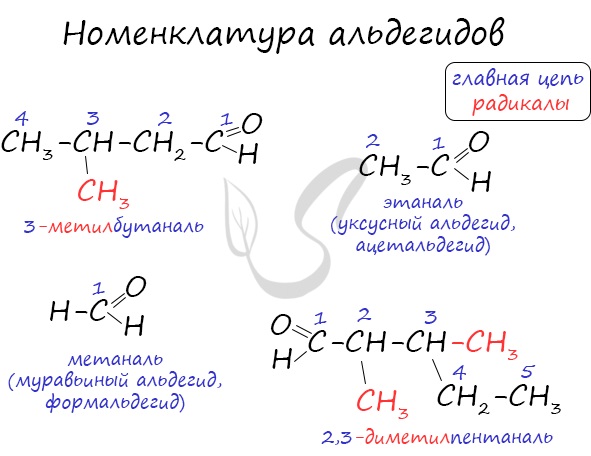
Названия альдегидов формируются путем добавления суффикса "аль" к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот - HO. Например: метаналь - HCHO, этаналь - CH3CHO, пропаналь - C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь - формальдегид, этаналь - ацетальдегид. Замечу, что формалином называется 40% раствор формальдегида.
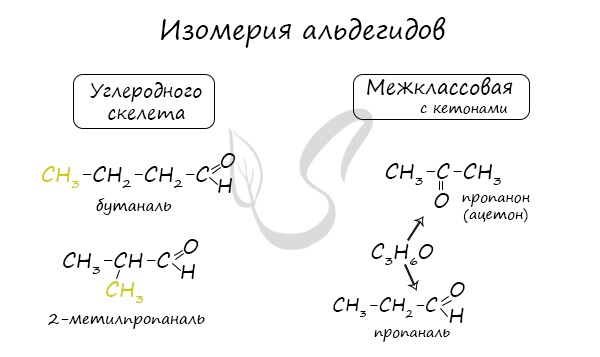
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
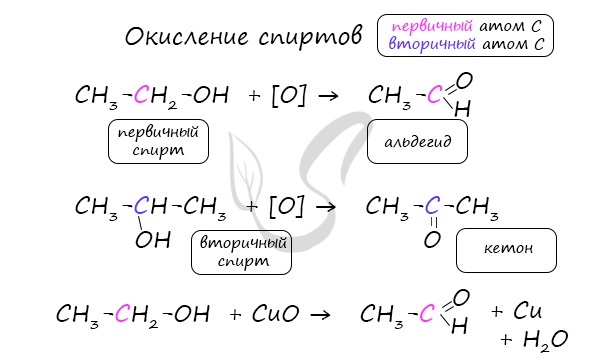
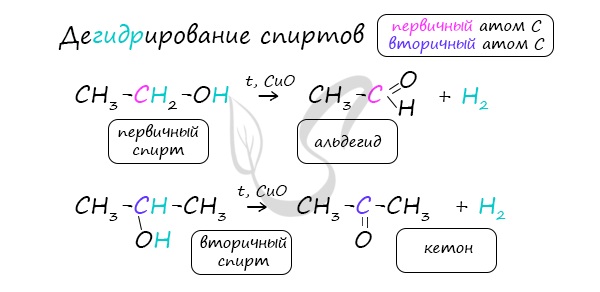
- Окисление спиртов
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов - кетоны. Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей карбоновых кислот возможно получение кетонов.

В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа.
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны.

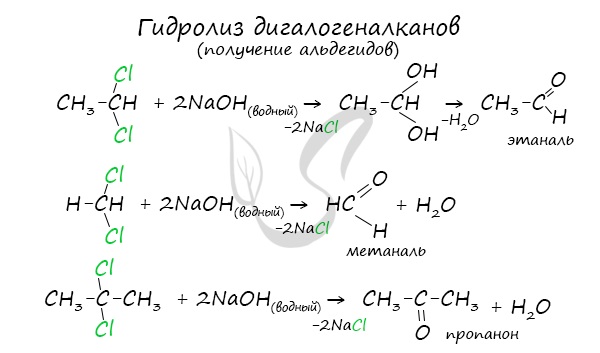
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов - у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.

В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.

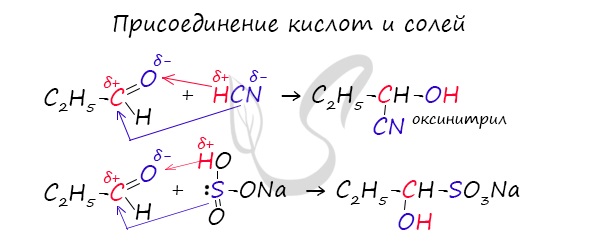
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
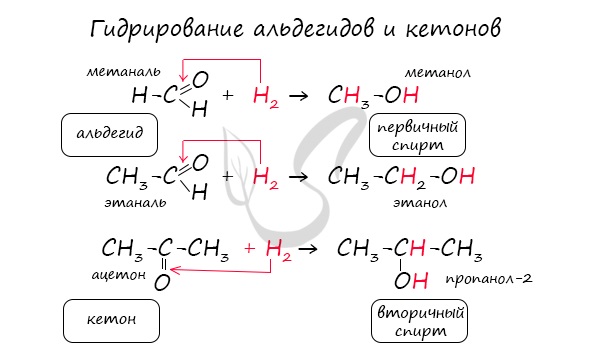
Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе. Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов - вторичных спиртов.
В результате полного окисления, горения, образуется углекислый газ и вода.
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли

Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая распадается на углекислый газ и воду. Это связано с интересным фактом - наличием альдегидной группы у муравьиной кислоты.

Окисление также возможно другим реагентом - гидроксидом меди II. Эта реакция также относится к качественным для альдегидов, в результате образуется кирпично-красный осадок оксида меди I.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

