Промиелоцитарный лейкоз у кого был выздоровление


При поражении опухолью в кровь начинают вырабатываться незрелые мутированные лейкоциты, которые постоянно делятся и полностью заполняют пространство, мешая здоровым клеткам. Также мутированные лейкоциты не выполняют свою защитную функцию.

Лейкемия лечится или нет
Первый вопрос, возникающий у людей, которые столкнулись с подозрением на рак крови, лейкемия лечится или нет.
Всем известно, что это тяжёлое и серьёзное заболевание, но, пока оно не коснётся определённого человека, мало кто вникает во все тонкости. Это вполне свойственно человеческой натуре.
Но на самом деле информацией по этой теме не стоит пренебрегать, так как этот недуг приобретает масштабное распространение и, к сожалению, часто ему подвергаются маленькие дети.
Существуют проверенные медикаментозные методы, используя которые, можно контролировать болезнь и добиваться ремиссии

Причины заболевания
Возможными причинами заболевания являются:
- нарушения в хромосомном аппарате и структуре клетки;
- воздействие повышенного уровня радиации на протяжении длительного периода времени;
- взаимодействие с токсичными препаратами и химическими веществами;
- вредные привычки, в том числе курение;
- после проведенной химиотерапии;
- генетическая предрасположенность.

Виды лейкемии
Лейкозы бывают острыми и хроническими. При острой форме начинают быстро делиться незрелые белые клетки, болезнь развивается в короткие сроки.
Хроническая лейкемия прогрессирует медленнее, в течение нескольких лет, при этом лейкоциты сначала созревают, затем становятся аномальными.
Заболевание классифицируют в зависимости от того, какие клетки поражены – лимфоциты, которые не содержат гранул, или миелоциты – молодые клетки с зернистой структурой.
Таким образом, выделяют четыре вида лейкозов:
- Острый миелоидный. Подвержены заболеванию и взрослые, и дети.
- Острый лимфобластный. Чаще болеют дети, хотя встречается и у взрослых.
- Хронический лимфоцитарный. Обычно развивается у людей от 55 лет.
Миелоидная лейкемия. Характеризуется быстрым ростом миелоидных клеток, в результате они накапливаются в периферической системе.

Симптомы лейкоза
Симптомы лейкоза, особенно в начале, очень неспецифичны и эти признаки легко пропустить. Поэтому мы рекомендуем вам очень внимательно относиться к тому, если вы:
- чувствуете выраженную слабость;
- быстро утомляетесь;
- страдаете от головных болей;
- не хотите есть;
- чувствуете боли в костях;
- отметили, что появилась сыпь и непонятные синяки;
- появились носовые кровотечения, кровят десна;
- теряете вес;
- часто болеете инфекционными заболеваниями.
Конечно, один-два эти симптома можно просто отнести, например, на рабочую нагрузку. Однако не упустите тяжелую болезнь, не рискуйте своей жизнью – раз заметили признаки, то приходите к нам на диагностику. Чем раньше вы начнете лечение заболеваний крови – тем больше шансов на ваше выздоровление.

Стадии
Отдельно нужно рассмотреть основные стадии лейкоза.
- Начальная. Чаще всего диагностируется у пациентов, которые страдают анемией.
- Развернутая. Тут уже проявляются все симптомы.
- Ремиссия. Может быть полная или неполная. Характеризуется повышением бластных клеток максимум на 5% именно в костном мозге (при их отсутствии в крови).
- Рецидив. Может развиваться как в костном мозге, так и иных органах. Стоит сказать о том, что каждый последующий рецидив опаснее предыдущего.
- Последняя. В таком случае у больного развиваются язвенно-некротические процессы, а также происходит угнетение кроветворения.

Шансы на выздоровление
В настоящее время диагноз лейкемия не является приговором, как это было раньше. Ответ на вопрос, лечится ли лейкоз, зависит от определенных факторов:
- разновидности заболевания;
- своевременной диагностики;
- характера поражения тканей и органов;
- возрастных особенностей;
- других возможных рисков.
Таким образом, важно тщательно и внимательно следить за состоянием своего здоровья. Максимальной гарантии того, что лейкемия лечится, у специалистов на данный момент нет, однако благодаря современной медицине существует немалое количество методов дают возможность продлить жизнь пациента на несколько десятков лет.

Лечение острых форм лейкемии
Острые лимфолейкозы у маленьких деток вылечиваются в 95%. Почти у 70% переболевших признаков заболевания нет минимум в течение пяти лет.
При лечении острой лимфобластной формы используется химиотерапия на основе трех препаратов. Если после использования химиотерапии возникает рецидив заболевания, врач советует использовать пересадку стволовых клеток при соответствующих показаниях, решение зависит от пациента.
При лечении миелоидной формы используется сильная лекарственная терапия в несколько курсов. Иногда применяется трансплантация костного мозга. Чем выше возраст пациента, тем ниже вероятность выздоровления.

Лечение хронической лейкемии
В отличие от острой формы заболевания, хроническая не требует такого срочного вмешательства. Она развивается медленнее и способы ее лечения отличаются. Прежде всего идет период наблюдения. На ранних стадиях симптомы практически незаметны, но наблюдение врача просто обязательно.
Таким пациентам тоже назначают привычное лечение, но в случае с трансплантологией клетки могут брать из организма пациента. Также применяют биологическую терапию, помогая организму улучшить защитные функции. К пациентам применяют и привычные методы лечения.

Методы лечения
Способ борьбы с недугом подбирается, исходя из его стадии и формы. При хронической лейкемии используют терапию, ориентированную на приостановление развития болезни, поддержание защитных функций организма и предотвращение осложнений. Кроме того, многих пациентов интересует, лечится или нет острый лейкоз крови. Стоит сказать, что при грамотном подходе, симптомы этой формы недуга также можно устранить. Для этого используют:
Химиотерапию. Она уничтожает раковые клетки. Лучевую терапию. Она разрушает пораженные клетки посредством рентгеновского излучения.
Пересадку стволовых клеток. С помощью этого метода восстанавливается образование здоровых клеток.
Прежде чем приступить к оперативному вмешательству, проводят химиотерапию. Она необходима для того, чтобы освободить место для новых, здоровых клеток костного мозга.

Профилактические меры
Чтобы избежать патологии необходимо:
- выбирать место проживания с насколько возможно более благополучной экологией,
- пациенты, у которых родственники болели раком, должны раз в полгода сдавать кровь на обследование;
- такая же рекомендация касается людей, у которых есть генные поломки, превышающие нормы.
Лейкоз является злокачественным заболеванием, которое часто называют раком крови. При заболевании красный костный мозг вырабатывает лейкозные клетки – патологические кровяные тельца. Почему это происходит в организме человека, ученые до настоящего времени так и не установили.
No related posts.
Врач с 36 летним стажем работы. Медицинский блогер Левио Меши. Постоянный обзор животрепещущих тем по психиатрии, психотерапии, зависимостям. Хирургии, онкологии и терапии. Беседы с ведущими врачами. Обзоры клиник и их врачей. Полезные материалы по самолечению и решению проблем со здоровьем. Посмотреть все записи автора Левио Меши
Нет такого региона, откуда бы не приезжал на лечение в Москву пациент в тяжелом состоянии. Но если еще в 90-е годы процент выживаемости заболевших раком крови составлял всего 30 из 100, то сегодня этот диагноз — не приговор. Больным предлагают сложное высокотехнологичное лечение для того, чтобы выжить.
Степан Белов, 23 года, Москва
Степан столяр. Умеет делать из дерева столы и шкафы, может отреставрировать старый скособоченный и проеденный жуком буфет, умеет вырезать фигурки птиц или животных. Наверное, работа с деревом — теплым и живым материалом — требует от человека особой душевной тишины, потому что Степан очень спокойный человек. Чрезвычайно спокойный.

Степан Белов. Фото: Фонд борьбы с лейкемией.
Про острый лимфобластный лейкоз он узнал случайно. Мчался на мотоцикле (да, это отличное транспортное средство для очень спокойного человека), не справился с управлением, получил травму, а заодно задел лимфоузел на шее. Месяц этот узел рос и раздувался, а потом гистология показала лейкоз.
После начала химиотерапии мужчина лишь один раз испугался за свою жизнь — когда он утром проснулся и увидел, что на подушке остались все его волосы. Разом.
Год спустя он чувствует себя прекрасно, постепенно вливается обратно в шумную и неспокойную жизнь. И только одно его беспокоит — разрешат ли врачи работать с деревом. Ведь дерево это не только годичные кольца на спиле, узоры, бархат коры и особое тепло. Это еще и стружка, пыль, много пыли. Молодой человек говорит, что будет ждать, когда разрешат. А терпения ему не занимать, мы знаем.
Рыбкина Татьяна, 41 год, Рязань
В жизни Татьяны было два события, которые можно без оглядки назвать чудом.
Первое — рождение дочки.

Татьяна Рыбкина с дочкой Настей и сыном Степой. Фото: Фонд борьбы с лейкемией.
А второе чудо, иначе и не назовешь, произошло, когда Татьяне сделали пересадку костного мозга. Неродственный донор, которого нашли в регистре, отказался от операции в последний момент, и донором для Татьяны стал родной брат. Правда, его костный мозг подходил ей только наполовину. Тогда жертвователи фонда борьбы с лейкемией собрали деньги на специальную систему, которая очищает трансплантат от нежелательных альфа/бетта Т-лимфоцитов, провоцирующих развитие опасных осложнений.
Олеся Абдуллина, 39 лет, Салехард, Ямало-Ненецкий АО

Олеся Абдуллина с дочкой Соней. Фото: Фонд борьбы с лейкемией.
Олеся и Соня живут в Салехарде . Олесе 39 лет, Соне 7. Два года они прожили вдали друг от друга, и это была жизнь будто всего на 50 процентов — неполноценная.
Тогда, два года назад, Олеся заболела гриппом — высокая температура, озноб. Пошла к врачу, сдала анализ крови, и оказалось, что грипп – это на самом деле острый лимфобластный лейкоз.
Олесю тут же отправили из Салехарда в Москву. Соня осталась с бабушкой дома. В больнице Олеся пролежала почти год. Все, как обычно – химиотерапия курсами, улучшение. А потом не как обычно – рецидив.
Врачи сказали, что нужна трансплантация костного мозга. Бабушка, с которой оставалась Соня, к тому времени умерла, и Олеся повезла дочку к крестной в Геленджик , чтобы если… Если понятно что, ребенок жил в семье. Ведь при трансплантации костного мозга не все выживают. Олеся это понимала.
Трансплантацию сделали, женщина выжила, но только костный мозг не прижился. Такое бывает. И тогда Олесю стали готовить ко второй пересадке. Она прошла удачно на 50% — слишком сильно был истощен организм. После приживления у Олеси начались грибковые осложнения — аспергиллез легких.
Женщина осталась в больнице сначала на 4 месяца, а потом еще на 4. С Соней они виделись за это время два раза. Дочка приезжала к маме на Новый год. Тогда они сидели под елкой и загадывали желания, примерно одно и то же. Соня ходила на ёлки, а Олеся ждала дочь в больнице – ей нельзя было выходить на улицу. Второй раз Олесю отпустили к дочке в сентябре — отвести в первый класс. Потому что это событие почище Нового года, бывает раз в жизни. Казалось, что если не мама ведет ребенка в школу, это неправильно. И почему-то страшно.
Сегодня Олеся вернулась домой. Ей стало лучше, хотя инфекция пока никуда не делась, и девушка постоянно находится под наблюдением врачей. Соня тоже вернулась домой из Геленджика. Теперь все дома — и это огромное, тихое счастье. Для двоих.
Иван Прокудин, 30 лет, Спасское, Нижегородская область

Иван Прокудин с супругой. Фото: Фонд борьбы с лейкемией.
Но даже диагноз, острый промиелоцитарный лейкоз, Иван в пылу предсвадебных хлопот как-то пропустил мимо ушей. Его, конечно, положили в больницу, в хорошую палату, одновременно с мужчиной с таким же диагнозом. Но Иван чувствовал себя в целом нормально, и думал, что уж к свадьбе-то будет бодряком. А потом, как-то под утро сосед Ивана умер. И молодому человеку вдруг стало все понятно. Что лейкоз это рак, что смерть рядом, и что свадьбу придется отложить.
Подготовка — тяжелая химия, убивающая, кажется, все живое — подарила Ивану еще одну болезнь периферическую нейропатию. Это когда нервные окончания конечностей отмирают, перестаешь чувствовать холод и тепло, а больно так, будто в ноги впиваются иглы. Мужчина не спал неделями и похудел вдвое. Трансплантацию провели в августе, донором стал родной брат Ивана, он подошел стопроцентно.
Этой зимой, на новый год, они с женой все же поедут в свадебное путешествие. В Париж — самый романтичный город мира. Рак не сдавался пять лет и отступил на шестой. Наверное, это тот самый случай, когда можно сказать, что победила любовь.
Еще больше историй о неравнодушии и помощи - на портале "Открытые НКО"
Только массивная трансфузиологическая поддержка (переливание свежезамороженной плазмы в минимальном объеме 1 л/сут, переливание тромбоконцентратов для поддержания уровня тромбоцитов не менее 50 • 10 9 /л) позволила снизить раннюю летальность до 15—20 %.
Итоговые работы по химиотерапии острого промиелоцитарного лейкоза, проведенные в последние годы, продемонстрировали необходимость использования более высоких, чем стандартные, доз даунорубицина (более 45 мг/м2 в день в программе 7 + 3). Доказательством этому служат данные Юго-западной онкологической группы США (SWOG) по лечению острого промиелоцитарного лейкоза. Авторы ретроспективно проанализировали результаты терапии острого промиелоцитарного лейкоза по протоколам, которые они использовали в разные годы.
Так, в начале 80-х годов (1982—1986) в программах индукции, консолидации, поддерживающей терапии использовался даунорубицин в дозе 70 мг/м2 в сутки в течение 3 дней (210 мг/м2 суммарно на курс 7+3). В указанных дозах в общей сложности проводили 4 курса химиотерапии, затем в течение 2 лет продолжали поддерживающее лечение по схеме POMP (метотрексат, винкристин, преднизолон, 6-меркаптопурин). С 1986 по 1991 г. в протоколах лечения острого промиелоцитарного лейкоза доза даунорубицина была уменьшена до 45 мг/м2 в сутки в течение 3 дней (суммарно 135 мг/м2 на курс 7 + 3).
Проводили всего 3 курса с даунорубицином в такой дозе (в третьем курсе применяли цитарабин в высоких дозах), а затем дозу даунорубицина вновь снижали до 60— 90 мг/м2 суммарно на курс, проводили 1 курс высокими дозами цитарабина или 2 курса 7 + 3, после чего лечение прекращали.
В таблице четко показано, что снижение дозы даунорубицина в индукции привело не только к уменьшению частоты достижения полной ремиссии, но и к существенному уменьшению процента долгожителей.
Результаты этого исследования свидетельствуют также о том, что при использовании программы 7 + 3 в лечении больных острым промиелоцитарным лейкозом прогностическими факторами являются раса пациента (у больных черной расы процент достижения ремиссии ниже, чем у белых), количество бластных клеток в крови (при наличии их в крови вероятность достижения ремиссии и безрецидивная выживаемость ниже), содержание лейкоцитов (при количестве лейкоцитов более 10*109/л общая и безрецидивная выживаемость больных существенно ниже) и тромбоцитов (при глубокой тромбоцитопении вероятность достижения ремиссии ниже).
Такие драматические различия двух протоколов терапии острого промиелоцитарного лейкоза, возможно, объясняются еще и тем, что на I этапе исследований продолжительность постремиссионного лечения была 2 года, тогда как на II этапе общая длительность лечения составила всего около полугода.
В настоящее время признается, что отсутствие поддерживающей химиотерапии существенным образом увеличивает вероятность развития рецидивов: с 10 до 35 %.
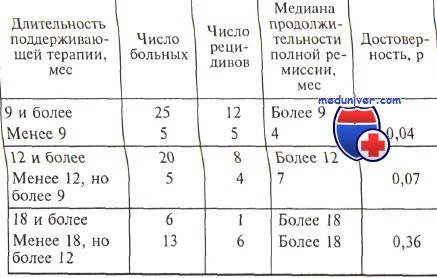
Исключительная важность проведения поддерживающего лечения при остром промиелоцитарном лейкозе обсуждалась в середине 80-х годов многими исследовательскими группами. Все исследователи отмечали снижение вероятности развития рецидивов при использовании поддерживающего лечения, при этом довольно четко определялся вариант поддерживающей терапии: курсы реиндукции, повторяемые раз в 2—3 мес, или постоянная терапия цитостатическими препаратами. И тот и другой вариант лечения применяли в течение длительного времени после достижения ремиссии — от 2 до 5 лет.
Следует обратить внимание, что в этих исследованиях часто использовали не только даунорубицин и цитарабин, но и преднизолон, винкристин, 6-меркаптопурин, метотрексат в качестве как постоянной терапии короткими курсами (программа POMP: ежедневно 6-меркаптопурин и еженедельно метотрексат постоянно, винкристин и преднизолон курсами), так и только постоянного поддерживающего лечения 6-меркаптопурином и метотрексатом. В таблице представлены некоторые работы, посвященные сравнению разных видов поддерживающего лечения при остром промиелоцитарном лейкозе.
Как видно из данных, представленных в таблице, в двух из трех исследований, в которых наряду с курсами реиндукции использовали постоянную поддерживающую терапию, получены убедительные доказательства в пользу постоянного приема цитостатических средств: продолжительность полной ремиссии увеличивалась в 2—3 раза — 48 мес в сравнении с 15 мес, 25 и 17 мес в сравнении с 9,7 мес. Следует подчеркнуть, что эти исследования малочисленные и нерандомизированные. Испанская группа не выявила различий в длительности ремиссии при добавлении к курсам реиндукции постоянного поддерживающего лечения (25 и 24 мес). Американские ученые использовали в программе реиндукции схему POMP.
Установлено, что при мультивариантном анализе единственным фактором, повлиявшим на продолжительность полной ремиссии, стал именно курс POMP: у больных, которым его проводили, медиана продолжительности ремиссии к 3 годам не достигнута (у 56 % больных сохраняется полная ремиссия) и составляет 15 мес у тех больных, при лечении которых POMP не использовали. Авторы указывают, что определенное влияние на вероятность развития рецидивов оказывает и длительность поддерживающей терапии.
Складывается впечатление, что с увеличением длительности поддерживающего лечения увеличивается и продолжительность полной ремиссии. Описанный французскими и американскими авторами феномен чувствительности клеток острого промиелоцитарного лейкоза к воздействию 6-меркаптопурина и метотрексата (достоверное увеличение продолжительности полной ремиссии при их использовании в качестве постоянной терапии) неясен. Эти доказанные в 80-е годы факты стали основой многих программ терапии острого промиелоцитарного лейкоза — во Франции, Италии, Испании: постоянное поддерживающее лечение в течение 2 лет проводится 6-меркаптопурином и метотрексатом.
В других исследованиях, в которых не предусмотрена длительная поддерживающая терапия (например, протокол MRC-10 в Великобритании), также были получены хорошие долгосрочные результаты лечения больных острым промиелоцитарным лейкозом. В исследовании, которое было инициировано в 1988 г. и завершено в 1995 г., всем больным ОМЛ проводили 4 курса химиотерапии (DAT-10, DAT-8, ADE, MACE), после чего части больных выполняли ауто- или алло-ТКМ. Полная ремиссия достигнута у 103 из 117 больных острым промиелоцитарным лейкозом, которые не получали ATRA, что составило 88 %, а ранняя летальность была 11 %.
Столь хорошие результаты без длительного поддерживающего лечения и без очень высоких доз антрацикл и новых антибиотиков в индукционной терапии при небольшом числе курсов с даунорубицином (150 мг/м2 на курс, 2 курса), по-видимому, можно объяснить применением за весь период лечения (4 курса химиотерапии) шести цитостатических препаратов (даунорубицин, цитарабин, 6-тиогуанин, этопозид, амсакрин, митоксантрон) в адекватных дозах и различных сочетаниях.
Важным фактором в лечении острого промиелоцитарного лейкоза является не только доза даунорубицина в курсах индукции, но и длительность его использования в период постремиссионной терапии (консолидация и поддерживающее лечение). В таблице представлены сводные данные лечения больных ОПЛ в различных гематологических центрах, в которых применяется разная постремиссионная терапия.
Из представленных в таблице данных видно, что использование высоких доз даунорубицина в индукции позволяет достичь высокого процента ремиссий, но если препарат не применяют и в ходе постремиссионной терапии, долгосрочные результаты становятся хуже. В исследовании, проведенном Th. Buchner, доказана необходимость использования ан-трациклиновых антибиотиков на всех этапах терапии при ОПЛ, а также эффективность длительного поддерживающего лечения.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Общая стратегия лечения острого миелобластного лейкоза
В современной гематологии терапию лейкозов, в том числе и острого миелобластного, необходимо проводить в специализированных стационарах по строгим программам. Программа (протокол) включает перечень необходимых для диагностики исследований и жёсткий график их проведения. После завершения диагностического этапа пациент получает лечение, предусмотренное этим протоколом, с жёстким соблюдением сроков и порядка элементов терапии. В настоящее время в мире существуют несколько ведущих исследовательских групп, анализирующих диагностику и лечение острого миелобластного лейкоза у детей в мультицентровых исследованиях. Это американские исследовательские группы CCG (Children's Cancer Group) и POG (Pediatric Oncology Group), английская группа MRC (Medical Research Council), немецкая группа BFM (Berlin-Frankfurt-Miinster), японская CCLG (Children's Cancer and Leukemia Study Group), французская LAME (Leucamie Aique Mycloi'de Enfant), итальянская AIEOP (Associazione Italiana Ematologia ed Oncologia Pediatric) и др. Результаты их исследований - основные источники современных знаний о диагностике, прогнозе и лечении острого миелобластного лейкоза у детей.
Основная цель лечения - эрадикация лейкемического клона с последующим восстановлением нормального гемопоэза.
Первый этап - индукция ремиссии. Для прогноза важна оценка чувствительности к терапии после проведения индукционного курса. Окончательную оценку, согласно большинству протоколов, проводят после двух курсов лечения.
Постремиссионная терапия должна состоять не менее чем из трёх блоков. Это может быть только химиотерапия или химиотерапия с последующей аутологичной или аллогенной трансплантацией гемопоэтических стволовых клеток. Некоторые терапевтические режимы включают поддерживающую терапию. Важный элемент - профилактика и лечение поражений ЦНС путём интратекального введения цитостатических препаратов, системной высокодознои терапии, а иногда и краниального облучения. Основной препарат для интратекальной терапии при остром миелобластном лейкозе - цитозин-арабинозид, в некоторых протоколах дополнительно используют преднизолон и метотрексат.
Современная терапия острою миелобластного лейкоза должна быть дифференцированной, т.е. различной по интенсивности (а значит, и по токсичности) в зависимости от группы риска. Кроме того, лечение должно быть настолько специфичным, насколько это возможно.
Терапия индукции
Цитотоксическая терапия острого миелобластного лейкоза вызывает транзиторную, но тяжёлую миелосупрессию с высоким риском инфекций и геморрагических осложнений. Спектр цитостатических препаратов, эффективных в отношении острого миелобластного лейкоза, достаточно невелик. Базовые препараты - цитозин-арабинозид, антрациклины (даунорубицин, митоксантрон, идарубицин), этопозид, тиогуанин.
В 1989-1993 годах группа CCG провела исследование 589 детей с острым миелобластным лейкозом. Исследование показало преимущество индукции в режиме интенсивного тайминга. Суть этого режима в том, что больные получают индукционную терапию, состоящую из двух одинаковых 4-дневных курсов с интервалом 6 дней. Каждый курс лечения включает цитозин-арабинозид, даунорубицин, этопозид и тиогуанин. Необходимость повторения курса лечения строго через фиксированный интервал, независимо от показателей гемопоэза, обусловлена тем, что леикемические клетки, которые находились во время первого курса вне митотической фазы, войдут в неё ко времени начала второго курса и подвергнутся цитотоксическому воздействию химиопрепаратов. Преимущество интенсивного тайминга в достоверном увеличении EFSc 27% у больных, получавших ту же терапию в стандартном режиме, до 42%. В настоящее время группа CCG опубликовала данные о пилотном исследовании индукции интенсивного тайминга с использованием идарубицина, показаны преимущества этого препарата в терапии индукции у детей.
Группа MRC в исследовании AML-9 (1986 год) показала преимущества продлённой терапии индукции (5-дневную индукцию с применением даунорубицина, цитозин-арабинозида и тиогуанина сравнивали с 10-дневной). Несмотря на более высокий уровень смертности от токсичности (21 против 16%), уровень достижения ремиссии был выше в группе продлённой терапии. Следующее исследование этой группы - AML-10 - включало 341 ребёнка. Индукционная терапия в AML-10 была основана на стандартных дозах цитозин-арабинозида и даунорубицина с добавлением трегьего препарата - этопозида или тиогуанина, в зависимости от группы рандомизации. Индукция в AML-12 (в исследование включены 529 детей) состояла из схемы ADE (цитозин-арабинозид + даунорубицин + этопозид), в другой группе рандомизации - из схемы АМЕ (цитозин-арабинозид + митоксантрон + этопозид). Ремиссия в обоих исследованиях составила 92%, смерть в индукции и резистентные острые миелобластные лейкозы - по 4%. Уровень ремиссии в обеих ветвях протокола AML-12 (ADE и АМЕ) был практически одинаковым - 90 и 92%. В начале 1990-х годов DFS при остром миелобластном лейкозе увеличилась с 30 до 50%; с 1995 года (протокол AML-12) значение данного показателя составляет 66%.
Индукция по протоколу исследовательской группы LAME состоит из стандартных доз цитозин-арабинозида и митоксантрона (суммарная доза 60 мг/м 2 ), ремиссия достигнута у 90% больных.
В России наиболее хорошо известны протоколы группы BFM. До 1993 года индукционная терапия состояла из курса ADE (цитозин-арабинозид + даунорубицин + этопозид). Согласно протоколу AML-BFM-93 (исследование включает 471 ребёнка), индукционная терапия в одной группе рандомизации была прежней - ADE, в другой группе - состояла из цитозин-арабинозида, этопозида и идарубицина. Уровень достижения ремиссии среди всех пациентов составил 82,2%. Показано, что введение идарубицина достоверно увеличило редукцию бластов у пациентов к 15-му дню от начала индукционной терапии, однако это не повлияло на частоту досгижения ремиссии и DFS, которая в этих группах была сходной.
Постиндукционная терапия
Большинство протоколов в качестве постремиссионной терапии предполагает два или более курса цитостатиков. Как правило, не менее одного курса полихимиотерапии основано на высоких дозах цитозин-арабинозида (1-3 г/м 2 в одно введение). Дополнительные препараты - этопозид и/или антрациклины (идарубицин или митоксантрон).
Наиболее успешны протоколы, предусматривающие три постремиссионных блока химиотерапии, часть которых проводят в режиме интенсивного тайминга и/или с использованием высоких доз цитозин-арабинозида.
Трансплантация гемопоэтических стволовых клеток
Современная терапия острого миелобластного лейкоза предусматривает для определённых категорий пациентов трансплантацию гемопоэтических стволовых клеток (ТГСК). Существуют два принципиально различных вида трансплантации - аллогенная и аутологичная.
По сравнению с аллогенной, роль аутологичной трансплантации в профилактике рецидива не столь очевидна.
Терапия острого промиелоцитарного лейкоза
Вариант М, по ЕАВ - особый вид острого миелолейкоза. Его регистрируют во всех регионах мира, но в некоторых он существенно преобладает. Среди всех случаев острого миелобластного лейкоза в США и Европе на острый промиелоцитарный лейкоз приходится 10-15%, в то время как в Китае - около трети, а среди латиноамериканской популяции - до 46%. Основное звено патогенеза и диагностический признак острого промиелоцитарного лейкоза - транслокация t(15;17)(q22;ql2) с образованием химерного гена PML-RARa. В клинической картине лидирует коагулопатия (в равной степени вероятны ДВС и гиперфибринолиз), которая может усугубляться на фоне химиотерапии, формируя высокий уровень смертности от геморрагического синдрома в начале лечения (20%). Неблагоприятные в отношении прогноза факторы - инициальный лейкоцитоз (количество лейкоцитов превышает 10х10 9 /л) и экспрессия CD56 на лейкемических промиелоцитах.
Большинству пациентов для достижения ремиссии достаточно применения ATRA в качестве монотерапии, однако без дополнительной терапии заболевание практически всегда рецидивирует в течение первого полугодия. Наилучшая стратегия - комбинирование ATRA с индукционной химиотерапией. Показано, что индукция с использованием all-трансретиноевой кислоты в комбинации с антрациклинами, несколько курсов основанной на антрациклинах консолидации и поддерживающая низкодозная терапия с или без ATRA обеспечивает 75-85% EFS в течение 5 лет у взрослых. Применение ATRA в индукции одновременно с химиотерапией даёт более высокую безрецидивную выживаемость, чем последовательное использование препаратов. Применение поддерживающей терапии также уменьшает вероятность рецидива, а увеличение дозы антрациклинов в индукционной терапии и ATRA в консолидации может улучшить результаты лечения больных группы риска.
Результаты исследований эффективности лечения острого промиелоцитарного лейкоза у детей до настоящего времени не опубликованы, однако природа заболевания и принципы терапии одинаковы во всех возрастных группах.
Какой прогноз имеет острый миелобластный лейкоз?
Читайте также:

