Применение прегабалина в онкологии
Лечение болевого синдрома в онкологии
Несмотря на выдающиеся достижения современной онкологии, проблема терапии боли у пациентов с онкозаболеваниями остается актуальной и у нас, и за рубежом. Общеизвестно, что практически каждый третий пациент, впервые пришедший на прием к онкологу, испытывает боль разной степени интенсивности.
Подбор и назначение эффективной противоболевой терапии – сложная задача, требующая многокомпонентного подхода. Для правильного и адекватного обезболивания при раке врачу-онкологу необходимо собрать анамнез боли: причина, давность, интенсивность, локализация, тип, факторы, усиливающие или уменьшающие боль; время возникновения боли в течение дня, применявшиеся ранее анальгетики, их дозы и эффективность.


Осмотр и клинико-лабораторные исследования важны для выбора наиболее безопасного для конкретного пациента комплекса анальгетиков и адъювантных средств.
Причиной боли при онкологическом заболевании является:
-
Боль, вызванная самой опухолью (поражение костей, мягких тканей, кожи, внутренних органов, органов пищеварительного тракта);
Боль при осложнениях опухолевого процесса (патологический перелом, некроз, изъязвление, воспаление, инфицирование тканей и органов, тромбозы);
Боль при паранеопластическом синдроме;
Боль при последствиях астенизации (пролежни);
- при осложнениях хирургического лечения (например, фантомная боль),
- при осложнениях химиотерапии (стоматит, полинейропатия и др.),
- при осложнениях лучевой терапии (поражение кожи, костей, фиброз и др).
Классификация болевого синдрома:
Специалистами разработана классификация болевых синдромов при онкологии, каждый из которых требует особенного подхода в терапии.
По локализации источника боли
По временным параметрам
По степени выраженности боли
Оценка интенсивности хронического болевого синдрома
0 баллов – боли нет, 1 балл – слабая боль, 2 балла – боль умеренная, 3 балла – боль сильная, 4 балла – нестерпимая, самая сильная боль.
Нередко онкологи применяют визуально-аналоговую шкалу интенсивности боли от 0 до 10, на которой предлагают пациенту отметить степень своих болевых ощущений. Эти шкалы позволяют количественно оценить динамику хронического болевого синдрома в процессе лечения.

На основании данных диагностики врач-онколог устанавливает причину, тип, интенсивность хронического болевого синдрома, локализацию боли, сопутствующие осложнения и возможные психические нарушения.


Пример "болевого" опросника, который заполняет врач-онколог при первичном осмотре пациента
На последующих этапах наблюдения и терапии лечащий врач проводит повторную оценку эффективности обезболивания, выраженности побочных эффектов фармакотерапии. Этим достигается максимальная индивидуализация терапии болевого синдрома, отслеживаются возможные побочные эффекты применяемых анальгетиков и динамика состояния пациента.
Основные принципы назначения фармакотерапии боли у онкологических пациентов:
- Прием обезболивающих препаратов по часам, а не по требованию. Соблюдение этого принципа позволяет достичь наибольшего эффекта с минимальной суточной дозой обезболивающего препарата.
Адекватная доза и режим приема анальгетиков должны соблюдаться как основа противоболевого действия;
Лечение по восходящей - означает, что лечение боли у онкологических больных следует начинать с ненаркотических препаратов, постепенно переходя к более сильным препаратам.
Трехступенчатая схема обезболивания при раке

- На первом этапе лечения боли слабой и средней интенсивности применяются ненаркотические препараты (неопиды). Основными препаратами этой группы являютсяаспирин, парацетамол, анальгин, седальгин, пентальгин, диклофенак и пр.
Необходимо понимать, что использование ненаркотических анальгетиков в лечении более сильной боли ограничено их способностью к обезболиванию. Обезболивающий эффект имеет свои пределы и не усиливается бесконечно с увеличением дозы препарата. При этом возрастает только опасность побочных реакций и проявлений токсичности.
- Поэтому когда боль у онкологических пациентов усиливается, несмотря на увеличение дозы обезболивающих препаратов, наступает второй этап лечения боли – добавление мягких опиоидных анальгетиков. Это трамал, трамадол, кодеин, дионин.
Обращаем ваше внимание, что подбор и дозировку анальгетиков проводит только врач-онколог!
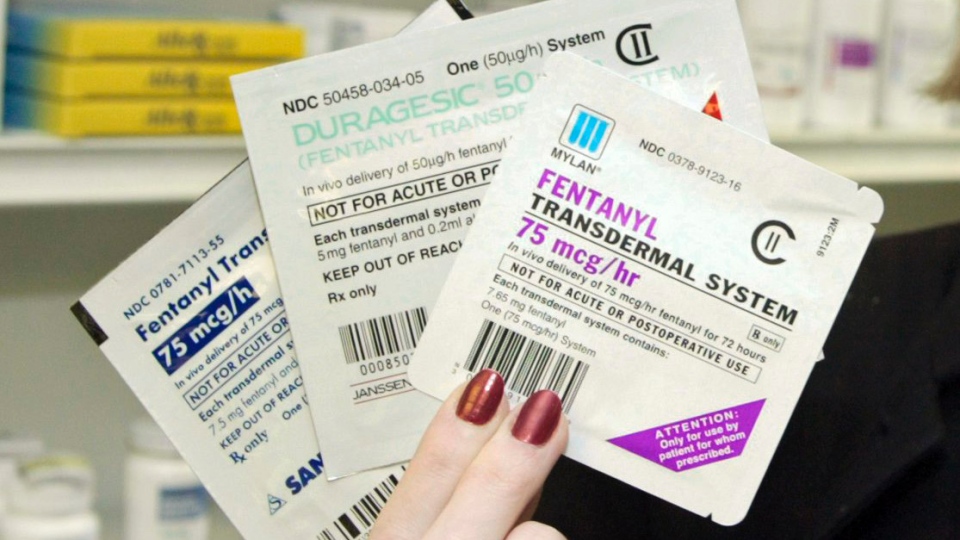
- Когда применение ненаркотических препаратов не дает нужного эффекта, лечащий врач переходит к использованию препаратов третьего этапа - сильных опиатов (просидол, норфин, морфин, дюрогезик, MST-Continus, фендивия).
Дюрогезик – трансдермальный пластырь - содержит фентанил в дозе 25, 50. 75 и 100 мкг/час и выпускается в виде пластыря, содержащего резервуар с обезболивающим препаратом. Доза зависит от размера пластыря. Длительность действия препарата составляет 72 часа.

Наряду с основными анальгетиками (опиаты и неопиаты) большое значение имеют адъювантные, то есть вспомогательные препараты – кортикостероиды (дексаметазон), антидепрессанты (амитриптилин), противосудорожные (карбамазепин), антигистаминные, транквилизаторы.
Эти препараты используются в основном при лечении отдельных симптомов и осложнений у онкологических больных.
Лечение нейропатической боли
Лечение нейропатической (жгучей) боли представляет собой значительно более сложную задачу вследствие недостаточной эффективности большинства анальгетиков.
По статистике более 50% пациентов, имеющих нейропатическую боль, продолжают испытывать ее на фоне назначенного лечения опиоидами, что свидетельствует о низкой эффективности традиционных обезболивающих препаратов.
В Европейских рекомендациях по лечению нейропатической боли препаратами первой линии названы антиконвульсанты, антидепрессанты и местные анестетики – это амитриптилин, габапентин и прегабалин.
Прегабалин – препарат последнего поколения, обладающий меньшими побочными эффектами, полной безопасностью, эффективностью начальной дозы и быстрым началом действия.
Важной особенностью прегабалина является его способность уменьшать и полностью нивелировать остроту болевых ощущений, что подтверждается значительным снижением (в 2-5 раз) числа жалоб на жгучие, простреливающие и режущие боли. Это способствует улучшению качества жизни онкологических больных с хроническими болевыми синдромами.


Подводя итоги, мы хотим еще раз подчеркнуть, что один из важнейших принципов лечения болевого синдрома в онкологии – принцип индивидуальности. Выбор препарата для обезболивания при раке, а также подбор дозировки в каждом конкретном случае зависит от причины, вызывающей боль, общего состояния пациента, от наличия и выраженности имеющихся расстройств отдельных органов и систем.
Важно прогнозировать возможные или уже имеющиеся на момент осмотра побочные эффекты предшествующей противоопухолевой или обезболивающей терапии. Следует осуществлять направленный выбор основного препарата для терапии, в зависимости от патогенеза боли (ноцицептивная, нейропатическая, психогенная).
В современной онкологии врачи обладают широким арсеналом препаратов для борьбы с болью онкологического генеза, поэтому почти во всех случаях (>90%) удается полностью купировать болевой синдром или же значительно уменьшить его интенсивность.

Интенсивность боли определяет больной, а не его родственники.
Для оценки эффективности лечения рекомендуется ведение дневника боли с фиксированием даты, времени приема, дозы, пути введения, продолжительности действия и побочных эффектов.
Ступень 1. Лечение слабой боли начинают с нестероидных противовоспалительных средств, которые продаются в любой аптеке без рецепта врача. Препараты подбираются с учетом противопоказаний и индивидуальной переносимости больного. Чем эффективнее лекарство снимает боль, тем вреднее оно для желудка, поэтому при высоком риске гастропатии одновременно рекомендуется омепразол или нольпаза.

Ступень 2. Лечение боли умеренной интенсивности.
На этом этапе к максимальной дозе нестероидного противовоспалительного препарата добавляется минимально эффективная доза трамадола в таблетках. Постепенно доза трамадола увеличивается до 400 мг в сутки (по 50 мг до 8 раз в день или по 100 мг 3-4 раза в день), а таблетки меняются на внутримышечные инъекции по 100 мг 4 раза в сутки каждые 6 часов. Обезболивающее действие наступает через 30-40 минут после приема таблетки или через 5-10 минут после внутримышечной инъекции. Длительность действия от 4 до 6 часов.
Побочные действия. Трамадол часто вызывает тошноту с рвотой, запоры и сонливость. При тошноте и рвоте таблетки можно заменить на инъекции.
Медикаментозная коррекция побочных эффектов такая же, как и при обезболивании на 3 ступени (см. ниже).
Взаимодействие с другими препаратами:
Транквилизаторы, седативные средства взаимно потенцируют эффекты.
Осторожность необходима при одновременном назначении с нейролептиком, антидепрессантом, карбамазепином. Нельзя вводить в одном шприце с диклофенаком, реланиумом.

Комбинации снижают болевой синдром меньшей дозой трамадола и позволяют как можно дольше задержаться на 2 ступени обезболивающей лестницы. При грамотном обезболивании потребность в наркотических анальгетиках можно значительно отсрочить.
При умеренной боли вместо трамадола врач может назначить пластырь дюрагезик 12,5 мкг/час или таргин в таблетках в дозе 2,5 мг/5 мг
Ступень 3. Лечение сильной боли.
На наркотическую ступеньку следует переходить только при неэффективной комбинации 400 мг трамадола с адъювантными анальгетиками. Опиоидные анальгетики намного сильнее по обезболивающему действию, но и страшнее по побочным эффектам. А вот обратно вернуться на 2 ступень будет невозможно!
Промедол или морфин выписываются на специальных рецептурных бланках строгой отчетности. С 1 июля 2015 года законодательно изменился порядок выписки таких рецептов:
- Выписать рецепт имеет право участковый терапевт, а не только онколог.
- Не нужна справка из онкодиспансера о необходимости симптоматической терапии.
- Рецепт действителен не 5, а 15 дней.
- В одном рецепте можно выписать в 2 раза большее количество препарата перед длинными праздниками или при отъезде онкобольного.
- Врач имеет право выписать рецепт на дому, в поликлинике лично больному или его родственнику.
- Не нужен полный возврат пустых ампул и других использованных упаковок для выписки нового рецепта.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Повышение интереса к вопросу лечения острой боли при раке, к которой относят также и послеоперационный болевой синдром, отмечают с каждым годом. Это обусловлено новыми фундаментальными исследованиями в области физиологии и фармакологии. В отечественной и зарубежной литературе этому вопросу уделяют огромное внимание, а фармакотерапию острой боли при раке, по мнению ведущих специалистов, следует рассматривать как самостоятельное направление в анестезиологии и реаниматологии.
Особое внимания заслуживает лечение острой боли при раке, и это обусловлено многими факторами. В настоящее время в большинстве случаев при злокачественных новообразованиях используют комбинированный или комплексный методы лечения, поскольку более половины пациентов, поступающих в онкологические учреждения, имеют местно-распространенный процесс, с выходом опухоли за пределы первичного очага, поражением регионарных лимфатических узлов или врастанием опухоли в окружающие органы и ткани.
Все это предполагает необходимость проведения предоперационного лучевого или химиотерапевтического лечения, а в некоторых случаях, и их сочетания. Однако хорошо известно, что перечисленные выше методы лечения могут вызывать такие побочные эффекты, как лучевые и токсические реакции, резорбционный эндотоксикоз, выраженность которых зависит от схемы химиотерапии, зоны облучения и индивидуальных особенностей организма пациента.
Данные литературы свидетельствуют о том, что даже при начальных формах опухолевого процесса для онкологических больных характерны нарушения гемокоагуляции, гемореологии, антиоксидантной защиты, иммунологических показателей, не говоря уже о более распространенных процессах. Именно поэтому, по мнению ведущих специалистов, следует использовать щадящие, патогенетически обоснованные подходы к выбору методов обезболивания и компонентов для лечения ОБС у онкологических больных. Такая тактика приобретает особую актуальность при распространенных опухолевых процессах в связи с высокой вероятностью рецидива заболевания или дальнейшего прогрессирования процесса через некоторое время и, таким образом, необходимостью проведения последующей противоболевой терапии с использованием опиатов.
Принципы лечения острого болевого синдрома в онкохирургии
Любая операция представляет для организма пациента агрессию той или иной степени выраженности. Чем выше степень этой агрессии, тем в большей и, возможно, более ранней защите нуждается больной. Оперативные вмешательства в онкологии отличаются от операций, выполняемых в неонкологических клиниках, высокой травматичностью и рефлексогенностью. Даже при небольших опухолевых поражения оперативное лечение подразумевает не только удаление самой опухоли, но и широкую лимфодиссекцию, и, соответственно, денервацию.
Именно поэтому вряд ли острую боль у онкологического больного следует рассматривать только в рамках одной из его разновидностей (висцеральный, соматический, нейропатический и т. д.). Следует говорить о ОБС смешанного генеза с преобладанием того или иного компонента и использовать мультимодальный подход к лечению этого синдрома. Нельзя сбрасывать со счетов и тот факт, что, уже поступая в онкологическое учреждение, до установления диагноза, пациент испытывает психологический стресс, что может привести к тяжелым последствиям.
Всё это отражено в определении понятия боли, приведенной Международной ассоциацией изучения боли, по определению которой боль - это не только неприятное ощущение, но и эмоциональное переживание, сочетанное с уже имеющимся или возможным (что не менее важно) повреждением ткани, или же описываемое в терминах такого повреждения. Поэтому считают, что именно в этот период (после направления в онкологическую клинику и всего периода диагностики) пациенты нуждаются в индивидуальной фармакологической защите.
Лекарства для снятия острой боли при раке
Хорошие результаты дают седативные препараты на основе растительного сырья, такие как валериана, пустырник и другие различные растительные сборы, в состав которых входят такие компоненты. Некоторые пациенты нуждаются в назначении так называемых дневных транквилизаторов (медазепам, лизопам, и др.), поскольку от них требуется достаточно быстрая и концентрированная реакция в ходе проведения некоторых клинико-инструментальных исследований. Для коррекции нарушений сна во время обследования онкологическим пациентам предпочтительнее назначать небензодиадепиновые транквилизаторы из группы имидазопиридинов (золпидем), которые относят к группе частичных агонистов бензодиазепинового рецепторного комплекса. В связи с тем что они селективно связываются с ω1-подтипом рецепторов, у них практически не выражены хорошо известные нежелательные эффекты, свойственные препаратам-агонистам бензодиазепиновых рецепторов. Имидазопиридиновые препараты не нарушают структуру сна, однако при уже имеющихся нарушениях структуры сна они способствуют восстановлению нормальных соотношений фаз и стадий сна. Эти препараты не вызывают постсомнических нарушений (вялости, сонливости, подавленного настроения и др) после утреннего пробуждения и таким образом не влияют на полноценное дневное бодрствование пациентов.
Не менее важный этап - непосредственная преднаркозная подготовка (премедикация), поскольку от её патогенетической направленности во многом зависит эффективность терапии послеоперационного болевого синдрома (второй этап антиноцицептивной защиты). Предотвращение ноцицептивной стимуляции (те превентивное или упреждающее воздействие на основные звенья патогенеза острой боли при раке) и развития болевого синдрома гораздо проще и требует меньших медикаментозных затрат, нежели борьба с уже развившейся сильной болью.
В 1996 г. на Международном конгрессе в Ванкувере (World Congress on Pain, Vancouver) метод предупреждающей аналгезии (preemptive analgesia) признан перспективным направлением в патогенетической терапии болевых синдромов, его широко используют в наиболее прогрессивных клиниках в настоящее время. Для этих целей, кроме бензодиазепиновых препаратов для премедикации (за 30-40 мин до оперативного вмешательства), назначают анальгетики периферического действия (например, кетопрофен, парацетамол, диклофенак), хотя некоторые из них (кетопрофен) обладают и центральным механизмом антиноцицептивного действия. Как препарат для предупреждающей (упреждающей) аналгезии заслуживает внимания наркотический анальгетик смешанного механизма действия и средней потенции - трамадол. Наиболее актуально его назначение перед непродолжительными оперативными вмешательствами, что позволяет снизить расход основных компонентов общей анестезии и обеспечить полноценное послеоперационное обезболивание.
Следующий, третий этап защиты организма пациента - ранний послеоперационный период (до 3 сут после операции) и его важнейшая составляющая - ближайший посленаркозный период (2-4 ч после операции), поскольку именно в эти часы прекращается защитное действие анестезии и возрастает ноцицептивная импульсация при еще неполном восстановлении основных функций организма. Считают, что при неэффективной аналгезии в течение первых суток послеоперационного периода высока вероятность формирования у пациентов хронического болевого синдрома (ХБС), обрекающего больного на длительные мучения (до 3-6 мес). В основе ХБС, возникшего в результате неадекватной терапии острой боли при раке, по мнению ведущих специалистов в области обезболивания, лежат пластические изменения ЦНС. Выбор препаратов для обезболивания на этом этапе во многом зависит от используемого варианта анестезиологического пособия, компонентов анестезии, а также от объема, травматичности и анатомической области, затронутой при операции. На современном уровне развития анестезиологии и реаниматологии считают оптимальным придерживаться мультимодального подхода к послеоперационному обезболиванию, который подразумевает воздействие на разные звенья ноцицептивной импульсации. Однако представители различных зарубежных и отечественных школ несколько расходятся во взглядах по вопросам лечения острой боли при раке.
Как и прежде, для лечения послеоперационного болевого синдрома важную роль отводят опиоидным анальгетикам - как чистым агонистам μ-опиоидных рецепторов (морфин, тримеперидин, омнопон, суфентанил, фентанил и др), так и агонист-антагонистам опиатных рецепторов (бупренорфин, буторфанол, налбуфин,дезоцин,трамадол и др.).
Варианты использования наркотических анальгетиков могут быть различными, но чаще их комбинируют с другими препаратами. Определение пути введения опиоидных анальгетиков зависит от зоны оперативного вмешательства, его объёма, наличия тех или иных форм препаратов и приоритетов клиники.
Используют внутримышечное и внутривенное введение (болюсно либо с использованием инфузоматов), пероральное, в виде защечных (букальных) и подъязычных (сублингвальных) таблеток, трансдермальное, эпидуральное (болюсно либо в виде инфузии). Хорошие результаты получены от эпидурального применения современных местных анестетиков (ропивакаин) и их сочетания с наркотическими анальгетиками (морфин, тримеперидин и др.) или адренопозитивными препаратами.
Большое значение при проведении послеоперационного обезболивания придают нестероидным противовоспалительным препаратам (ингибиторам циклооксигеназы) и некоторым другим анальгетикам периферического действия. Некоторые из НПВП разрешены не только для внутримышечного, но и для внутривенного введения (кетопрофен, лорноксикам и др.). Существуют различные таблетированные формы и свечи, что крайне важно учитывать при проведении противоболевой терапии у разной категории пациентов.
Среди препаратов, обладающих антиноцицептивной активностью, определенного интереса заслуживает адренопозитивный препарат клонидин, который оказывает влияние на процессы трансмиссии и модуляции. Клонидин стимулирует α1 (сегментарный уровень) и α2 (ЦНС) адренорецепторы, т. е. обладает периферическим и центральным механизмами действия. Существуют эмулированные и таблетированные формы препарата. Для лечения острой боли при раке используют внутримышечное, внутривенное и эпидуральное введение препарата.
Значительную роль в антиноцицептивной защите отводят поливалентным ингибиторам протеаз (апротинин др.), которые путём образования ферментно-ингибиторных комплексов инактивируют протеазы (трипсин, химотрипсин, калликреин и др.) плазмы крови и клеточных элементов тканей, т.е. оказывают защитное действие непосредственно в месте болевого воздействия. Вводят препарат внутривенно (болюсно или инфузионно).
В последние годы для послеоперационного обезболивания стали активно использовать антагонисты возбуждающих кислот (тизанидин - таблетированные формы, кетамин - внутривенные инфузии) и противосудорожные препараты - габапентин (нейронтин), прегабалин (лирика), которые взаимодействуют с (α2-дельта-протеин) вольтаж-зависимыми кальциевыми каналами и, таким образом, проявляют анальгетический эффект. Механизм действия этих препаратов, видимо, до конца не изучен, однако при терапии ОБС с нейропатическим компонентом получены первые хорошие результаты.
Детально изучив работы ведущих специалистов в области терапии ОБС можно, для примера, представить некоторые возможные комбинации препаратов для составления схем послеоперационного обезболивания. Дополнительно останавливаться на необходимости предоперационной (период обследования) фармакологической защите и назначения патогенетически обоснованной премедикации видимо не следует, так как этот вопрос достаточно подробно обсуждён выше. Пути введения препаратов для послеоперационной аналгезии могут быть разными в зависимости от зоны операции (внутримышечно, внутривенно, эпидурально, через рот и т. д.). При назначении тех или иных схем следует учитывать, что реакция на боль строго индивидуальна и вариабельна у различных пациентов, в любую из назначенных больному схем при необходимости можно внести дополнения.
В зависимости от распространённости (стадии), локализации онкологического процесса, объема удаленных или резицированных тканей, рефлексогенности оперативного вмешательства с достаточной долей условности все операции по уровню нанесенной травмы тканям организма пациента, видимо, можно разделить на операции малой, средней и высокой травматичности.
К оперативным вмешательствам малой травматичности можно отнести, например, резекцию молочной или щитовидной железы, удаление опухоли мягких тканей и др., средней травматичности - резекцию легкого, желудка или толстой кишки и другие, сопоставимые по степени травматичности операции.
К операциям высокого уровня травматичности тканей можно отнести гастрэктомии и пневмонэктомии с расширенной лимфаденэктомией, брюшно-промежностную экстирпацию прямой кишки, одномоментную резекцию и пластику пищевода.
Особую травматичность представляют циторедуктивные операции при обширных опухолевых поражения и оперативные вмешательства удаления огромных (например, забрюшинных) опухолей, в том числе и удаление больших опухолей мягких тканей и костных структур с одномоментным замещением образовавшегося дефекта реваскуляризированным аутотранстплантатом. Такое условное деление еще раз призвано подчеркнуть, что чем агрессивнее хирургическое лечение, тем в более мощной антиноцицептивной защите нуждаются пациенты.
Ниже приведены некоторые возможные комбинации препаратов для составления схем послеоперационного обезболивания. Понятно, что перечислить все возможные варианты схем не представляется возможным, поэтому мы приводим лишь некоторые примеры.
Возможные комбинации препаратов для схем послеоперационной аналгезии
Анальгетик периферического действия (кетопрофен, парацетамол)
Болевой синдром при раке проявляется у 35-50% пациентов на ранних стадиях злокачественного процесса. По мере прогрессирования болезни уже до 80% чувствуют боль от умеренной до сильной. В терминальной стадии больно уже почти всем – 95% пациентов. Боль мешает спать, есть, двигаться, принимать осознанные решения, влияет на работу органов и систем.
Хорошая новость в том, что современная медицина научилась держать эту боль под контролем в 90% случаев. То есть либо купировать болевой синдром полностью, либо значительно уменьшать его интенсивность. Таким образом, на любых стадиях рака можно сохранять онкологическим пациентам нормальное качество жизни.
В России есть специфические проблемы, связанные как с получением анальгетиков, особенно наркотических, так и с несоблюдением в некоторых медучреждениях рекомендаций ВОЗ по обезболиванию.
Сегодня постараемся разобраться, какие же лекарства кому и когда нужны, и как еще современная медицина умеет бороться с болью.

Рефлекс отдергивания – здоровая биологическая реакция на острую боль
Но в нездоровом организме онкологического пациента (а также пациента с сердечно-сосудистым заболеванием или ВИЧ, или, например, туберкулезом) боль утрачивает свою полезную сигнальную функцию и наоборот, мешает как основной терапии, так и оказанию паллиативной помощи. Пациент впадает в депрессивное состояние, теряет силы, необходимые для борьбы с болезнью. Хронический болевой синдром превращается в самостоятельную патологию, которую нужно отдельно лечить.
Именно поэтому более чем миллиону человек в России ежегодно требуется обезболивание. Причем от 400 до 800 тысяч из них (по разным подсчетам) нуждаются в опиоидных анальгетиках.
Чтобы разобраться, какой подход нужен для купирования боли, врачу-онкологу нужно понять ее причину и происхождение.
Одна из больших трудностей диагностики ЗНО (злокачественных новообразований) – у пациента часто сначала вообще ничего не болит. Опухоль банально может быть пока слишком маленькой.
Еще такое случается, если опухоль растет в неплотных тканях (таких как молочная железа) или увеличивается внутри полости органа (например, желудка). Также без боли могут развиваться те виды рака, при которых нет солидных первичных опухолей – лейкозы, злокачественные заболевания системы кроветворения.
В нашей практике были случаи, когда бессимптомно протекали даже IV стадии онкологических процессов – вплоть до появления множественных метастазов пациенту не было больно.
Во всех остальных случаях, когда боль присутствует, врачу важно знать, из-за чего она появилась. По причинам возникновения выделим три основных группы.
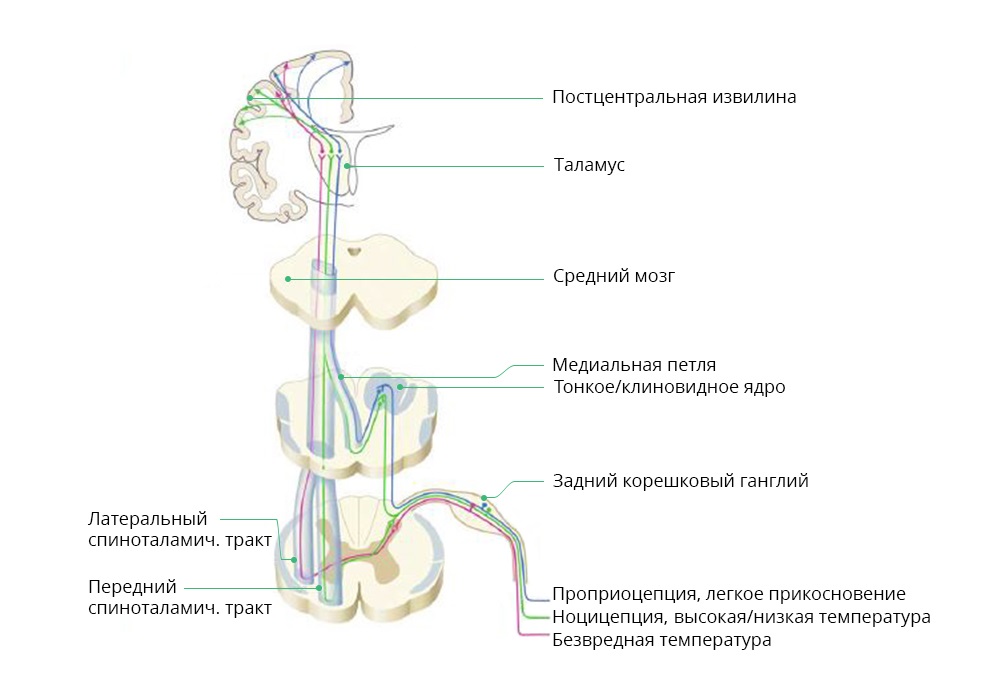
Схема прохождения ноцицептивного и других сигналов от внешних раздражителей
При онкологических заболеваниях ноцицептивная боль, чаще всего, является реакцией на саму опухоль или метастазы. Так, метастазы в позвоночнике могут давать прорывную, резкую боль при перемене положения тела пациентом. Нейропатическая боль. Ее причина – нарушение в работе нервных структур – нервов, спинного или головного мозга. Сочетает два фактора: с одной стороны, интенсивность – пациенту очень больно, иногда не помогают даже сильнодействующие анальгетики. С другой стороны – затруднена локализация. В отличие от острой ноцицептивной боли, пациент часто не может сказать, где именно у него болит.
Такая боль бывает вызвана ростом опухоли или метастаза, когда они давят, например, на позвоночник или защемляют нервные корешки. Также причиной, к несчастью, могут быть и побочные эффекты противоопухолевого лечения.
Дисфункциональная боль. Тот случай, когда органические причины боли отсутствуют, но она не уходит: например, опухоль уже удалили, заживление после операции прошло, а боль осталась. Бывает, что боль, по оценке самого пациента, гораздо сильнее, чем должна быть при его состоянии здоровья.
В таких случаях необходимо учитывать психологическое состояние пациента. Сильный стресс может заметно повлиять на изменения восприятия, вплоть до полностью психогенных болей.
Для выбора адекватной анальгезии врач должен понимать, насколько человеку больно, постараться понять, где именно болит и как долго. От этого зависят назначения в рецепте на обезболивание. Кроме уточняющих вопросов о характере и локализации боли, врач обязательно оценивает ее интенсивность.
Во всем мире для этого используют шкалы НОШ (нумерологическая оценочная шкала) и ВАШ (визуально-аналоговая шкала), либо гибридные варианты – в зависимости от возраста и состояния пациента. Совсем маленьким детям и очень пожилым людям, а также пациентам с когнитивными нарушениями бывает сложно ответить на стандартные вопросы. Иногда приходится работать с такими только по поведению и выражению лиц.

Шкала оценки боли от 0 (ничего не болит) до 10 (нестерпимо больно)
Важно при этом получить как можно больше дополнительной информации: если пациент считает, что терпеть – достойное занятие, а жаловаться – недостойное, или выяснится, что у пациента были периоды злоупотребления и зависимостей, это может внести коррективы в терапию болевого синдрома.
Мы уже затронули тему работы с психологическим состоянием больного, и коснемся ее еще раз – об этом важно помнить и врачам, и близким пациента. ВОЗ даже ввела для этого специальное понятие: суммарная боль. Она охватывает не только физические раздражители, но и эмоциональные и социальные негативные аспекты жизни пациента.
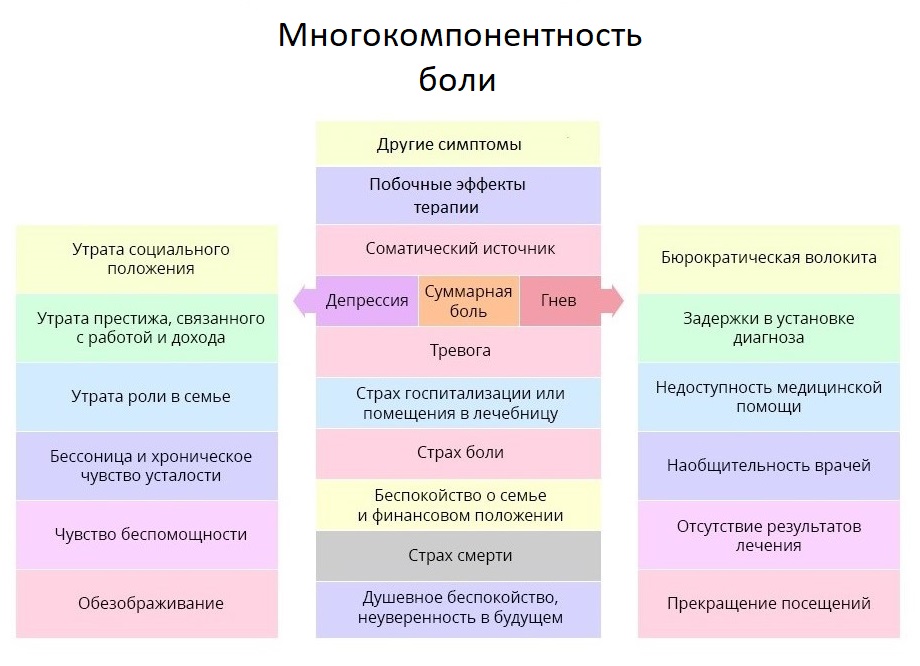
Боль онкопациента куда глубже и сложнее, чем кажется со стороны. Терапия боли – тот случай, когда врач должен относиться к субъективным оценкам пациента с особым вниманием.
Наверное, каждый врач считает более правильными и удачными те препараты, которые оказались наиболее действенными в его личном практическом опыте. Но любой онколог, стремясь купировать болевой синдром, должен помнить про рекомендации ВОЗ для лечения онкологических болей.
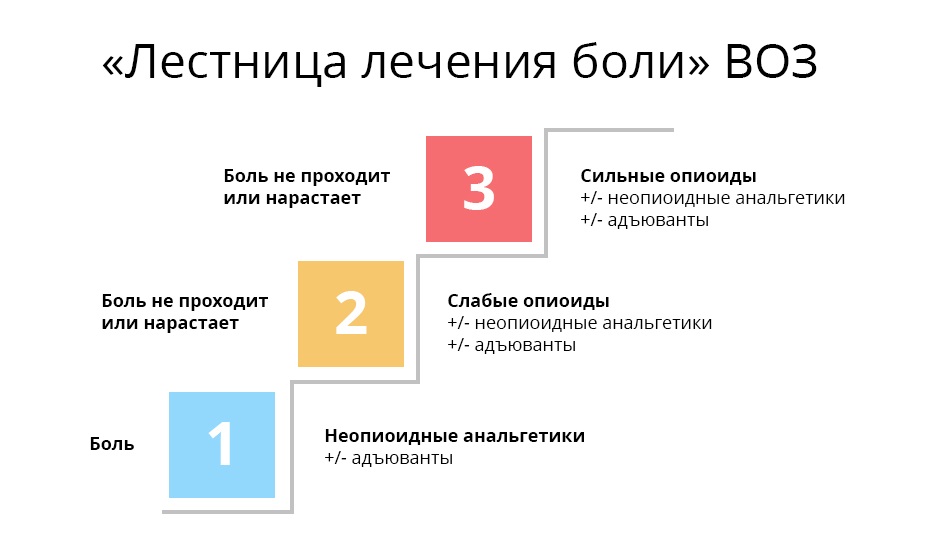
Первая ступень. При слабой боли начинают с ненаркотических анальгетиков и нестероидных противовоспалительных средств и препаратов (НПВС/НПВП). Это привычные безрецептурные парацетамол, ибупрофен, аспирин и др. При мышечной и суставной боли назначают диклофенак и др.

Схема действия НПВС – они блокируют фермент циклооксигеназу, снижая синтез простагландинов, тем самым уменьшая чувствительность болевых рецепторов.
Такие препараты не вызывают привыкания и зависимости, но в большой дозировке могут навредить ЖКТ, поэтому бесконечно и бесконтрольно дозу увеличивать нельзя, чтобы не усложнить ситуацию желудочным кровотечением.
Эндорфины – нейромедиаторы, одна из функций которых – тормозить передачу слабых болевых импульсов из спинного мозга в головной. Это позволяет нам не плакать от боли каждый раз, когда мы ставим локти на стол или спрыгиваем с высоты полуметра. Но при интенсивной боли выработка эндорфинов уменьшается. Опиоидные рецепторы освобождаются, нервные импульсы не тормозятся, человек испытывает боль.
Трамадол принимают вместе с анальгином, парацетамолом и другими медикаментами первой ступени – эффект получается комплексным: одновременное воздействие и на центральную, и на периферическую нервную систему.
Важно, что трамадол, хотя и является опиатом – относится к ненаркотическим анальгетикам. Пациенту проще его получить и не нужно бояться потенциальной зависимости.
Третья ступень. На этой ступени оказываются врач и его пациент, когда ему уже перестали помогать слабые опиаты. В дело вступают сильные опиаты, основной – морфин. Сильные опиаты связываются с опиоидными рецепторами гораздо надежнее слабых, поэтому действуют мощнее. Однако, такой эффект стоит дорого: эти препараты уже могут вызывать зависимость – но только, если употреблять их неправильно и бесконтрольно.
Важно, что на каждой ступени может использоваться так называемая адъювантная, то есть вспомогательная, терапия. Адъювантные препараты не обезболивают самостоятельно, но в сочетании с основными анальгетиками либо усиливают их действие, либо нивелируют побочные эффекты. В эту группу входят антидепрессанты, кортикостероиды, противорвотные и противосудорожные, антигистаминные и т.д.
Таким образом, ВОЗ дает основные принципы и рекомендации для плавного перехода со ступеньки на ступеньку, которые помогают избегать тупика в терапии – когда боль усиливается, а средств борьбы с ней уже не осталось.
Такое случается, если онколог назначает опиоидные препараты раньше времени или в дозе больше необходимого. Если прыгнуть с кеторола на промедол (как, к сожалению, делают некоторые врачи – кто по неопытности, кто из-за отсутствия нужных препаратов), то сначала эффект может превзойти ожидания. Но затем получается, что боль станет требовать увеличения дозировки быстрее, чем предписано безопасным режимом. Ступеньки закончатся раньше, чем вы пройдете нужное количество шагов. В этом случае врач сам у себя отнимает средства лечения.
Строго говоря, как раз уколы, сиречь инъекции, в современном обезболивании стараются не использовать. Выбирать для обезболивания самый болезненный метод введения как-то нелогично.
Поэтому все популярнее сейчас Трансдермальный метод введения – в виде пластырей.
В отличие от инъекций – максимально удобен для пациента. У него есть свои ограничения, конечно – по температуре тела, по количеству подкожно-жировой клетчатки, но в большинстве случаев он хорош:
- препарат (обычно фентанил) высвобождается постепенно, хватает на 72 часа;
- не требует контролировать время приема таблеток или введения препаратов;
- исключает передозировку (это важно для наркотического анальгетика).
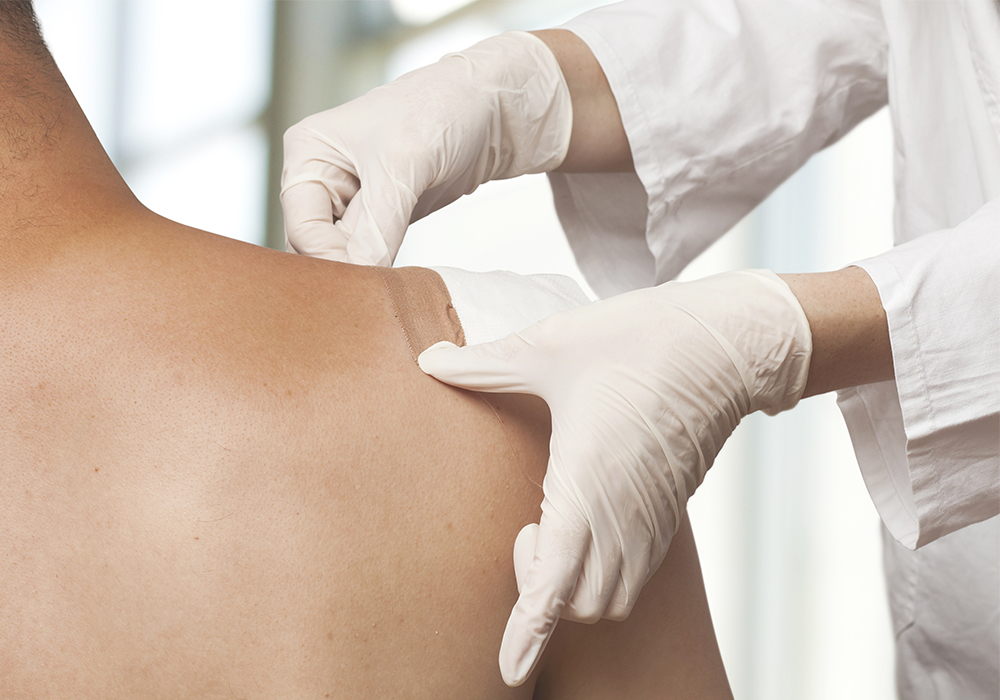
Фентаниловый пластырь – сильное, безопасное и комфортное обезболивание
Эпидуральная анестезия. Да, ее делают не только беременным. Те же препараты, что при спинальной анестезии, вводят в полость между твердой мозговой оболочкой и стенками позвоночного канала. Эпидуральная анестезия используется на поздних стадиях, при метастатическом поражении костей, когда боль не снимается инъекциями и препаратами перорально.
Паллиативная химио-, таргетная и лучевая терапия. Она используется не с целью разрушить опухоль, а с целью просто сделать ее меньше, чтобы освободить сдавленные нервные узлы, вызывающие боль.
Нейрохирургические методы. Нейрохирург надрезает корешки спинномозговых или черепных нервов. Это не приводит к утрате двигательной активности (хотя может потребовать реабилитации), но мозг лишается возможности получать болевые сигналы по этому пути.
Радиочастотная абляция (РЧА). В первом нашем посте, про паллиативную медицину, мы прикрепляли видео о том, как этот метод помог пациентке избавиться от болевого синдрома на последней стадии рака. Тогда РЧА применялась для того, чтобы разрушить метастазы, давившие на нервные корешки спинного мозга.
В случаях же, когда разрушить метастазы или саму опухоль невозможно, РЧА можно использовать для разрушения проводящих нервных путей. Это похоже на предыдущий вариант, только хирург действует не скальпелем, а специальной иглой, разогретой радиочастотными колебаниями до высокой температуры.
Нейролизис при помощи эндосонографии. Нейролизис – это разрушение нервного пути, проводящего боль, с помощью специальных химических растворов. Под контролем ультразвука эндоскоп подводят точно к чревному (солнечному) нервному сплетению через ЖКТ и разрушают часть нервных волокон. Обезболивающий эффект от процедуры наступает в 90% случаев при раке желудка или, например, поджелудочной железы. Сохраняется результат процедуры от месяца до года в редких случаях. Все зависит от скорости развития опухоли. При том, что в случае с применением препаратов-анальгетиков, их пришлось бы применять еженедельно.
Вертебропластика. Этот способ можем пояснить на живом примере из собственной практики. Повреждение позвоночника метастазами приводит к разрушению тела позвонка. Костная структура позвонка деформируется, происходит компрессия (сдавливание) спинномозговых корешков. Возникает корешковый компрессионный сидром, который сопровождается сильными болями. Вертебропластика укрепляет тело пораженного позвонка, чтобы он перестал давить на нервные корешки.
Операция малоинвазивная, ее проводят под местным обезболиванием и контролем компьютерной томографии. В тело позвонка вводится специальная игла-канюля, одновременно специальным инструментов восстанавливается высота позвонка. В полость позвонка вводится костный цемент. Результат вмешательства также контролируется КТ исследованием. В 98% случаев вертебропластика устраняет болевой синдром сразу же после окончания операции. Период реабилитации минимальный, через пару часов пациент может принимать вертикальное положение.
Так что, вариантов помочь пациенту с болевым синдромом у хорошего онколога сегодня много. Мы убеждены, что вне зависимости от стадии его рака, человек может максимально долго иметь нормальное качество жизни, без ограничений и страданий.
Проблема недостаточного обеспечения сильными анальгетиками больных с тяжелыми диагнозами – одна из самых, уж извините, больных проблем в российской онкологии в частности и паллиативной медицине в целом.
После самоубийства контр-адмирала Апанасенко в 2014 начались какие-то подвижки, но далеко не все так радужно, как обещалось.
Чтобы страха, а значит, и потенциальной ненужной боли, не осталось, давайте разъясним, какой порядок действий, нужный для получения наркотического препарата.
Кто выписывает рецепт?
- врач-онколог,
- участковый терапевт,
- врач любой специальности, который прошел обучение работе с наркотическими и психотропными веществами.
Сколько действует рецепт?
Нужно ли сдавать ампулы?
Нет. По закону, никто не вправе требовать от пациента или его родных сдавать использованные ампулы, пластыри и упаковки от наркотических анальгетиков.
Может кто-то из родственников получить рецепт и препарат от имени больного?
- Чтобы выписать рецепт, врач должен провести осмотр. Но если пациент не может добраться до больницы, он имеет право вызвать врача на дом.
- За печатью все же придется отправить кого-то из близких в поликлинику – печать лечебного учреждения на рецепте обязательна.
- Получить препарат в специально указанной аптеке может как сам пациент, так и его доверенное лицо (с паспортом и копией паспорта пациента)
Что делать, если возникли сложности с получением обезболивающего?
- Звонить на горячую линию Министерства здравоохранения: 8-800-200-03-89,
- Росздравнадзора: 8-800-500-18-35,
- В страховую компанию, у которой оформлен ваш полис ОМС.
В заключение хочется как-то обобщить все сказанное по этой тяжелой теме:
Читайте также:

