При взрыве смеси водорода с хлором
Взрыв - смесь - водород
Взрывы смесей водорода с воздухом и кислородом В начале текущего столетия одно германское военное судно, только что построенное, совершало свое первое пробное плавание. [1]
В атих условиях давление взрыва смесей водорода с воздухом и кисг лородом более чем в 2 раза превышает давление взрыва при 20 С. Поэтому необходимо особо тщательно соблюдать меры безопасности при работе с ЬФ дородом при низких температурах. [2]
Метод основан на использовании энергии взрыва смеси водорода и кислорода, которую получают электролизом воды на забое скважины. Способ успешно опробован на 20 неглубоких артезианских скважинах, при этом их дебиты возросли в 1 5 - 2 5 раза. [3]
Предложены различные методы определения давления взрыва смеси водорода с хлором при детонационном горении. [5]
Важнейшим мероприятием по борьбе со взрывами смесей водорода с воздухом является тщательная герметизация аппаратов и трубопроводов, в особенности при электролизе с ртутным катодом. Разработаны и осуществляются меры безопасности, исключающие возможность воспламенения смесей газов от электрических импульсов. [6]
Закон этот можно легко иллюстрировать опытом взрыва смеси водорода с кислородом. Если смешать при атмосферном давлении 100 см3 кислорода и 200 см3 водорода, нагретых предварительно до 100, а затем взорвать смесь газов искрой и измерить при 100 объем образовавшегося водяного пара, последний окажется равным 200 см3; при этом не останется избытка ни водорода, ни кислорода. Отсюда ясно, что два объема водяного пара возникают при соединении двух объемов водорода и одного объема кислорода. Принимая во внимание закон Авогадро, можно сказать, что 2N молекул водорода и N молекул кислорода дают 2 N молекул воды. [7]
При удалении накипи протравливанием кислотой необходимо опасаться взрыва смеси водорода с воздухом, так как от действия соляной кислоты на накипь выделяется водород. Подвергшиеся обработке кислотой поверхности тщательно промывают водой от возможных остатков кислоты и растворенной накипи. Для лучшей нейтрализации кислоты промывку делают содовым раствором - 0 5 кг едкого натра ( каустической соды) на 10 - 12 л воды. [8]
В работе [49] показано, что давление взрыва смесей водорода с хлором при детонационном горении может достигать 20 6 МПа, а скорость распространения пламени составлять 2000 - 3000 м / с. Предложены различные методы определения давления взрыва смеси водорода с хлором при детонационном горении. [9]
Для безопасного ведения процесса электролиза необходимо предотвратить возможность образования и взрыва смесей водорода с хлором или воздухом. Смеси водорода с хлором, содержащие от 5 8 до 88 % Н2, взрывоопасны. Взрыв может произойти при возникновении электрической искры, действии света, особенно в случае прямого освещения смеси солнечным светом, при местном повышении температуры до 450 - 500 С. Во избежание взрыва внутри ванн прежде всего необходимо исключить возможность проникания водорода в хлор. [10]
Из приведенного ниже примера видно, что расчетные значения давления взрыва смесей водорода с хлором незначительно отличаются от приведенных выше экспериментальных значений. [11]
Специфической опасностью работы с водородом является опасность возникновения горения или взрыва смеси водорода с воздухом, кислородом и кислородсодержащими газами, а также опасностью взрыва систем: жидкий водород - твердый кислород, жидкий водород - твердый, обогащенный кислородом воздух. При проливах жидкого водорода на грунт после испарения и смещения с воздухом образуется взрывоопасное облако. [12]
Справедливость закона Авогадро можно показать и на хорошо известном учащимся опыте взрыва смеси водорода с кислородом в эвдиометре. [14]
Вспышка может быть использована, когда требуется ультрафиолетовый свет, например при взрыве смеси водорода с хлором. [15]

Хлор является сильнодействующим ядовитым веществом удушающего характера. Что делать, если на предприятии или близлежащем химическом заводе произошла утечка хлора?
Хлор – это газ с резким специфическим запахом. Он тяжелее воздуха, при испарении похож на туман.
Как эффективный бактерицид хлор начал использоваться почти два столетия назад. С одной стороны, хлор спас сотни тысяч жизней благодаря своей способности разрушать вредные бактерии и вирусы, но в то же время он оказывает отравляющее воздействие и на человека.
Кроме этого, хлор является одним из важнейших продуктов химической промышленности по объёму производства и области применения.
При нормальных условиях хлор представляет собой газ зеленовато-жёлтого цвета с резким раздражающим запахом, в сжиженном же состоянии хлор может находиться только при избыточном давлении или при температуре ниже минус 34 °С.
При утечке хлор дымит, при температуре -34 °С сжижается, при температуре -101 °С затвердевает. Хлор малорастворим в воде – в одном объёме воды растворяется около двух его объёмов. Жидкий хлор в 1,5 раза тяжелее воды, газообразный хлор в 2,5 раза тяжелее воздуха.
Один килограмм жидкого хлора при испарении дает 315 литров газообразного хлора, при испарении на воздухе в значительных количествах даёт с водяными парами белый туман. В смеси с водородом (более 50 % водорода) хлор взрывоопасен, а при нагревании ёмкости с хлором взрываются.
Хранится и транспортируется жидкий хлор в сосудах, выдерживающих избыточное давление. Один баллон с жидким хлором при разгерметизации становится бомбой с радиусом поражения от 150 метров до 1 километра, с действием в зоне поражения более суток.
Наибольшую опасность представляет хлор в сжиженном состоянии. При выбросах жидкого хлора смертельно опасную зону составляет площадь в радиусе примерно 400 м от места выброса.
Опасность хлора заключается во взаимодействии хлоргаза со слизистыми оболочками человека – образуется соляная кислота, вызывающая отёк лёгких, поражение глаз и носа, кожные раздражения. При вдыхании высоких концентраций хлора возможен смертельный исход – попадая в лёгкие, он обжигает лёгочную ткань и вызывает удушье.
Учёные предполагают, что хлор, как и продукты его взаимодействия с другими веществами, увеличивает риск сердечно-сосудистых заболеваний, аллергических реакций и выкидышей у беременных женщин.
При вдыхании хлор вызывает судорожный, мучительный кашель, в тяжёлых случаях происходит спазм голосовых связок и отёк лёгких. Хлор раздражающе действует на влажную кожу, вызывая её покраснение, могут иметь место химические ожоги и обморожение. Также хлор оказывает сковывающее воздействие на центральную нервную систему.
Первыми явными признаками отравления хлором являются:
резкая боль в груди,
резь в глазах (слезотечение),
нарушение координации движений.
При получении информации об аварии нужно:
Защитить органы дыхания и поверхность тела. Лицо, нос и рот можно защитить с помощью противогазов всех типов, марлевой повязки, смоченной водой или 20 % раствором соды (1 чайная ложка на стакан воды). Средством защиты кожи может послужить любая накидка.
Покинуть район аварии в направлении, указанном в сообщении. Вне помещения выходить из зоны химического заражения следует в сторону, перпендикулярную направлению ветра. Избегайте перехода через туннели, овраги и лощины, так как в низких местах концентрация хлора будет выше.
Если из опасной зоны выйти невозможно, нужно остаться в помещении и произвести его герметизацию: плотно закройте окна, двери, вентиляционные отверстия, дымоходы, уплотните щели в окнах и на стыках рам. Входные двери зашторьте, используя одеяла и любые плотные ткани. При возможности поднимитесь на верхние этажи здания. Нельзя укрываться на первых этажах многоэтажных зданий, в подвальных и полуподвальных помещениях.
Оказавшись вне опасной зоны, нужно снять верхнюю одежду и оставить её на улице.
Как можно быстрее принять душ, промыть глаза и носоглотку.
Наблюдать за своим самочувствием, при первом появлении признаков отравления обратиться к врачу. В ожидании помощи пострадавшему необходим покой и тёплое питьё.
Пострадавшего от отравления хлором нужно как можно быстрее вынести из опасной зоны. При транспортировке пострадавший должен быть в горизонтальном положении.
Вне опасной зоны снимите с пострадавшего всю одежду, стесняющую дыхание, и уложите в горизонтальное положение. Необходимо обеспечить покой, тепло, приток свежего воздуха.
В ожидании медицинской помощи рекомендуется:
обильное тёплое питьё – 2 % раствор соды, боржоми, молоко с содой, чай, кофе;
при кашле или першении в горле необходимы тёпло-влажные ингаляции 2 % раствором соды, противокашлевые препараты;
при слезотечении, жжении в глазах – промывание глаз водой или 2 % раствором соды. Этим же раствором нужно промыть нос. В глаза можно закапать 30 % раствор альбуцида;
при затруднении дыхания, осиплости голоса – вводится подкожно 1 мл 0,1 %-ного раствора атропина;
при обмороке – нужно дать понюхать нашатырный спирт. При отсутствии дыхания немедленно приступить к его восстановлению.
Рекомендуется затемнить помещение. При первой возможности пострадавшие должны быть доставлены в медицинское учреждение для обследования и дальнейшего лечения.
Задача 71.
При прохождении смеси равных объемов SO 2 и О 2 через контактный аппарат 90% молекул SO 2 превращается в SO 3 . Определить состав (в процентах по объему) газовой смеси, выходящей из контактного аппарата.
Решение:
Уравнение реакции горения сернистого газа имеет вид:
Из уравнения реакции вытекает, что из двух молекул SO2 и одной молекулы O2 образуются две молекулы SO3. Известно, что из каждого литра SO2 превратилось в SO3 0,9л, при этом образовалось тоже 0,9л SO3.Кислорода на каждый литр прореагировало соответственно 0,45л О2 (0,9/2 = 0,45).
Таким образом, выходящая смесь газов из контактного аппарата, на каждый литр смеси состояла из 0,1л SO2 (1 – 0,9 = 0,1) и 0,55л О2 (1 – 0,45 = 0,55). Общий объём смеси, выходящей из контактного аппарата, составляет 1,55л (0,1 + 0,55 + 0,9 = 1,55).
Задача 72.
Смесь, состоящая из трех объемов Сl2 и одного объема H2, оставлена в закрытом сосуде на рассеянном свету при постоянной температуре. Через некоторое время содержание Сl2 в смеси уменьшилось на 20%. Изменилось ли давление в сосуде? Каков процентный состав смеси по объему?
Решение:
Уравнение реакции взаимодействия хлора с водородом имеет вид:
При взаимодействии одного моля хлора с одним моль водорода образуется два объёма хлороводорода, т. е. реакция идёт без изменения объёма. При нормальных условиях из трёх литров хлора в реакцию вступило 0,6л (3 . 0,2 = 0,6). Точно такое же количество водорода тоже вступило в реакцию. Таким образом, при взаимодействии 0,6л хлора и 0,6л водорода образовалось 1,2л хлороводорода (2 . 3 = 0,6). Так как реакция идёт без изменения объёма, то давление в системе тоже не изменится.
Находим процентный состав газовой смеси по формуле:

Задача 73.
При взаимодействии NН3 с Сl2 образуются хлороводород и азот. В каких объемных соотношениях взаимодействуют NH3 и С12 и каково отношение объемов получающихся газов?
Решение:
Уравнение реакции взаимодействия аммиака с хлором имеет вид:
При взаимодействии аммиака с хлором из каждых двух объёмов аммиака и трёх объёмов хлора образуются шесть объёмов хлороводорода и один объём азота. Таким образом, аммиак и хлор взаимодействуют в объёмных отношениях 2 : 3 (2VNH3 : 3VCl), а отношение объёмов получающихся газов – 1 : 6 V(N2 : V(HCl).
Ответ: V(NH3) : V(Cl2) = 2 : 3; V(HCl) : V(N2) = 6 : 1.
Задача 74. Какой объем Н2 (при 17°С и давлении 102,4кПа) выделится при растворении 1,5кг цинка в соляной кислоте?
Решение:
Уравнение реакции имеет вид:
Зная мольную массу цинка (65,4г/моль) и мольный объём газа (22,4л), находим объём водорода, который выделится при растворении 1,5кг цинка из пропорции:
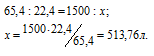
Затем приводим полученный объём к указанным условиям используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим V0:
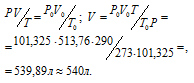
где P и V - давление и объём газа при температуре T = 290К (273 +17 = 290); P0 = 101,325 кПа; T0 = 273 К; P = 102,4 кПа; V0 -объём газа (н.у.) = 513,76 л.
Ответ: 540л.
Задача 75.
После взрыва смеси, состоящей из одного объема исследуемого газа и одного объема Н2, получился один объем водяного пара и один объем азота. Все измерения производились при одинаковых условиях. Найти формулу исследуемого газа.
Решение:
Молекулярная формула воды H2O, а азота – N2. Так как продукты реакции и исходные вещества состоят из одинаковых объёмов, то, учитывая, что образуются по одной молекуле воды и азота из одной молекулы водорода и одной молекулы исследуемого газа, можно предположить, что молекула исследуемого газа состоит из двух атомов азота и одного атома кислорода. Следовательно, формула исследуемого газа имеет вид N2O.
Ответ: N2O.
Задача 76
При одинаковых условиях взяты равные объемы N2 и O2. Каково соотношение масс обоих газов:
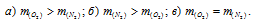
Решение:
Согласно закону Авогадро, в равных объёмах любых газов, взятых при одинаковых условиях (одной и той же температуре и одинаковом давлении) содержится одинаковое число молекул (6,02 . 10 23 ). Поскольку M(O2) равен 32 г/моль, а M(N2) – 28г/моль, то m(O2) > m(N2)
Ответ: а).
Задача 77.
Смешали равные объемы Н2 и С12. Как изменится объем смеси после протекания реакции: а) не изменится;
б) увеличится в два раза; в) уменьшится в два раза?
Решение:
Уравнение реакции взаимодействия хлора с водородом имеет вид:
При взаимодействии одного моля хлора с одним моль водорода образуется два объёма хлороводорода, т.е. реакция идёт без изменения объёма. Поэтому объём смеси после протекания реакции не изменится.
Ответ: а).
Задача 78.
Каково соотношение объемов, занимаемых 1 моль НСI и 1 моль Сl2 (Т и Р одинаковы):
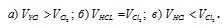
Решение:
Согласно закону Авогадро одно и тоже число молекул любого газа занимает при одинаковых условиях (температура и давление одинаковы) один и тот же объём. Вместе с тем 1 моль любого газа содержит одинаковое число молекул. Следовательно, при одинаковых условиях 1 моль любого газа занимает один и тот же объём. Этот объём называется мольным объёмом газа и при нормальных условиях (Т = 0 0 С и Р = 101,325 кПа) равен 22,4л. Поэтому соотношение объёмов одного моля HCl и одного моля Cl2 (T и Р одинаковы):
Ответ: б).
Задача 79.
При нагревании НВг полностью разлагается. При этом объём газа не изменяется. Каковы продукты реакции разложения: а) атомы Н и Вг; б) молекулы Н2 и Вг2 в) молекулы Н2 и атомы Br?
Решение:
Уравнение реакции термического разложения бромоводорода имеет вид:
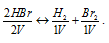
Таким образом, из двух молекул НВг образуются одна молекула Н2 и одна молекула Вг2, т.е. объём системы после реакции не изменяется. Следовательно, продуктами реакции термического разложения HBr являются газообразные Н2 и Вг2.
Далее я приведу описание некоторых наиболее распространенных АХОВ, потому как для успешного проведения мероприятий по защите от сильнодействующих ядовитых веществ и ликвидации последствий их воздействия необходимо знать их физические и токсические свойства.
Хлор - ядовитый газ, почти в 2,5 раза тяжелее воздуха, часто применяется в чистом виде или в соединении с другими компонентами. При температуре около 20?С и атмосферном давлении хлор находится в газообразном состоянии в виде зеленовато-желтого газа с резким неприятным запахом. Он энергично вступает в реакцию со всеми живыми организмами, разрушая их. Жидкий хлор - подвижная маслянистая жидкость, которая при нормальной температуре и давлении имеет темно-зеленовато-желтую окраску с оранжевым оттенком и удельным весом 1,427 г/см?. При температуре -102?С и ниже хлор твердеет и принимает форму мелких кристаллов темно-оранжевого цвета и удельным весом 2,147г/см?. Жидкий хлор плохо растворяется в воде, и хлорирование воды на обеззараживающих сооружениях водоканала производится только газообразным хлором. Производство газообразного хлора (водорода и щелочи) основано на электролизе поваренной соли. Это сложный комплекс: приготовление рассола, очистка его, выпаривание, электролиз, охлаждение, перекачка газа. Сухая смесь с воздухом взрывается при содержании хлора от 3,5 до 97%, т.е. смеси, содержащие менее 3,5% хлора, невзрывоопасны. Наиболее опасны по силе взрыва смеси, в которых хлор и водород находятся в стехиометрическом соотношении (50 на 50%). Такие смеси взрываются с наибольшей силой, а взрыв сопровождается сильным звуковым ударом и пламенем. Инициатором взрыва хлороводородной смеси (кроме открытого пламени) может быть электрическая искра, нагретое тело, прямой солнечный свет в присутствии контактирующих веществ (древесного угля, железа и оксидов железа). Влажный хлор вызывает сильную коррозию (это соляная кислота), что приводит к разрушениям емкостей, трубопроводов, арматуры и оборудования.
Аварийная ситуация в цехе может возникнуть при внезапном отключении подачи воды, электрического тока, образовании взрывоопасной смеси, проникновении хлора (газа) в производственное помещение, создании давления в водородном коллекторе при электролизе, при возникновении пожара. Во всех случаях необходима работоспособная световая или звуковая сигнализация об этих ситуациях, а водородные компрессоры должны автоматически останавливаться.
Железнодорожные цистерны, танки, бочки, баллоны должны заполняться только по массе с тщательным контролем массы пустой и заполненной емкости, так как жидкий хлор при нагревании на 1?С увеличивается в объеме почти на 0,2%, а с увеличением давления на каждые 100кПа его объем уменьшается на 0,012%, т.е. в заполненном жидким хлором сосуде повышение температуры на 1% приводит к повышению давления на 1500-2000 кПа. Норма заполнения сосудов жидким хлором установлена из расчета 1,25 кг на 1л емкости.
На металлы, кроме олова и алюминия, сухой хлор почти не действует, а в условиях влаги подвергает их сильной коррозии. При концентрации хлора в воздухе 0,1-0,2 мг/л у человека вызывается отравление, удушливый кашель, головная боль, резь в глазах, поражение легких, раздражение слизистых оболочек и кожи. Пострадавшего необходимо немедленно вынести на свежий воздух (только в горизонтальном положении, так как из-за отека легких любые нагрузки на них провоцируют усугубление положения), согреть, дать дышать парами спирта, кислорода, кожу и слизистые оболочки промывать 2%-ным содовым раствором в течение 15 мин.
Пожаровзрывобезопасность, N 7, 2010 год
(см. ярлык "Примечания")
Г.В.Васюков
канд. техн. наук,
доцент Академии ГПС
МЧС России,
г.Москва, Россия
П.А.Кожин
адъюнкт Академии ГПС
МЧС России,
г.Москва, Россия
Проведено обобщение и анализ исследований в области пожарной опасности водорода при условиях, когда температура окружающей среды и водородных смесей до реакции составляет около 20°С, а начальное давление смесей соответствует атмосферному. Выделены основные направления изучения пожарной опасности водорода: влияние различных флегматизаторов и ингибиторов на пожаровзрывоопасные свойства водородсодержащих смесей, обеспечение пожарной безопасности технологических процессов с участием водорода, изменение условий и параметров взрыва водородсодержащих смесей (концентрационные пределы распространения пламени, максимальное давление взрыва, скорость нарастания давления взрыва, нормальная скорость горения), исследование кинетики реакций горения водорода, влияние загроможденности пространства на интенсификацию и подавление процесса горения водородно-воздушных смесей.
Ключевые слова: водород, пожарная опасность, пожаровзрывобезопасность, детонация, дефлаграция, окисление, кинетика, ингибирование, флегматизация, радикально-цепной механизм.
Водород уже давно привлекает внимание человека. Причинами этому являются его уникальные физико-химические свойства, а также практически неисчерпаемые запасы водорода на планете, что делает его наиболее предпочтительным, а порой незаменимым веществом в различных областях промышленности. В настоящее время водород широко используется в химии, нефтехимии, энергетике, на транспорте и в других отраслях промышленности, и область его применения постоянно расширяется. В недалеком будущем следует ожидать развития водородной энергетики, использования водорода в авиации, автомобилестроении и других отраслях.
Одной из основных причин, которые сдерживают применение водорода в различных отраслях промышленности, является его высокая пожарная опасность. Исследованием взрывоопасных свойств водорода специалисты занимаются более 30 лет. В настоящее время достаточно тщательно изучена пожарная опасность водорода при условиях, которые условно можно разделить на две группы: нормальные условия протекания реакции и условия, отличные от нормальных. Данная статья посвящена анализу исследований пожарной опасности водорода при нормальных условиях, в качестве которых приняты условия, при которых температура окружающей среды и водородных смесей до реакции составляет около 20°С, а начальное давление смесей соответствует атмосферному.
Водород имеет следующие свойства, характеризующие его пожаровзрывоопасность:
- мольная теплота сгорания 241,6 кДж/моль;
- стандартная температура самовоспламенения 510°С;
- концентрационные пределы распространения пламени (КПРП) в воздухе 4,1-75,0% (об.), в кислороде - 4,1-96,0% (об.);
- минимальная энергия зажигания 0,017 МДж;
- максимальная нормальная скорость горения в воздухе 2,7 м/с;
- максимальное давление взрыва 730 кПа;
- критический диаметр 0,6·10 м;
- минимальное взрывоопасное содержание кислорода при разбавлении азотом 5% (об.), диоксидом углерода - 7,9% (об.) [1].
Исследован механизм, по которому происходит окисление водорода. При реакции окисления происходит соударение молекул Н и О , имеющих достаточную энергию для разрыва химических связей. Образуются два гидроксильных радикала (ОН). Число образующихся ОН обычно мало, поэтому они находятся в окружении молекул. Образовавшийся гидроксильный радикал легко вступает в реакцию с молекулой водорода, вследствие чего образуется конечный продукт (вода), а также новая активная частица (атом водорода). Последняя легко вступает в реакцию с молекулой кислорода, и образуется атом кислорода ( ), который имеет два не-спаренных электрона (бирадикал). Бирадикал вступает в реакцию с молекулой водорода с образованием новых гидроксильных радикалов и атомов водорода Н. Новые радикалы ОН будут снова вступать в реакцию с молекулой водорода, а атомы Н - с молекулой кислорода и так далее. Возникает цепочка превращений, в результате которых образуется большое количество молекул воды (Н О). Такие реакции называются радикально-цепными. Цепочка превращений прервется при встрече двух активных частиц. В результате их соударения образуется молекула водорода или воды, происходит гибель активных частиц, и цепочка превращений на этом обрывается. В реакциях, ведущих к обрыву реакционных цепей, присутствует частица М, отводящая избыток энергии от образующихся Н и Н О. В отводе избыточной энергии также может участвовать стенка реактора.
Механизм химических превращений при окислении водорода в целом выглядит следующим образом:
Н + Н Н О +
+ О Н +
+ Н Н + Н
+ + М (стенка) Н + М
+ Н + М (стенка) Н О + М
Длина цепи для радикально-цепных реакций составляет от 10 до 10 , т.е. за один акт химического взаимодействия в реакциях развития цепей может образовываться до 10 молекул воды [2].
Одними из первых были проведены исследования по изучению образования взрывоопасных объемов водородно-воздушных (ВВС) и водородно-кислородных (ВКС) смесей в замкнутых, частично ограниченных и свободных пространствах при высоких массовых скоростях поступления водорода (залповых выбросах). Исследования проводились на предварительно перемешанных смесях водорода с воздухом и кислородом, заключенных в эластичную оболочку, и газовых облаках, образующихся при проливе и испарении жидкого водорода в атмосферу. Показано, что при таких условиях коэффициент участия водорода во взрыве составляет не более 0,5 от первоначальной массы газа. Изучены вопросы перехода дефлаграционного горения водорода в детонационный режим. Так, для воздушных смесей водорода возможен переход в детонационный режим, если радиус образовавшегося газового облака достигает 70 м. Для чистых ВКС переход в детонационный режим можно ожидать уже при размерах облака 3-4 м. На основании полученных результатов предложены некоторые способы предупреждения и снижения последствий взрыва газовоздушных облаков [3].
Экспериментально исследовано сгорание локальных ВВС в закрытом сосуде. Для случая перемешанных смесей получена обобщающая зависимость максимального избыточного давления от содержания горючего газа. Установлено, что максимально возможное давление наблюдается при концентрации водорода 22% от объема смеси (рис.1).
Рис.1. Зависимость максимального относительного давления от концентрации водорода С в локальном объеме при =3,9
Показана возможность использования полученной обобщающей зависимости для неоднородных по концентрации горючего локальных смесей. Разработана и экспериментально апробирована методика оценки максимального относительного давления взрыва для локальных неоднородных по концентрации горючего ВВС в замкнутом объеме. Предложена формула для определения максимального давления в зависимости от массы водорода:
где - максимальное относительное давление в сосуде; ;
- максимальное давление взрыва, Па;
- начальное давление, Па;
- энергия, выделившаяся в результате химической реакции и выраженная в единицах ; ;
- тепловой эффект реакции, кДж/кг;
М - масса горючего газа, кг [4].
Проведены работы по обеспечению пожаровзрывобезопасности производственных процессов с участием водорода путем его окисления на каталитических сжигателях на основе гидрофобизированного катализатора в беспламенном режиме. Для сжигателей в виде сеток с размерами ячеек 0,315 и 0,63 мм был получен эффект стабилизации пламени без повышения давления и температуры в реакционном сосуде. Установлено, что сетка с размером ячейки 0,08 мм препятствует доступу свежей смеси, необходимой для поддержания горения, а с размером ячейки 2,2 мм не является огнепреграждающей для концентраций водорода выше 8% (об.). Изучено влияние на эффективность сжигания водорода пламенным сжигателем диаметра и длины корпуса, а также размера ячейки огнепреграждающей сетки 8.
В технологических аппаратах в химической и других отраслях промышленности широко используется пленочное водяное охлаждение. В таких аппаратах движущаяся водяная пленка может оказывать турбулизирующее влияние на распространяющийся фронт пламени ВВС, которая часто обращается в таких аппаратах. В результате турбулизации горение интенсифицируется с возрастанием взрывных нагрузок. Зависимости давления Р от времени при отсутствии и наличии водяной пленки показаны на рис.2 и 3. Фактор турбулизации пламени , характеризующий уровень его (пламени) ускорения, предполагался постоянным в течение всего процесса и составлял: = 6 и = 15.
Рис.2. Осциллограммы давление Р - время t при сгорании ВВС в реакционном сосуде при отсутствии движущейся водяной пленки и концентрации водорода 20% (об.), зажигание снизу: - коэффициент теплоотдачи стенкам трубы = 850 Вт/(м ·К), = 6; 2 - = 600 Вт/(м ·К), = 15; эксперимент; расчет
Рис.3. Осциллограммы давление Р - время t при сгорании ВВС в реакционном сосуде при наличии движущейся водяной пленки (1, 3) и ее отсутствии (2) и концентрации водорода: 1, 2 - 30% (об.); 3 - 15% (об.)
Выявлено, что волна давления при сгорании ВВС в трубе с движущейся водяной пленкой имеет несколько пиков (рис.4).
Рис.4. Осциллограммы давление Р - время t при сгорании ВВС в реакционном сосуде при наличии движущейся водяной пленки и концентрации водорода 18% (об.): 1, 2, 3 - давления, регистрируемые датчиками, расположенными соответственно в нижней, средней и верхней точках сосуда; 4 - расход воды в усл.ед.
Изучен процесс перехода горения в детонацию для смесей (2Н + О ) + N , а также возможность возникновения гидроудара в столбе жидкости, который может в 2-3 раза превышать максимальное давление газовой смеси [11].
Исследованы механизмы воспламенения водорода на первом, втором и третьем пределах воспламенения. Показано, что на всех трех пределах реакция горения протекает по цепному механизму, который определяет закономерности процесса, основной из которых является превышение скорости разветвления цепей над скоростью обрыва [12].
Изучены процессы распространения пламени в ВВС в загроможденном пространстве 13. Показано, что невозможно точно прогнозировать уровень интенсификации горения при прохождении пламенем турбулизирующих препятствий, поскольку загроможденность пространства может вызывать не только интенсификацию, но и подавление процесса горения. Это подтверждают исследования распространения пламени в ВВС в трубе с засыпкой из металлических шариков. В результате их установлено, что в зависимости от диаметра шариков и состава смеси может быть реализовано как ускорение, так и замедление распространения пламени, вплоть до его угасания (рис.5) [16].
Рис.5. Осциллограммы давление - время t
Читайте также:

