При миеломе какой белок может быть в моче

Сбор анамнеза. Врач анализирует, как давно появились боли в костях, онеменеие, утомляемость, слабость, кровотечения, кровоизлияния. Учитывается наличие хронических заболеваний и вредных привычек. На основе результатов лабораторных и инструментальных исследований ставиться диагноз, определяется форма и стадия миеломной болезни, назначается лечение.
Осмотр. Выявляет внешние признаки миеломной болезни:
опухоли на разных участках тела, преимущественно на костях и мышцах.
кровоизлияния, возникшие в результате нарушения свертываемости крови.
бледность кожных покровов – признак анемии.
учащенный пульс – попытка сердца компенсировать недостаток гемоглобина ускоренной работой.
Общий анализ крови. Лабораторное исследование, которое позволяет оценить общее состояние системы кроветворения, функции крови и наличие различных заболеваний. Забор крови осуществляется утром натощак. Для исследования берут 1 мл крови из пальца или из вены. Врач-лаборант изучает каплю крови под микроскопом, существуют автоматические анализаторы.
О миеломной болезни свидетельствуют такие показатели:
повышение СОЭ – свыше 60-70 мм/час
снижено количество эритроцитов – мужчины менее 4 10^12 клеток/л, женщины менее 3,7 10^12 клеток/л.
снижено количество ретикулоцитов – менее 0,88% (из 100% эритроцитов)
снижено количество тромбоцитов – менее 180 10^9 клеток/л.
снижено количество лейкоцитов – менее 4 10^9 клеток/л.
снижен уровень нейтрофилов – менее 1500 в 1 мкл (менее 55% от всех лейкоцитов)
повышен уровень моноцитов – свыше 0,7 10^9 (более 8% от всех лейкоцитов)
гемоглобин снижен – менее 100 г/л
в крови могут обнаружиться 1-2 плазматические клетки.
Из-за угнетения кроветворной функции костного мозга уменьшается количество кровяных клеток (эритроцитов, тромбоцитов, лейкоцитов). Общее количество белка увеличивается за счет парапротеинов. Высокий уровень СОЭ свидетельствует о наличии злокачественной патологии.
Биохимический анализ крови позволяет оценить работу отдельных органов и систем по наличию того или иного вещества в крови.
Кровь забирается в утренние часы натощак, до приема лекарств и других исследований (рентгена, МРТ). Кровь берут из вены. В лаборатории в пробирки с кровью добавляют химические реагенты, которые вступают в реакцию с определяемыми веществами. Миеломную болезнь подтверждают:
увеличение общего белка – свыше 90-100 г/л
альбумин снижен мене 38 г/л
уровень кальция повышен – свыше 2,75 ммоль/литр.
мочевая кислота повышена – мужчины свыше 416,5 мкмоль/л, женщины свыше 339,2 мкмоль/л
креатинин повышен – мужчины свыше 115 мкмоль/л, женщины свыше 97 мкмоль/л
уровень мочевины повышен – более 6,4 ммоль/л
Выявленные отклонения свидетельствуют о повышении белка в крови за счет патологических парапротеинов, выделяемых миеломными клетками. Высокие уровни мочевой кислоты и креатинина указывают на поражение почек.
Выявление в моче свободных легких цепей иммуноглобулинов (белка Бенс-Джонса), используемое для диагностики моноклональных гаммапатий, в том числе множественной миеломы.
Свободные легкие цепи иммуноглобулинов в моче
Синонимы английские
Bence-Jones protein, Urine (immunofixation)
Free light chains, Urine
Какой биоматериал можно использовать для исследования?
Суточную мочу, среднюю порцию утренней мочи.
Общая информация об исследовании
Белок Бенс-Джонса – это группа моноклональных свободных легких цепей иммуноглобулинов, которые могут быть определены в моче или в крови. Их появление характерно для лимфопролиферативных заболеваний, таких как множественная миелома. Эта особенность была впервые описана английским врачом Генри Бенс-Джонсом при исследовании образца мочи, что и дало такое название. Впоследствии стало известно, что белок Бенс-Джонса – это, в действительности, гомогенная группа свободных легких цепей иммуноглобулинов, синтезируемых одной плазматической клеткой (моноклональных). Белок Бенс-Джонса – это собирательное название мономеров, димеров, тетрамеров и других полимерных структур, состоящих из легких цепей иммуноглобулинов.
Свободные цепи иммуноглобулинов – это полипептиды с молекулярной массой 22 кДа, которые синтезируются плазматическими клетками и, соединяясь с тяжелыми цепями, образуют молекулы иммуноглобулинов различных классов: IgG, IgM, IgA и других. В зависимости от строения константного домена, различают два класса легких цепей – лямбда (λ) и каппа (κ) цепи. Каждый иммуноглобулин может иметь только один класс легких цепей – или лямбда, или каппа. В норме плазматические клетки синтезируют больше легких, чем тяжелых цепей. Легкие цепи, не вошедшие в состав иммуноглобулинов, называются свободными. Свободные каппа-цепи, как правило, существуют в виде мономера, имеют небольшой размер и поэтому относительно легко фильтруются в первичную мочу. Лямбда-цепи, напротив, обычно существуют в форме димера, что затрудняет их фильтрацию в почечных клубочках. В редких случаях как каппа-, так и лямбда-цепи могут образовывать тетрамеры – крупные комплексы белков, которые в мочу не проникают. В норме практически все количество легких цепей, поступивших в почечные канальцы, подвергается реабсорбции и лишь их незначительная часть выделяется с мочой (не более 0,75-1,8 мг/л). Появление избытка свободных легких цепей иммуноглобулинов в моче (появление белка Бенс-Джонса) может свидетельствовать об их чрезмерной продукции плазматическими клетками (гаммапатии) или о нарушении процесса почечной реабсорбции (заболевания почек). Обнаружение белка Бенс-Джонса может быть использовано для диагностики и контроля лечения этих заболеваний.
Белок Бенс-Джонса определяется у 50-70 % пациентов с множественной миеломой, 30-40 % пациентов с макроглобулинемией Вальденстрема и у 90 % пациентов с первичным амилоидозом. Другими состояниями, при которых может наблюдаться белок Бенс-Джонса в моче, являются лимфома, лейкоз (чаще хронический лимфолейкоз или плазмаклеточный лейкоз), рак поджелудочной железы, медуллярная карцинома щитовидной железы, доброкачественная гаммапатия неясного генеза. При отсутствии какой либо причины появления этого белка в моче говорят об идиопатической протеинурии Бенс-Джонса.
Свободные легкие цепи иммуноглобулинов не могут быть определены с помощью обычного анализа мочи – для этого используются специальные тесты. Как правило, лабораторная диагностика при подозрении на гаммапатию начинается с обычного электрофореза белков плазмы и мочи. Этот шаг необходим для определения концентрации М-белка (парапротеина) и начальной дифференциальной диагностики гаммапатий. Электрофорез, однако, недостаточно чувствительный метод. По этой причине на втором этапе обследования рекомендуется проведение более чувствительного теста – иммунофиксации белков мочи. Это позволяет избежать диагностических ошибок, учитывая, что гаммапатии могут иметь нормальный результат электрофореза белков. Метод иммунофиксации позволяет не только выявить даже незначительное количество свободных легких цепей, но и определить их класс (лямбда-или каппа-цепи).
Как правило, проводят параллельный анализ как крови, так и мочи. Это связано с некоторыми особенностями экскреции легких цепей при гаммапатиях. Например, у большинства пациентов с клиническими признаками миеломы при электрофорезе сыворотки обнаруживается более 3 г М-белка в дл крови. Однако примерно у 20 % пациентов выявляется лишь незначительное повышение М-белка (менее 1 г в дл крови) или вовсе нормальный уровень иммуноглобулинов крови. При анализе мочи у таких пациентов удается выявить повышенную экскрецию легких цепей в мочу (такая миелома часто называется миеломой Бенс-Джонса). Таким образом, параллельный анализ позволяет предотвратить ошибки диагностики.
Следует отметить, что существует особая, редкая форма миеломы, при которой легкие цепи не выявляются ни в крови, ни в моче ни с помощью электрофореза, ни иммунофиксации (так называемая несекретирующая множественная миелома). Для диагностики этой формы миеломы рекомендуется определение соотношения свободных легких цепей иммуноглобулинов λ и κ в сыворотке крови.
Белок Бенс-Джонса также может не определяться в моче на ранней стадии заболевания, когда избыток свободных легких цепей еще может быть реабсорбирован в почечных канальцах (вплоть до 1 г в день при нормальной функции почек), и в редких случаях, когда свободные легкие цепи образуют тетрамеры, не фильтрующиеся в почечном клубочке.
Ложноположительный результат может быть получен при приеме некоторых лекарственных средств (например, аспирин и пенициллин в высоких дозах), хронической почечной недостаточности или при некоторых системных заболеваниях (ревматоидный артрит, СКВ, полимиозит).
Учитывая эти ограничения метода иммунофиксации, интерпретация результатов должна проводиться с учетом дополнительных анамнестических, лабораторных и инструментальных данных.
Для чего используется исследование?
- Для диагностики и контроля лечения моноклональных гаммапатий (множественной миеломы, болезни легких цепей, макроглобулинемии Вальденстрема).
Когда назначается исследование?
- При подозрении на множественную миелому и другие заболевания из группы моноклональных гаммапатий (множественной миеломы, болезни легких цепей, макроглобулинемии Вальденстрема).
Что означают результаты?
Результат: не обнаружено.
Парапротеина, представленного каппа/лямбда легкими цепями - не обнаружено.
- первичный амилоидоз;
- моноклональная гаммапатия неясного генеза;
- криоглобулинемия;
- синдром Фанкони;
- гиперпаратиреоз;
- множественная миелома;
- остеомаляция;
- макроглобулинемия Вальденстрема;
- медуллярный рак щитовидной железы;
- аденокарцинома поджелудочной железы;
- лимфома;
- лейкоз;
- идиопатическая протеинурия Бенс-Джонса.
- норма;
- эффективное лечение заболевания.
Что может влиять на результат?
- Стадия заболевания: белок Бенс-Джонса может не определяться в моче на ранней стадии заболевания;
- прием аспирина и пенициллина в высоких дозах может приводить к получению ложноположительного результата;
- наличие системных заболеваний (ревматоидный артрит, СКВ, полимиозит) и хронической почечной недостаточности может приводить к получению ложноположительного результата;
- наличие тетрамеров лямбда- или каппа-легких цепей (не попадающих в мочу) может приводить к получению ложноотрицательного результата.
- Рекомендуется проводить иммунофиксацию белков как мочи, так и крови;
- интерпретацию результатов следует проводить с учетом дополнительных анамнестических, лабораторных и инструментальных данных.
6 Альбумин в сыворотке
19 Белок общий в сыворотке
22 Белок общий в моче
10 Суммарные иммуноглобулины G (IgG) в сыворотке
10 Суммарные иммуноглобулины M (IgM) в сыворотке
8 Белковые фракции в сыворотке
42 Иммунофиксация иммуноглобулинов сыворотки крови с антисыворотками IgG, A, M K, L с количественным определение парапротеина
Кто назначает исследование?
Гематолог, онколог, терапевт, врач общей практики.
Литература
- NauKC, LewisWD. Multiplemyeloma: diagnosisandtreatment. Am Fam Physician. 2008 Oct 1;78(7):853-9. Review.
- Levinson SS, Keren DF. Free light chains of immunoglobulins: clinical laboratory analysis. Clin Chem. 1994 Oct;40(10):1869-78.
- Whicher JT, Hawkins L, Higginson J. Clinical applications of immunofixation: a more sensitive technique for the detection of Bence Jones protein. J Clin Pathol. 1980 Aug;33(8):779-80.
- Chernecky C. C. Laboratory Tests and Diagnostic Procedures / С.С. Chernecky, В.J. Berger; 5th ed. - Saunder Elsevier, 2008.
Число лейкоцитов, вариабильное, нормальное или повышенное. В развитых стадиях болезни можно наблюдать лейкопении, отягощаемые и применяемыми цитостатическими лечениями. Лейкоцитарная формула, обычно нехарактерная, может показывать иногда повышенное число плазмоцитарных элементов, подобных клеткам в костном мозге.
Число тромбоцитов нормальное или умеренно пониженное.
Исследование костного мозга при множественной миеломе имеет важнейшее значение для постановки диагноза. Костная пункция производится обычно в грудную кость или в подвздошный гребень, но ее можно производить и в другие затронутые кости: позвонки, пяточную кость, ключицу. Иногда проникание в кость происходит очень легко, костная ткань давая ощущение особой хрупкости.
В цитоплазме миеломатозных клеток можно встретить гиалиновые шарики (тела Russel), многочисленные вакуоли, придающие клетке вид ежевики (клетки Mott), или хрустальные азурофильные включения иногда подобные телам Auer при миелобластической лейкемии (протеиновые кристаллы) (цветная вклейка III).
С цитохимической точки зрения, цитоплазма миеломатозных клеток является пероксидазо-отрицательной и окрашивается метахроматически с метиловой зеленью. Гиалиновые шарики (тела Russel) обычно PAS-положительные.
Миеломатозные клетки преставляют множество нуклеоцитоплазматических асинхронизмов созревания. Согласно Bernier и Graham, степень этих асинхронизмов пропорциональна клиническому распространению заболевания.

Исследования при помощи электронного микроскопа показали наличие определенных аномалий на уровне клеточных органитов, аномалии тем более явные, чем менее дифференцирована миеломатозная клетка. Митохондрии численно увеличены и имеют патологические аспекты: удлиненные, кольцевидные, иногда с чертами миелиновой дегенерации; аппарат Гольджи везикулярнио трансформирован, центриоли имеют гигантский удлиненный вид, а число рибозомов может возрастать (Bessis). Наиболее интересный аспект представляет эргастоплазмический аппарат. В большинстве случаев он расширен и имеет везикулярный вид.
Содержимое эргастоплазмических везикул состоит из протеина и имеет твердую консистенцию, принимая аспект тел Russel, либо в растворимой форме, flaming cells или тезауроцотив (Paraskevas и сотр.), либо в кристаллизованной форме.
Протеиновые кристаллы бирефрингентные с периодичностью около 110 A (Bessis). В других случаях эргатоплазмический аппарат менее развит и представлен несколькими пластинками, а редко бывает плохо развитым, подобным лимфоидной клетке. На уровне ядра появляются аномалийные, гипертрофированные нуклеоли, а также и множество интрануклеарных вакуолей (Smetena и сотр.). Некоторые авторы описали наличие в ядре вирусных телец, в 15% случаев (Sorensen), тельца, которые Bessis нашел лишь в одном из 12 изученных им случаев.
Иммунохимические и иммунофлюоресцентные исследования, с разными специфическими антисыворотками (IgG, IgA, IgM, IgD IgE, ламбда, каппа) показали наличие Ig в цитоплазме миеломатозных клеток. Они локализированы в особенности на уровне эргастоплазмического аппарата и рибозомов. Делались попытки установить связь между морфологическим аспектом клеток и типом секретированного Ig. Полученные до настоящего времени результаты неубедительны. Paraskevas и сотр. утверждают, что пламенистые клетки секретируют IgA.
Цитогенетическое исследование множественной миеломы показало существование разных форм анейплоидии, но которые наблюдаются не во всех случаях. Кроме этого кыло описано и присутствие различных хромозомов маркеров. Вследствие внедрения метода бандирования, Liang и Rowley нашли хромозом 14р+ у 3 больных с множественной миеломой и 1 больного с плазмоцитарной лейкемией, из 22 изученных больных. Этот хромозом 14q+ был найден и при других лимфомах типа Б, а также, изредка, и при лимфомах non-Б. Следует отметить, что Croce и сотрудники установили, что структуральные гены для тяжелых цепей Ig локализированы у человека на хромозоме 14.
Исследование протеинового обмена при множественной миеломе. Расстройства протеинового метаболизма составляют характерный аспект множественной миеломы. Злокачественно модифицированные плазмоциты сохраняют и усиливают способность синтетизировать цельные Ig или только определенные составные части глобулиновой молекулы.
В сыворотке большинства больных, общее количество протеинов повышено, достигая 23 г/100 мл. Среднее количество сывороточных протеинов у больных с миеломой равняется 9 г/100 мл. Этот рост происходит за счет глобулинов, точнее Ig. При электрофорезе на бумаге или в агаре наблюдается появление узкой и высокой полосы, с заметным сокращением остальных дуг. Это является изображением количественного роста гомогенного населения глобулинов. Пик находится обычно в зоне миграции у-глобулинов или b-глобулинов. Аномалийный протеин, находящийся в сыворотке больных с миеломой, получил название парапротеина, миеломатозного глобулина (М-глобулин) или компонента М.
В рамках множественной миеломы может происходить:
1) избыточный синтез, однако уравновешенный, цепей Н и L, с образованием цельных Ig;
2) неуравновешенный синтез, с избытком цепей L и образованием цельных Ig, параллельно с повышенным количеством свободных цепей L и
3) синтез лишь цепей L.
В настоящее время миеломы делятся по типу секретируемого Ig: миеломы IgG наиболее частые, встречающиеся в 60% случаев; миеломы IgA, в 20—25% случаев; IgD, в 2,1% случаев; и ограниченное число миелом IgE. Среди случаев множественной миеломы, 20% — с цепями L (миеломы Бенс-Джонса), причем некоторые без патологического протеина в сыворотке, так как он элиминируется через мочу. Очень малый процент заболеваний (1%) не представляет изменений протеинового метаболизма (несекретирующие миеломы).
В рамках миелом IgG, наблюдается следующее распределение на субклассы (Schur): yG1 60—82%; yG2 10—18%; yG3 6—15%; yG4 1—8%. Сравнивая эти цифры с относительными концентрациями в нормальной сыворотке (гл. 7) можно утверждать, что моноклональные Ig типа yGl и yG3 встречаются чаще по сравнению с yG2.
Характерной чертой миеломатозного Ig является его гомогенность: узкая зона электрофоретической миграции, индивидуальная антигенная специфичность и цепь L только одного типа (ламбда или каппа). При миеломах IgG и IgA преобладают случаи с цепями каппа (2/3 случаев) (Hobbs и Corbet); при миеломах IgD, цепи ламбда преобладают в 90% случаев, в то время как при миеломах Бенс-Джонса, цепи ламбда присутствуют приблизительно в 45% случаев (Jancelewicz и сотр.). До сих пор не удалось выявить физико-химические или иммунохимические различия между миеломатозными протеинами и соответствующими им нормальными Ig.
Было доказано, что миеломатозные Ig обладают способностью связываться с другими веществами, следовательно действовать как антитела. Такая антителовая деятельность отмечалась по отношению к бактериальным соединениям (стрептолизин 0 или спрептококковая гиалу-ронидаза), к гематиям, к некоторым сывороточным протеинам, а также и к гаптенам (динитрофенол, 5-ацетоурацил, пуриновые и пиримидиновые нуклеотиды) (Osterland и сотр.). Способность миеломатозного протеина связываться с гематиями или сывороточными протеинами порождает определенные симптомы, как например агглютинация гематий в виде монетных столбиков, явления повышенной кровоточивости и пр.
У больных с миеломой, количественный рост характерного миеломатозного Ig сопровождается сокращением производства других типов глобулинов.
Значительная диспротеинемия в крови больных с множественной миеломой оказывает влияние на все пробы коллоидальной лабильности.
Реакция оседания эритроцитов в большинстве случаев бывает очень ускоренной, достигая 100 мм в час. При миеломах Бенс-Джонса, РОЭ показывает более низкие цифры, иногда даже в нормальных пределах.

Реакции на формол-гелифицирование, сульфат кадмия, Вельтмана — положительные. Реакция Sia (помутнение сыворотки в дистилированной воде) — слабо или умеренно положительная.
В редких случаях отмечалось наличие сывороточных криоглобулинов с появлением синдрома Рейно на холоде и наблюдалось также наличие пироглобулинов.
Тесты на коагуляцию модифицированы у некоторых больных. Патологические протеины в сыворотке могут интерферировать с различными фазами коагуляции, как например в трансформация фибриногена в фибрин, во взаимодействии с факторами II, V и VII. Функции тромбоцитов могут быть также модифицированными.
Анализ мочи показывает наличие протеина Бенс-Джонса в 40—50% случаев, когда он детерминируется путем нагревания и в 61% случаев, когда он выявляется путем иммуноэлектрофореза. Он представлен выведением легких цепей. Протеин Бенс-Джонса преципитирует в моче нагретой до 50—60°, создавая беловатое облако, которое перерастворяется при кипячении. В случае ассоциированной альбуминурии, перерастворение является неполным и иногда оказывается неполным и без альбуминурии. В такой ситуации мочу можно сделать прозрачной путем добавления нескольких капель 5%-й уксусной кислоты. Физикохимическое исследование альбумина Бенс-Джонса показало, что он состоит из легких цепей, димеризованных дисульфидными связями. Постоянно легкая цепь в моче идентична с легкой цепью сывороточного миеломатозного протеина.
В мочевом осадке могут появляться цилиндры, гематии, а в случаях почечного калкулеза появляются кристаллы фосфатов, уратов, а также гематии и лейкоциты.
Гиперкальцемия встречается часто при множественной мизломе (20—53% случаев), достигая 12—16 мг/100 мл сыворотки. Этот рост связан в первую очередь с процессами костной деструкции, но и с гиперпаратиреоидизмом, как вторичное явление почечной недостаточности. Гиперкальцемия при множественной миеломе не сопровождается ростом фосфора в крови, а щелочные сывороточные фосфатазы находятся в нормальных пределах, что представляет ценные данные для дифференциальной диагностики по отношению к первичному гиперпаратиреоидизму.
Сывороточная мочевая кислота бывает часто повышена, а в случаях, осложняющихся почечной недостаточностью, наблюдается рост креатинина и непротеинового азота.
Патологоанатомическое исследование при множественной миеломе. Наиболее явные изменения встречаются на уровне скелета, особенно в черепных костях, позвонках, ключицах, ребрах, грудной кости, лопатке, тазовых костях. Длинные кости затронуты в меньшей мере. На срезе, кость оказывается мягкой, а нормальная ткань заменяется красноватой или серо-красноватой туморальной тканью. Иногда опухоль переходит за периост, инфильтрируя смежные участки.
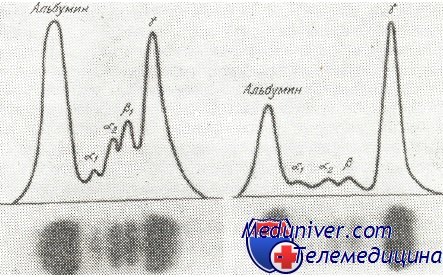
Изображения электрофореза нормальной сыворотки человека (слева) и сыворотки больного с множественной миеломой (справа). При миеломе констатируется наличие большого количества гаммагпобулина (высокая и узкая волна), с сокращением альбуминов и остальных глобулинов
Микроскопически, туморальная ткань состоит из пролиферации злокачественных плазмоцитоидных клеток, описанных при исследовании костного мозга. На срезе остеокласты и остеобласты немодифицированы.
В редких случаях внекостных миелом можно обнаруживать плазмоцитарные опухоли в различных органах, причем характерные особенности пролиферированных клеток подобны тем, которые наблюдаются при костных опухолях.
При множественной миеломе почка бывает часто затронута. Наиболее важные поражения встречаются на уровне канальцев. Дистальные канальцы расширены, с уплощенным эпителием и просветами заполненными эозинофильными и полихроматофильными цилиндрами. На периферии этих цилиндров встречаются многоядерные синцитин эпителиальных клеток. Цилиндры состоят из цельного миеломатозного Ig или из цепей L (протеин Бенс-Джонса). На электронном микроскопе, эти цилиндры имеют фибрилярную, амилоидную структуру (Abrahams и сотр.). Не удалось установить несомненную связь между наличием амилоида и протеинурией Бенс-Джонса. Несмотря на это, Glenner и сотр. показали in vitro образование амилоидных волокон путем протеолитической дигестии человеческого протеина Бенс-Джонса. Возможно, что подобный процесс происходит и на уровне почечных канальцев (Zlotnick).
В тубулярных эпителиальных клетках часто встречаются отложения кальция. Также на уровне почечных канальцев было отмечено наличие кристаллов, находящихся как в просвете, так и в эпителии. Их химическая структура не была установлена.
Почечные гломерулы бывают реже затронутыми при множественной миеломе. Отмечается утолщение базальной мембраны и мезангиомы, которое выступает с особенной ясностью на электронном микроскопе. Встречается также и гипертрофия эндотелиальных и эпителиальных клеток. В развитых фазах болезни появляются гиалиноз и склероз. Иногда в гломерулах можно найти отложения амилоида, что приводит к его гомогенизации.

Миелома — злокачественная опухоль, подавляющая нормальное кроветворение, разрушающая кости и вырабатывающая патологические белки, повреждающие внутренние органы. Когда говорят о миеломе крови или костей, или позвоночника, или костного мозга, то имеют ввиду одно заболевание с разнообразными проявлениями.
Относящееся к гемобластозам или онкогематологическим процессам, то есть злокачественным болезням крови и лимфатической ткани заболевание имеет много названий: множественная миелома, миеломная болезнь и генерализованная плазмоцитома, плазмоцитарная миелома.
- Причина миеломы
- Что происходит при миеломе?
- Диагностика миеломной болезни
- Когда диагноз миеломы не вызывает сомнений
- Симптомы миеломы
- Лечение миеломной болезни у молодых
- Лечение миеломы у пожилых
- Прогноз при миеломной болезни
Причина миеломы
Миелома состоит из изменённых плазматических клеток. В нормальном костном мозге плазматические клетки рождаются из В-лимфоцитов, но число их ограничено всего 5%, большее количество — уже патология.
Определённой ясности с первопричиной развития плазматической опухоли нет, в инициации процесса подозревают плохую наследственность и склонность к аллергии против собственных тканей, радиацию и работу с токсичными веществами, под подозрение попал и вирус герпеса 8 типа.

Миеломная болезнь поражает трёх из 100 тысяч россиян, как правило, пожилых — преимущественно на седьмом десятке жизни, у молодых до 40 лет заболевание встречается очень редко.
Среди страдающих заболеваниями крови и лимфатической ткани плазмоцитому имеет 10-13%, но из всех существующих в природе злокачественных процессов на больных плазмоклеточной опухолью приходится не более одного процента.
Что происходит при миеломе?
По какой-то причине в костном мозге появляются ненормальные клетки, размножаясь, они нарушают нормальное кроветворение, что проявляется анемией. Недостаток эритроцитов сказывается на работе всех органов, но особенно сильно на легочной ткани и головном мозге, что проявляется недостаточностью их функций.
Функция нормальных плазматических клеток — выработка антител-иммуноглобулинов для защиты от болезнетворных агентов. Миеломные плазмоциты тоже вырабатывают иммуноглобулины, но дефектные парапротеины, не способные к иммунной защите.
В костях миеломные клетки стимулируют остеокласты, вызывая остеолизис — разъедание кости. Из разрушенной кости кальций выходит в плазму, накапливаясь, приводит к гиперкальциемии — тяжёлому состоянию, требующему принятия срочных мер.
Диагностика миеломной болезни
Диагноз устанавливается по анализам крови, где находят парапротеины и определяют их суммарную и видовую концентрацию. Парапротеины обозначают как иммуноглобулины — IgA, IgG и IgМ. Плазмоциты вырабатывают иммуноглобулины по собственному усмотрению и в разном количестве, по их изменению продукции патологических белков впоследствии оценивают эффективность лечения и активность заболевания.
Степень агрессивности плазматических клеток выясняют при микроскопии костного мозга, его получают из грудины при стернальной пункции или при биопсии тазовой кости. Особенно актуально исследование при невысокой продукции парапротеинов или при изменении характера течения болезни.

Часто заболевание случайно обнаруживается во время обычной рентгенографии органов грудной клетки по литическим дефектам ребер. На первом этапе необходимо выявить все деструктивные изменения в костях, чтобы в дальнейшем следить за процессом и результатами терапии, что позволяет высокочувствительная низкодозная КТ всего скелета.
При МРТ изучается состояние плоских костей — черепа и таза, что обязательно при тлеющей и солитарном варианте опухоли. МРТ помогает оценить не только дефекты кости, но и наличие опухолевой инфильтрации мягких тканей, вовлечение в процесс спинного мозга.
Обязательно проводится анализ на кариотип для выявления генетических аномалий, влияющих на прогноз в отношении жизни больного и эффективность лечения.
Когда диагноз миеломы не вызывает сомнений
Характерные особенности клеток определяют течение процесса от медленной и практически доброкачественной гаммапатии или тлеющей миеломы до стремительного плазмоклеточного лейкоза.
Не всегда изначально удаётся классифицировать заболевание, что усложняет выбор оптимальной терапии. В 2014 году международный консенсус определил критерии, облегчающие постановку точного диагноза и отделяющие один вариант опухолевого процесса от других.
В первую очередь, в костном мозге определяют процент плазматических клеток, так при симптоматической миеломной болезни их должно быть более 10%, а 60% говорит о высокой агрессивности опухоли.
- М-протеин в крови, то есть IgA или IgG;
- легкие цепи иммуноглобулинов;
- в моче белок Бенс-Джонса;
- очаги в костях скелета.
При недостаточности специфических критериев диагностике помогают неспецифические, но часто встречающиеся последствия деятельности плазмоцитов и парапротеинов на органы-мишени:
- повышение уровня кальция крови в результате массивного разрушения костей;
- снижение гемоглобина при опухолевом замещении костного мозга;
- повышение креатинина крови — маркёра почечной недостаточности.
Симптомы миеломы
Замечено, что каждый пул плазматических клеток производит иммуноглобулины с персональными особенностями и по своему графику, отчего клинические проявления очень своеобразны и глубоко индивидуальны. Нет двух одинаковых больных, тем более невозможно найти двух похожих пациентов по диагностическим критериям. Тем не менее, выделяют несколько типов заболевания.
По количеству поражений опухоль может быть генерализованной или множественной и солитарной — с единственным очагом.
По течению различают вялотекущую или тлеющую, она же индолетная, и симптоматическую плазмоцитому, протекающую с явными клиническими проявлениями.

Основное проявление симптоматической миеломы — боли в костях вследствие их разрушения, которые появляются не сразу и часто даже не в первый год заболевания. Болевой синдром возникает при вовлечении в опухолевый процесс надкостницы, пронизанной нервными окончаниями. При медленно текущем процессе до выявления опухоли может пройти несколько лет, поскольку ничего кроме эпизодов слабости у пациента не возникает.
В развёрнутой стадии с множественными поражениями на первый план выходят в разных комбинациях и с индивидуальной интенсивностью переломы в местах деструкции костей и проявления почечной недостаточности, или амилоидоз органов.
Лечение миеломной болезни у молодых
Вялотекущий вариант миеломной болезни не всегда требует лечения, поскольку не угрожает жизни, а терапия совсем не безвредна. В данном случае наблюдение за течением процесса более выгодно пациенту, нежели токсичная химиотерапия. Регулярные обследования позволяют вовремя диагностировать активизацию процесса.
Симптоматическая миелома разделяется по стадиям от I до III по уровню в крови специфического микроглобулина и альбумина, стратегия при стадии I и II-III различается только используемыми препаратами и их комбинациями.
При любой стадии основное и определяющее тактику — состояние пациента и его возраст. Так сохранным больным до 65-летнего возраста и без тяжёлых хронических болезней предлагается агрессивная химиотерапия высокими дозами с пересадкой собственных стволовых клеток крови, по-научному, аутологичной трансплантацией.
Физически сохранные пациенты от 65 до 70-летия тоже могут претендовать на высокодозную химиотерапию, но уже не комбинацией лекарств, а единственным препаратом — мелфаланом.
До начала высокодозной химиотерапии проводится несколько курсов полихимиотерапии обычными дозами, затем специальным препаратом стимулируется выработка костным мозгом собственных стволовых клеток, которые собираются и консервируются. Затем пациент получает очень высокие дозы цитостатиков, в результате чего гибнут все клетки крови — опухолевые и нормальные. Нормальные, заблаговременно законсервированные кровяные элементы и вводят пациенту.
Лечение миеломы у пожилых
Пациенты старше 65 лет и помоложе, но с сопутствующими болезнями, влияющими на общее состояние и активность, тоже на первом этапе проходят цикловую химиотерапию, в том числе с использованием таргетных препаратов. Результат лечения оценивается по анализам крови и костного мозга, где определяют концентрацию специфических для заболевания белков и процент опухолевых клеток.
На результате лечения отражается не только возраст, но и наличие нескольких хронических болезней, астенизация, подразумевающая физическое ослабление с похуданием или без оного.
В последние годы спектр химиопрепаратов существенно расширился за счёт таргетных средств, продемонстрировавших хороший непосредственный результат и увеличение продолжительности жизни участников исследований.
Поражения скелета подлежат длительной терапии бисфосфонатами, уменьшающими болевой синдром, предотвращающими переломы и гиперкальциемию. На отдельные опухолевые очаги воздействуют ионизирующим излучением, обязательна лучевая терапия при угрозе сдавления спинного мозга и поражении шейного отдела позвоночника.

Прогноз при миеломной болезни
Кроме возраста пациента и его физического состояния на прогнозе миеломы и продолжительности жизни отражается чувствительность опухоли к лекарственному лечению и биологические характеристики плазматических клеток, в частности генетические аномалии с делецией участков хромосом и амплификацией — удвоением генов.
Читайте также:

