При лимфоме ходжкина что сначала делать химию или облучение
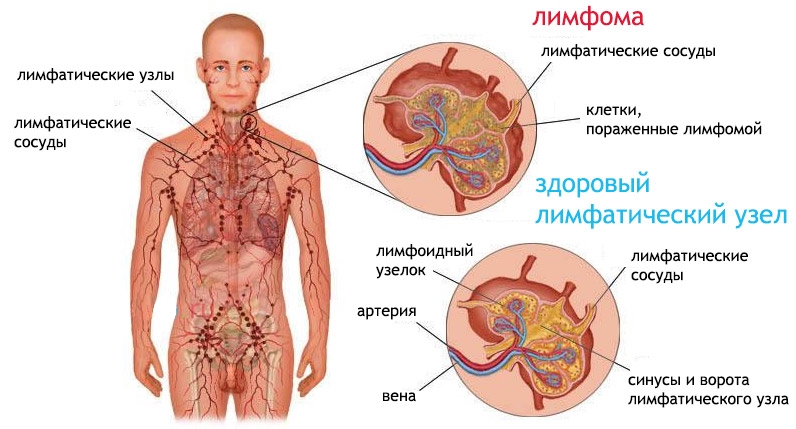
Лимфомы — группа онкозаболеваний, поражающих лимфатическую систему. Общим для всех лимфом является их рост из лимфоцитов — клеток крови, выполняющих защитную функцию. В отличие от лейкозов, поражение органов кроветворения если и наблюдается, то носит вторичный характер. Измененные опухолевым процессом клетки скапливаются в лимфатические узлах, но их также можно найти в костном мозге, селезенке и в других органах.
Определяют две обширные группы этих новообразований: лимфома Ходжкина (лимфогранулематоз) и все остальные — неходжкинские лимфомы, которых насчитывается более трех десятков. В зависимости от вида лимфоцитов, из которых растет опухоль, они разделяются на B- и Т-клеточные.
Лимфома Ходжкина
Болезнь Ходжкина была впервые описана еще в 19 веке. От остальных лимфом ее принципиально отличают так называемые клетки Штернберга-Рида, которые обнаруживают при микроскопии лимфоидной ткани. Болезнь Ходжкина часто диагностируется у подростков, а также имеет пики заболеваемости в 20 и 50 лет. Определить тип лимфомы без исследования образца измененной ткани нельзя.
Неходжкинские лимфомы
Сильно различаются по гистологической и клинической картине и требуют различной тактики лечения. Одни из них, индолентные лимфомы, протекают медленно и имеют относительно благоприятный прогноз. Другие, напротив, отличаются быстрым прогрессированием, выраженной симптоматикой и нуждаются в незамедлительном лечении — агрессивные лимфомы.
Обычно аномальные изменения лимфоцитов начинаются в лимфоузлах с развитием классической клинической картины. Однако встречаются и варианты течения, когда заболевание первично возникает не в лимфоузле, а в других органах, например в селезенке или головном мозге. В таком случае говорят об экстранодальной лимфоме.
Индолентные лимфомы
Распространенная группа медленно прогрессирующих опухолей. К таковым, например, относятся лимфоцитарная, лимфома маргинальной зоны. Эти опухоли отличаются благоприятным прогнозом, но очень отличаются друг от друга, поэтому требуют разного подхода к лечению. 1
Врачи

Стаж в радиологии - 17 лет, общий - 18 лет.
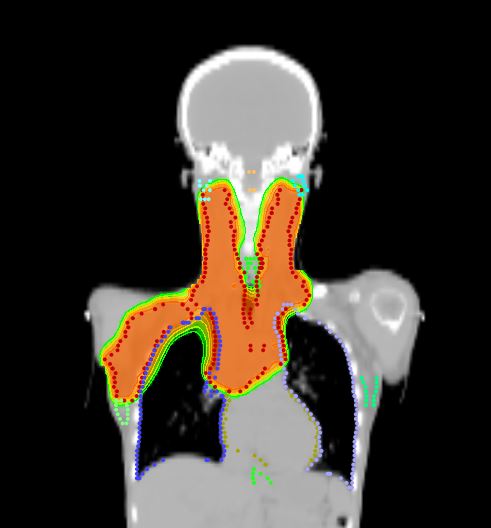
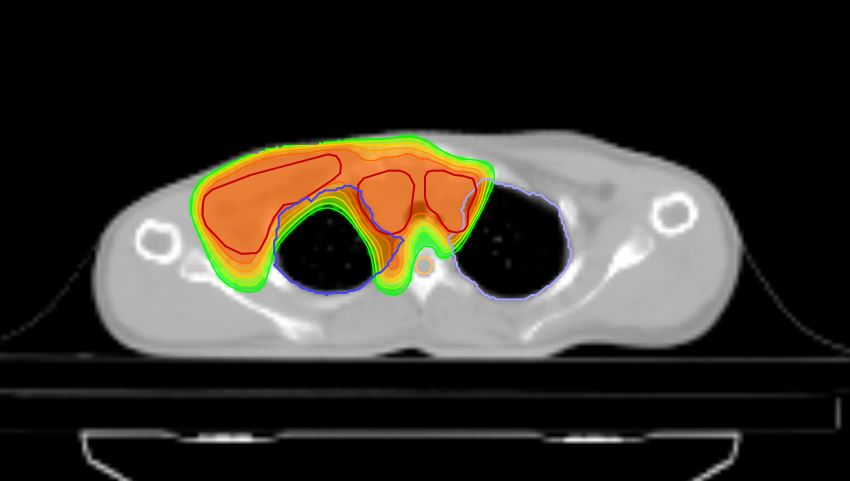
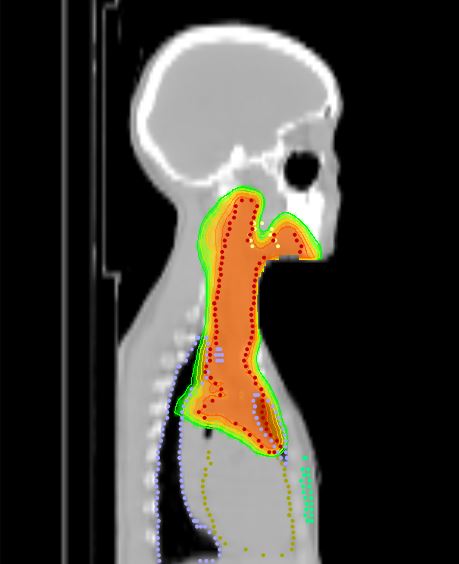
Томотерапия при лимфомах
Стандартная лучевая терапия как при лимфоме Ходжкина, так и при неходжкинских лимфомах, иногда вызывает достаточно серьезные осложнения в виде радиационного поражения легких и сердца, а также риска появления рака другой локализации.
В этой ситуации настоящим спасением становится Томотерапия, которая позволяет подать высокую дозу радиации в строго очерченную зону с минимальным влиянием на здоровые ткани. (см. ссылку)
Это позволяет снизить риск радиационных осложнений и повысить эффективность лечения. Достоинствами дистанционного облучения на аппарате Tomotherapy HD также являются:
- возможность применения при рецидивах;
- эффективность даже на поздних стадиях;
- облучение нескольких очагов за один сеанс;
- минимальный дискомфорт при процедуре.
Отзывы

Я очень благодарна коллективу за хорошее отношение, к пациентам относятся с уважением, всегда подскажут, что где и всегда придут на помощь. Благодарю за всё.

«Здравствуйте, меня зовут Рушана, я живу в городе Казани и оказалась в этом центре, как и многие, наверное, люди нежданно-негаданно для себя. Потому что большую часть своей жизни мы не предполагаем, что мы можем еще с чем-то столкнуться, что в нашей жизни могут быть какие-то серьезные трудности, которые мы еще до этого не преодолевали.
Стоимость лечения лимфом
| Наименование услуги | Цена, руб. | Ед. измерения |
|---|---|---|
| Консультация врача онколога радиотерапевта | 0 | шт. |
| Консультация врача детского онколога | 0 | шт. |
| Повторная консультация специалистов | 500 | шт. |
| Топометрия на специализированном компьютерном томографе первичная | 15 000 | процедура |
| Топометрия на специализированном компьютерном томографе повторная | 7 000 | процедура |
| Дозиметрическое планирование лучевой терапии (томотерапии) первичное | 20 000 | шт. |
| Дозиметрическое планирование лучевой терапии (томотерапии) повторное | 7 000 | шт. |
| Лучевая терапия (томотерапия), включая IMGRT (*) | 223 000 | курс |
| Лучевая терапия (томотерапия) стереотаксическая радиохирургия(*) | 250 000 | курс |
| Лекарственная сопроводительная терапия: внутривенные введение в процедурном кабинете (без учета стоимости лекарственных препаратов) | 1 000 | процедура |
| Лекарственная сопроводительная терапия: внутримышечное введение в процедурном кабинете (без учета стоимости лекарственных препаратов) | 200 | процедура |
| Топометрическая разметка | 750 | процедура |
Вид лучевой терапии и количество сеансов курса определяется врачебной комиссией индивидуально для каждого пациента исходя из локализации, нозологии опухоли и с учетом анамнеза.

Факторы риска
Причины лимфом сегодня достоверно неизвестны, однако учеными предполагается несколько основных факторов риска заболевания:
- Возраст. С годами растет риск развития неходжкинских лимфом. При болезни Ходжкина такой закономерности не наблюдается, однако у пожилых она обычно протекает тяжелее.
- Инфекционный агент. Установлена связь лимфом с инфицированием вирусами иммунодефицита человека, Эпштейна-Барр, гепатитов В и С, а также helicobacter pylory.
- Изменение иммунного статуса, в том числе вследствие аутоиммунной патологии, СПИДа, иммуносупрессивной терапии.
- Токсические агенты, и в частности пестициды, гербициды, удобрения, краска для волос.
Присутствие этих факторов совсем не означает, что у человека должна развиться лимфома. Гораздо чаще получается наоборот, и даже при наличии нескольких из них болезнь у большинства людей не возникает. Алкоголь, курение и избыточный вес, вероятно, не оказывают влияние на частоту возникновения лимфом.
Симптомы лимфом
Классическим проявлением любых лимфом является увеличение лимфоузлов — лимфаденопатия. Чаще всего, поражаются шейные, подмышечные и паховые узлы. Обычно они безболезненны, хотя боль может иметь место при быстром росте. Вместе с тем опухолевый процесс может затронуть:
- пищеварительный тракт, что сопровождается дискомфортом в животе;
- органы грудной клетки — кашель, одышка, боль в груди;
- костный мозг — анемия, тромбоцитопения, иммунодефицит;
- головной мозг — головная боль, двоение в глазах, парезы и параличи;
- спинной мозг — симптомы поясничного радикулита, нарушение функции тазовых органов, парезы нижних конечностей.
Вне зависимости от того, где располагается лимфома, человека могут беспокоить колебания температуры тела, ночные поты, снижение веса.
Многие люди вообще не предъявляют никаких жалоб, а увеличенные лимфоузлы у них обнаруживаются, например, во время профосмотра или при исследовании других заболеваний. Важно также отметить, что перечисленные симптомы не являются достоверным признаком лимфомы, поскольку часто отмечаются и при другой патологии. Даже классические увеличенные лимфоузлы чаще всего являются признаком инфекционных заболеваний. Тем не менее, и пациент, и тем более лечащий врач, всегда должны иметь в виду лимфому, как вероятную причину появления тех или иных симптомов.
Что можно/нельзя при лимфоме
На качество жизни оказывает влияние и химиолучевая нагрузка, которая неизбежна при лечении. Рекомендовано придерживаться здорового образа жизни с правильным питанием и адекватной физической активностью, отказом от вредных привычек.
Возможность заниматься профессиональной деятельностью прямо зависит от характера течения заболевания. Пациентам противопоказан тяжелый физический труд, нервно-психическое напряжение, работа в неблагоприятных метеорологических условиях, контакты с ионизирующим излучением и промышленными ядами.
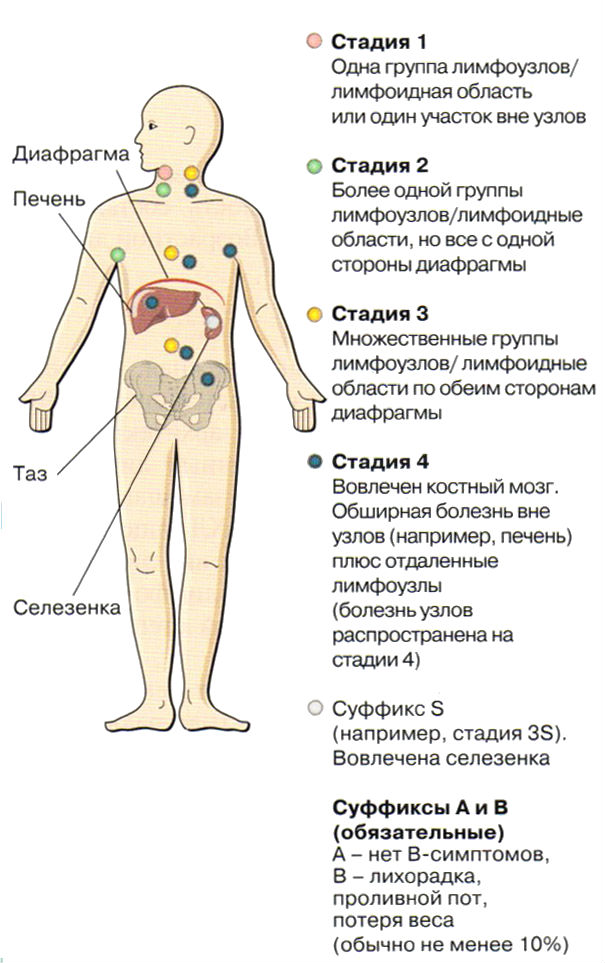
Стадии лимфом
Стадирование лимфом играет важную роль при выборе программы лечения, хотя это далеко не единственный критерий при построении лечебной тактики. Существует несколько классификаций заболевания. Одной из самых распространенных является классификация Ann Arbor, согласно которой выделяют 4 стадии онкологического процесса:
- I — вовлекается одна группа лимфатических узлов;
- II — две и более групп, если они расположены с одной стороны диафрагмы;
- III — распространение за диафрагму;
- IV — вовлечение внутренних органов, например кишечника или костного мозга.
Вместе с номером стадии используется буквенное обозначение особенностей заболевания:
- А — бессимптомное течение;
- B — B-симптомы: температура, ночные поты и снижение массы тела;
- S — вовлечение селезенки;
- E — вовлечение тканей, лежащих рядом с пораженными лимфоузлами.
Таким образом, под обозначением IIISB следует понимать лимфому, при которой страдают лимфоузлы с обеих сторон диафрагмы с повреждением селезенки и типичными В-симптомами заболевания. 2
Диагностика лимфом
Единственным методом, позволяющим достоверно поставить диагноз, является микроскопия лимфоидной ткани, которую получают при биопсии. В полученном гистологическом материале обнаруживают атипичные клетки, после чего уточняется о какой из лимфом идет речь в конкретном случае. Так для диагностики лимфогранулематоза в материале достаточно обнаружить клетки Штернберга-Рида или клетки Ходжкина.
Для оценки распространенности процесса и стадирования применяется лучевая диагностика: КТ, МРТ, ПЭТ-КТ. Для оценки вовлеченности костного мозга показана трепанобиопсия, при жалобах на боли в костях — остеосцинтиграфия, а сцинтиграфия с цитратом галлия, который избирательно накапливается в лимфоидной ткани, помогает в обнаружении скрытых очагов. Применяются также биохимический и клинический анализы крови, иммунологическое и цитогенетическое исследования, спинномозговая пункция, УЗИ и некоторые другие процедуры.
Лечение лимфом
Лимфомы — обширная группа болезней, и какие-либо универсальные схемы лечения при них неприменимы. Даже цели лечения сильно зависят от вида лимфомы и особенностей ее течения: полное выздоровление или достижение стойкой ремиссии. Следует отметить, что в большинстве случаев, даже если невозможно полностью избавиться от болезни, то вполне реально держать ее под контролем, а ремиссия при некоторых видах лимфом и адекватном лечении достигает 10-20 лет, что вполне сравнимо с выздоровлением. Основными методами лечения сегодня являются химиотерапия, радиологическое лечение и иммунотерапия.
Основная задача химиотерапии заключается в уничтожении опухолевых клеток. При этом используются как проверенные препараты, так и современные перспективные препараты, а также их комбинации. Химиотерапия применима на всех стадиях заболевания, и при большинстве видов лимфом является основным методом лечения.
Лучевая терапия, как правило, применяется после завершения химиотерапии, однако в некоторых случаях применяется самостоятельно. Учитывая высокую радиочувствительность лимфом, лучевая терапия может приводить к полному излечению, даже при использовании относительно небольших доз радиации. Особенности применения определяются морфологией опухоли и стадией процесса. На первой и второй стадиях лимфом облучаются все пораженные зоны, на третьей и четвертой могут облучаться остаточные после химиотерапии или исходно крупные узлы.
Иммунная терапия — перспективное направление лечения онкологических заболеваний, которое подразумевает использование иммунных механизмов организма или их замещение. Лимфоциты производят антитела — специальные белки, которые связываются строго с определенными антигенами — чужеродными веществами. Такими антигенами являются и опухолевые клетки. В большинстве атипичных клеток пациентов с лимфомой встречается белок CD20. Препарат, созданный из антител к этому белку — Ритуксимаб, находит на клетках опухоли молекулу CD20 и атакует ее, уничтожая клетку. Примерно также работает алемтузумаб, направленный против антигена CD52. Воздействовать на антигены можно не только антителами. Например, при применении ибритумомаба тиуксетана CD20 атакуют молекулы радиоактивного вещества — итрия. Это позволяет подавать дозу радиации строго к определенным клеткам.
Современные методы лечения позволяют достаточно оптимистично оценивать прогноз для жизни пациента. При болезни Ходжкина, пятилетнего выживания без симптомов болезни удается добиться у более 80% взрослых и свыше 95% детей. Для неходжкинских лимфов эти цифры составляют 63% и 83% соответственно. 3
Часто задаваемые вопросы
Сколько стоит курс лечения?
Курс лечения вместе с предлучевой подготовкой стоит 258 000 рублей. Есть возможность оформления рассрочки на весь период лечения.
Есть ли онлайн-консультация?
Для жителей других регионов, а также для тех, кому визит к врачу затруднителен, наш центр предоставляет возможность бесплатной онлайн - консультации.
Документы, которые необходимы для получения онлайн-консультации?
Для получения консультации о возможности получения томотерапии, вам необходимо направить нам все имеющиеся у вас медицинские выписки и обследования, включая гистологическое заключение. Направление на бесплатную консультацию не требуется.
Возможно ли лечение детей?
Томотерапия наиболее благоприятна для лечения детей, так как лучевая терапия проходит щадящим методом, не задевая здоровые органы и ткани развивающегося ребенка.
На какой стадии можно применять лучевую терапию?
В современной онкологии возможности лучевой терапии применяются очень широко на любой стадии. Однако каждому пациенту требуется индивидуальный подход, так как выбор тактики и плана лечения зависит от многих факторов: расположения опухоли, сопутствующих заболеваний, возраста и общего состояния пациента. Поэтому для получения информации о возможности лечения, необходимо получить консультацию врача-радиотерапевта.


Химиотерапия при лимфоме — это спасение жизни, которую иными способами сохранить не удастся. Конечно лекарства не обещают 100% радикальности, как операция при раке, но вместе с облучением это единственно возможное и эффективное лечение. Проблема в том, что лимфомы способны изменяться, что обещает рецидивы и независимость от терапии.
- Как проходит химиотерапия при лимфоме
- Химиотерапия при лимфоме Ходжкина
- Химиотерапия при неходжкинских лимфомах
- Возможные осложнения после химиотерапии при лимфоме
- Методы химиотерапии при лимфоме
- Противопоказания к применению химиотерапии при лимфоме
- Препараты, применяемые при химиотерапии
- Рацион и диета при химиотерапии при лимфоме
- Прогнозы для пациентов
Как проходит химиотерапия при лимфоме
При подавляющем большинстве злокачественных лимфом или лимфосарком химиотерапия подаётся на первое-второе и на третье, при некоторых клеточных вариантах после первой линии дополняется лучевой терапией в скромных, по сравнению с раковыми заболеваниями, дозах.
Роль облучения — поддержка достигнутого результата и дополнение его позитивом. Сегодня полностью отошли от радикальной программы лучевой терапии, несколько десятилетий доминировавшей при лимфоме Ходжкина, отказавшись от профилактического облучения не поражённых опухоль лимфоколлекторов. Из профилактического — только введение цитостатиков в спинномозговую жидкость, уменьшающее вероятность злокачественного поражения головного мозга и его оболочек.
Сегодняшнее противоопухолевое лечение лимфом отобрало самые результативные комбинации, учитывающие иммуногистохимические характеристики злокачественных клеток. Для каждого прогностического варианта определено оптимальное число циклов, возраст больного и его хронические болезни уже не противопоказание для активного лечения, потому что созданы лекарственные комбинации на все случаи болезни, тем не менее, ограничения по применению цитостатиков включены в стандарты.
Химиотерапия используется всегда, когда в ней есть необходимость и нет абсолютных противопоказаний. На выборе схемы лечения сказываются не только клеточный вариант и прогностические характеристики лимфомы, распространённость болезни по данным ПЭТ-КТ, но и исходное состояние здоровья пациента.
Химиотерапия при лимфоме Ходжкина
Лимфома Ходжкина (или по-старому лимфогранулематоз) — одно из самых благоприятно текущих заболеваний лимфоидной ткани. Ходжкинская лимфома входит в ограниченное число болезней, излечиваемых только одной химиотерапией, но важная ремарка: диагностированная на ранней стадии и с признаками благоприятного течения. Прогноз ожидается малооблачным при небольшом поражении — не более двух групп лимфоузлов в верхней или нижней половине тела — по одну сторону диафрагмы, лучше без вовлечения лимфоузлов средостения и с исходными нормальными клиническими и биохимическими анализами крови.
Каждого пациента после первичного обследования относят к трём основным группам, по стандартам которых будет проводится противоопухолевое лечение, во всех случаях на первом этапе проводится химиотерапия, затем результат закрепляется трёхнедельным облучением зон поражения.
Число курсов зависит от исходного поражения и прогноза, в лучшем случае при лимфоме I-II стадии предложат от 2 до 4 циклов четырёхкомпонентной схемы. При том же объёме поражения, но худших прогностических факторах, потребуется 4-6 курсов. Для повышения результативности первых два цикла у сохранных молодых пациентов заменяют на 6-компонентную схему, затем проводят 2 стандартных ABVD и можно уходить на облучение.
Распространенные стадии не обещают хорошего прогноза, поэтому химиотерапия длительная и многокомпонентная. Причём сколько циклов потребуется — 6 или 8, определят по результатам первых 4 циклов: если опухоль полностью ушла и ПЭТ это покажет — предложат пройти только два цикла, затем назначается трёх-четырёхнедельное облучение. При незначительном эффекте — 8 циклов и лучевая терапия на пораженные лимфоузлы.
У пожилых пациентов, в популяции это каждый третий больной, лечение выбирается с учетом хронической патологии. Так у курильщиков и страдающих болезнями легких в комбинацию не включают блеомицетин, накапливающийся в легочной ткани и вызывающий специфическое воспаление. При сердечной патологии кардиотоксичные антрациклины заменяют на другие противоопухолевые антибиотики.
Лимфома Ходжкина чувствительна к множеству цитостатиков, что позволяет найти оптимальную комбинацию, вплоть до применения одного-единственного цитостатика.
Химиотерапия при неходжкинских лимфомах
Неходжкинские лимфомы представлены множеством морфологических видов, каждый с особенностями течения и лечения. Разберём самые частые варианты заболевания.
Самая благоприятная по течению фолликулярная лимфома встречается в каждом пятом случае злокачественных лимфом у взрослых. В самом начале процесса без явных признаков активности не всегда требуется безотлагательная химиотерапия, у некоторых пациентов прогноз настолько неплох, что можно ограничиться облучением лимфомы либо длительным наблюдением с тщательным мониторингом анализов и регулярным обследованием каждые 3 месяца.
Сразу ХТ начинается только при вовлечении в злокачественный процесс любых органов или при поражении не менее трёх лимфатических зон с размером узлов более 3 сантиметров, или при лихорадке с потливостью, или при плохих показателях крови.
Оптимальный режим — R-CHOP, сочетающий сравнительно мягкие в плане осложнений алкилирующие цитостатики с иммунным препаратом ритуксимабом. Это моноклональное антитело при начальном и прогностически благоприятном процессе используют без ХТ — в монорежиме внутривенно, подкожно каждые 8 недель в течение двух лет применяют для поддержания позитивного результата после завершения циклов.
Вопрос о высокодозной химиотерапии с пересадкой костного мозга ставится при рецидиве или переходе фолликулярной лимфомы в более агрессивную, вероятность чего возрастает с течением времени, так через 10 лет переход в диффузную В-крупноклеточную лимфому отмечается у каждого шестого, а через 15 лет — у каждого второго. По истечении полутора десятилетий после первичного лечения частота рецидивов лимфомы сходит на нет.
У каждого третьего первичного пациента с лимфомой выявляют диффузную крупноклеточную В-клеточную лимфому (ДВКЛ), ежегодно её диагностируют только у пяти из каждых ста тысяч россиян.

Стандарт химиотерапии при неагрессивном варианте ДВКЛ, позволяющий 80% больных прожить дольше пятилетки — 6 циклов комбинации CHOP с ритуксимабом. При полном уничтожении новообразований в результате лекарственного воздействия, возможно подключение лучевой терапии в обычной для лимфом дозе 30-36 грей, а при остаточных опухолевых очагах дозу облучения доводят до 36-40 Грей.
Аналогичная комбинация цитостатиков с иммунным препаратом неважно работает при агрессивном варианте и большом распространении, поэтому химиотерапию усугубляют уменьшением интервалов между циклами R-CHOP или переводят на многокомпонентные комбинации.
При неблагоприятном прогнозе всем пациентам уже на первой линии проводится профилактика поражения головного мозга — введение высоких дох метотрексата и цитарабина в спинномозговую жидкость.
После завершения основной программы поддерживающая химиотерапия не проводится из-за не столь хорошей чувствительности опухолевых клеток к лекарствам. При рецидиве крупноклеточной лимфомы прибегают к комбинациям 2-й линии и трансплантации стволовых клеток крови после высокодозной ХТ.
Периферическая Т-клеточная лимфома — каждый четвёртый случай злокачественного поражения Т-клеточного ростка кроветворения или каждая шестая лимфома. Морфологически группа представлена разнообразными клеточными вариантами. Агрессивно текущее заболевание, как правило, вовлекает не только лимфатические узлы, но и другие органы.
В первой линии используют традиционный CHOP, но в редких случаях удается отказаться от ВДХТ с аутологичной трансплантацией клеток костного мозга. Некоторые виды лимфом благоприятного течения отзываются на облучение и L-аспарагиназу. При отсутствии эффекта лечение подбирается индивидуально.
Лимфомы одного названия предполагают множество различных морфологических вариантов заболевания, внутри групп клетки различаются ИГХ-характеристиками, предполагающими возможности индивидуального подбора противоопухолевого лечения, поэтому специалисты нашей Клиники могут предложить не один-два стандарта, а десятки комбинаций ХТ.
Возможные осложнения после химиотерапии при лимфоме
Тошноту и рвоту уменьшает включение в схемы глюкокортикоидных гормонов. Многокомпонентные комбинации обязательно предваряются введением антиэметиков , приём которых продолжается после завершения терапии.
Для профилактики нейтропении через сутки после цитостатика вводят стимулятор КСФ, что помогает не снижать следующую дозу и не увеличивать интервал без лечения.
Повреждение миокарда характерно для антрациклинов, облучение средостения дополнительно увеличивает кардиотоксичность. Осложнение может проявиться через несколько лет, профилактика не разработана, поэтому у страдающих сердечно-сосудистыми болезнями из схемы исключают антрациклины.
При чувствительности к ХТ и большом распространении лимфомы возможно развитие синдрома лизиса опухоли (СЛО), когда вышедшие из погибшие опухолевых клеток вещества отравляют организм, приводя к почечной недостаточности и гиперкалиемии с фатальной аритмией. Индуцированный лекарствами распад опухоли научились предотвращать.
При пересадке донорского костного мозга высока вероятность отторжения — реакция трансплантат-против-хозяина. При высокодозной терапии отдается предпочтение пересадке собственных клеток даже при угрозе рецидива лимфомы. Рецидив можно вылечить, отторжение трансплантата фатально для пациента.
Методы химиотерапии при лимфоме
Пациент получает лечение всеми способами, кроме внутримышечных инъекций из-за раздражающего действия цитостатиков и опасности осложнений со стороны мягких тканей.
Большинство цитостатиков вводится внутривенно струйно — болюсно или капельно.
Частый компонент схем — преднизолон принимается в таблетках, цитостатик прокарбазин — в капсулах.

Ритуксимаб применяется внутривенно и подкожно, подкожные инъекции удобны для поддержки.
Профилактика нейролейкемии проводится интратекально — введением препарата в спинномозговой канал, потому что организм специальным гематоэнцефалическим барьером защищает головной мозг от проникновения лекарства в крови.
Противопоказания к применению химиотерапии при лимфоме
Абсолютные противопоказания к ХТ при лимфомах — только декомпенсация других хронических заболеваний с существенным снижением функции органов.
Препараты, применяемые при химиотерапии
При лимфомах применяется почти два с половиной десятка противоопухолевых препаратов, из которых составляют несколько десятков схем. Можно пересчитать по пальцам цитостатики, не используемые при лимфосаркомах.
Рацион и диета при химиотерапии при лимфоме
Прогнозы для пациентов
Эффективность лечения оценивают в середине программы и по её окончании, причём оптимально ПЭТ-КТ обследование.
На прогнозе сказывается очень много факторов, для каждого заболевания разработан свой прогностический индекс, поэтому и в диагнозе обязательно указывают прогностическую группу.
В конечном итоге перспективы на дальнейшую жизнь определяет результат химиотерапии и скорость развития рецидива.
Каждому хочется знать — что ждёт впереди, при злокачественном процессе важнее — как лечат и где лечат, потому что без современного обследования невозможно подобрать оптимальную терапию. В Европейской клинике всё проходит на очень высоком уровне, вы можете лично убедиться в этом.
Демина Елена Андреевна1, Леонтьева А. А.1, Рябухина Ю.Е.1, Тумян Г.С.1, Трофимова О.П.1, Сотников В.М.2, Ларионова В.Б.1, Парамонова Е.В.1, Манзюк Л.В.1, Мухортова О.В.3, Асланиди И.П.3, Зайцева А.Ю.4, Радкевич Л.А.4, Рудас М.С.5, Манукова В.А.5, Османов. Е.А.1
2. ФГБУ РНЦРР МЗ РФ, Москва
3. ФГБУ НЦССХ им.А.Н.Бакулева МЗ РФ, Москва
История лечения лимфомы Ходжкина начинается в 1902 году, когда W.A. Pussey впервые успешно применил Х-излучение [1]. В 1925 году R. Gilbert заложил основы радикальной лучевой терапии, предложив облучать не только пораженные лимфатические узлы, но и зоны сопредельных лимфатических коллекторов [2]. Спустя 25 лет, в 1950 году его ученица, V. Peters подтвердила правильность такого подхода, опубликовав результаты применения этой методики у 113 пациентов с локализованной I стадией ЛХ: 10-летняя выживаемость составила 79%, что дало возможность говорить о потенциальной курабельности этого заболевания [3]. Кардинальные изменения в ЛТ опухолей произошли после внедрения в клиническую практику новых терапевтических установок (линейных ускорителей). Это позволило выработать новые методики облучения глубоко расположенных областей и уменьшить лучевую нагрузку на здоровые ткани. Впервые эти установки применил H.S. Kaplan [4]. Он внедрил в практику методику крупнопольного облучения и изготовление индивидуальных сфокусированных защитных блоков. Совместно с Saul Rosenberg H. Kaplan определил оптимальную суммарную очаговую дозу (СОД) лучевой терапии 40-44 Гр для ЛХ, а также сформулировал концепцию поэтапного облучения всехлимфатических коллекторов - радикальную лучевую терапию (РЛТ) [4]. Методика РЛТ позволила получать стабильные результаты лечения - 20-летняя общая выживаемость больных ЛХ с локальными стадиями (IA, IIA), получавших ЛТ в Stanford, составила 68%, безрецидивная – 75% [4,5]. Однако в группе больных с III стадией летальность по-прежнему оставалась такой же высокой, как и ранее, а при IV стадии применение РЛТ оказалось бесперспективным [5]. До середины 60-х годов ХХ века РЛЛ оставалась единственным методом лечения ЛХ и до 80-х годов являлась стандартом терапии для больных с локализованными стадиями ЛХ. С середины 60-х годов в течение десятилетия были разработаны и внедрены в практику две самые известные схемы химиотерапии МОРР и ABVD, которые показали возможность излечения при любых стадиях ЛХ [7,8,9]. Успешное применение химиотерапии и сообщения о повышении частоты вторых опухолей и сердечно-сосудистых заболеваний, связанных с ЛТ у долгоживущих больных ЛХ привело к уменьшению использования ЛТ и попыткам комбинирования её с химиотерапией. В середине 70-х годов L. Prosnitz предложил начинать лечение генерализованных стадий ЛХ с химиотерапии и комбинировать её с ЛТ, что позволило значительно уменьшить поля облучения: от расширенного поля облучения (extended field) до размеров пораженного лимфомой поля (involved field), а так же снизить суммарную дозу облучения до 30-36Гр [10]. Осознание того, что повысить эффективность лечения может разумное применение более низких доз ЛТ и сокращение полей до облучения только вовлеченных лимфатических узлов (involved node) в сочетании с уменьшением объема химиотерапии привело к усовершенствованию программ комбинированной терапии [11]. Несколько крупных рандомизированных исследований выявили преимущество комбинированного химиолучевого лечения перед радикальной лучевой терапией [12,13]. С конца 80-х годов комбинированная химиолучевая терапия стала приоритетным методом лечения для абсолютного большинства больных ЛХ с любой стадией заболевания, показав потенциально более высокую эффективность сочетания химио и лучевой терапии и доказала возможность излечения для большинства больных ЛХ: 10-20 лет без рецидива проживают 70-90 % из них 15. Лимфома Ходжкина стала одним из первых заболеваний при котором была доказана возможность излечения абсолютного большинства больных, но она первой же выявила и новую проблему - проблему осложнений лечения. Молодой возраст основного контингента больных и полученная возможность прожить столь же долгую жизнь, как и у сверстников, заставили обратить внимание на качество жизни излеченных больных. ЛХ оказалась первым онкологическим заболеванием, при котором стала обсуждаться необходимость сохранения детородной функции и возможность беременности и родов. Длительные, 20–30-летние наблюдения за больными выявили такие грозные поздние осложнения лечения, как вторые опухоли, инфаркты миокарда, инфекции, приводящие к преждевременной гибели излеченных больных. Облучение лимфатических коллекторов выше диафрагмы у женщин в возрасте до 20 лет почти в 20 раз повышает частоту развития рака молочной железы по сравнению с популяционной [18]. По данным Бостонского онкологического института при длительном наблюдении (медиана 14,6 лет) относительный риск кардиальных осложнений оказался в 20 раз выше у больных, получивших комбинированное химио-лучевое лечение с антрациклин-содержащими схемами по сравнению с больными, получившими только аналогичную химиотерапию [19]. Все эти осложнения дали импульс к поиску новых вариантов лечения ЛХ высокоэффективных, но не повреждающих нормальные ткани.
К середине 2000 годов было показано, что 90-95% больных с ранними стадиями ЛХ и благоприятным прогнозом можно вылечить с использованием минимального объема терапии – два цикла ABVD с последующей лучевой терапией небольшим полем [20]. В большом Канадском исследовании с длительным сроком наблюдения (медиана 11,3 года) было проведено сравнение эффективности и токсичности одной полихимиотерапии по схеме ABVD (4-6 циклов) с комбинированной терапией ABVD + ЛТ на зоны исходного поражения. Контроль над болезнью оказался лучше в группе, получившей ЛТ: выживаемость без прогрессирования (ВБП) 92% против 87% в группе ABVD (р=0,01), но общая выживаемость (ОВ) была выше в группе больных, получивших только химиотерапию 94% против 87% (p=0,04) - за счет меньшего числа летальных исходов от второй опухоли и кардиальных осложнений, что обеспечило лучшее качество жизни больным, не получившим ЛТ [21]. Одинаково высокая ОВ в этих двух исследованиях и небольшое число рецидивов в группе больных, получивших только ABVD, по мнению авторов этого исследования, свидетельствует о том, что большая часть больных (около 80%) получили лучевую терапию напрасно, так как были вылечены одной только химиотерапией.
В последнее десятилетие начался следующий этап поиска оптимального лечения ЛХ столь же эффективного, но менее токсичного. Успешная реализация этого поиска во многом зависит от точности определения распространенности опухоли, поскольку ЛТ метод местного воздействия, а также возможности коррекции лечения по результатам ответа на первые циклы химиотерапии. Инструментом для достижения такой цели стала позитронно-эмиссионная томография (ПЭТ).
Британское рандомизированное исследование III фазы RAPID было призвано ответить на вопрос о возможности коррекции терапии ЛХ по данным ПЭТ [22]. В этом исследовании ПЭТ выполнялась после трех циклов ABVD у больных с IA/IIA стадиями ЛХ без массивного поражения средостения. Если результаты ПЭТ были позитивными, проводился 4-й цикл ABVD и облучение исходных зон поражения. Больные с негативными результатами ПЭТ (420 пациентов) рандомизировались на 2 группы, одна из которых не получала больше лечения, а в другой группе проводилось облучение зон исходного поражения. После достижения медианы наблюдения в 60 месяцев в группе больных, рандомизированных на проведение ЛТ, прогрессирование было констатировано у 8 больных; умерли 8 больных, но 5 из этих 8 больных не получили ЛТ. В группе без ЛТ прогрессирование отмечено у 20 больных и 4 больных умерли. Трехлетняя ВБП составила соответственно 94.6% и 90.8% в группах с ЛТ и без неё. Тем не менее, авторы полагают, что результаты исследования RAPID свидетельствуют об одинаково хорошей эффективности лечения при отрицательных результатах ПЭТ после химиотерапии как при проведении консолидации лучевой терапией, так и без неё. Эти результаты дают возможность выработать более индивидуальный подход к лечению ранних стадий ЛХ. Для больных, у которых риск терапии второй линии может оказаться высоким или её проведение невозможной в силу возраста или сопутствующих заболеваний, контроль над ЛХ имеет первостепенное значение, и современная комбинированная терапия остается лучшим выбором. Для остальных больных, особенно молодых, токсичность ЛТ вызывает большое беспокойство, а три цикла ABVD при негативных данных ПЭТ дают хороший шанс на выздоровление без риска индуцированной ЛТ второй опухоли или сердечно-сосудистых заболеваний при условии осуществления регулярного наблюдения.
Одновременно другая исследовательская группа EORTC/LYSA в H10 протоколе также оценила эффективность ПЭТ-адаптированной терапии у больных с IA/IIA стадиями ЛХ [23]. Больные с благоприятным (протокол H10F) или неблагоприятными (протокол H10U) прогнозом были рандомизированы между стандартным лечением (ABVD + ЛТ на зоны исходного поражения) и лечением, основанным на результатах ПЭТ после двух циклов ABVD. Больные с ПЭТ негативными результатами после двух циклов ABVD (ПЭТ-2) получали дополнительно 2 (H10F) или четыре (H10U) цикла ABVD, а при ПЭТ-2 позитивных результатах терапия интенсифицировалась до ВЕАСОРРэск с последующим облучением зон исходного поражения. Промежуточный анализ результатов был проведен при достижении медианы наблюдения в 1,1 год и показал, что в протоколе H10F ВБП в течение года (1-ВБП) достигла 100% в группе, получившей химиотерапию по схеме ABVD + ЛТ на зоны исходного поражения. В группе, получившей только химиотерапию по схеме ABVD, 1-ВБП оказалась значимо хуже и составила лишь 94,9% (р=0,017). Анализ, проведенный в исследовании H10U показал аналогичные результаты: 1-ВБП составила 97,3% против 94,7% в группах, получавших и не получавших ЛТ соответственно, р=0,026. На основании этого статистического анализа авторы пришли к выводу о недостаточности одной только химиотерапии такого объема для лечения больных с ранними стадиями ЛХ, и исследование было остановлено.
Однако можно утверждать, что оба исследования и H10 (EORTC/LYSA) и RAPID показали аналогичные результаты: лучевая терапия после химиотерапии улучшает результаты ВБП по сравнению с одной только химиотерапией, но за счет облучения всех больных с негативными результатами ПЭТ, при этом большинство из них уже вылечены. Очевидно, для полной оценки этой стратегии потребуется длительное наблюдение и изучение причин смерти, но, как указал Мейер и его коллеги, это станет обязательным требованием в будущих исследованиях по лечению локализованных стадий ЛХ [21]. Таким образом, комбинированное химиолучевое лечение, включающее небольшое число циклов химиотерапии (преимущественно ABVD) с последующим облучением остаточных исходно пораженных лимфатических узлов минимальным полем сегодня остается стандартом лечения больных с ранними стадиями ЛХ.
Создание и распространение программ комбинированного лечения для распространенных стадий ЛХ за последние десятилетия преобразовало мнение об инкурабельности этой группы больных в осознание возможности излечения большинства [24,25]. Использование схемы ABVD с последующим локальным облучением резидуальной опухоли стало стандартом терапии первой линии [26]. Однако, роль лучевой терапии при современном лечении распространенных стадий ЛХ остается дискуссионной и зависит от эффективности предшествующей химиотерапии, что показало рандомизированное исследование EORTC - лучевая консолидация не улучшила результаты лечения больных в полной ремиссии ЛХ, получивших 6 или 8 циклов ABVD, но потенциально улучшила эффективность лечения у больных с частичной ремиссией [27,28].
В таком случае, какие критерии могут определить группу больных, которым необходима лучевая консолидация? Несколько исследований показали, что при положительных данных ПЭТ после химиотерапии рецидивы наступают у 45-75% больных, если дополнительно не проводилась лучевая терапия 30. Однако частота рецидивов снижается до 10-20%, если лучевая консолидация была выполнена [32,33]. На основании этих данных GHSG провела рандомизированное исследование HD15, в котором после 6 или 8 циклов ВЕАСОРР-эск и 8 циклов ВЕАСОРР-14 консолидирующая лучевая терапия проводилась только больным с частичной ремиссией (ЧР) и позитивными результатами ПЭТ. При сравнении 5-летней ВБП двух групп больных, не получавших лучевой консолидации (группа с полной ремиссией и группа с ЧР и негативным результатами ПЭТ), различия в ВБП выявлено не было – по 92,6% в каждой группе. Выживаемость без прогрессирования в группе больных, которым проводилась лучевая консолидация после ПЭТ-позитивной ЧР – всего 11% пациентов - оказалась статистически значимо ниже: 86,2%, р=0,022 [34]. Единственным недостатком этого, наиболее крупного исследования является короткий срок наблюдения.
Большим числом исследований показано, что негативные результаты ПЭТ после окончания лечения являются наиболее весомым благоприятным прогностическим фактором, однако M. Magagnoli с соавторами показали, что даже при негативных результатах ПЭТ размеры остаточной опухоли более 4см снижают 4-летнюю ВБП с 82% до 52% [35].
Данные Gallamini A. о высоком прогностическом значении ПЭТ после 2-го цикла полихимиотерапии (ПЭТ-2) у больных с распространенными стадиями ЛХ инициировали целую серию исследований по коррекции лечения в соответствии с результатами ПЭТ-2 [36]. Результаты большинства этих исследований еще не опубликованы, поэтому выявить группу больных, у которых отказ от лучевой консолидации не повлияет на эффективность лечения, пока не представляется возможным, так как, кроме непосредственных результатов необходимы и более длительные сроки наблюдения.
Негативные результаты ПЭТ констатированы у 52 больных, а у 9 больных результаты были расценены, как позитивные. Четырехлетняя выживаемость до прогрессирования при отрицательных данных ПЭТ составила 93,8%, а в случаях высокой или остаточной метаболической активности опухоли – 44,4%, р=0,002.
ПЭТ-2 была выполнена у 36 больных и оказалась негативной у 25(69,4%), позитивной - у 11(30,6%) больных. Четырехлетняя ВБП в группе с негативными результатами промежуточной ПЭТ составила 100%, а в группе больных с накоплением FDG оказалась хуже - 81,8%, р=0,032.
Так как в литературе обсуждается вопрос о влиянии размеров остаточной опухоли на длительность ремиссии, был проведен анализ ВБП у 52 больных с негативными результатами ПЭТ. После окончания лечения размеры остаточной опухоли превышали 4,5 см у 14 больных и были меньших размеров у 38 больных. В группе больных с негативными результатами ПЭТ и размерами остаточной опухоли менее 4,5см рецидивы не констатированы и ВБП составила 100%. В группе больных с негативными результатами ПЭТ и размерами остаточной опухоли более 4,5см у 1 больного выявлено прогрессирование ЛХ и у 2 больных – рецидив, 3-летняя ВБП оказалась статистически значимо хуже и составила 87,5%, а 4-летняя - 42,9%, р=0,013.
Консолидирующая лучевая терапия выполнена у 65 больных и у 18 больных лучевая терапия не проводилась, рецидив констатирован у 1 больного в каждой группе и различия в ВБП выявлено не было: 4-летняя ВБП составила 93,3% в группе больных без ЛТ и 88,9% в группе, получившей ЛТ, р=0.177.
Небольшая численность групп, позволяет сделать лишь предварительные выводы о прогностической значимости промежуточной ПЭТ у больных с распространенными стадиями лимфомы Ходжкина, получивших интенсивную химиотерапию первой линии по схеме ЕАСОРР-14. Однако соответствие результатов данным GHSG полученным при интенсивном лечении большой группы больных ЛХ, подтверждает преимущество ранней интенсификации терапии для больных с распространенными стадиями ЛХ.
Результаты проведенного исследования подтвердили правомерность обсуждения вопроса об отказе от лучевой терапии у больных с распространенными стадиями ЛХ при проведении интенсифицированной химиотерапии ЕАСОРР-14, возможно, в первую очередь в группе больных с негативными результатами ПЭТ и при небольших размерах остаточной опухоли. Такая тактика позволит избежать целого ряда поздних осложнений лечения. Однако у больных с негативными результатами ПЭТ и значительными размерами остаточной опухоли отказ от консолидирующей лучевой терапии преждевременен. Необходимо более длительное наблюдение в большой группе больных.
Статья добавлена 28 апреля 2016 г.
Читайте также:

