При канцерогенезе рака почки
Риски возникновения онкологических заболеваний
Процесс канцерогенеза можно представить следующим образом. В организме в результате воздействия на него физических агентов, химических факторов, психологического стресса, гормональных влияний, вирусов нарушается нормальное функционирование клетки.
Происходит перенапряжение клеточных систем, их частичное разрушение и повреждение.
В результате возникших изменений включаются механизмы восстановления клетки или система самоуничтожения, если повреждения настолько сильны, что восстановить их невозможно.
Но при избыточном действии какого-либо фактора, или при других нарушениях этих механизмов происходит накопление нарушений в структуре клетки, в первую очередь в генетическом материале.
Это ведет к патологической работе клетки, накапливаются новые нарушения и таким образом формируется порочный круг, который в заключении и приводит к образованию злокачественной клетки, таким образом процесс канцерогенеза завершается.
Каждая опухолевая клетка характеризуется определенным комплексом нарушений на различных уровнях – генном, хромосомном, клеточном, геномном.
В канцерогенезе играют роль три основных класса генов:
- онкогены,
- антионкогены,
- гены-эффекторы.
Онкогены в процессе канцерогенеза запускают и регулирую жизнедеятельность злокачественной клетки и отвечают за ее независимый рост. Онкогены изучены достаточно детально, функции десятков из них описаны в литературе.
Антионкогены, наоборот, менее изучены. Есть много сообщений о том, что в опухолевых клетках нарушена их работа вследствие различных мутаций.
В последнее время онкологи значительное внимание уделяют исследованию такого аспекта канцерогенеза, как выключение запрограммированной гибели клетки (апоптоза). Обнаружены конкретные гены, отвечающие за апоптоз, в раковых клетках их работа заблокирована.
Нарушение правильной работы генетического материала и его перепрограммирование в процессе канцерогенеза ведет также и к появлению таких признаков злокачественного роста, как неконтролируемый рост и способность к метастазированию.
Формирование метастазов - это поздний этап канцерогенеза, он включает в себя миграцию раковых клеток по кровеносным и лимфатическим сосудам, прикрепление к стенке сосуда в органе-мишени, выход в ткань с образованием метастатического очага и прорастанием в метастаз новых сосудов (неоангиогенез). Для проникновения в здоровую ткань раковая клетка выделяет вещества, которые разрушает межклеточные структуры и дают возможность проникнуть сквозь слой здоровых клеток.
На пути раковых клеток стоят две защитные системы, которые препятствуют канцерогенезу. Первая – физическое уничтожение раковых клеток, вторая – блокирование жизненно важных для раковой клетки процессов.
Первый вариант осуществляется специальным видом лимфоцитов, которые носят название натуральных киллеров; их основная функция – уничтожение любых чужеродных клеток, это происходит с помощью интерферонов и интерлейкинов.
В природе существует несколько миллионов природных и синтезированных человеком химических веществ и соединений. Человек активно контактирует с десятками тысяч. Среди множества химических агентов, несомненно, канцерогенными признаны несколько десятков. Они присутствуют в окружающей среде, выделяются в процессе промышленного производства или являются продуктами жизнедеятельности живых организмов.
Химические канцерогены могут оказывать свое действие сами по себе (так называемые прямые канцерогены) или нуждаются для этого в активации (это происходит в процессе обмена веществ в организме человека).
Это агенты физической природы.
Наиболее широкая группа их относится к различным видам ионизирующего излучения – рентгеновские лучи, гамма лучи, различные элементарные частицы атома – протоны, нейтроны, альфа и бета частицы.
Физические канцерогены так же являются компонентом естественной среды или являются продуктом жизнедеятельности человека.
В некоторых случаях постоянное механическое травмирование тканей человека тоже может способствовать развитию злокачественной опухоли.
В начале 20 века активно развивалась и пропагандировалась инфекционная теория развития злокачественных новообразований, которая в то время была отвергнута. Во второй половине 20 века с развитием медицинской и микробиологической науки к этой проблеме вернулись вновь. Результатом исследований было открытие нескольких вирусов, способных прямо или опосредованно вызывать возникновение злокачественных опухолей как у животных, так и у человека.
Далеко не все раковые заболевания вызваны вирусами. Но связь их с некоторыми формами опухолей несомненна. Так, рак шейки матки ассоциирован с заражением вирусом папилломы человека (ВПЧ) 16 и 18 типов, вирус Эпштйен-Барра может способствовать развитию лимфом. Хроническое инфицирование вирусами гепатитов В и С (особенно!) очень часто провоцирует развитие цирроза печени с исходом в рак печени.
Таким образом, группа агентов, вызывающих развитие злокачественных опухолей весьма разнообразна по происхождению и многочисленна. Борьба с ограничением их воздействия на организм человека – основная задача первичной профилактики рака. Это достигается как усилиями самого человека (отказ от вредных привычек, правильное питание), так и государственными социально-гигиеническими мероприятиями.
Предложения клиник
FUS-абляция миомы матки в центре Нордвест
Уникальный неинвазивный метод лечения миомы в клинике Нордвест. Ведущие специалисты и профессора.
Терапия HIPEC в немецких клиниках
Терапия HIPEC - это сочетание хирургического вмешательства, гипертермии и химиотерапии. Повышенная концентрация химии без лишнего вреда организму.
Полный онкологический чек-ап в Москве
Онкоцентр "София" предлагает различные методы диагностики рака на любой стадии.
- В России
- В Израиле
- В Германии
- В Швейцарии

- Опухоли почки
- Метастазы рака почки
- Как часто и у кого встречается рак почки?
- Диагностика опухолей почек
- Лечение рака почки на разных стадиях
- Цены в Европейской онкологической клинике на лечение рака почки
Опухоли почки
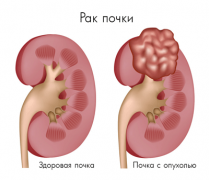
Второй характеристикой опухоли почки, как впрочем и большинства других опухолей, является потеря спецификации клетки – так как клетка быстро делится, она просто не успевает специализироваться. Таким образом, опухоль почки в первом приближении можно характеризовать, как массу клеток, бесконтрольно делящихся и потерявших способность к специализации. Чем меньше специализирована клетка опухоли для выполнения своей функции, чем быстрее она делится и чем больше его способность к распространению по кровеносным и лимфатическим сосудам, тем опухоль злокачественнее.
Почти 90 % опухолей почки злокачественны. Оставшиеся 10 процентов приходятся на ангиомиолипомы и другие, гораздо более редкие доброкачественные опухоли почки. Между тем, даже доброкачественные опухоли почки вполне могут быть опасны для здоровья. Например – ангиомиолипома может повредить сосуды почки, вызывая кровотечение. Что же касается злокачественных опухолей или рака почки, то тут мы сталкиваемся с повреждением функционирующей почечной ткани, ее сосудов и кровотечением, с метастазированием в кости, легкие, головной мозг и, соответственно, нестерпимыми болями.
Метастазы рака почки
Метастазирование — это распространение опухоли по кровеносным или лимфатическим сосудам. Опухоли, как и всему живому в организме, требуется питание, обеспечиваемое сосудами. Вот в эти сосуды и попадают 1-2 клетки из основной опухоли, которые распространяются на различные органы. Для рака почки характерно метастазирование в кости и легкие, а также в печень, надпочечники и головной мозг.
рака почки, как и основная опухоль, нарушает функцию органа, где развивается. Например, метастаз рака почки в легкие вызывает упорный кашель, метастаз в кости — страшные, изнуряющие боли, от которых помогают только сильнодействующие наркотические препараты. К сожалению, часть пациентов, обративших к врачу, уже имеют отдаленные метастазы в тех или иных органах. Это резко ухудшает прогноз течения заболевания, так как приходится бороться не с одной опухолью, а, по сути, с опухолями множеством опухолей в нескольких органах.
Как часто и у кого встречается рак почки?
Диагностика опухолей почек
При подозрении на рак почки пациенту назначают общий анализ мочи, общий и биохимический анализы крови.
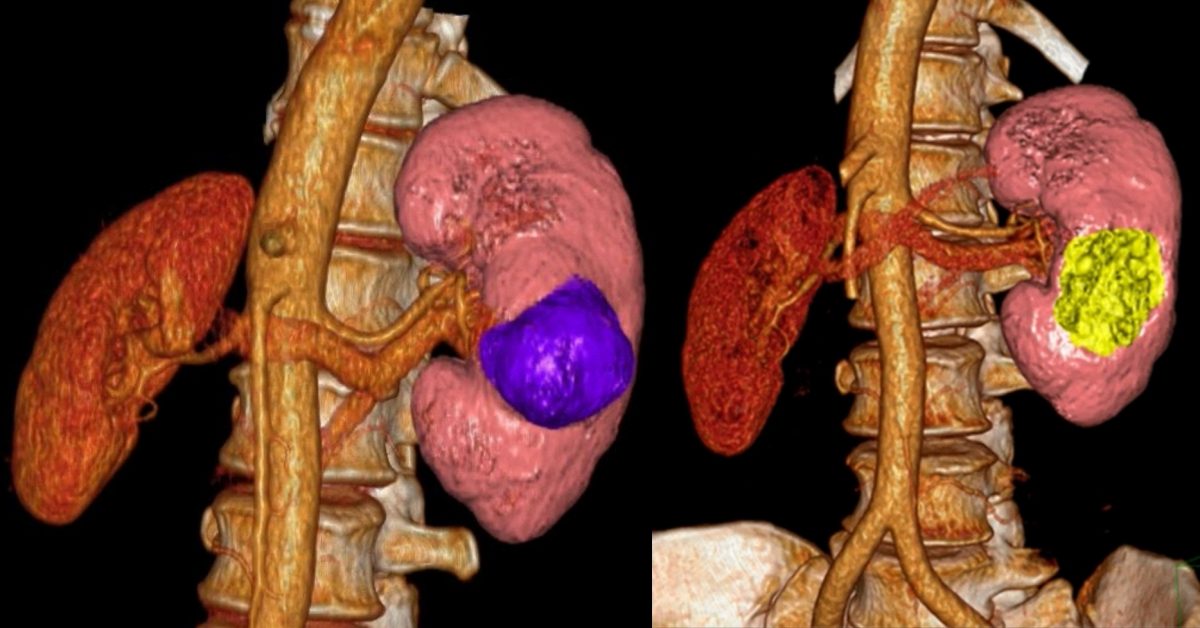
Один из наиболее информативных методов диагностики рака почки – компьютерная томография. Она помогает оценить размер, форму и локализацию злокачественного новообразования, обнаружить очаги в лимфатических узлах и других анатомических структурах за пределами почек. Исследование нередко дополняют внутривенным контрастированием. Введение контраста противопоказано при нарушении функции почек.
Магнитно-резонансную томографию применяют реже, чем КТ. Она показана, когда пациенту нельзя проводить компьютерную томографию с контрастом, если имеется подозрение на прорастание опухоли в нижнюю полую вену или другие крупные сосуды, для обнаружения метастатических очагов в головном и спинном мозге.

Ангиография – рентгенография с контрастирование сосудов, почки. Она помогает в диагностике заболевания и планировании хирургического лечения.
Позитронно-эмиссионная томография помогает обнаружить вторичные очаги рака в различных частях тела. Суть метода в том, что в организм пациента вводят вещество, которое обладает слабой радиоактивностью и накапливается в опухолевых клетках. Затем выполняют снимки с помощью специального аппарата, и на них опухолевые очаги хорошо видны.
В отличие от других онкологических заболеваний, биопсия при раке почки проводится редко. Обычно результатов других исследований хватает для того, чтобы принять решение о необходимости хирургического вмешательства. Уже после операции удаленную опухоль направляют в лабораторию, чтобы подтвердить диагноз. Биопсию проводят, если другие исследования не позволяют разобраться, показана ли операция. В случаях, когда хирургическое вмешательство противопоказано, исследование опухолевой ткани помогает определиться с тактикой лечения.
В медицине нет категоричных, стопроцентных ответов. Какова цель операции по удалению рака почки? Удалить опухоль? Удалить почку с подлежащими структурами? Удалить только первичный очаг опухоли, а потом бороться с метастазами теми или иными способами? Перенесет ли пациент операцию, каково его общее состояние? Какую именно операцию выбрать для конкретного больного? На эти вопросы должен ответить онкоуролог, перед тем, как предложить хирургическое, консервативное или комбинированное лечение. В основном, это зависит от стадии рака почки, расположения опухоли, наличия метастазов в лимфатические узлы и общего состояния здоровья пациента.

Это зависит главным образом от стадии, на которой была диагностирована опухоль, и начато лечение. Пятилетняя выживаемость (процент пациентов, оставшихся в живых спустя 5 лет) наиболее высока для I стадии и составляет 81%. На II и III стадиях она, соответственно, составляет 74 и 53%. При IV стадии — 8%.
Стадия рака почки зависит от размеров и расположения опухоли. Так, рак почки первой стадии — это опухоль меньше 7 см, не выходящая за пределы почки. Рак почки второй стадии — это опухоль меньше 10 см, также не выходящая за пределы почки. А вот рак почки третьей стадии — это уже опухоль любых размеров, ограниченная почкой, либо повреждающая надпочечник, почечную вену, но имеющую метастаз в ближайших лимфатических узлах. Рак почки четвертой стадии может быть любых размеров, однако при этой стадии опухоль либо выходит за пределы почечной фасции, либо имеются больше одного метастаза в ближайших лимфатических узлах, либо имеются метастазы в легкие, кости, печень или головной мозг.
Стадию рака почки определяют в соответствии с международной классификацией TNM. Рядом с каждой из трех букв аббревиатуры указывают индекс, описывающий характеристики первичной опухоли (T), поражение регионарных лимфатических узлов (N), наличие отдаленных метастазов (M):
T1 – опухоль, находящаяся в пределах границ почки и имеющая наибольший диаметр не более 4 см (T1a) или 4–7 см (T1b).
T2 - опухоль, находящаяся в пределах границ почки и имеющая наибольший диаметр 7–10 см (T2a) или более 10 см (T1b).
T3 – злокачественное новообразование распространяется на почечную вену и ее ветви, на надпочечник на одноименной стороне, паранефральную клетчатку, не прорастая фасцию Героты (T3a), на нижнюю полую вену ниже (T3b) или выше (T3c) диафрагмы или врастает в стенку вены.
T4 – опухоль распространяется за пределы фасции Героты.
N0 – опухолевые очаги в регионарных лимфоузлах отсутствуют.
N1 – обнаруживается опухолевый очаг в одном лимфоузле.
N2 – обнаруживаются опухолевые очаги в двух и более регионарных лимфоузлах.
M0 – отдаленных метастазов нет.
M1 – отдаленные метастазы присутствуют.
В зависимости от значений T, N и M, выделяют четыре стадии рака почки:
- Стадия I: опухоль в почке не более 7 см (T1), лимфоузлы не поражены, отдаленных метастазов нет.
- Стадия II: первичная опухоль более 7 см (T2), отсутствуют очаги поражения в лимфатических узлах и отдаленные метастазы.
- Стадия III: злокачественная опухоль распространяется на соседние структуры (T3) и/или поражен один регионарный лимфатический узел (N1).
Стадия IV: опухоль распространяется на соседние структуры (T4), либо поражено 2 и более регионарных лимфоузла (N2), либо обнаружены отдаленные метастазы (M1).
Опухоль почки размером 2 см может быть расположена вблизи почечных сосудов и ее удаление технически может быть невозможным. Однако данные литературы указывают, что если нет метастазов в лимфатические узлы и отдаленные органы, то опухоль почки до 7 см можно удалять с сохранением почки, что, безусловно, лучше полного удаления почки и инвалидизации пациента.
Лечение рака почки на разных стадиях
Выбор тактики лечения при раке почки в первую очередь определяется стадией опухоли и состоянием здоровья пациента.
При стадиях I и II возможно хирургическое лечение. Стандартным вариантом считается нефрэктомия. К органосохраняющим операциям прибегают реже, в частности, при опухолях в единственной почке. Кроме того, на выбор объема операции влияет размер опухоли. Также удаляют близлежащие лимфатические сосуды, особенно если они увеличены, окружающую жировую клетчатку.
При III стадии рака почки основным методом лечения также является нефрэктомия, при этом должны быть удалены все регионарные метастазы. Если опухоль прорастает в почечную или нижнюю полую вену или мигрирует в их просвете в виде опухолевого тромба, пораженные ткани также нужно удалить, при этом может потребоваться подключение пациента к аппарату искусственного кровообращения.
При высоком риске рецидива после операции применяют адъювантную терапию таргетным препаратом сунитинибом. Пациенты получают его в течение года.
Если хирургическое вмешательство противопоказано, прибегают к радиочастотной аблации, эмболизации.
На IV стадии подходы к лечению могут быть разными, в зависимости от степени распространения рака в организме. В некоторых случаях возможно хирургическое лечение, в том числе циторедуктивные операции, во время которых хирурги не могут убрать опухоль полностью, но стараются удалить как можно больший ее объем. В редких случаев возможно удаление основной опухоли в почке и единичных вторичных очагов в других органах. После операции назначают курс таргетной терапии, иммунотерапии.
При неоперабельном раке почки основными методами лечения становятся иммунотерапия и таргетная терапия.

В некоторых случаях рак почки удается выявить на ранних стадиях, когда опухолевые клетки не распространяются за пределы органа. Но зачастую заболевание диагностируют на более поздних стадиях. Во-первых, это связано с тем, что рак почки может очень долго протекать бессимптомно. Во-вторых, для этого типа рака на данный момент не существует рекомендованных скрининговых исследований.
Все симптомы можно разделить на ренальные (связанные с поражением почек) и экстраренальные.
Среди ренальных проявлений рака почки наиболее характерны три:
- Гематурия (примесь крови в моче) – самый распространенный и зачастую первый симптом. Он возникает более чем у половины пациентов с раком почки. Моча приобретает красный цвет, при этом боль не беспокоит либо носит острый характер и возникает после гематурии. Этим злокачественная опухоль отличается от неопухолевых заболеваний почки, например, мочекаменной болезни, при которой обычно сначала возникает боль, а потом появляется примесь крови в моче. Гематурия периодически исчезает, но через некоторое время снова появляется, причем, промежутки между кровотечениями сокращаются. Количество крови в моче не зависит от размеров опухоли.
- Боли беспокоят около половины пациентов. Острая боль после гематурии возникает из-за того, что сгустки крови перекрывают просвет мочеточника. Тупые сильные боли зачастую говорят о плохом прогнозе.
- Пальпируемая опухоль – симптом, который выявляет врач во время осмотра примерно у трети пациентов.
Все три симптома одновременно встречаются у одного из десяти пациентов с раком почкеи. Обычно при этом выявляют запущенные опухоли.
Среди экстраренальных симптомов в первую очередь стоит отметить повышение температуры тела. У 5% больных лихорадка – единственное проявление заболевания. У некоторых пациентов повышается артериальное давление, отмечается покраснение лица из-за увеличения количества эритроцитов в крови, у мужчин – расширение вен мошонки (варикоцеле). На поздних стадиях снижается аппетит, пациент теряет вес без видимой причины, постоянно ощущает утомление, недомогание.
Итак, на данный момент в современной онкологии выделяют несколько теорий канцерогенеза, но основной и общепринятой является мутационная теория, согласно которой в большинстве случаев рак (злокачественные новообразования) развиваются из одной опухолевой клетки. Согласно этой теории рак в организме человека возникает вследствие накопления мутаций в специфических участках клеточной ДНК, которые приводят к образованию дефектных белков. Основоположник теории – немецкий биолог Теодор Бовери (Teodor Boveri) профессор Вюрцбургского университета. Ещё в 1914 году он высказал предположение о том, что нарушения в хромосомах могут привести к возникновению рака. В дальнейшем эти нарушения были квалифицированны им как мутации.
С 60-х годов прошлого столетия в онкологии и фундаментальных науках, изучающих биологию рака, была сформулирована концепция мутагенеза как основной причины развития опухолей. Основная идея канцерогенеза рака и опухолей в этой научной теории отводилась мутации одного или нескольких генов, что по мнению исследователей, и приводило к нарушениям кариотипа, неуправляемой пролифе-рации, автономности и бессмертности опухолевой ткани. Было показано, что в соматической клетке существует система протоонкогенов и генов-супрессоров, которые формирует сложный механизм контроля темпов клеточного деления, роста и дифференциации. Нарушения этого механизма возможны как под влиянием факторов внешней среды, так и в связи с геномной нестабильностью. Протоонкогены это группа нормальных генов клетки, оказывающая стимулирующее влияние на процессы клеточного деления, посредством специфических белков — продуктов их экспрессии. Превращение протоонкогена в онкоген (ген, определяющий опухолевые свойства клеток) является одним из механизмов возникновения опухолевых клеток. Это может произойти в результате мутации генетического кода протоонкогена с изменением структуры специфического белка продукта экспрессии гена, либо же повышением уровня экспрессии протоонкогена при мутации его регулирующей последовательности (точечная мутация) или при переносе гена в активно транскрибируемую область хромосомы (хромосомные аберрации). На данный момент изучена канцерогенная активность протоонкогенов группы ras (HRAS, KRAS2). При различных онкологических заболеваниях регистрируется значительное повышение активности этих генов (рак поджелудочной железы, рак мочевого пузыря и т. д.). Также раскрыт патогенез лимфомы Беркитта, при которой активация протоонкогена MYC происходит в случае его переноса в область хромосом, где содержатся активно транскрибируемые коды иммуноглобулинов.
Гены-супрессоры представлены группой генов, чья функция противоположна функции протоонкогенов. Гены-супрессоры оказывают тормозящее влияние на процессы клеточного деления и выхода из процесса дифференцировки. Доказано, что в ряде случаев инактивация генов-супрессоров с исчезновением их антагонистического влияния по отношению к протоонкогенам ведет к развитию некоторых онкологических заболеваний. Так, потеря участка хромосомы, содержащего гены-супрессоры, ведет к развитию таких заболеваний, как ретинобластома, опухоль Вильмса и другие неоплазии.
К сожалению, теория мутагенеза опухолей пока не дала ответ на ряд очень важных теоретических вопросов на причины развития опухолей, не смогла объяснить феномены индивидуальной анеуплодии кариотипа при раке и конечно же не позволила разработать эффективные средства для терапии рака и других злокачественных опухолей . Мы не будем останавливаться на этой хорошо известной теоретической платформе механизмов развития рака, так как она очень подробно изложена в основных современных руководствах по онкологии, специализированной литературе о биологии рака и в Викепедии. Пытливый читатель найдет описание этой теории в целом каскаде научных исследований за последние 50 лет. В поддержку этой теории выступали Герман Мюллер, Альфред Кнудсон, Роберт Уэйнберг, Берт Фогельштейн, Эрик Фэрон, которые в разное время на протяжение 1914 – 2010 гг. находили подтверждения, доказательства того факта, что рак является следствием генетических мутаций.
Другая теория канцерогенеза - теория случайных мутаций. Автор теории случайных мутаций учёный из Вашингтонского университета Лоренс Леб (Lawrence A. Loeb), который утверждал, что в любой клетке за время её жизни случайная мутация возникает в среднем всего в одном гене. По предположению Лоренса Леба иногда под действием канцерогенов, оксидантов, или же в результате нарушения системы репликации и репарации ДНК частота мутаций резко возрастает. Вывод исследователя – рак возникает вследствие огромного числа мутаций — от 10 000 до 100 000 на клетку. Но Лоренс Леб признаёт, что подтвердить или опровергнуть это предположение очень трудно. Таким образом, по теории Lawrence A. Loeb канцерогенез – как следствие возникновения случайных мутаций, обеспечивающих клетке преимущества при делении. Хромосомные перестройки в рамках этой теории рассматриваются лишь как случайный побочный продукт канцерогенеза.
Не менее общепризнанной теорией происхождения опухоли является теория ранней хромосомной нестабильности. Основоположники этой теории - Кристоф Лингаур и Берт Фогельштейн. В 1997 г. они обнаружили, что в злокачественной опухоли прямой кишки очень много клеток с изменённым числом хромосом и выдвинули идею, что ранняя хромосомная нестабильность приводит к появлению мутаций в онкогенах и генах-онкосупрессорах. Основная идея теории - нестабильность генома. Этот генетический фактор вместе с давлением естественного отбора может привести к появлению доброкачественной опухоли, которая, по мнению авторов, иногда трансформируется в злокачественную опухоль, дающую метастазы.
Еще одна точка зрения на происхождение рака сформулирована в теории тканевого онкогенеза. Одним из авторов теории тканевого онкогенеза можно по праву назвать Ю.М. Васильева. Причиной появления раковых клеток по этой теории является нарушение тканевой системы контроля пролиферации клоногенных клеток, обладающих активизированными онкогенами. Основным фактом, который подтверждает механизм, основанный на нарушении тканевого гомеостаза, является способность опухолевых клеток нормализоваться при дифференцировке. Лабораторные исследования на мышах показали, что даже клетки с хромосомными нарушениями при дифференцировке нормализуются.
Появление несанкционированных сигналов является хотя и необходимым, но не достаточным условием образования опухоли. Опухолевый рост становится возможным лишь после осуществления ещё одной, третьей, стадии канцерогенеза — уклонения трансформированных клеток от дальнейшей дифференцировки, которое обычно вызывается несанкционированной активностью генов некоторых клеточных микроРНК. Последние препятствуют функционированию белков, отвечающих за протекание специализации клеток; известно, что не менее 50 % опухолей ассоциированы с теми или иными повреждениями в участках генома, которые содержат гены микроРНК. Прекращение дифференцировки возможно также из-за отсутствия цитокинов, необходимых для перехода созревающих клеток на следующий этап специализации (в этом случае присутствие цитокина может вызвать нормализацию и продолжение дифференцировки раковых клеток — процесс, обратный канцерогенезу). Созревание трансформированных клеток приостанавливается, и они — в результате непрерывной пролиферации и подавления апоптоза — накапливаются, формируя опухоль — клон клеток, обладающих рядом особенностей, не свойственных нормальным клеткам организма. Так, в частности, для опухолевых клеток характерен высокий уровень анеуплоидии и полиплоидии, что является результатом нестабильности генома. Также наблюдаются различные нарушения митоза. Клетки опухоли с наиболее распространённым набором хромосом образуют стволовую линию.
В ходе развития опухоли, в силу её генетической нестабильности, происходит частое изменение ее клеточного состава и смена стволовой линии. Такая стратегия роста имеет адаптативный характер, так как выживают только наиболее приспособленные клетки. Мембраны опухолевых клеток не способны реагировать на стимулы микроокружения (межклеточная среда, кровь, лимфа), что приводит к нарушению морфологических характеристик ткани (клеточный и тканевой атипизм). Сформировавшийся опухолевый клон (стволовая линия) синтезирует собственные цитокины и идёт по пути наращивания темпов деления, предотвращения истощения теломер, уклонения от иммунного надзора организма и обеспечения интенсивного кровоснабжения. Это четвёртая, заключительная стадия канцерогенеза — опухолевая прогрессия. Её биологический смысл заключается в окончательном преодолении препятствий на пути опухолевой экспансии. Опухолевая прогрессия носит скачкообразный характер и зависит от появления новой стволовой линии опухолевых клеток. Прорастая в кровеносные и лимфатические сосуды опухолевые клетки разносятся по всему организму и, оседая в капиллярах различных органов, формируют вторичные (метастатические) очаги опухолевого роста.
Рак почки – это злокачественная опухоль, развивающаяся из почек. Почки – это парные органы, размерами примерно с кулак, располагающиеся на задней брюшной стенке справа и слева от позвоночника. Над каждой из почек находятся надпочечники.
Почечноклеточный рак
Почечноклеточный рак (ПКР) является самым распространенным типом опухоли почки. Около 9 из 10 опухолей почки это ПКР.
Как правило, ПКР представлен одной опухолью почки, однако в некоторых случаях встречаются одновременно поражения обеих почек, или 2 или более опухоли в одном органе.
Существует несколько типов почечноклеточного рака, однако в основном отличить их друг от друга можно лишь под микроскопом. Несмотря на это, знание типа опухоли необходимо для помощи врачу выбрать тактику Вашего лечения.
Среди злокачественных опухолей почек, помимо почечноклеточного рака, существуют еще переходноклеточный рак, опухоль Вильмса и саркома почки.
Переходноклеточный рак
Из каждых 100 раков почки, около 5-10 будут представлять собой переходноклеточный (уротелиальный) рак. Эти опухоли представляют собой опухоли не собственно почки, а собирательной системы — чашек и лоханки. Этот тип рака, так же как и рак мочевого пузыря, очень часто связан с курением и воздействием токсических веществ (например, на производстве). Уротелиальный рак может проявлять себя, подобно почечноклеточному: болью в спине и, иногда, примесью крови в моче.
Переходноклеточный рак обычно лечится хирургически, операция предполагает удаление всей почки и мочеточника вместе с частью стенки мочевого пузыря, куда впадает мочеточник. Химиотерапия бывает необходима до или после операции, в зависимости от степени распространения опухоли.
Около 9 из 10 уротелиальных раков удается обнаружить на ранней стадии. Шансы на излечение снижаются в случае, если опухоль прорастает стенку мочеточника и врастает в почку, либо она выглядит агрессивнее при микроскопическом исследовании.
После лечения уротелиального рака необходимо наблюдаться у врача-онколога и выполнять следующие процедуры:
- цистоскопия — осмотр мочевого пузыря через специальный инструмент
- компьютерная томография
- магнитно-резонансная томографмя
Данная опухоль может появиться в мочевом пузыре и даже в других органах.
Данная опухоль почти всегда поражает детей, и крайне редко возникает у взрослых.
Саркома почки — это редкий тип опухоли, возникающий из стенок кровеносных сосудов или соеденительной ткани почки. Он составляет менее 1%от всех злокачественных опухолей почек
Какие факторы риска являются значимыми для рака почки?
Фактор риска – это что-то, что повышает шанс развития онкозаболевания. Различные опухоли могут иметь разные факторы риска. Некоторые факторы риска, такие как курение, можно предотвратить. Другие же, такие как возраст или наследственность, не могут быть предотвращены.
В случае рака почки, точная причина возникновения опухоли до сих пор не известна. Однако есть несколько путей снизить риск возникновения болезни:
- Курение сигарет ассоциировано с большим количеством случаев рака почки, и отказ от курения может снизить риск.
- Ожирение и высокое артериальное давление также являются факторами риска для рака почки. Контроль артериального давления и меры по снижению веса уменьшают шансы заболеть.
- И, наконец, необходима смена места работы в случае, если приходится контактировать с опасными веществами, такими как кадмий и органические растворители.
Симптомы и признаки рака почки
Опухоль почки на ранних стадиях, как правило, не вызывает никаких симптомов, однако чем больше стадия, тем больше риск появления различных симптомов, таких как:
- Примесь крови в моче (гематурия)
- Боль в пояснице с одной стороне
- Общая слабость
- Потеря аппетита
- Потеря веса, не связанная с диетой
- Повышение температуры на фоне отсутствия инфекционных заболеваний
- Анемия (снижение гемоглобина)
Эти признаки и симптомы могут быть вызваны раком почки, однако наиболее часто они вызываются другими, доброкачественными заболеваниями. Например, одной из основных причин появления крови в моче является мочекаменная болезнь. Таким образом, если появился один или несколько из вышеперечисленных симптомов, лучше посетить врача.
Диагностика
При подозрении на злокачественное образование в почках назначают ряд уточняющих обследований. С их помощью врач получает информацию о размере, границах, месте расположения опухоли в почке и оценивает общее состояние здоровья пациента.
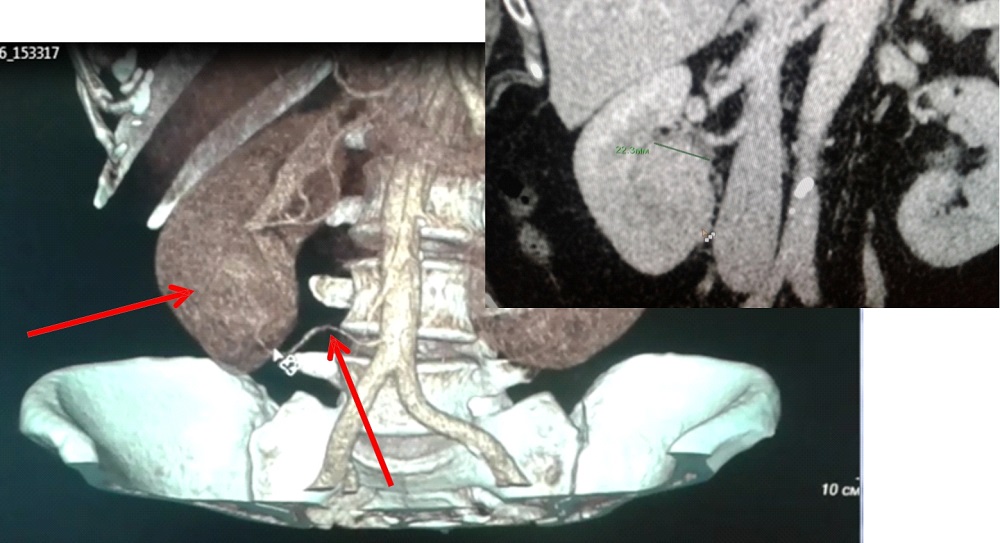
Комплекс исследований может включать в себя:
- Анализ мочи.
- Общий анализ крови.
- Биохимическое исследование крови.
- Компьютерная томография
- МРТ
- Ультразвуковое исследование
- Позитронно-эмиссионная томография (ПЭТ)
Некоторые другие исследования, такие как рентгенография или остеосцинтиграфия, будут полезны для определения распространения опухоли, т.е. метастазирования, в другие органы.
Стадирование рака почки
Лечение и прогноз заболевания определяются в зависимости от стадии опухоли почки. Наиболее широко для стадирования рака почки применяется система AJCC (Американского комитета по злокачественным заболеваниям), также известная как система TNM.
Стадия злокачественного образования зависит от его распространения: прорастания опухоли в близко расположенные ткани и органы, окружающие его лимфатические узлы, а также от наличия метастазов в отдаленных органах.
Стадирование основывается на результатах врачебного осмотра, биопсии и диагностических исследований.
Для злокачественной опухоли почки может быть 2 типа стадирования:
- Клиническая стадия, которая отражает клиническое представление врача о болезни
- Патологическая стадия, которая основана на тех же принципах, что и клиническая, плюс учитываются данные операции и исследования удаленного органа. Патологическая стадия считается более точной, чем клиническая.
Стадия может измениться после операции, например, если будет обнаружено распространение рака шире, чем предполагалось.
Стадия и прогноз
Выживаемость – это часто используемый показатель для оценки прогноза у пациента.
5-летняя выживаемость показывает на процент пациентов, кто прожил более чем 5 лет после установления диагноза. Разумеется, много людей живут намного дольше, чем 5 лет, и многие излечены от заболевания. Также, причиной смерти некоторых людей может быть не онкологическое заболевание.
| Стадия | 5-летняя выживаемость |
| I | 81% |
| II | 74% |
| III | 53% |
| IV | 8% |
Эти цифры получены из национальной базы данных по злокачественным заболеваниям США, и могут отличаться для пациентов в РФ. Эти показатели включают в себя людей с установленным диагнозом рака почки, которые позже могли умереть от других причин, например, болезни сердца.
Лечение рака почки
Варианты лечения рака почки могут включать в себя:
- Хирургию
- Абляцию
- Активное наблюдение
- Лучевую терапию
- Таргетную терапию
- Иммунотерапию
- Химиотерапию
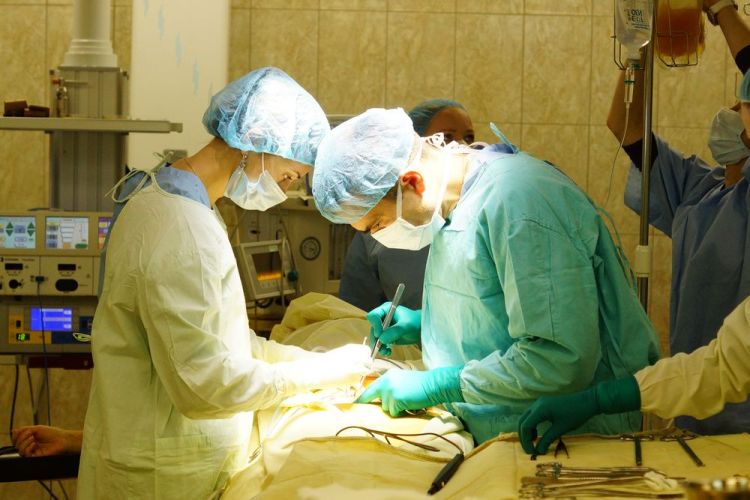
Хирургия – это основное лечение рака почки. Шансы избавиться от заболевания без проведения операции очень малы. Даже пациенты с распространением рака на другие органы получают пользу от удаления опухоли почки. Удаление почки с опухолью может помочь некоторым пациентам продлить жизнь, а также убрать такие симптомы как боль и кровотечение.
В зависимости от стадии и расположения опухоли, хирургическим методом может быть удалена только опухоль с окружающей частью почки — так называемая резекция почки, либо целая почка с опухолью — нефрэктомия. Надпочечниковая железа и жировая ткань вокруг почки также может быть удалена вместе с почкой, если возникнет необходимость.
Нефрэктомия – удаление почки, иногда вместе с надпочечником и окружающей жировой клетчаткой. Большинство людей с одной почкой живут обычной жизнью.
В условиях отделения онкоурологии и общей онкологии НИИ онкологии им. Н.Н. Петрова наиболее часто выполняется лапароскопический вариант данной операции. При этом вместо большого разреза используется несколько небольших разрезов 10-15 мм длиной, через которые устанавливаются специальные тонкие инструменты и лапароскоп с видеокамерой на конце. При помощи лапароскопии хирург видит происходящее на экране. После удаления почки для того, чтобы убрать ее из брюшной полости, производится разрез внизу живота, соответсвующий по размерам удаленному органу.
В случае, если опухоль распространяется в просвет почечной вены и/или в нижнюю полую вену, лапароскопический вариант операции возможен, однако он чаще, чем обычно, требует перехода на большой разрез при технических сложностях.
В ходе данной процедуры, хирург удаляет только ту часть почки, которая содержит опухоль, оставляя оставшуюся ткань почки неповрежденной. В настоящий момент это предпочтительный метод лечения для пациентов с ранней стадией рака почки. Часто резекции вполне достаточно для удаления одиночных небольших опухолей до 4 см в диаметре.
Также этот метод может применяться у пациентов с бОльшими образованиями, до 7 см. Специалистами НИИ онкологии им. Н.Н. Петрова успешно выполнялись вмешательства на опухолях размерами 10 и более см, однако такие операции возможны только в отдельных случаях, с учетом анатомии опухоли.
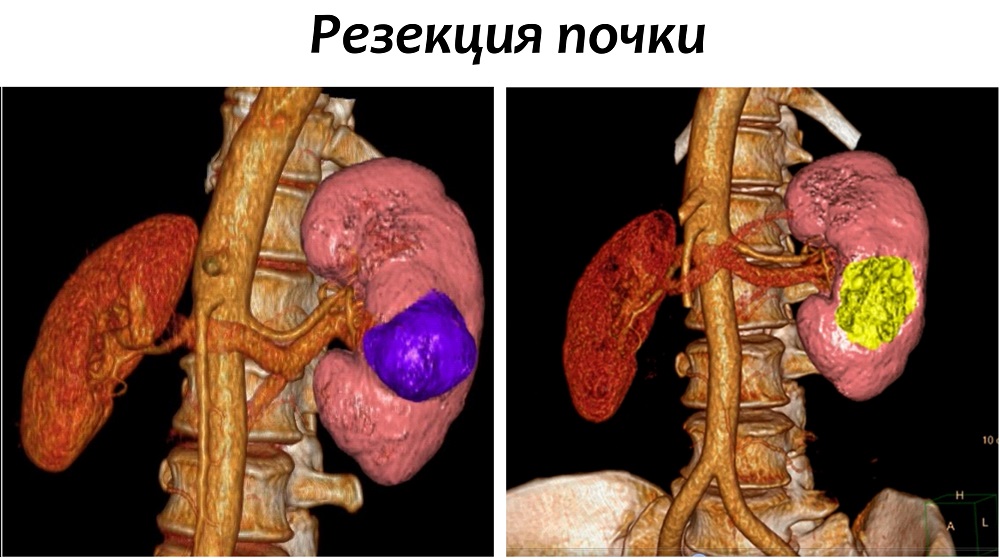
Современные исследования показали, что отдаленные результаты у пациентов, перенесших резекцию почки, почти такие же, как у пациентов, у которых почка была удалена. Однако несомненным плюсом остается сохранение большей части почечной функции.
По сравнению с открытой операцией после лапароскопии менее выражен болевой синдром и уже в первые сутки после операции больные более активны.
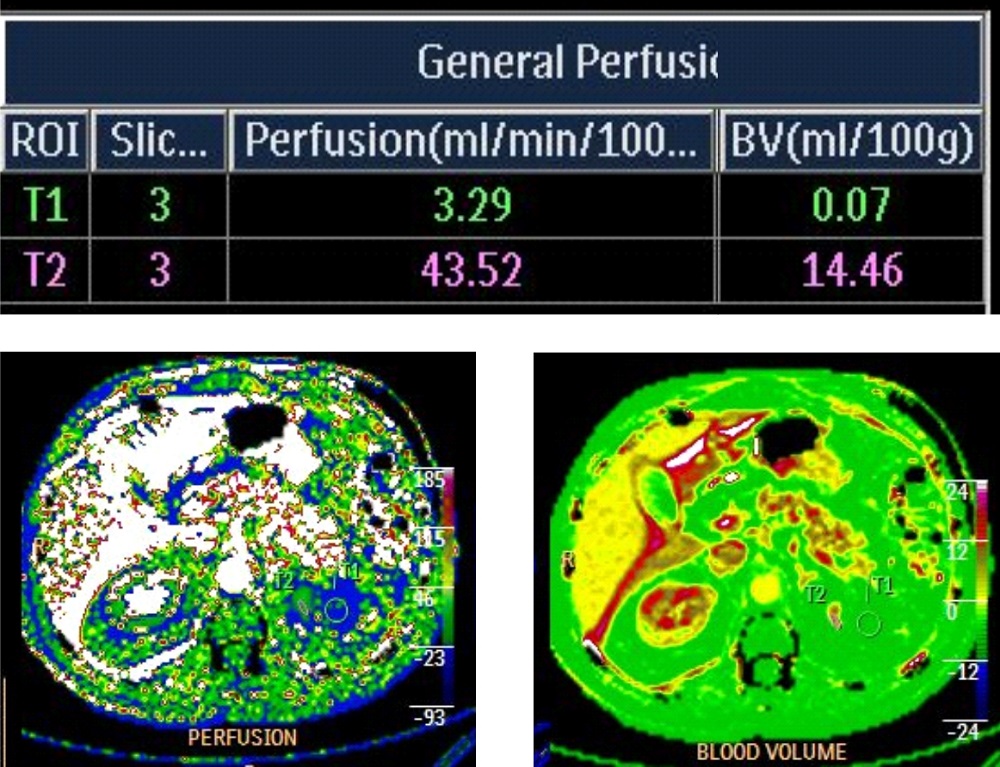
После резекции почки, для определения функционального состояния пациента в НИИ онкологии проводится перфузия почки.
Эта операция предполагает под собой удаление ближайших к почке лимфатических узлов в случае, если имеется подозрение на их поражение. В настоящий момент не существует единого мнения, необходимо ли во всех случаях рака почки удалять лимфатические узлы. В основном считается, что необходимость удаления лимфоузлов возникает, если они выглядят увеличенными по данным КТ или МРТ, либо в ходе операции.
Адреналэктомия является стандартной частью нефрэктомии, однако если опухоль расположена в нижнем сегменте почки, относительно далеко от надпочечника, и визуализационные методы не показывают поражения надпочечника, он может быть сохранен. Так же, как и удаление лимфоузлов, удаление надпочечника рассматривается индивидуально в каждом случае.
У около 25% больных раком почки на момент диагностики имеется распространение (метастазы) заболевания на другие органы. Наиболее часто к ним относятся легкие, кости, печень и головной мозг. В некоторых случаях при такой ситуации может помочь оперативное лечение. Наиболее часто оно может применяться в случаях, если имеется единичный метастаз, который может быть хирургически удален, либо в случаях, когда удаление метастаза может облегчить симптомы болезни, такие как боль.
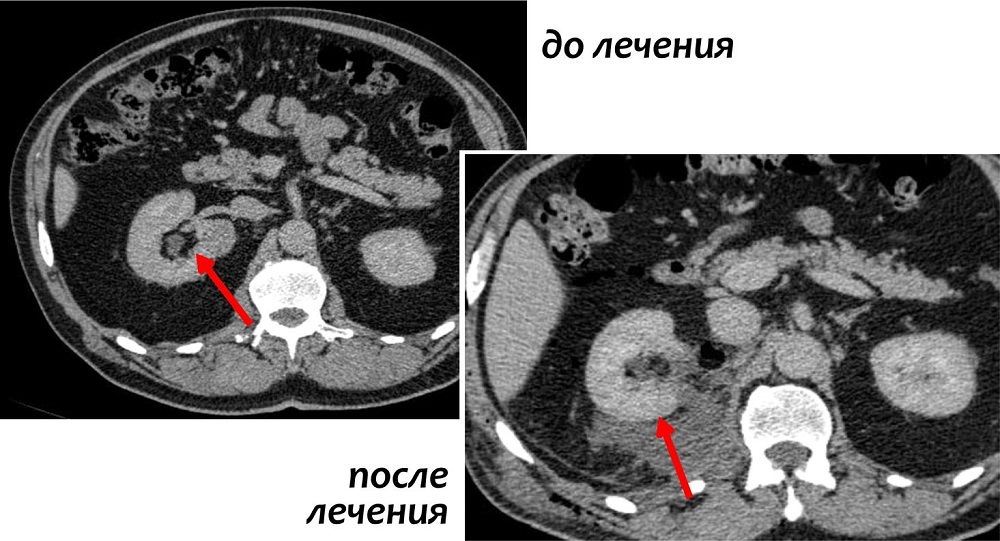
Риск и побочные явления после операции
Оперативное вмешательство всегда предполагает риск возможных осложнений. К ранним осложнениям относятся: реакция на анестезию (наркоз), кровотечение, которое может потребовать переливание крови, формирование гематом и возникновение инфекции. У большинства пациентов после операции возникает боль, которая может быть снята применением обезболивающих препаратов.
Другие риски включают в себя:
- Повреждение в ходе операции других органов и кровеносных сосудов, таких как : селезенка, печень, поджелудочная железа, аорта, нижняя полая вена, кишечник.
- Пневмоторакс (появление воздуха в грудной полости)
- Послеоперационная грыжа в месте проведения разреза
- Истечение мочи в брюшную полость или в забрюшинную жировую ткань после выполнения резекции почки
- Почечную недостаточность (нарушение функции оставшейся почки или части резецированной почки)

Авторская публикация:
Джалилов Имран Бейрутович
врач хирург-онколог отделения онкоурологии
НИИ онкологии им Н.Н. Петрова
Читайте также:

