Превращение клетки из нормальной в раковую
Как нормальная клетка превращается в раковую (ГЕОРГИЕВ Г.П. , 1999), БИОЛОГИЯ
Открыто более сотни генов, мутации в которых могут способствовать превращению нормальной клетки в опухолевую - это онкогены и гены-супрессоры опухолей. В статье рассмотрены основные функциональные классы, к которым относятся эти гены.
КАК НОРМАЛЬНАЯ КЛЕТКА ПРЕВРАЩАЕТСЯ В РАКОВУЮ
Московский государственный университет
им. М.В. Ломоносова
Рак - это генетическая болезнь, то есть болезнь, связанная с потерей, или повреждением, или активацией, или, наконец, привнесением извне определенных генов. Как известно, ген - это отрезок ДНК, который кодирует тот или иной белок. Последовательность, состоящая из трех нуклеотидов (всего их четыре - A, G, C и Т), кодирует ту или иную аминокислоту, общее число которых равно 20. Последовательность аминокислот в молекуле белка определяет трехмерную пространственную структуру белка и его функцию. Как мы видим, между структурой ДНК (гена) и ее продукта - белка существует прямая связь.
Оказалось, что некоторые вирусы способны в определенных условиях вызывать образование опухолей. Эти вирусы были названы онкогенными вирусами. Вирусы, как правило, содержат очень мало генов - от нескольких генов до нескольких десятков, тогда как в каждой клетке человека присутствует около 100 000 генов. Далее было показано, что из всех генов вируса обычно только один нужен для превращения клетки в опухолевую, то есть для этого нужно появление в клетке лишь одного нового белка. Такие гены были названы онкогенами. У некоторых вирусов это собственные гены вируса (вирусные онкогены), у других вирусов в процессе цикла их развития происходит захват генов хозяина, например генов мыши или человека, и последние выступают в роли онкогенов. Это особенно интересная группа, поскольку в нее входят гены самой клетки, которые функционируют на определенных этапах развития и на их матрице синтезируются нормальные белки.
Возникает вопрос, почему эти нормальные гены начинают индуцировать возникновение опухолей. Есть несколько путей подобной активации онкогена. Прежде всего такая активация может происходить и в вирусе и вне вируса, просто в клетке. Один из путей активации онкогена - структурная мутация, то есть изменение структуры гена, например замена нуклеотида в ДНК, ведущая к замене аминокислоты в белковой цепи и к изменению функции белка. Другой путь - это усиление активности онкогена, то есть усиление синтеза матричных РНК на матрице ДНК и в итоге усиление синтеза белкового продукта онкогена и его накопление в клетке. Активация онкогена может быть результатом увеличения числа копий данного гена в геноме или следствием такой перестройки генома, когда рядом с потенциальным онкогеном появляется новый регуляторный элемент, обеспечивающий его более активную транскрипцию, то есть синтез матричной РНК. Есть и другие способы активации онкогена. Число известных онкогенов непрерывно растет и уже перевалило за 100.
Вскоре после открытия первых онкогенов появились сообщения о существовании генов, утрата или подавление активности которых также приводит к развитию опухолей. Иными словами, белковые продукты этих генов необходимы для того, чтобы не дать клетке превратиться в раковую. Эти гены были названы антионкогенами или генами-супрессорами опухолей (ГСО). Число известных ГСО тоже быстро растет, хотя и уступает числу открытых онкогенов. Итак, есть гены, белковые продукты которых помогают нормальной клетке превратиться в раковую, и гены, белковые продукты которых этому препятствуют. Возникает центральный вопрос, какова природа белковых продуктов онкогенов и ГСО. Оказалось, что она чрезвычайно разнообразна. Основные классы генов и их белковых продуктов, которые могут выступить в роли онкогенов или ГСО, приведены в табл. 1.
Чтобы клетка начала расти и размножаться, нужны специальные сигналы, вырабатываемые обычно другими клетками, а иногда и самой клеткой. Это обычно белковые молекулы, называемые факторами роста (рис. 1). Их производство строго регулируется, но если происходит нарушение регуляции, то факторы могут накапливаться в больших количествах. Они начинают сигнализировать клетке о необходимости расти и делиться. Поэтому некоторые гены, кодирующие факторы роста, могут выступать в роли онкогенов.
Чтобы фактор подействовал, необходим рецептор для данного фактора, расположенный на поверхности клетки-мишени. Когда фактор присоединяется к рецептору, последний активируется, что может в ряде случаев выразиться в ферментативной реакции, например фосфорилировании определенных белков. При некоторых повреждениях рецепторов факторов роста они обретают свойства "зажигаться" при отсутствии своего фактора роста. Такой рецептор будет непрерывно передавать сигнал о необходимости начинать рост, хотя фактор роста и отсутствует. Поврежденный ген, кодирующий такой измененный фактор роста, может выступать в роли онкогена.
Передача сигнала на рост не ограничивается факторами роста и их рецепторами. В передаче такого сигнала участвует много других белков - передатчиков сигнала. Это своего рода клеточное реле. Такая передача часто идет путем фосфорилирования одним белком второго, вторым третьего и т.д. Гены, кодирующие участников этих цепей, могут выступать в роли онкогенов.
Цепи передачи сигналов заканчиваются в клеточном ядре. Там происходит активация так называемых факторов транскрипции, то есть белков, связывающихся с регуляторными участками определенных генов в ДНК и активирующих транскрипцию данных генов. Иными словами, под действием факторов транскрипции на соответствующих генах происходит синтез матричных РНК, а на матрице последних - белков. Это те белки, которые нужны для роста и размножения клеток. И снова среди генов, кодирующих факторы транскрипции, оказываются онкогены. Если соответствующий ген работает с высокой активностью независимо от описанной выше регуляторной цепи, то он способствует превращению нормальной клетки в опухолевую (см. рис. 1).
Итак, многие гены, кодирующие белки передачи сигнала для роста и размножения клеток, являются потенциальными онкогенами. В отлаженной системе нормальной клетки они обеспечивают строго регулируемые рост и размножение, но при повреждении или нерегулируемой активации этих генов клетки превращаются в раковые.
Превращению нормальной клетки в опухолевую противостоят другие системы. Одна из них - это цепь передачи сигнала для подавления клеточного роста от поверхности клетки к ядру. Эти цепи состоят из компонентов, подобных описанным выше, но имеющих противоположный знак действия, то есть их действие реализуется в подавлении транскрипции генов, необходимых для роста и размножения клеток. Некоторые гены, продукты которых участвуют в таком процессе, были идентифицированы как ГСО, их инактивация индуцировала преобразование клеток в опухолевые.
Важный механизм, препятствующий превращению нормальной клетки в опухолевую, - это механизм "проверки в ходе клеточного цикла"(рис. 2). Размножаясь, клетки проходят через несколько фаз клеточного цикла. Важнейшие фазы - это деление клеток или митоз (М); фаза, предшествующая синтезу ДНК (G1); фаза репликации или синтеза ДНК (S), когда происходит удвоение генетического материала; следующая за ней фаза подготовки к делению (G2) и снова митоз (M). Кроме того, клетки могут переходить из G1 не в S, а в фазу G0 или фазу покоя, когда деление клеток отсутствует.
Оказалось, что переход из одной фазы клеточного цикла в другую - это строго регулируемый процесс. На определенных этапах клеточного цикла существуют "точки проверки", во время которых специальные белки определяют, все ли в клетке в порядке и готова ли она к переходу в следующую фазу цикла. Например, если в клетке повреждена ДНК, об этом идет сигнал и переход в следующую фазу блокируется. Или, например, в клетке синтезируются не те белки, которые должны синтезироваться на данном этапе. Опять идет сигнал о блокаде перехода в следующую фазу. Очень важной точкой проверки является точка между G1 и S, поскольку именно в фазе S происходит удвоение генетического материала ДНК и становится возможным последующее деление клетки.
Ясно, что такая система проверки требует большого количества специальных белков. Ключевая роль в разрешении на продвижение по циклу принадлежит белкам семейства циклинов. Последние связываются со специальными ферментами, фосфорилирующими белки, циклинзависимыми киназами (ЦЗК). Только находясь в комплексе с циклинами, ЦЗК начинают фосфорилировать свои белки-мишени, и это, в свою очередь, активирует гены, продукты которых нужны на следующей фазе цикла.
Многие гены, кодирующие белки - участники этой системы контроля, выступают в роли онкогенов или ГСО. Гены, кодирующие белки, помогающие клетке беспрепятственно пройти через цикл, выступают в роли онкогенов. Гены, кодирующие белки, которые блокируют прохождение клетки через точки проверки, выступают в роли ГСО. Как бы то ни было, недостаточно только запустить сигнализацию о необходимости роста и размножения клеток, надо еще сломать системы проверки.
Что же происходит с клеткой, которая остановилась в своем движении по клеточному циклу в точке проверки, например из-за того, что в ней оказалась повреждена ДНК. Первый путь - это устранение повреждений ДНК с помощью специальных ферментов. Если такая "репарация ДНК" не произойдет, то остановленная в своем продвижении по циклу клетка вступает на путь "программированной смерти", которая обозначается термином "апоптоз". Приходят в действие специальные клеточные системы, которые разрушают ее жизненно важные структуры, в том числе хромосомы, и клетка умирает. Апоптоз играет большую роль в развитии организма, ибо таким путем устраняются ненужные организму клетки. Таким же способом устраняются клетки, которые получили повреждения и резко изменили свои свойства, - различные мутантные клетки. Именно эти механизмы устраняют многие клетки, приобретшие черты раковых. Они сами себя убивают.
Как и другие перечисленные процессы, апоптоз определяется большим числом белков. Одно из центральных мест занимает ген, кодирующий белок р53, - белок с молекулярным весом около 53 000. Этот белок включает апоптоз не только если в ДНК появляются повреждения, но и во многих других случаях. Наряду с белками, включающими апоптоз, есть белки, препятствующие апоптозу, и между теми и другими существует тонкий баланс. Апоптоз выступает в роли мощного защитника от превращения нормальной клетки в раковую. Гены, способствующие апоптозу, относятся к ГСО, а гены, ему препятствующие - к онкогенам.
Поломка процесса апоптоза резко облегчает клетке превращение в раковую. В неспособных к апоптозу клетках легко будут накапливаться различные повреждения ДНК, ведущие к появлению мутаций. Среди этих мутаций будут встречаться мутации, активирующие онкогены и подавляющие ГСО. Клетки с такими мутациями приобретут преимущества в отношении роста и размножения перед своими собратьями и начнут разрастаться.
На их пути к окончательному приобретению независимости и превращению в раковые клетки стоит еще одна преграда - ограничение числа клеточных делений в нормальных клетках в связи с укорочением концов хромосом или теломеров. На концах хромосом расположены особым образом устроенные отрезки ДНК или теломеры. При каждом делении длина теломера уменьшается. Когда их длина падает до критической величины, начинаются слипание концов хромосом, дезорганизация генома и гибель клеток. Поэтому если посеять на чашках клетки человека, то они примерно через 50 делений погибают - иными словами, в культуре клеток существует предел для размножения клеток, зависящий от утраты теломеров. Нормальные клетки человека и других животных в культуре смертны. Однако у человека и других видов есть клетки, функцией которых является размножение и поддержание нужного уровня числа клеток в организме. У этих клеток потеря теломеров не происходит благодаря тому, что в них есть фермент теломераза, восстанавливающий исходные размеры теломеров. В более зрелых клетках, из которых обычно происходят опухолевые клетки, теломераза утрачивается, ген для нее сохраняется, но он молчит.
Большинство опухолевых клеток в культуре клеток не погибает, а продолжает расти в течение бесконечно длительного времени, пока им предоставляется свежая среда. Они становятся бессмертными. Одновременно эти клетки содержат активный фермент теломеразу, то есть в них ген теломеразы работает. Следовательно, ген теломеразы выступает в роли еще одного онкогена, позволяющего опухолевым клеткам благодаря его активации приобретать бессмертие. Следует отметить, что в некоторых опухолевых клетках существуют и другие механизмы приобретения бессмертия.
Это основные, хотя и не все классы онкогенов и ГСО, участвующие в превращении нормальной клетки в опухолевую. Кроме перечисленных генов и их белковых продуктов, для которых установлена функция, открыто еще много онкогенов, и особенно ГСО, для которых функция еще не установлена. Поэтому можно ожидать появления новых функциональных групп среди ГСО и онкогенов. Как бы то ни было, видно, что громадное число генов, тем или иным способом связанных с контролем роста и размножения клеток, при своих изменениях (мутациях) могут способствовать превращению нормальной клетки в опухолевую.
Важным открытием явилось установление факта, что, как правило, активации одного онкогена или, наоборот, потери функции одного ГСО недостаточно для превращения нормальной клетки в опухолевую. Это понятно в свете приведенных данных о наличии разных барьеров, стоящих на пути такого превращения. В среднем подсчитано, что в случае клеток человека число таких мутационных событий составляет в среднем 10. Только при этом нормальная клетка становится раковой. У мышей, на которых ведется большинство экспериментов по индукции опухолей, этот барьер снижен - там необходимо 3-5 мутационных событий.
Поскольку онкогенов и ГСО чрезвычайно много, то и набор мутаций в различных опухолях человека весьма разнообразен. В одних опухолях активированы или подавлены одни гены, в других - другие. Каждая опухоль, таким образом, имеет свой генетический портрет, который и определяет ее свойства. Более того, опухоль часто гетерогенна, то есть в ней есть клетки с разным набором генетических изменений.
Это создает крайне сложную и запутанную картину, когда речь заходит об анализе механизма возникновения какой-либо конкретной опухоли человека. Особенно важно, что это многоообразие и гетерогенность сильно ограничивают возможности разработки терапии опухолей на основе знания произошедших в ней генетических изменений. Ситуация несколько облегчается тем, что некоторые ГСО или онкогены оказываются измененными гораздо чаще, чем другие. Так, например, ГСО, кодирующий белок р53, поврежден примерно в 50% всех опухолей человека, а онкоген ras содержит активирующую его мутацию примерно в четверти всех опухолей человека. Некоторые другие ГСО и онкогены изменены преимущественно в опухолях той или иной локализации.
Как отмечено выше, р53 играет важную роль в направлении клеток с поврежденной ДНК по пути апоптоза. Когда ген р53 выведен из строя, клетки с поврежденной ДНК (мутантные клетки) перестают выбраковываться и в них происходит накопление новых мутаций, которые могут затрагивать ГСО и онкогены. Поэтому повреждение р53 резко ускоряет аккумуляцию других изменений и дефект р53 наблюдается в опухолях очень часто.
В заключение остановимся на роли наследственной, вирусной и экологической компонент в развитии опухолей человека. Как правило, рак развивается у людей пожилого и старого возраста. Это связано с тем, что мутации в генах возникают случайно и вероятность накопления в клетке нужного для онкогенного превращения набора мутаций весьма низка - для этого требуются многие годы. Не последнюю роль играет и ослабление с возрастом иммунных систем организма, которые препятствуют выживанию опухолевых клеток.
Однако в некоторых случаях, обычно в определенных семьях, опухоли развиваются у людей более молодого возраста. Оказалось, что в этих случаях уже исходно во всех клетках организма в одном из онкогенов или ГСО имеется мутация. Тогда на ее фоне дальнейшее накопление мутаций, необходимых для превращения нормальной клетки в раковую, происходит быстрее и опухоли развиваются с гораздо большей частотой и в более раннем возрасте. Некоторые из таких мутаций предопределяют раннее развитие опухолей практически со 100%-ной вероятностью. Например, если у человека исходно поврежден ГСО rb, играющий важную роль в процессе контроля прохождения клетки через клеточный цикл, у него всегда развиваются опухоли сетчатки (ретинобластомы). Подобные наследуемые повреждения изучают, значительная часть их известна, а другие будут выявлены в ближайшие годы. Тогда с помощью предродовой генной диагностики с последующим абортом (в случае передачи плоду поврежденного гена) наиболее вредные мутации можно будет полностью вывести из человеческой популяции.
Другой часто обсуждаемый фактор - эпидемиологический. Поскольку опухоль - генетическая болезнь, она незаразна. Но, как отмечалось выше, имеются вирусы - носители онкогенов. ДНК таких вирусов, или их генетический аппарат, может встраиваться в геном клетки, где развивается вирус и таким образом в этих клетках появится активный онкоген. Например, вирус папилломы человека, передаваемый половым путем, вносит в геном клетки хозяина ген, белковый продукт которого связывается с белком р53 и его инактивирует. Результат тот же, что и при повреждении гена р53, опухоль непосредственно не возникает, но вероятность ее появления резко возрастает. Таким образом, некоторые вирусы, привнося в клетки новые онкогены, могут повышать вероятность возникновения рака у данного индивидуума.
Что касается роли негативных факторов внешней среды, ее загрязнение различными химикатами, то здесь ситуация тоже ясная. Большинство этих загрязнений обладает мутагенной активностью, то есть в их присутствии возрастают число мутаций в клетках организма и вероятность появления того набора мутаций, который приведет к онкогенному перерождению клеток. Естественно, что полностью от мутагенов избавиться нельзя: к ним относятся и солнечная иррадиация, и космические излучения. Но при хорошем контроле за уровнем загрязнения внешней среды вероятность повышения частоты мутаций естественно снижается.
Такова в настоящее время общая картина механизма превращения нормальной клетки в опухолевую. Основные принципы понятны, участники процесса раскрыты, но конкретные механизмы развития каждой отдельной опухоли различны, и полную картину этих изменений сегодня дать невозможно, а возможно, в этом и нет необходимости. Однако проблема рака остается нерешенной и требует новых и новых усилий. Хотя полученная информация позволяет уже сейчас предупреждать развитие некоторых видов опухолей, эта информация недостаточна для развития методов эффективной терапии.
1. Lewin B. Genes for SMA: Multum in Parvo // Cell. 1995. Vol. 80(1). P. 1-5.
2. Lewin B. The Best of Molecular Biology // Mol. Cell. 1997. Vol. 1(1). P. 1.
3. Lewin B. The Mystique of Epigenetics // Cell. 1998. Vol. 93(3). P. 301-303.
Георгий Павлович Георгиев, доктор биологических наук, профессор, действительный член РАН, директор Института биологии гена РАН, лауреат Ленинской премии, Государственных премий СССР и РФ, член пяти зарубежных академий. Область научных интересов - молекулярная генетика высших организмов. Автор одной монографии и 400 научных работ.
Общие положения
Опухоли способны возникать спонтанно, без видимых на то причин, а также могут быть индуцированы. У человека, как правило, появляющиеся опухоли – это спонтанные, хотя отличить спонтанно возникшую опухоль от индуцированной чрезвычайно трудно. Опухоли, искусственно вызванные, называются индуцированными. Индуцировать канцерогенез способны различные химические вещества (метилхолантрен, бензпирен, афлатоксин В1), физические факторы (ультрафиолетовый свет, ионизирующая радиация), вирусы (папова-, герпес-, адено- и ретровирусы). У человека 3 типа вирусов тесно связаны с опухолями, это вирус Эпштейна-Барр (лимфома Беркита), цитомегаловирус (саркома Капоши) и вирус папилломы.
Известные к настоящему времени проонкогены и кодируемые ими молекулы приведены в таблице 6-1. По своим функциональным особенностям они могут быть разделены на три категории: 1) гены, индуцирующие клеточную пролиферацию; 2) гены, подавляющие клеточную пролиферацию, опухолесупрессирующие гены; 3) гены апоптоза.
Таблица 6-1. Некоторые проонкогены и кодируемые ими молекулы.
| Гены | Кодируемые продукты |
| Гены, кодирующие факторы, способствующие клеточной пролиферации | |
| 1. Ростовые факторы sis 2. Рецепторы факторов роста fms erbB neu erbA 3. Трансдукторы srs abl Ha-ras N-ras K-ras 4. Факторы транскрипции myc jun fos | тромбоцитарный ростовой фактор (PDGF) рецептор колониестимулирующего фактора 1 (CSF-1) рецептор эпидермального фактора роста (EGF) белок (HER2), связанный с EGF- рецептором рецептор тиреоидного гормона тирозинкиназа тирозинкиназа ГТФ-связанные белки с ГТФ-азной активностью ГТФ-G-связанные белки с ГТФ-азной активностью ГТФ-связанные белки с ГТФ-азной активностью ДНК-связанные белки компонент фактора транскрипции АР1 компонент фактора транскрипции АР1 |
| Антиопухолевые гены (гены, кодирующие продукты, подавляющие клеточную пролиферацию) | |
| Rb p53 DCC APC NF1 | ингибитор ретинобластомы ядерный белок, подавляющий образование мелкоклеточного рака легких и толстой кишки супрессор карциномы толстой кишки супрессор аденоматозного полипоза супрессор нейрофиброматоза |
| Гены, контролирующие апоптоз | |
| bcl-2 | супрессор апоптоза |
Первая категория проонкогенов и их онкогенных копий кодирует белки, которые функционируют как факторы роста (тромбоцитарный фактор роста (PDGF) или рецепторы к факторам роста (рецептор колониестимулирующего фактора 1 (R-СSF1)), рецептор эпидермального фактора роста (R-EGF), рецептор тиреоидного гормона). Обычно одна популяция клеток продуцирует ростовые факторы, а другая экспрессирует рецепторы к ним. В нормальных условиях эти процессы тщательно регулируются и тонко сбалансированы. Установлено, что повышенная продукция факторов роста или повышенная экспрессия рецепторов, их воспринимающих, способны приводить к повышенному и неконтролируемому клеточному росту.
Другие продукты, кодируемые этой категорией проонкогенов, участвуют в трансдукции сигнала с поверхности внутрь клетки (тирозинкиназы, ГТФ-связанные белки с ГТФ-азной активностью) и в процессах транскрипции (ДНК-связанные белки). Повышенная активность каждого из названных проонкогенов способна стимулировать клеточный рост.
Вторая категория проонкогенов – антионкогены кодируют белки, подавляющие клеточный рост. Инактивация этих генов приводит к развитию опухоли. К ним относятся гены Rb, p53, DCC, APC, NF1. Например, известно, что инактивация гена Rb приводит к развитию у детей редкого наследственного заболевания, такого, как ретинобластома. Опухоль развивается из предшественников нервных клеток сетчатки. Мутация в гене р53, который кодирует ядерный фосфопротеин, приводит к развитию в 90% случаев мелкоклеточного рака легкого и более чем в 50% случаев рака груди и рака толстой кишки.
Третья категория проонкогенов кодирует белки, регулирующие запрограммированную клеточную смерть (подавляющие или индуцирующие апоптоз). В этой категории генов хорошо изучен ген bcl-2. Установлено, что bcl-2 является важным регулятором продолжительности жизни гемопоэтических клеток, Т- и В-лимфоцитов. Интересно, что вирус Эпштейна-Барр также содержит ген, подобный bcl-2, и через инкорпорацию этого гена способен вызывать супрессию апоптоза в инфицированных клетках и тем самым нарушать баланс между процессами естественной гибели клеток и их новообразованием.
Также онкогены были выявлены у ряда вирусов. Так, у вируса саркомы Роус был идентифицирован онкоген, названный v-src, который кодирует протеинкиназу 60-кD, которая катализирует присоединение фосфата к остаткам тирозина на белках. При переносе этого онкогена в нормальные клетки последние подвергаются злокачественной трансформации.
Серией работ показано, что превращение нормальных клеток в опухолевые может происходить в результате хромосомной транслокации. Такой пример приведен на рисунке 6-1.
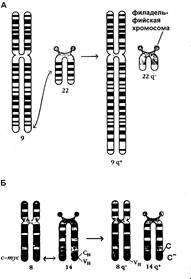
Рис.6-1. Хромосомные транслокации при хроническом миелолейкозе (А) и лимфоме Беркита (Б)
Как видно на рисунке, при лимфоме Беркита ген c-myc (клеточный проонкоген) перемещается со своего нормального положения в хромосоме 8 в кластер гена тяжелой цепи иммуноглобулина на хромосому 14. В результате этой транслокации происходит активация этого гена и усиление синтеза кодируемого им с-белка, который, как известно, функционирует как фактор транскрипции. При хронической миелоидной лейкемии клетки больных содержат филадельфийскую хромосому, которая образуется в результате транслокации генов между 9 и 22 хромосомами.
Суммируя накопленный к настоящему времени материал, можно заключить, что трансформация нормальных клеток в опухолевые может происходить в результате встраивания вирусных онкогенов в геном клетки, хромосомных транслокаций проонкогенов, что приводит к их активации и трансформации клеточных проонкогенов в онкогены под влиянием химических канцерогенов, физических факторов, вирусной инфекции. Все эти процессы сопровождаются нарушением нормального функционирования генов, которые в нормальных условиях выполняют важные регуляторные функции. В результате изменения функциональной активности генов происходит изменение количества (увеличение или снижение) регуляторных молекул и их активности, что в итоге приводит к расбалансировке между процессами размножения клеток и их гибелью.
Приведенное заключение подтверждается тем, что во многих опухолевых клетках, в отличие от нормальных, содержатся множественные копии клеточных онкогенов, ответственных за клеточную пролиферацию, что в свою очередь способно приводить к увеличению продукции молекул, усиливающих клеточный рост. Так, во многих раковых клетках выявляется повышенная экспрессия рецепторов к эпидермальному фактору роста, который кодируется геном c-erbB, а при раке груди наблюдается усиленный синтез рецепторов к фактору роста, кодируемого c-neu.
| Мы многое узнали о том, как живет и эволюционирует клетка, хотя недостаточно - о том, как предотвращать рак. Скорее наоборот: мы увидели многообразие факторов и механизмов, которые его индуцируют, а это ослабляет надежду на универсальные способы терапии. Поэтому вспоминаются слова Екклесиаста: во многой мудрости много печали; и кто умножает познания, умножает скорбь. Но ученые работают". Хесин Р. Б., советский ученый |
Проблема онкологических заболеваний является одной из главных для современного общества. По прогнозам Всемирной организации здравоохранения заболеваемость и смертность онкологическими заболеваниями во всем мире за период с 1999 года по 2020 год возрастет в 2 раза (с 10 до 20 млн. новых случаев и с 6 до 12 млн. регистрируемых смертей).
Опухолью называют избыточные патологические разрастания тканей, состоящих из качественно изменившихся, утративших дифференцировку клеток организма.
Термин "рак" пришел к нам с древних времен. В те времена болезнь называли по основному, наиболее заметному, признаку заболевания. По аналогии между выростами злокачественной опухоли в окружающие ее ткани и конечностями рака, это заболевание получило название рак (по лат. cancer). Этот древний термин в наше время хорошо известен всем и пугает каждого. При общении с больными его лучше не использовать.
Трансформация - процесс превращение нормальной клетки в опухолевую.
В возникновении опухолей определяющим являются два фактора: возникновение измененной клетки (трансформация) и наличие условий для ее беспрепятственного роста и размножения в организме.
На протяжении всей жизни в многоклеточном организме происходит огромное число клеточных делений. Например, в человеческом организме это число составляет приблизительно 10 16 . Периодически в соматических клетках возникают мутации, в том числе и те, которые могут привести к образованию опухолевых клеток. Причем чем больше циклов деления прошла клетка, тем больше вероятность появления дефектных клеток в ее потомстве. Это объясняет резкое увеличение вероятности возникновения онкологических заболеваний с возрастом. Более 50% всех случаев рака выявляются у людей в возрасте б5 лет и старше. Статистические данные показывают, что если принять смертность от рака в 20-летнем возрасте за единицу, то после 50 летнего возраста риск умереть от этого заболевания увеличится в десятки раз.
С образовавшимися дефектными клетками организм борется с помощью иммунной системы. Поскольку возникновение дефектных клеток неизбежно, по всей вероятности, именно нарушения иммунной системы являются определяющими в развитии опухолей. Концепция о роли иммунных механизмов в развитии злокачественных новообразований была выдвинута еще в 1909 г. Эрлихом. Исследования последних лет подтвердили существенную роль иммунодефицитных состояний в развитии опухолей.
Очевидно, что чем больше в организме появляется дефектных клеток, тем выше вероятность пропуска таких клеток со стороны иммунной системы. Трансформацию клеток вызывают канцерогенные факторы.
Канцерогенными факторами называются факторы внешней и внутренней среды, которые могут быть причинами возникновения и развития опухолей.
К факторам внутренней среды условия местонахождения клетки, генетическую предрасположенность организма. Так в чем более неблагоприятных условиях находится клетка, тем больше вероятность возникновения ошибок при ее делении. Травматизация кожи, слизистых оболочек или других тканей организма любыми механическими или химическими раздражителями ведет к увеличению риска возникновения опухоли в этом месте. Именно это определяет повышенный риск возникновения рака тех органов, слизистая которых подвергается наиболее интенсивной естественной нагрузке: рака легких, желудка, толстого кишечника и др. Постоянно травмируемые родинки или рубцы, длительно не заживающие изъязвления так же ведут к интенсивному клеточному делению в неблагоприятных условиях и повышению этого риска. В развитии некоторых опухолей важное значение имеют генетические факторы. У животных роль генетической предрасположенности экспериментально потверждена на примере высоко- и низкораковых линий мышей.
Внешние канцерогенные факторы условно можно разделить на три основные группы: физические, химические и биологические.
К физическим факторам относится ионизирующее излучение – радиация. В последние десятилетия возникло и достигло больших масштабов загрязнение Земли радионуклидами в результате хозяйственной деятельности человека. Выброс радионуклидов происходит в результате аварий на атомных электростанциях и атомных подводных лодках, сброса в атмосферу слабоактивных отходов с ядерных реакторов и пр. К химическим факторам относятся различные химические вещества (компоненты табачного дыма, бензпирен, нафтиламин, некоторые гербициды и инсектициды, асбест и др.). Источником большинства химических канцерогенов в окружающей среде являются выбросы промышленного производства. К биологическим факторам относятся вирусы (вирус гепатита В, аденовирус и некоторые другие).
По характеру и темпам роста принято различать доброкачественные и злокачественные опухоли.
Доброкачественные опухоли растут относительно медленно и могут существовать годами. Они окружены собственной оболочкой. При росте, увеличиваясь, опухоль отодвигает окружающие ткани, не разрушая их. Клетки доброкачественной опухоли незначительно отличаются от нормальных клеток, из которых опухоль развивалась. Поэтому доброкачественные опухоли носят названия тканей, из которых они развились, с добавлением суффикса "ома" от греческого термина "онкома" (опухоль). Например, опухоль из жировой ткани называется липома, из соединительной - фиброма, из мышечной - миома и т. д. Удаление доброкачественной опухоли с ее оболочкой ведет к полному излечению больного.
Злокачественные опухоли растут значительно быстрее и не имеют собственной оболочки. Опухолевые клетки и тяжи их проникают в окружающие ткани и повреждают их. Прорастая в лимфатический или кровеносный сосуд, они током крови или лимфы могут переноситься в лимфатические узлы или отдаленные органы с образованием там вторичного очага опухолевого роста - метастаза. Клетки злокачественной опухоли значительно отличаются от клеток, из которой они развились. Клетки злокачественной опухоли атипичны, у них изменена клеточная мембрана и цитоскелет, из-за чего они имеют более или менее округлую форму. Опухолевые клетки могут содержать несколько ядер, не типичных по форме и размерам. Характерным признаком опухолевой клетки является утрата дифференцировки и вследствие этого потеря специфической функции.
Напротив, нормальным клеткамприсущи все свойства полностью дифференцированных клеток, выполняющих в организме определенные функции. Эти клетки полиморфны и их форма определяется структурированным цитоскелетом. Нормальные клетки организма обычно делятся до образования контактов с соседними клетками, после чего деление останавливается. Такое явление известно как контактное торможение. Исключение составляют эмбриональные клетки, эпителий кишечника (постоянная замена отмирающих клеток), клетки костного мозга (кроветворная система) и опухолевые клетки. Таким образом, важнейшим отличительным признаком опухолевых клеток является неконтролируемая пролиферация считается
Превращение нормальной клетки в трансформированную - процесс многостадийный.
1.Инициация. Почти каждая опухоль начинается с повреждения ДНК в отдельной клетке. Этот генетический дефект может быть вызван канцерогенными факторами, напримеркомпонентами табачного дыма, УФ-излучением, рентгеновскими лучами, онкогенными вирусами. По-видимому, в течение человеческой жизни немалое число клеток организма из общего их числа 10 14 претерпевает повреждение ДНК. Однако для инициации опухоли важны лишь повреждения протоонкогенов. Эти повреждения являются наиболее важным фактором, определяющим трансформацию соматической клетки в опухолевую. К инициации опухоли может привести и повреждение антионкогена (гена-онкосупрессора).
2.Промоция опухоли это преимущественное размножение измененных клеток. Такой процесс может длиться годами.
3.Прогрессия опухоли – это процессы размножения малигнизированных клеток, инвазии и метастазирования, ведущие к появлению злокачественной опухоли.
| | | следующая лекция ==> | |
| Апоптоз и некроз | | | Права, обязанности и полномочия структур управления при нормировании расхода топлив и смазочных материалов |
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Читайте также:

