Препараты сердечной недостаточности при онкологии

Структура статьи
- Рак и сердечно-сосудистые заболевания
- Сердечно-сосудистый риск у онкологического больного
- Механизмы развития сердечно-сосудистых заболеваний у онкологических пациентов
- Определение кардиотокисчности и методы ее диагностики
- Онкологические больные с имеющимися заболеваниями сердца и сосудов
- Перспективы онко-кардиологии
Ежегодно в мире регистрируется до 13 млн новых случаев онкологических заболеваний. Рак одна из основных причин смертности, уступая первенство лишь сердечно-сосудистым заболеваниям (ССЗ). Тем не менее ситуация меняется: благодаря ранней диагностике и применению более эффективных методов лечения, смертность от злокачественных новообразований проявляет устойчивую тенденцию к снижению. Современная химио- и лучевая терапия в комплексе с оперативной онкологией позволяют сохранять жизнь и работоспособность больных в течение десятилетий.
Рак и сердечно-сосудистые заболевания
Ситуация изменилась настолько, что при успешном лечении, прогноз заболевания нередко определяется не столько основным заболеванием, сколько сопутствующей патологией – в первую очередь, болезнями сердца и сосудов. ССЗ обычно выявляются в возрастной группе от 45 лет и старше. В преклонном возрасте теми или иными заболеваниями сердца страдают более половины населения.
С учётом того, что население земного шара неуклонно стареет, рост хронических заболеваний, таких как рак и сердечно-сосудистые заболевания во всем мире и в нашей стране, неизбежен. При этом, что характерно, повышается вероятность одновременного выявления двух заболеваний у одного пациента во множестве клинических случаев. Это не только статистическая вероятность, но и, возможно, следствие влияния так называемых факторов риска развития злокачественной опухоли и болезней сердца.
С учетом актуальности проблемы в последние годы появилось новая специальность кардиоонкология или онкокардиология. Последний термин предпочтителен, т.к. подчеркивает причинно-следственную связь поражения ССЗ при онкологическом заболевании.
Так, в США 5-летняя выживаемость больных впервые установленным диагнозом рак составляет 67%, а среди детей с онкологическими заболеваниями 7-летняя выживаемость и того более – 75%. Из тех, кто не выживает в этот период онкологическое заболевание является причиной смертности только у половины, тогда как у трети больных смерть наступает вследствие сердечно-сосудистых причин.
Примечательно, что сердечно-сосудистая смертность в данной группе значительно выше, чем в аналогичной возрастной группе, не получающей лечения по поводу рака. Это означает, что и само онкологическое заболевание, и методы его лечения повышают вероятность развития тяжелых заболеваний сердца и сосудов. Это вторая причина, по которой рак может быть причинно связан с ССЗ.
Третья причина – тромбозы и эмболии. Рак нередко ассоциирован с гиперкоагуляцией, с венозными и артериальными тромбозами. Некоторые противоопухолевые препараты также могут стимулировать тромбообразование. Лучевая терапия и некоторые химитерапевтические препараты, в свою очередь, могут привести к нарушению эндотелия сосудов, тромбоообразованию в сосудах малого и крупного диаметра.
Четвертая причина, по которой кардиологи должны внимательно следить за больными это повреждение сердца, обозначаемое термином кардиотоксичность. Химиотерапевтические препараты должны избирательно подавлять рост раковых клеток. Но избирательность эта весьма относительна. Убивая раковые клетки, например, при опухоли молочной железы или новообразованиях средостения, они вызывают повреждение кардиомиоцитов.
Сердечно-сосудистый риск у онкологического больного
Кардиотоксические эффекты появляются в виде нарушения сократительной функции сердца, ишемии миокарда, аритмиями и блокадами. Лучевая терапия также способствует ускорению атеросклероза и проявлению ИБС , развитию перикардита.
Несмотря на то, что рак молочной железы, рак яичка, лимфома Ходжкина, и многие другие виды рака успешно вылечиваются на ранним стадиях, проблемы с сердцем, возникающие на фоне лечения рака, сокращают ожидаемую продолжительность и качество жизни этих больных. Предварительное исследования сердечно-сосудистого статуса больных и тщательное кардиологическое наблюдение пациентов повышенного сердечно-сосудистого риска до, во время и после химиотерапии имеют крайне важное значение. Это и регулярные осмотры пациентов, динамическое наблюдение, ЭКГ , УЗИ сердца , некоторые специальные анализы, и при необходимости, радиоизотопные исследования сердца.
Кардиотоксичность, при лечении рака, наблюдаются не у всех пациентов. Есть некоторые факторы, которые определяют этот риск. Первый из них связан с типом, дозой и способом введения химиотерапевтических препаратов и применением (либо не применением) лучевой терапии. Например, некоторые химиотерапевтические препараты могут вызвать застойную сердечную недостаточность у каждого четвертого пациента, а есть препараты, которые могут привести к гипертонии 50% пациентов.
Поражение сердца проявляются также аритмиями и блокадами сердца, инфарктом миокарда и перикардитом. Интересно отметить, что вышеперечисленные осложнения могут наблюдаться как во время лечения, так и много лет спустя после проведения химио- и лучевой терапии. Нередко больные, перенесшие химиотерапию, проходят повторные курсы после длительного перерыва. Это группа повышенного риска сердечно-сосудистых осложнений.
Второй группой факторов, определяющих риск развития сердечных заболеваний в результате применения лекарственных средств являются: возраст пациента, наличие факторов риска сердечно-сосудистых заболеваний или уже существующее заболевание. Серьезные проблемы с сердцем, при применении курса лечения рака чаще развиваются у больных, перенесших инфаркт миокарда, с сердечной недостаточностью, гипертонией, поражениями клапанов и аритмиями. Такие заболевания должны быть определены до начала курса лечения рака.
Механизмы развития сердечно-сосудистых заболеваний у онкологических пациентов
Подавление роста раковых клеток химиотерапевтическими препаратами и лучевой терапией - основа лечения рака. Однако химиотерапевтические препараты не обладают абсолютной избирательностью действия. Подавляя раковые клетки, они подавляют регенерацию клеток миокарда (классический пример доксорубицин и антрациклины) вызывая снижение сократительной функции сердца. Замещение поврежденных кардиомиоцитов и рост новых клеток – основной механизм компенсации сердца для предотвращения сердечной недостаточности. При лучевой терапии наряду с прицельным облучением опухоли, в той или иной степени поражаются и другие органы и ткани, в особенности те, которые расположены в непосредственной близости к объекту воздействия. Ряд препаратов (5-фторурацил, капецитибин) напрямую влияют на функцию эндотелия, вызывая тромбозы эпикардиальных коронарных артерий, артерий мелкого калибра. Происходит обеднение сосудистого рисунка.
Некоторые из химиотерапевтических препаратов (бевацизумаб, сунитиниб) могут вызывать как снижение сократимости, так и эндотелиальную дисфункцию. Для лечения некоторых видов опухолей лучевая терапия неизбежна. Облучение при опухолях молочной железы (в особенности левой), опухолей средостения, легких, сердце часто попадает в зону лучевого воздействия. В этом случае, из-за нарушения целостности эндотелия, развивается перикардит и перикардиальный выпот, поражение клапанов сердца, укоренное развитие коронарных и каротидных стенозов. Прямое воздействие облучения на сердце может привести к нарушениям проводимости сердца, блокадам и аритмиям.
По времени наступления различают острую и хроническую кардиотоксичность.
Острая кардиотоксичность (в пределах 1 недели) происходит из-за повреждения кардиомиоцитов, отложения продуктов распада, воспалительных инфильтратов, интерстициального отека.
Хроническая кардиотоксичность (в течение 1 года и более) является следствием вакуолизации клеток из-за разрушения мембран и митохондрий, разрушения органелл, гибели клеток, снижения количества миофибрилл, дезориентации миокардиальных волокон.
Как острая, так и хроническая кардиотоксичность развивается по сложным механизмам. Лечение рака, как правило, подразумевает одновременное применение препаратов с различным механизмом действия и нередко комбинируется с лучевой терапией. Считается, что на ранних этапах лечения нарушения сократительной функции сердца носят функциональный характер.
На ранних стадиях функциональные повреждения могут быть устранены, сердечную недостаточность можно предупредить. Но если диагноз поставлен через 6 месяцев после развития такого повреждения, застойная сердечная недостаточность становится необратимой. По этой причине онкологи должны быть осведомлены о начале нарушения функционального состояния сердца и работать в связке с кардиологами.
Определение кардиотокисчности и методы ее диагностики
На сегодняшний день нет единого, общепринятого определения кардиотоксичности. О кардиотоксичности говорят тогда, когда фракция выброса левого желудочка на фоне химиотерапии равна или ниже 55%. Наиболее часто кардиотоксичность определяется как снижение фракции выброса левого желудочка на 5% при наличии симптомов сердечной недостаточности или при отсутствии симптомов - в случае снижения фракции выброса левого желудочка на 10%.
Исходя из этого, точность измерения фракции выброса приобретает принципиально важное значение. Исследование сократимости ЛЖ с помощью многокадровой синхронизированной изотопной вентрикулографии (MUGA) точный, воспроизводимый, хорошо зарекомендовавший себя метод. Несмотря на очевидные плюсы, методика не общедоступна, а главное, связана с дополнительной радиационной нагрузкой для больного с раком. Сказанное в равной степени справедливо и для мультиспиральной контрастной компьютерной томографии ( МСКТ ).
Двухмерная эхокардиография ( ЭхоКГ ) – незаменимый метод исследования сократительной функции сердца. Данная методика безвредна для пациента, ее можно применять многократно, у постели больного. Поэтому ЭхоКГ давно стала основным методом в оценке сократимости ЛЖ. Но, к сожалению, воспроизводимость данных ЭхоКГ невысока. Методика субъективна, поэтому вариабельнасть оценки разными исследователями весьма значительна.
Контрастная эхокардиография значительно облегчает оценку функции ЛЖ, повышает ее точность. В последние годы все чаще применяется 3-х мерная ЭхоКГ, точность которой выше, чем рутинного 2-х мерного исследования. Еще более перспективным, более ранним и чувствительным методом диагностики оказалось изучение растяжимости сердца.
Это перспективная методика ранней оценки изменений сократимости сердца, до того, как фракция выброса левого желудочка начинает снижаться. Метод выгодно отличается хорошей воспроизводимостью, минимальной вариабельностью при оценке разными исследователями. Существенным недостатком всех ультразвуковых методик является то, что она не всегда применима. Идеальные для анализа изображения можно получить не у каждого больного. Особенности конституции, заболевания легких, послеоперационные рубцы и лучевая терапия порой значительно ухудшают ультразвуковую визуализацию сердца.
Самым надежным (и самым точным) методом оценки фракции выброса ЛЖ, в последние годы, становится магнитно-резонансная томография сердца ( МРТ ). МРТ идеально подходит для изучения сократительной функции сердца у онкологического больного. Она позволяет одновременно выявить поражения клапанов сердца, отличить воспалительное поражения миокарда от рубцового. Но методика имеет свои ограничения и недостатки. Она мало применима для больных страдающих сердечной недостаточностью, клаустрофобией. МРТ сердца дорогостоящее исследование, ее невозможно выполнить у постели больного.
Из лабораторных исследований для больного, получающего химиотерапию важное значение приобретают маркеры повреждения миокарда, такие как Тропонины и маркёр сердечной недостаточности - предсердный натриуретический гормон. Показано, что даже небольшое повышение уровня Тропонинов после химиотерапии коррелирует с развитием сердечной недостаточности в будущем. Повышение уровня предсердного натриуретического гормона, с другой стороны, во-первых, позволяет дифференцировать одышку и слабость сердечного происхождения от несердечных причин, а с другой стороны, позволяет контролировать эффективность лечения сердечной недостаточности.
Онкологические больные с имеющимися заболеваниями сердца и сосудов
При этом борьба с раком не прекращается, уменьшая вероятность сопутствующего поражения сердца и увеличивая сердечно-сосудистый резерв, онкологи могут максимально радикально бороться с опухолью. Для такого сотрудничества, наиболее важным является создание надежной связи между онкологами и кардиологами.
Перспективы онко-кардиологии
Онкология и в частности химиотерапия, стремительно развивающиеся области медицины. Появляются новые препараты и протоколы лечения больных с раковыми заболеваниями. Разработка и внедрение алгоритмов наблюдения сердечно-сосудистой системы при клинических испытаниях I-III фазы с целью раннего распознавания потенциально неожиданных сердечных эффектов может стать важной частью будущих научных исследований.
В ближайшие годы ожидается разработка новых стратегий для раннего распознавания и лечения известных побочных эффектов лечения рака, таких как гипертония, бессимптомная дисфункция ЛЖ. Это включает в себя и совершенствование имеющихся технологий визуализации сердца и дальнейшую разработку, и внедрение новых методик, а также изучения роли сердечно-сосудистых биомаркеров в лечения рака.
Реабилитация онкологических больных, наблюдение над их приверженностью к сложной многокомпонентной терапии, психологическая реабилитация очень важные и мало изученные проблемы.
С невероятным ростом терапии рака и повышением осведомленности онкологов о часто неожиданных осложнениях со стороны сердечно-сосудистой системы, роль кардиолога в онкологии возрастает. Онкокардиология будет играть все более важную роль в содействии знаний в этой области и реализации его результатов в клинической практике.
Онко-кардиология интегральная специальность, цель которой не потерять больного от сердечно-сосудистых осложнений при успешном лечении онкологического заболевания. Несмотря на то, что проблема очевидна, в мире всего лишь несколько ведущих центров, которые успешно занимаются проблемами онко-кардиологии. На сегодня нет общепринятых стандартов и рекомендаций, которым следовали бы специалисты. Многое открывается буквально в ежедневном режиме.
Для осуществления этой задачи необходимо тесное взаимодействие между онкологом, химиотерапевтом, кардиологом, реаниматологом, клиническим фармакологом, специалистами по реабилитации.
Давид ДУНДУА, доктор медицинских наук, профессор Главный кардиолог Центра эндохирургии и литотрипсии (Москва)
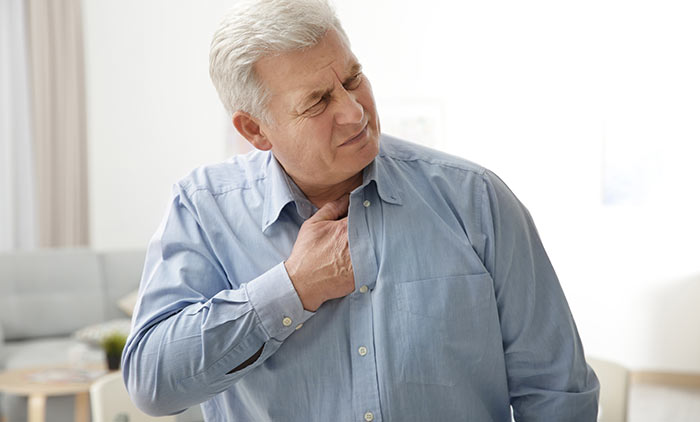
Химиотерапия — один из основных методов лечения рака. Химиопрепараты помогают замедлить рост опухоли и уменьшить ее в размерах, продлить жизнь больного, снизить риск рецидива после операции. Они незаменимы, но любой противоопухолевый препарат — обоюдоострый меч, он способен поражать не только раковые, но и здоровые клетки. Из-за этого есть риск возникновения многих побочных эффектов.
Способность химиопрепаратов вызывать нарушения со стороны сердца называется кардиотоксичностью. Ее проявления могут возникать непосредственно во время курса лечения, или спустя дни, месяцы и даже годы. Возникают осложнения, из-за которых ухудшается состояние пациента и может возникнуть опасность для жизни.
Для врача-онколога важно правильно оценить сердечно-сосудистый риск до начала терапии, учесть его при составлении плана лечения. В дальнейшем нужно тщательно контролировать состояние больного и своевременно принимать меры при возникновении тех или иных осложнений. В Европейской онкологической клинике для этого есть все необходимое. Наши врачи знают, как найти золотую середину между максимальной эффективностью противоопухолевой терапии и минимальными рисками побочных эффектов со стороны сердца, других органов.
- У кого повышены риски?
- Какие проблемы с сердцем могут вызывать химиопрепараты?
- Какие симптомами проявляются осложнения со стороны сердца?
- Как защитить сердце во время курса химиотерапии и после него?
- Как я могу поддержать свое сердце во время химиотерапии?
У кого повышены риски?
В первую очередь опасна химиотерапия при слабом сердце, то есть для людей, которые изначально страдают теми или иными сердечно-сосудистыми заболеваниями. Зачастую сам рак еще больше усугубляет их состояние. С осторожностью нужно назначать противоопухолевые препараты людям, у которых сердце в целом здорово, но имеются повышенные риски заболеваний, например, из-за наследственности.
Химиопрепараты могут взаимодействовать с некоторыми лекарствами, которые применяются при сердечно-сосудистых заболеваниях. Некоторые противоопухолевые средства ослабляют эффект варфарина. Иногда в качестве побочного эффекта химиотерапии развивается тромбоцитопения. В сочетании с антикоагулянтами (препараты, снижающие свертываемость крови) это грозит серьезными кровотечениями.
Некоторые таргетные препараты из группы блокаторов VEGF (ингибиторы ангиогенеза — подавляют образование в опухолевой ткани новых кровеносных сосудов) снижают эффективность клопидогрела (плавикса).
Статины (препараты для снижения уровня холестерина в крови) способны усиливать эффекты химиопрепаратов и делать их более токсичными.
Все эти взаимодействия нужно учитывать при назначении противоопухолевой терапии.
В группе повышенного риска по кардиотоксичности химиотерапии находятся люди старше 65 лет, лица, перенесшие в детстве лечение по поводу лимфомы Ходжкина.
Риски растут параллельно с увеличением дозы химиопрепаратов.
Конечно же, вероятность побочных эффектов со стороны сердца зависит и от вида химиопрепарата. Наиболее опасными в этом плане являются:
- доксорубицин;
- эпирубицин;
- даунорубицин;
- циклофосфамид;
- трастузумаб;
- осимертиниб.
Какие проблемы с сердцем могут вызывать химиопрепараты?
В целом проблемы с сердцем — редкое осложнение химиотерапии. Проявления кардиотоксичности зависят от того, какие структуры сердца оказываются поражены химиопрепаратами:
- При поражении миокарда (сердечной мышцы) развивается кардиомиопатия. Нарушаются сердечные сокращения, функция желудочков.
- Иногда возникает перикардит — воспаление оболочки из соединительной ткани, окружающей сердце. Если после воспалительного процесса остается рубец, такое состояние называется фиброзом перикарда.
- Химиопрепараты могут нарушить функцию сердечных клапанов. Возникает их стеноз или недостаточность. Кардиомиопатия, перикардит и поражения клапанов приводят к застойной сердечной недостаточности — состоянию, при котором сердце неспособно адекватно перекачивать кровь.
- Если страдают узлы, пучки и волокна, через которые в сердечной мышце распространяются электрические импульсы, развиваются разные виды аритмий.
- Артериальная гипертензия развивается как симптом сердечной недостаточности или как самостоятельное состояние. Часто к такому побочному эффекту приводят таргетные препараты из группы ингибиторов ангиогенеза: бевацизумаб (Авастин), сорафениб (Нексавар), сунитиниб (Сутент).
- При поражении сосудов, обеспечивающих кровью сердечную мышцу, у пациента возникают симптомы ишемической болезни сердца (ИБС). Иногда на фоне курса химиотерапии возникают инфаркты, инсульты.

Какие симптомами проявляются осложнения со стороны сердца?
Симптомы осложнений со стороны сердца во время химиотерапии бывают разной степени тяжести и по-разному влияют на состояние онкологических больных. Нужно немедленно сообщить врачу, если появились следующие жалобы:
ВАЖНО! Побочные эффекты химиопрепаратов могут возникать не только во время лечения, но и спустя годы после его завершения. Если после химиотерапии беспокоят боли в сердце или другие симптомы, то при обращении к кардиологу нужно обязательно рассказать о том, что пациент получал те или иные противоопухолевые препараты, взять на прием выписку из онкологического центра.
Как защитить сердце во время курса химиотерапии и после него?
Оценить риски помогает обследование перед началом курса химиотерапии. Врач может назначить ЭКГ, ЭХО-кардиографию, анализы крови, при необходимости — другие исследования.
Обычно с пациентами из группы повышенного риска, помимо онколога, работает кардиолог. Больного регулярно обследуют, контролируют состояние его сердечно-сосудистой системы. Если начинают развиваться те или иные побочные эффекты, в первую очередь кардиолог пытается с ними справиться с помощью поддерживающей терапии. Если это не удается, онколог снижает дозы химиопрепаратов или заменяет их другими, менее токсичными. Это вынужденная, крайняя мера, потому что она приводит к снижению эффективности противоопухолевого лечения.
В одних случаях сердечно-сосудистые патологии, вызванные химиопрепаратами, обратимы, в других являются стойкими и требуют постоянного наблюдения у кардиолога, медикаментозной коррекции.
Как я могу поддержать свое сердце во время химиотерапии?
До начала курса стоит поговорить с лечащим врачом. Спросите, насколько высок риск развития побочных эффектов в вашем случае, что планируется сделать, чтобы его снизить, что можете сделать вы самостоятельно.
Во время лечения ведите здоровый образ жизни и исключите все зависящие от вас риски:
- откажитесь от курения и алкоголя;
- ешьте здоровую пищу;
- поддерживайте физическую активность (спросите врача, какие нагрузки разрешены в вашем случае);
- избегайте стрессов, при необходимости обратитесь к психологу;
- ежедневно измеряйте артериальное давление.
Как только появились симптомы со стороны сердца — немедленно обратитесь к врачу!
Мы продолжаем публиковать главы из книги "Паллиативная помощь больным" под редакцией Айрин Салмон (начало - см. "СД" № 1' 2000).
Одышка - это неприятное чувство затруднения дыхания, которое нередко сопровождается тревогой. Одышка чаще всего возникает или усиливается в последние несколько недель перед смертью.
Одышку, как правило, сопровождают такие симптомы, как тахипноэ (учащение дыхания) и гиперпноэ (увеличение глубины дыхания). Частота дыхания в покое при одышке может достигать 30-35 в минуту, а физическая нагрузка или состояние тревоги могут увеличить этот показатель до 50-60 в минуту.
Однако следует иметь в виду, что ни тахипноэ, ни гиперпноэ не могут служить диагностическими признаками одышки. Одышка - явление субъективное, поэтому она (как и боль) должна оцениваться на основании описания больным своего самочувствия.
Дыхание человека контролируется дыхательными центрами в стволовой части мозга. Объем дыхания в значительной степени определяется химическим составом крови, а темп дыхания - механическими стимулами, передаваемыми по блуждающему нерву.
Повышение темпа дыхания приводит к относительному увеличению мертвого объема дыхания, уменьшению приливного объема и понижению альвеолярной вентиляции.
У некоторых пациентов с одышкой при физической нагрузке бывают приступы дыхательной паники. Во время этих приступов у больных возникает такое чувство, будто они умирают. При этом страх, вызванный одышкой, а также недостаточная осведомленность об этом состоянии вызывают усиление тревоги, что в свою очередь увеличивает частоту дыхания и, как следствие, усиливает одышку.
Причин возникновения одышки достаточно много: она может быть спровоцирована непосредственно самой опухолью, последствиями онкологического заболевания, осложнениями в результате лечения, сопутствующими заболеваниями, а также комбинацией вышеперечисленных причин.
К причинам, спровоцированным непосредственно самой опухолью, относятся одно- или двусторонний плевральный выпот, закупорка главного бронха, инфильтрация легкого раком, раковый лимфангит, сдавливание органов средостения, выпот в перикарде, массивный асцит, растяжение живота.
Причины, являющиеся следствием онкологического заболевания и/или потери сил: анемия, ателектаз (частичное спадение легкого), легочная эмболия, пневмония, эмпиема (гной в плевральной полости), синдром кахексии-анорексии, слабость.
Одышку могут вызвать такие осложнения лечения рака, как лучевой фиброз и последствия химиотерапии, а также сопутствующие заболевания: хронические неспецифические заболевания легких, астма, сердечная недостаточность и ацидоз.
При возникновении одышки следует объяснить больному его состояние и ободрить его, чтобы уменьшить чувство страха и тревоги, а также попытаться изменить его образ жизни: составить режим дня так, чтобы после нагрузки всегда следовал отдых, при возможности помогать пациенту по дому, с покупкой продуктов и т.д.
Лечение будет зависеть от причин, вызвавших одышку. Если причины возникновения состояния обратимы, то помочь может присутствие близких, успокаивающая беседа, прохладный сухой воздух, релаксационная терапия, массаж, а также такие виды лечения, как акупунктура, гипноз.
При дыхательной инфекции назначают антибиотики, при хронической закупорке бронхов / спадении легких, сдавливании органов средостения - откашливающие средства, кортикостероиды (дексаметазон, преднизалон); при раковом лимфангите показана лучевая терапия, при плевральном выпоте - лазерная терапия, при асците - кортикостероиды, при сердечной недостаточности - плевродез, откачивание жидкости, мочегонные средства, парацентез, переливание крови, ингибиторы ангиотензин-превращающего фермента; при легочной эмболии - антикоагулянты.
Также при одышке могут помочь бронходилятаторы. Морфин уменьшает позыв к дыханию, и его можно использовать для уменьшения одышки (если пациент уже принимает морфин, то следует увеличить дозу этого лекарства на 50%, если пациент еще не получает морфин, то хорошая начальная доза - 5 мг каждые 4 часа). Диазепам (реланиум) применяется, если больной испытывает чувство тревоги. Начальная доза препарата - 5-10 мг на ночь (2-3 мг для очень пожилых пациентов). Спустя несколько дней, если у больного возникнет избыточная сонливость, можно снизить дозу. Кислород также может быть полезным, если вдыхать его за несколько минут до и через несколько минут после физической нагрузки.
Медсестра должна постоянно контролировать, насколько удовлетворяются ежедневные нужды больного (умывание, прием пищи, питья, физиологические отправления, потребность в движении). Необходимо либо предотвращать одышку, чтобы пациент справлялся с удовлетворением этих нужд сам, либо обеспечивать ему надлежащий уход, если он сам не способен ухаживать за собой.
Медсестре следует иметь четкое представление о причинах одышки и применять соответствующее лечение. При инфекции органов дыхания необходимо сообщить об этом врачу, обеспечить больного плевательницей для сбора мокроты, сделать все, чтобы сократить до минимума риск распространения инфекции, придать пациенту положение, способствующее лучшей вентиляции легких, а также применить постуральный дренаж.
При уходе за больным с одышкой медсестре следует сохранять спокойствие и уверенность в себе, нельзя оставлять пациента одного. Ему необходимо создать максимально комфортную среду - открыть окна или поставить рядом вентилятор, а также предоставить возможность легко подать сигнал тревоги. Следует поощрять пациента делать дыхательные упражнения и обучить его технике релаксации.
Медсестре следует также заранее обучить больного, как контролировать дыхание во время приступов дыхательной паники. Во время приступа необходимо обеспечить больному успокаивающее присутствие. Также может помочь прием диазепама на ночь (5-10 мг).
Икота - это патологический дыхательный рефлекс, характеризующийся спазмом диафрагмы, приводящим к резкому вдоху и быстрому смыканию голосовых складок с характерным звуком.
Потенциальных причин возникновения икоты достаточно много. При далеко зашедшем раке большинство случаев икоты обусловлены растяжением желудка (в 95% случаев), раздражением диафрагмы или диафрагмального нерва, токсическими эффектами при уремии и инфекции, опухолью центральной нервной системы.
Возможные способы экстренного лечения - стимуляция гортани, массаж места соединения твердого и мягкого неба с помощью палочки с ватой, применение мышечных релаксантов, а также сокращение растяжения желудка, повышение парциального давления СО2 в плазме. Сократить растяжение желудка можно с помощью мятной воды (капнуть масло мяты перечной в воду), которая способствует срыгиванию избытка желудочного газа благодаря расслаблению нижнего пищеводного сфинктера; метоклопрамида (церукала), который сокращает нижний пищеводный сфинктер и ускоряет опорожнение желудка, а также средств, уменьшающих количество газов (например, диметикон). При этом мятную воду и церукал нельзя принимать одновременно.
Повысить парциальное давление СО2 в плазме возможно с помощью обратного вдыхания воздуха, выдохнутого в бумажный мешок, или задержки дыхания.
Среди мышечных релаксантов баклофен (10 мг внутрь), нифедипин (10 мг внутрь), диазепам (2 мг внутрь).
Центрального подавления рефлекса икоты можно достичь с помощью приема галоперидола (5-10 мг внутрь) или хлорпромазина (аминазина) (10-25 мг внутрь).
Большинство же "бабушкиных средств" от икоты заключаются в прямой или в непрямой стимуляции гортани. Например, быстро проглотить две чайных (с верхом) ложки сахара, быстро выпить две маленькие рюмки ликера, проглотить сухарик, проглотить раздробленный лед, бросить холодный предмет за ворот рубашки (блузки).
Шумное дыхание (предсмертные хрипы) - звуки, которые образуются в процессе колебательных движений секрета в нижней части глотки, в трахее и в главных бронхах за счет вдохов и выдохов и не обязательно являются признаком близкой смерти. Шумное дыхание характерно для больных, которые слишком слабы, чтобы откашляться.
В этих случаях необходимо положить больного на бок, чтобы улучшить дренаж дыхательных путей. Даже небольшое изменение положения может значительно успокоить дыхание.
Снизить выделение секрета у 50-60% больных поможет гиосцина бутилбромид (бускопан, спанил).
Очень важен также правильный уход за полостью рта, особенно если больной дышит через рот. Так как в этом случае пациент ощущает сильную сухость во рту, следует периодически протирать полость рта больного влажным тампоном и наносить на губы тонкий слой вазелина. Если больной может глотать, следует давать ему понемножку пить.
Очень важно уделять внимание близким пациента, по возможности объяснить им суть происходящего, обеспечить психологическую поддержку и обучить правилам ухода за больным.
Шумное и частое дыхание умирающего - явление, которое свидетельствует о последней попытке организма бороться с необратимой терминальной дыхательной недостаточностью. Создается впечатление жестоких страданий пациента, что нередко вызывает сильный стресс у близких и соседей по палате. При этом закупорки дыхательных путей может и не быть.
В подобных случаях медсестре, прежде всего, следует добиться уменьшения частоты дыхания пациента до 10-15 в минуту с помощью внутривенного или внутримышечного введения морфина. При этом может потребоваться двух- или трехкратное увеличение дозы морфина по сравнению с дозой, которая требовалась для обезболивания. При избыточных движениях плечей и грудной клетки можно ввести пациенту мидазолам (10 мг подкожно, а затем каждый час, по необходимости) или диазепам (10 мг внутримышечно).
Кашель - это сложный дыхательный рефлекс, задача которого - вывести посторонние частицы и избыток мокроты из трахеи и крупных бронхов. Кашель - своего рода защитный механизм. Однако продолжительные приступы кашля изматывают и пугают, особенно если кашель усугубляет одышку или связан с кровохарканьем. Кашель также может привести к тошноте и рвоте, костно-мышечным болям и даже к переломам ребер.
Кашель бывает трех типов: влажный кашель при способности больного к эффективному откашливанию; влажный кашель, но больной слишком слаб, чтобы откашляться; сухой кашель (то есть мокрота не вырабатывается).
Основные причины кашля можно условно разделить на три группы: вдыхание инородных частиц, избыточная бронхиальная секреция и аномальная стимуляция рецепторов в дыхательных путях, например за счет действия антигипертензивных лекарств, таких как каптоприл и эналаприл.
При далеко зашедшем раке кашель может вызываться сердечно-легочными причинами (введением жидкостей через нос, курением, астмой, хроническими обструктивными заболеваниями легких, сердечной недостаточностью, инфекцией органов дыхания, опухолью легкого и средостения, параличом голосовых связок, раковым лимфангитом, плевральным и перикардиальным выпотом), а также причинами, связанными с патологией пищевода (желудочно-пищеводным рефлюксом), аспирацией при разных патологических состояниях (нервно-мышечных болезнях, рассеянном склерозе, инсульте).
Лечение кашля зависит как от причины, так и от цели лечения. Например, цель лечения кашля у умирающих - создание им максимального комфорта. При этом бороться следует лишь с обратимыми причинами. Так, существенный противокашлевый эффект от прекращения курения наступает через 2-4 недели. Но проживет ли больной этот срок?
Существует довольно широкий круг мероприятий и лекарств, облегчающих кашель. Среди них паровые ингаляции с бальзамом (ментоловым, эвкалиптовым) или без такового, бромгексин, раздражающие муколитики (стимулируют образование менее вязкого бронхиального секрета, но раздражают слизистую желудка и могут вызывать тошноту и рвоту) - йодид калия, антиструмин, йодид 100/200; химические муколитики (изменяют химический состав мокроты и таким образом понижают ее вязкость), например ацетилцистеин (АЦЦ), а также центральные противокашлевые препараты - кодеин, морфин.
Среди нелекарственных мероприятий надо отметить придание пациенту удобной для откашливания позы, обучение его эффективному откашливанию, советы избегать видов лечения и факторов, провоцирующих кашель.
Медсестра должна быть бдительной в отношении признаков инфекции дыхательных путей и осложнений, а при появлении таких признаков - немедленно сообщать врачу. Необходимо помогать больному при осуществлении гигиены полости рта, а при появлении первых признаков стоматита - проводить необходимые лечебные мероприятия.
Следует успокаивать и ободрять пациентов и их близких. Например, уменьшить страх пациента, страдающего кровохарканием, и его близких поможет применение белья и носовых платков, окрашенных в темный, например зеленый, цвет.
Читайте также:

