Последствия после химиотерапии при раке носоглотки
Поскольку носоглотку отличает крайне обильная сеть лимфатических сосудов, рак носоглотки может легко распространяться в заглоточные и шейные лимфатические узлы (как с одной стороны, так и с обеих).
Из-за своего расположения в скрытой от простого осмотра анатомической области, опухоли данной локализации часто диагностируются только при поражении окружающих анатомических структур (основания черепа, околоносовых пазух, черепных нервов и мягкотканных пространств). Основным компонентом лечения остается лучевая терапия, поскольку в поле ее действия легко включаются области возможного местно-регионарного распространения инфекции.
В последние годы добиться значительного улучшения выживаемости и качества жизни удалось благодаря внедрению лучевой терапии с модулированной интенсивностью (ЛТМИ) и новых технологий визуализации, сочетанному использованию химиотерапии, стандартизации использующихся систем классификации, мультдисциплинарному подходу к лечению и международному обмену опытом.
Как правило, на ранних стадиях заболевания добиться местно-регионарного контроля опухолевого роста можно за счет использования лишь одной лучевой терапии. При опухолях Т III—IV или значительном поражении лимфоузлов требуется дополнительное проведение химиотерапии, поскольку при использовании только лучевой терапии не удается достичь удовлетворительного местно-регионарного контроля и предотвратить развитие отдаленных метастазов.

Пациенты с ранними стадиями заболевания составляют лишь около 10% всех случаев рака носоглотки, в этой группе возможно использование изолированной лучевой терапии. Традиционное фракционирование или двухмерное облучение позволяют достичь хорошего местно-регионарного контроля опухолевого роста при ранних стадиях заболевания, но при местно-распространенных опухолях их эффективность недостаточна.
При проведении традиционной лучевой терапии местного контроля удается достичь в 75-95% опухолей Т1-Т2, но лишь в 44-80% опухолей Т3-Т4. Повысить показатели эффективности можно либо добавлением брахитерапии, либо повышением конформности. При использовании более конформных методов лечения также удается достичь лучшего сохранения функции слюнных желез, органа слуха, повышается общее качество жизни пациентов.
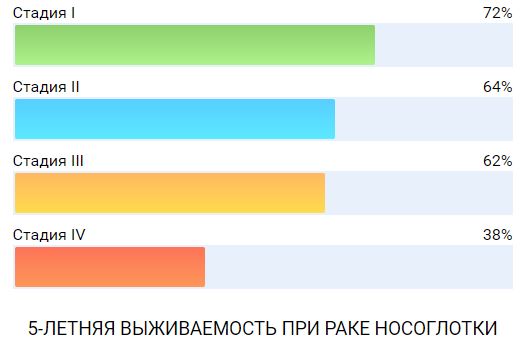
И хотя использование лучевой терапии на ранних стадиях заболевания позволяет добиваться хороших результатов, у 20-60% пациентов с местно-распространенным раком возникают местно-регионарные рецидивы, у 50-70% появляются отдаленные метастазы, а общая пятилетняя выживаемость составляет 28-56%.
В США стандартом лечения является сочетанная хи-миолучевая терапия с цисплатином, за которой следуют три курса адъювантной химиотерапии 5-фторурацилом и цисплатином.
В основе данной схемы лечения лежат результаты исследования третьей фазы Intergroup Study 0099, установившее, что по сравнению с изолированной лучевой терапией, добавление трех курсов CDDP (цис-диамминдихлороплатина) к лучевой терапии с последующим курсом адъювантной химиотерапии CDDP/5-фторурацилом улучшает трехлетний местно-регионарный контроль и снижает частоту развития отдаленных метастазов.
Это приводит к 10% увеличению трехлетней общей выживаемости и выживаемости без прогрессирования заболевания. В группе химиолучевой терапии чаще развивались лейкопетия и рвота 3-4 степени. Соблюдение предписанного режима лечения было неполным, т.к. только 2/3 пациентов могли перенести все три курса цисплатина,а 1/4 пациентов не могли перенести два курса. Только 60% пациентов получили два или три последовательных курса лечения.
Другие схемы лечения, использующиеся за пределами США, подразумевают еженедельное введение цисплатина (40 мг/м 2 ) с последующей лучевой терапией без адъювантной химиотерапии, либо использование индукционной химиотерапии с последующей химиолучевой терапией.
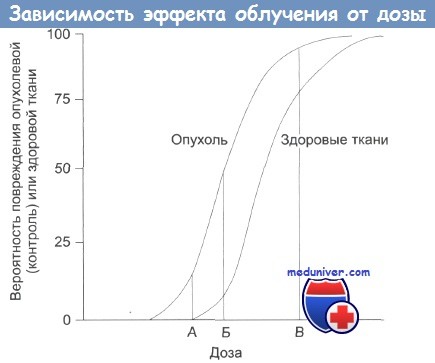
Зависимость терапевтического эффекта от дозы облучения.
А — нижняя безопасная доза;
Б — увеличение дозы: растет поражение здоровых тканей;
В — наивысшая вероятность успешного лечения, но и высокая вероятность поражения здоровых тканей, многочисленные побочные эффекты, некоторые из которых могут проявиться в отдаленном будущем
![]()
Варианты лечения рака носоглотки в Израиле
Система лечения рака носоглотки в Израиле будет составляться на основе многих важных факторов, таких как степень распространения рака, возраст и состояние больного, характерность протекания патологического процесса, локализация и объёмы опухолевого образования. Оперативное лечение рака носоглотки в нашей стране осуществляется в основном на ранних этапах болезни. Оно проводиться для удаления лимфатических регионарных узлов, в которых происходит патологический процесс.
В большинстве случаев лечение рака носоглотки может быть начато с радиотерапии или радиотерапии, совмещенной с курсом химиотерапии. В случае с небольшими опухолевыми образованиями бывает достаточно одной радиотерапии или ее объединения с химиотерапией.
В Израиле лечение рака носоглотки подразумевает проведение лучевой терапии наружным и внутренним способом. При наружной производится дистанционное облучение злокачественного узла. При внутренней же радиоактивные зерна подводятся собственно к опухоли или на довольно близкое к ней расстояние. Таким образом, получается облучить опухоль непосредственно изнутри без затрагивания полноценных клеток и тканей организма.
Еще одним эффективным методом лечения рака носоглотки в Израиле является стереотаксическая радиохирургия, которая заключается в локальном облучении патологических очагов под разными углами, что позволяет максимально облучить раковые клетки. Подобную процедуру проводят после прохождения магнитно-резонансной томографии и компьютерной томографии и занесения необходимых данных в компьютер.
В некоторых случаях радиотерапевтическое лечение может сопровождаться тяжелыми побочными эффектами, для их смягчения израильские ученые представили свою новую разработку LifeMel, которая способствует восстановлению показателей крови и благотворно влияет на организм в целом.
РАССЧИТАТЬ СТОИМОСТЬ ЛЕЧЕНИЯ
Химиотерапевтическое лечение рака носоглотки в клиниках Израиля может воспроизводиться несколькими способами:
Неоадъювантная химиотерапия - проводится перед радиотерапией; Адъювантная химиотерапия - выполняется после облучения с целью уничтожить остатки патологических клеток, включая и те, которые переходят от первичной опухоли и перекидываются на другие ткани и органы; Химиотерапия в ходе радиотерапии – объединение двух процедур усиливает эффект от лечения.
Рак носоглотки: особенности болезни
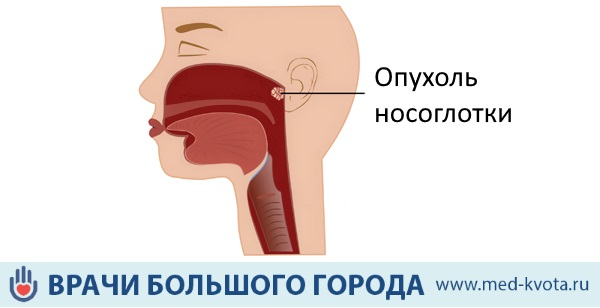
Опухоль носоглотки (назофарингеальная карцинома) относится к числу редких, но достаточно опасных онкологических заболеваний. Само анатомическое расположение этой опухоли способствует быстрому распространению опухолевых клеток и метастазированию, ведь раковые элементы разносятся по организму с лимфой и кровью. Опухоль носоглотки расположена близко к основанию мозга, поэтому является довольно труднодоступной для проведения оперативных методов лечения. Однако благодаря современным технологиям становится возможным успешно лечить даже самые сложные случаи раковых заболеваний.
В основном выделяют три типа носоглоточных опухолей: недифференцированный рак, плоскоклеточный ороговевающий и неороговевающий рак. Но на успешность и длительность курса лечения в основном влияет не разновидность рака, а стадия его развития.
К возникновению опухоли носоглотки могут привести различные факторы, так помимо вредных привычек спровоцировать развитие опухоли может наличие аденоидов и полипов, хронического воспалительного процесса, а также влияние химических веществ и т.п.
Симптоматика данной патологии доставляет больному немало дискомфорта, в частности у него наблюдается постоянная заложенность носа, неприятный запах из ротовой полости, интенсивные головные боли, снижение остроты слуха и заложенность в ушах, кровяная примесь в слюнных выделениях, боли при открытии рта и глотании, онемение некоторых зон лица.
При начале метастатического процесса появляется: боль в шейном отделе и ограниченность подвижности шеи, ее припухлость, кашель.
ПОЛУЧИТЬ БЕСПЛАТНУЮ КОНСУЛЬТАЦИЮ
- Компьютерная томография – позволяет получить детальные снимки органов и тканей в диагностируемых участках. Позволяет определить точную локализацию опухоли и очаги ее распространения;
- Радиоизотопное сканирование костного скелета – выявляет аномальные новообразования в костях. В ходе исследования больному внутривенно вводят немного радиоактивного вещества, которое избирательно накапливается в пораженных участках кости;
- Анализы крови – дают возможность узнать об общем состоянии здоровья пациента, нарушениях в клеточном составе крови, изменениях в содержаниях ферментов и пр.;
- Эндоскопическое исследование – в ходе данной процедуры врач сможет осмотреть задние отделы носоглотки. Выполняется процедура под местным обезболивающим;
- Магнитно-резонансная томография – позволяет четко визуализировать внутреннюю структуру организма. Может проводиться с использованием контрастных веществ;
- Биопсия – цитологическое исследование пораженных патологией тканей, выполняющиеся для подтверждения диагноза.
Стоимость лечения рака носоглотки в Израиле
| Наименование процедуры | Стоимость, Шек. | Стоимость, USD |
|---|---|---|
| Консультация онколога | от 2 100 | от 600 |
| Консультация ЛОР-онколога | от 2 310 | от 660 |
| Расширенные анализы крови | от 700 | от 200 |
| Биопсия опухоли с гистопатологией | от 4 550 | от 1 300 |
| ПЭТ-КТ | от 5 250 | от 1 500 |
| МРТ | от 4 550 | от 1 300 |
| Хирургическое удаление опухоли | 35 000 | 10 000 |
| Химиотерапия 1 курс в отдельной палате, не включая препараты | 3 115 | 890 |
| Радиотерапия, 1 поле | от 700 | от 200 |
| Иммунотерапия, 1 курс | от 17 500 | от 5 000 |
РАССЧИТАТЬ СТОИМОСТЬ ЛЕЧЕНИЯ
Более индивидуальный расчет стоимости лечения рака в Израиле вы можете получить после рассмотрения медицинской документации израильскими врачами.
Онколог-радиотерапевт – профессор Рахамим Бен-Иосеф, заведующий отделением радиотерапии в больнице Рамбам. Врач с тридцатью пятью годами клинического опыта, специализирующийся на терапии раковых опухолей горла. Ведет частную практику в больнице Ассута.

Бесплатная консультация по лечению в Москве.
Звоните 8 (800) 350-85-60 или заполните форму ниже:
Химиотерапия при раке носоглотки в сочетании с радиотерапией являются основными подходами в борьбе со злокачественными образованиями этого типа. Местнораспространенные опухоли головы и шеи хорошо поддаются этому виду воздействия, что объясняется особенностями строения и размножения онкоклеток. Интенсивный обмен веществ и активный рост онкообразования повышают степень его восприимчивости к цитостатическим средствам.

Если вам или вашим близким нужна медпомощь, свяжитесь с нами. Специалисты сайта посоветуют клинику, в которой вы сможете получить эффективное лечение:
Монохимиотерапия и полихимиотерапия — два основных варианта подхода в борьбе с метастазами раковых клеток, скорость разрастания которых иногда значительно превосходит агрессивность первичного очага. Использование одного химиопрепарата или нескольких (в совокупности или в последовательном приеме) дает разные результаты и зависит от стадийности заболевания и специфических особенностей организма.
При раке носоглотки лечащий онколог определит, каким способом оптимально проводить химиотерапию, назначит схему в зависимости от вида лечения:
Выбор лекарства зависит от восприимчивости онкообразования к определенному действующему компоненту и ограничений его применения.
Противопоказания
Химиотерапия является системным методом воздействия на рак (онкообразование в носоглотке в том числе), поэтому назначения обязательно проводятся с учетом абсолютных и относительных противопоказаний:
- • Низкий уровень тромбоцитов (тромбоцитопения). Для выявления этого фактора проводится лабораторный анализ крови.
- • Инфекционные заболевания, повышенная температура тела. Цитостатики ослабляют иммунитет человека и если их прием совпадает с обострением инфекции — ситуация грозит тяжелыми осложнениями.
- • Нарушения функции почек и печени. Поскольку все накопленные в организме токсины проходят через печень и почки, важно, чтобы эти органы своевременно справлялись со своей функцией.
- • Серьезные отклонения в работе дыхательной системы и сердца.
При назначении схемы онкотерапии доктор обязательно учитывает возраст и общее состояние больного, наличие психических отклонений или запущенных системных заболеваний (например, диабет).
Подготовка
Химиотерапия не требует специальной подготовки, при раке носоглотки курс проходит циклами с периодом для отдыха и восстановления сил. Перед началом курса больному рекомендуется употребление легкоусвояемых продуктов и позитивный настрой на достижение успеха в борьбе с онкопатологией. Лечащий онколог проинструктирует о планируемой продолжительности курса и возможных неприятных последствиях, которые ожидают пациента.
Как делают (проводят) химиотерапию при раке носоглотки?
Химиотерапевтическое воздействие на онкоструктуры проводится циклами. Внутривенные инъекции проходят в условиях стационара — первая процедура требует особенного контроля со стороны медперсонала. Количество циклов непосредственно онкотерапии и отдыха зависит от стадийности диагностированного онкопроцесса и наличия сопутствующих заболеваний. Интервал между циклами — 3-4 недели.
Последствия и побочные эффекты химиотерапии при раке носоглотки
После поступления токсичных противоопухолевых препаратов в кровь онкобольного, воздействию подвергаются как раковые так и здоровые клетки, поскольку химиотерапия — системный метод лечения онкопатологии органов носоглотки. Это приводит к проявлению негативных реакций организма:
- • изменения в крови на уровне формулы — проявляется малокровие и снижаются показатели тромбоцитов;
- • частые тошнота и рвота;
- • стоматиты — воспаления в полости рта и образование язв;
- • выпадение волос;
- • общая слабость, потеря аппетита, головокружения.

Реабилитация
После полученного курса химиотерапии, когда рак носоглотки остался в прошлом, человек нуждается в реабилитации. Основные мероприятия — это социальная психоэмоциональная поддержка и способствование восстановлению физических сил.
Рекомендуется прием поливитаминных комплексов, сбалансированное питание, прогулки на чистом воздухе и позитивные эмоции.
Сколько стоит химиотерапия при раке носоглотки?
При диагностированном раке слизистых (носоглотки, гортани, языка и других органов), специализированные клиники Москвы предлагают комплекс медицинских услуг, стоимость которых включает цену используемых при химиотерапии медпрепаратов и затраты на пребывание в стационарном отделении во время всего курса. Не последнюю роль играет также стадия заболевания и уровень квалификации медицинского персонала лечебного учреждения.

Лечение рака носоглотки в Израиле
Лечение рака носоглотки в Израиле — это совокупность различных видов терапий, цель которых — результативная борьба с.

Лечение рака носоглотки
Лечение рака носоглотки — это комплекс мероприятий, направленных на удаление опухолевых тканей в полостях лица, либо на подавление.
Рак носоглотки — это злокачественное новообразование, возникающее из перерожденных тканей, расположенных между носом и глоткой.

Облучение при раке носоглотки
Лучевая терапия при раке носоглотки — самостоятельный способ лечения онкологической патологии органа. Здоровые и опухолевые ткани.

Бесплатная консультация по лечению в Москве.
Звоните 8 (800) 350-85-60 или заполните форму ниже:
IV РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
ХИМИОЛУЧЕВАЯ ТЕРАПИЯ РАКА НОСОГЛОТКИ
Т.П. Чуприк-Малиновская, Г.Г. Матякин
Центральная клиническая больница Медицинского центра Управления делами Президента РФ, Москва
Комбинация лучевой и химиотерапии является основной стратегической линией лечения местно-распространенных опухолей головы и шеи. В то же время обзор 40 рандомизированных исследований по оценке эффективности лучевого и химиолучевого методов лечения при опухолях данной локализации не выявил статистически достоверных различий в результатах выживаемости. Анализ результатов лечения, включающий более 10 тыс. больных раком верхних дыхательных путей, показал, что абсолютная 5 летняя выживаемость при проведении химиотерапии составила 4%, при сочетании компонентов она увеличивается до 8% (7). Многочисленные исследования в рамках Онкологической группы лучевой терапии (RTOG) показали особую эффективность сочетания лекарственной и лучевой терапии при раке носоглотки и раке пищевода (10). Для рака носоглотки преимущества химиотерапии более очевидны, и наилучшие результаты были получены при сочетании химио- и лучевой терапии в режимах ускоренного или гиперфракционированного облучения (1,7).
Лучевая терапия обеспечивает местное излечение у 90% больных раком носоглотки, при этом выживаемость в сроки 5, 10 и 20 лет составляет соответственно 53%, 45% и 39% (3,5,13). При этом принципиальное значение имеет величина подводимой дозы излучения и объем облучаемых тканей. Показано, что при увеличении СОД с 40-49 Гр до 60-69 Гр результаты улучшаются с 48 % до 56 %. Широкое внедрение методик внутриполостного облучения радиоактивными источниками путем последовательного ручного или автоматического их введения в полость носоглотки позволило подвести к опухоли очаговые дозы 90 Гр и даже 20 Гр без существенного увеличения числа осложнений (2,5,11,28). Проведение сочетанного облучения позволяет достичь 5-ти летнего излечения у 60 % больных (2,28). С другой стороны, Алиев Б.М. с соавт , Киселева Е.С. с соавт., Cox J.D. (2,3,4,9) приводят данные о целесообразности применения гиперфракционированного облучения с многократным расщеплением суточной дозы, что сопровождается повышением эффективности лечения рака носоглотки на 20-30% (26).
Однако следует отметить, что у трети больных возникают метастазы в отдаленные органы в среднем через 8 месяцев после окончания лечения (5,13). Показана значимость исходных размеров метастазов в лимфатические узлы шеи, ухудшающих течение заболевания. Недифференцированный характер опухолей носоглотки, высокая склонность опухолей к регионарному лимфогенному и/или диссеминированному гематогенному метастазированию, исходная распространенность опухолей, когда подавляющее большинство больных (85-90%) поступают на лечение с 3-4 стадиями заболевания, обуславливают целесообразность использования лучевой и лекарственной терапии.
Основное количество опубликованных исследований относится к изучению роли неоадъювантной химиотерапии. При этом были использованы различные схемы лечения.
1. Наибольшее распространение при лечении опухолей головы и шеи и, в частности, при раке носоглотки получил режим комбинации платиносодержащих препаратов и 5-фторурацила. Giglio R. (14) сообщают о результатах рандомизированного исследования по изучению эффективности химиолучевой терапии при использовании цисплатина 20 мг/м 2 +5-фторурацил 300мг/м 2 +фолиевая кислота 20мг/м 2 с 1 по 4 дни в 1, 4, 7 и 10 недели в сочетании с облучением в режиме 2 Гр ежедневно во 2 и 3 недели и по 1,5 Гр х 2 раза в день в течение 5-6 и 8-9 недель лечения до СОД 80Гр. Во второй группе проводилось гиперфракционированное облучение по 1,2 Гр х 2 раза в день с 6-часовым интервалом до СОД 79,2 Гр. Результаты свидетельствуют об улучшении местного контроля и увеличении интервала до прогрессирования в группе химиолучевой терапии, при этом отдаленные результаты статистически не различались. Токсичность также была выше при комбинированном лечении. Аналогичные результаты приводят авторы (12,19,21,27), использовавшие интенсивный режим пролонгированного инфузионного введения цисплатина (25 мг/м 2 ежедневно) и 5-фторурацила (1000 мг/м 2 ежедневно) в течение 4-х дней. Следует отметить тот факт, что частота достижения полной резорбции опухоли после нескольких курсов химиотерапии достигает 52%, после химио- и лучевой терапии - 82%. Дальнейшее наблюдение показало, что в случае полной регрессии опухоли выживаемость составила 70% при общей выживаемости 49%.
2. В течение последних 8 лет проводились сравнительные рандомизированные исследования по оценке эффективности сочетания 2-3 курсов химиотерапии препаратами цисплатин 60 мг/м 2 + эпирубицин 110 мг/м 2 и облучения и применения только лучевой терапии. (8) Результаты лечения 334 больных раком носоглотки не выявили достоверных различий в анализируемых группах по критериям общей и безрецидивной выживаемости. Однако, в группе больных, у которых был достигнут полный эффект лечения, комбинированная терапия достоверно улучшила показатели безрецидивной выживаемости (58% против 46%), при этом общая выживаемость оказалась одинаковой в обеих группах (80% и 72%). Особую роль лекарственная терапия приобретает у пациентов с размерами метастатических узлов более 6 см, что соответствует символу N3: различия в безрецидивной выживаемости составили 63% и 28% (р=0,057) и общая выживаемость- 73% и 37% соответственно. Основной вывод данного исследования: авторы не рекомендуют в качестве стандартной схемы химиолучевую терапию препаратами цисплатин + эпирубицин при локализованном раке носоглотки.
Подведены итоги III фазы мультицентровых клинических испытаний двух групп больных недифференцированным раком носоглотки (тип 2-3 по классификации ВОЗ) при наличии метастазов в лимфатические узлы шеи соответственно N2-3. Схема химиотерапии включала в себя блеомицин 15 мг однократно в 1 день + постоянная инфузия в течение 5 дней в дозе 12 мг/м 2 , эпирубицин 70 мг/м 2 в 1 день, цисплатин 100 мг/м 2 в 1 день. Число курсов - 3 с последующим присоединением лучевой терапии в режиме обычного фракционирования (РОД 2 Гр СОД 70 Гр в течение 7 недель). Аналогичный курс лучевой терапии был использован во второй группе больных. Сроки наблюдения за больными составили в среднем 74 месяца. Результаты исследования показали, что химиолучевая терапия достоверно улучшает безрецидивную выживаемость (41% против 30%, р=0,02), различий в общей выживаемости при этом нет. Оценивая продолжительность жизни больных с неудачами лечения, оказалось, что она выше в группе лучевой терапии (15). Авторы, проводившие анализ результатов лечения по данной схеме в Медицинском институте в Бильбао, Испания, отмечают увеличение токсичности, особенно гематологической и легочной, при химиолучевой терапии (17).
3. Новые режимы включают в себя сочетание паклитаксела 175 мг/м 2 и карбоплатина при метастатическом раке носоглотки, при этом эффект отмечен у 75% больных (18,24). Однако при этом авторы сообщают гематологической токсичности 3-4 степени у 31% больных.
По нашим данным (6), применение неоадъювантной химиотерапии и облучения сопровождалось полной резорбцией опухоли у 81% больных, при этом наиболее эффективными оказались схемы химиотерапии с применением препаратов платины, адриабластина, блеомицина. Уменьшение опухоли на 50% и более после окончания лекарственной терапии отмечено у 76%, 5-ти и 10-ти летняя выживаемость составили соответственно 63% и 59%.
Адъювантная химиотерапия. Данные о поддерживающей химиотерапии у больных с полной резорбцией опухоли после облучения приведены в ряде исследований (3,25), однако, результаты не однозначны.
Изучение результатов лечения 229 больных раком носоглотки, выполненное Rossi A. et all (22) на основе рандомизированного исследования двух групп, не выявило существенных преимуществ назначения 6 ежемесячных курсов полихимиотерапии препаратами винкристин, циклофосфан, адриамицин после лучевой терапии по сравнению с группой лучевой терапии, при этом частота отдаленных метастазов составила 50%. Harrisson L.B. et all (16) рекомендует обязательное назначение адъювантной химиотерапии препаратами платины в различных комбинациях при местно-распространенных опухолях. Tsujii H. et all (25) приводят данные об улучшении отдаленных результатов после применения 4-6 поддерживающих курсов химиотерапии (цисплатин, циклофосфан, метотрексат, фторафур): 5-летняя выживаемость составила 70% против 40% при лучевой терапии. Алиев Б.М. с соавт. (1,3) показали преимущества назначения лекарственной терапии до и после облучения, увеличив при этом 5-летнюю выживаемость больных до 62%.
Анализ результатов лечения 353 больных, получавших различные схемы лучевой и химиотерапии (3), показал отсутствие существенных различий в группах больных с лучевой терапией (172) и химиолучевым лечением (181) по критериям частоты полной резорбции опухоли (84% и 82%), рецидивов (22% и 26%), висцеральных метастазов (24% и 23%) и отдаленным результатам: 5 летняя выживаемость 55% и 63% и 10-летняя - 51% и 49%. Вместе с тем, показано, что наиболее эффективно использование химиотерапии до и после окончания облучения: 10-летняя выживаемость составила 57%. В случае применения сочетания химиотерапии препаратами платины, антрациклинов и блеомицина и облучения в режиме гиперфракционирования были достигнуты наилучшие результаты выживания больных в сроки 5 и 10 лет - 63% и 60%. Важным выводом является тот факт, что в случае назначения поддерживающей химиотерапии (циклофосфан 2 г на курс в течение 6 месяцев) у больных с полной резорбцией опухоли достоверно уменьшается частота развития метастазов в отдаленные органы (до 20%, р Поделиться |
Злокачественные опухоли головы и шеи в России составляют около 20% всех злокачественных новообразований.
В основном эти опухоли представляют собой плоскоклеточный рак (ПКР) (до 90%), возникающий в слизистой оболочке верхних отделов дыхательной и пищеварительной систем: полости носа и ее придаточных пазух, полости рта, носо-, рото- и гортаноглотки, гортани.
Некоторую долю составляют эпителиальные злокачественные опухоли, возникающие в больших и малых слюнных железах, а также в щитовидной железе.
Традиционно при изучении эффективности противоопухолевых препаратов лечение опухолей головы и шеи различных локализаций рассматривается как единая проблема. Главным образом, это ПКР разных отделов верхних дыхательных и пищеварительных путей, таких как полость рта, глотка, гортань и слизистая оболочка придаточных пазух. Факторами риска развития этих заболеваний являются табакокурение, употребление крепких спиртных напитков.
В последние годы появились работы о вирусе папилломы человека как факторе риска развития плоскоклеточного рака головы и шеи, особенно интересен факт лучшего прогноза заболевания и высокой чувствительности опухоли к химиолучевому лечению у пациентов с определяемым папилломавирусом.
У ПКР головы и шеи есть общие особенности: увеличение частоты рака с увеличением возраста, трудность определения первоначальной локализации опухоли в связи с близостью границ различных отделов и органов, включающих полость рта, ротоглотку, полость носа, гортань и гортаноглотку. Общность проявляется также и в направлении метастазирования, преимущественно в регионарные лимфоузлы шеи.
Отдаленные метастазы достаточно редки и обнаруживаются, как правило, в легких, лимфоузлах средостения, реже — в печени и костях скелета. Костные поражения вторичного характера при плоскоклеточном раке головы и шеи происходят преимущественно путем местного распространения на соседние структуры. От локализации опухоли зависит симптоматика, тактика обследования, клиническое течение заболевания, характер метастазирования, прогноз заболевания, что в конечном счете определяет план оптимального лечения.
Стадирование рака головы и шеи
Разработана классификация по системе TNM для основных локализаций опухоли в области головы и шеи: губы и полости рта, ротоглотки, носоглотки, гортаноглотки, гортани, полости носа и ее придаточных пазух, слюнных желез, щитовидной железы.
Помимо системы TNM для оценки степени распространенности опухолевого процесса и оценки прогноза заболевания обязательно использование классификации рака по стадиям. В табл. 9.3 отражена классификация ПКР по стадиям и группировка по системе TNM для основных локализаций в области головы и шеи.
Таблица 9.3. Группировка плоскоклеточного рака головы и шеи по стадиям

Цель химиотерапии
Химиотерапия (XT) применялась ранее у больных раком головы и шеи в основном с паллиативной целью при неоперабельных распространенных опухолевых процессах, чаще рецидивного характера, с наличием отдаленных метастазов. В последние годы она используется в качестве равноправного компонента сочетанного воздействия вместе с хирургическим и лучевым методами лечения.
Лечение плоскоклеточного рака головы и шеи проблематично в основном из-за того, что на всех этапах развития болезни требуется тщательный мультидисциплинарный подход для выбора существующих опций лечения больных.
На рис. 9.1 показан мультидисциплинарный подход к лечению ПКР головы и шеи. В верхней части рисунка — возможные стадии развития опухолевого процесса; в средней части — возможные варианты применяемого консервативного лечения; в нижней части — хирургический метод лечения, использование которого возможно на любом этапе развития болезни как с лечебной, так и паллиативной целью.

Рис. 9.1. Схема мультидисциплинарного подхода к лечению плоскоклеточного рака головы и шеи
Таким образом, на сегодняшний день XT при плоскоклеточном раке головы и шеи применяется в следующих клинических ситуациях. При лечении первичных местнораспространенных опухолевых процессов в виде нескольких курсов индукционной (неоадъювантной) полихимиотерапии (ПХТ) перед хирургическим лечением или облучением. Индукционная химиотерапия позволяет отобрать пациентов с опухолями, чувствительными к дальнейшему лучевому лечению, и выполнить хирургическое вмешательство на ранних этапах в случае неудовлетворительного ответа на XT.
Индукционная XT не увеличивает количество осложнений от последующего хирургического вмешательства, снижает риск развития отдаленных метастазов и дает возможность сохранения органов, но не улучшает выживаемость. Основная критика использования индукционной химиотерапии заключается в том, что она применяется только для отбора пациентов и в дозах, недостаточных, чтобы оказать реальное влияние на их выживаемость.
В последние годы вошло в широкую клиническую практику применение конкурентного (сочетанного или одномоментного) химиолуиевого лечения, когда на фоне лучевой терапии больному вводят химиопрепараты, что обеспечивает повышение выживаемости, улучшение локорегионарного контроля и увеличение доли сохранения органов, что особенно важно при лечении рака таких локализаций, как гортань и гортаноглотка.
Логичным продолжением применения XT при местнораспространенных первичных опухолях стало появление схем так называемого последовательного, или секвентального, химиолучевого лечения. При данном виде лечения на первом этапе проводится несколько курсов индукционной ПХТ с последующим конкурентным химиолучевым лечением. Основными комбинациями, используемыми при индукционной полихимиотерапии, на сегодняшний день признаны цисплатин с 5-ФУ, доцетаксел с цисплатином и 5-ФУ. Последняя схема представляется как наиболее эффективная, но и наиболее токсичная.
При развитии рецидива опухоли и невозможности выполнения радикального хирургического вмешательства пациентам обычно предлагается XT как лечение первой линии. С точки зрения ограниченных возможностей лечения эта категория пациентов с ПКР головы и шеи давно нуждалась в более современных химиотерапевтических средствах, но за последние десятилетия не появилось комбинаций химиопрепаратов, улучшавших показатели выживаемости этой группы больных.
Стандартом лечения этих больных была комбинация цисплатина и 5-ФУ, но при этом применение комбинации этих препаратов лишь увеличивало количество ответов опухоли на химиотерапию, не изменяя показатели выживаемости пациентов. По последним данным, единственной комбинацией химиопрепаратов, дающей не только увеличение количества полных и частичных ремиссий, но и увеличивающей продолжительность жизни больных с рецидивами и отдаленными метастазами плоскоклеточного рака головы и шеи, считается схема с использованием цетуксимаба, цисплатина и 5-ФУ.
Отбор пациентов для проведения химиолучевого лечения
Для принятия решения о проведении химиолучевого лечения удобно пользоваться следующим разделением пациентов с первичными опухолевыми процессами области головы и шеи, когда речь идет о ПКР.

В настоящее время принято считать, что пациенты с ранними стадиями болезни успешно лечатся с применением лучевой терапии в самостоятельном варианте, ау пациентов с умеренными и распространенными стадиями могут применяться химиолучевые методы лечения.
Химиотерапия
Химиотерапия рака некоторых локализаций в области головы и шеи
При I и II стадиях рака гортани, как правило, проводится лучевая терапия или хирургическое лечение, при этом предпочтение отдается облучению. Стандартом лечения рака гортани III стадии является комплексный подход, включающий химиолучевое лечение, либо в виде нескольких курсов индукционной ПХТ с последующей лучевой терапией, либо в виде конкурентного химиолучевого лечения с операцией в случае неэффективности лучевой терапии.
Клиническими исследованиями доказано повышение эффективности лучевой терапии при проведении одновременной с ней химиотерапией или индукционной XT. Такой подход позволяетувеличить количество больных раком гортани III стадии, которым удается сохранить гортань, и этим улучшить качество их жизни.
При раке гортани IV стадии стандартом лечения является ларингэктомия с последующим облучением. Однако в настоящее время проводятся исследования по изучению возможности проведения на первом этапе неоадъювантной или одновременной с облучением XT.
При распространении регионарных метастазов до стадии N2 и N3 и полной регрессии первичной опухоли рекомендуется обязательное выполнение шейной лимфодиссекции на завершающем этапе лечения.
В начальных стадиях плоскоклеточного рака ротоглотки (I и II стадий) проводится лучевое лечение. Также возможно использование хирургического метода лечения. В этих случаях выбор метода лечения обусловлен в основном локализацией опухоли и предполагаемой степенью возможных функциональных послеоперационных нарушений.
При III и IV стадиях рака ротоглотки стандартом лечения является химиолучевой метод. Использование противоопухолевых препаратов в виде 1-2 курсов индукционной XT целесообразно при распространенных опухолевых процессах в расчете на уменьшение объема опухоли к моменту облучения.
При неоперабельных опухолях целесообразно проводить химиотерапию одновременно с облучением. По данным клинических исследований, в таких ситуациях XT позволяет улучшить местный контроль опухоли, а также улучшить безрецидивную и общую выживаемость по сравнению с одной лучевой терапией.
Кроме ПКР носоглотки сюда относятся также переходноклеточный рак и лимфоэпителиома (опухоль Шминке). При раке носоглотки XT, как правило, является компонентом химиолучевого лечения. Противоопухолевые препараты вводятся в виде 1-2 курсов до начала облучения.
Такая индукционная химиотерапия позволяет в значительной степени уменьшить объем опухоли носоглотки и, если имеются, регионарных метастазов. В случае высоко- и умеренно дифференцированного рака чаще используется комбинация цисплатина и 5-ФУ, но возможны и другие сочетания противоопухолевых препаратов. При недифференцированном раке так называемого носоглоточного типа, связанного с вирусом Эпштейна-Барр, высокоэффективна схема АЦОП + цисплатин.
При раке полости рта I стадии проводится операция или облучение. Стандартом лечения рака II стадии кроме операции или облучения может быть комбинация этих методов. При этих стадиях XT, как правило, не проводится.
Поскольку результаты хирургического, лучевого или комбинированного методов лечения распространенного рака полости рта, соответствующего III и IV стадиям, до настоящего времени остаются неудовлетворительными, многими исследователями проводятся клинические испытания, направленные на изучение роли дополнительной индукционной XT.
Показано, что неоадъювантная химиотерапия приводит к уменьшению размера опухоли и, тем самым, способствует большей радикальности операции или облучения. Относительно улучшения показателей безрецидивной и общей выживаемости при методах лечения, включающих XT, выводы пока неоднозначны, требуется продолжение проспективных рандомизированных исследований. Тем не менее XT стала составной частью комплексного лечения рака полости рта.
Рак слюнных желез в большинстве случаев имеет железистую природу. Основные методы лечения — операция и облучение, чаще в виде комбинации этих методов. Роль химиотерапии при раке слюнных желез изучается в серии клинических исследований.
Есть данные о том, что некоторые гистологические варианты рака слюнных желез могут быть чувствительны к XT. При неоперабельных формах рака исследуется эффективность химиолучевого воздействия с использованием схем, включающих цисплатин, циклофосфамид, 5-ФУ и доксорубицин.
Принципы лечения рака щитовидной железы определяются морфологическим вариантом опухоли и ее стадией. Для дифференцированного рака (папиллярная, фолликулярная и папиллярно-фолликулярная аденокарцинома) основным методом при I, II и III стадиях служит хирургическое лечение.
Возможно использование радиоактивного йода (131I) в расчете на снижение риска рецидива и метастазов. При IV стадии выполняется тиреоидэктомия, в дальнейшем, при наличии отдаленных метастазов, в зависимости от их способности накапливать изотоп применяется либо 131I, либо наружное облучение и гормонотерапия Т4. Известны попытки химиотерапии с использованием доксорубицинсодержащих комбинаций.
При недифференцированном раке щитовидной железы применение гормонотерапии бесперспективно. При медуллярных формах рака лечение начинают с операции, при III стадии — в сочетании с облучением. При наличии отдаленных метастазов медуллярного рака применяют XT с использованием доксорубицинсодержащих комбинаций. В последние годы при этой форме рака успешно применяется ИФН-а (роферон) и октреотид.
При анапластическом раке щитовидной железы в случае возможности используется хирургическое лечение и наружное облучение. Применяется XT. Наибольшая эффективность (около 30%) при раке щитовидной железы отмечается у доксорубицина и эпирубицина. Противоопухолевой активностью при этой форме рака обладает также цисплатин, блеомицин. Показано, что комбинация доксорубицина с цисплатином имеет преимущество перед применением одного доксорубицина.
В стадии клинических исследований находится изучение сочетанного химиолучевого лечения при анапластическом раке. При полном клиническом эффекте становится возможным выполнить операцию, что может улучшить выживаемость больных анапластическим раком.
Режимы химиотерапии
Ниже приведены схемы наиболее часто используемых режимов ПХТ при ПКР любой локализации в области головы и шеи. Они могут применяться в качестве индукционной XT с последующим хирургическим вмешательством или лучевой терапией, а также при рецидивных или метастатических опухолях.
1. Цисплатин — 100 мг/м2 в/в в 1-й день. 5-ФУ — 1000 мг/м2/сут в/в 96-часовая непрерывная инфузия в 1-4-й день. Повторение цикла каждые 21 (28) день.
2. Цисплатин — 100 мг/м2 в/в в 1-й день. 5-ФУ — 750 мг/м2/сутки в/в 120-часовая непрерывная инфузия в 1-5-й день. Повторение цикла каждые 21 день.
3. Карбоплатин — AUC 6 в/в 1-й день. 5-ФУ — 1000 мг/м2/сутки в/в 96-часовая непрерывная инфузия в 1-4-й день. Повторение цикла каждые 21 день.
4. Цисплатин — 75 мг/м2/сутки в/в в 1-й день. Капецитабин — 1000 мг/м2 внутрь 2 раза в сутки в 1-14-й день. Повторение цикла каждые на 21 день.
5. Паклитаксел — 175 мг/м2 в/в в 1-й день. Цисплатин — 75 мг/м2 в/в во 2-й день. Повторение цикла каждые 21 день.
6. Паклитаксел — 175 мг/м2 в/в в 1-й день. Карбоплатин — AUC 6 в/в в 1-й день. Повторение цикла каждые на 21 день.
7. Доцетаксел — 75 мг/м2 в/в в 1-й день. Цисплатин — 75 мг/м2 в/в в 1-й день. Повторение курса 21 день.
8. Доцетаксел — 75 мг/м2 в/в в 1-й день. Цисплатин — 75-100 мг/м2 в/в в 1-й день. 5-ФУ — 1000 мг/м2/сутки в/в 96-часовая непрерывная инфузия в 1-4-й день. Повторение цикла каждые 21 день.
9. Паклитаксел — 175 мг/м2 в/в в 1-й день. Цисплатин — 100 мг/м2 в/в во 2-й день. 5-ФУ — 500 мг/м2/сут непрерывная инфузия 120-часовая в 1-5-й день. Повторение цикла каждые 21 день.
10. Цетуксимаб — 400 мг/м2 в/в 2-часовая инфузия в 1-й день 1-го курса, затем 250 мг/м2 в/в 1-часовая инфузия в 8-й и 15-й дни и в 1-й день последующих курсов. Цисплатин — 75-100 мг/м2 в/в в 1-й день. 5-ФУ — 1000 мг/м2/сут в/в 96-часовая непрерывная инфузия в 1-4-й день. Повторение цикла каждые 21 день.
При проведении конкурентного одновременного химиолучевого лечения рекомендованы следующие курсы химиотерапии:
1. Цисплатин — 100 мг/м2 в/в в 1, 22 и 43-й дни лучевой терапии. Лучевая терапия в суммарной очаговой дозе (СОД) 66-70 Гр, разовой очаговой дозе (РОД) 2 Гр.
2. Цисплатин — 20 мг/м2 в/в еженедельно при проведении лучевой терапии. Лучевая терапия в СОД 66-70 Гр, РОД 2 Гр.
3. Карбоплатин — AUC 1,5 в/в еженедельно при проведении лучевой терапии. Лучевая терапия в СОД 66-70 Гр, РОД 2 Гр.
4. Цетуксимаб — 400 мг/м2 в/в 2-часовая инфузия за неделю до начала лучевой терапии, затем 250 мг/м2 в/в 1-часовая инфузия еженедельно при проведении лучевой терапии.
Лучевая терапия в СОД 66-70 Гр, РОД 2 Гр.
При проведении монохимиотерапии рекомендовано применение следующих схем:
1. Доцетаксел — 75 мг/м2 в/в в 1-й день. Повторение цикла через 21 день.
2. Паклитаксел — 175 мг/м2 в/в в 1-й день. Повторение цикла через 21 день.
3. Метотрексат — 40 мг/м2 в/в или в/м. Повторение цикла каждую неделю.
4. Винорелбин — 30 мг/м2 в/в. Повторение цикла каждую неделю.
5. Цетуксимаб — 400 мг/м2 в/в 2-часовая инфузия в 1-й день, затем 250 мг/м2 в/в 1-часовая инфузия еженедельно.
При эстезионейробластоме полости носа и недифференцированном раке носоглотки используется схема АЦОП с цисплатином в сочетании с лучевой терапией:
Доксорубицин — 40 мг/м2 в/в в 1-й день.
Циклофосфамид — 600 мг/м2 в/в в 1-й день.
Винкристин — 2 мг/м2 в/в в 1-й день.
Цисплатин — 100 мг/м2 в/в в 4-й день.
Преднизолон — 1 мг/кг внутрь в 1-5-й день.
Повторение цикла каждые 21 день.
При раке головы и шеи железистого происхождения (рак больших и малых слюнных желез, неоперабельный рак щитовидной железы) возможно применение следующих режимов медикаментозного противоопухолевого лечения:
1. Доксорубицин — 60 мг/м2 в/в в 1-й день. Цисплатин — 40 мг/м2 в/в в 1-й день. Повторение цикла каждые 21 день.
2. Дакарбазин — 200 мг/м2 в/в в 1-3-й день. Эпирубицин — 25 мг/м2 в/в в 1-3-й день. 5-ФУ — 250 мг/м2 в/в в 1-3-й день. Повторение цикла каждые 21 день.
3. Доксорубицин — 60 мг/м2 в/в в 1-й день. Блеомицин — 15 мг в/в в 1-5-й день. Винкристин — 1,4 мг/м2 в/в в 1-й и 8-й дни. Повторение цикла каждые 21 день.
4. Винкристин — 1,4 мг/м2 в/в в 1-й день. Доксорубицин — 60 мг/м2 в/в в 1-й день. Циклофосфамид — 1000 мг/м2 в/в в 1-й день. Повторение цикла каждые 21 день.
Читайте также: