Пнет что за опухоль
Незрелая периферическая нейроэктодермальная опухоль ( Аскина )
А.Н.Махсон , М.С.Попов, И.В.Кузьмин, М.С.Бурлаков, К.К.Пугачев, М.И.Попов
(Московская городская онкологическая больница № 62)
Незрелая * периферическая нейроэктодермальная опухоль (НПНО) - недифференцированная высоко злокачественная саркома, развивающаяся скорее всего из мигрирующих эмбриональных клеток неврального гребешка ( peripheral primitive neuroectodermal tumor - PNET ). Описана в различных органах и системах под разными названиями. Синонимы: мелкоклеточная недифференцированная опухоль грудной стенки, злокачественная мелкоклеточная торакопульмональная опухоль, примитивная нейроэктодермальная опухоль, эктомезенхимома , эпендимобластома , “ нейробластома ”, нейроэпителиома .
Терминология . Злокачественные нейроэпидермальные опухоли – это целая группа новообразований из мелких круглых клеток, включающая нейробластому , рабдомиосаркому , лимфомы и саркому Юинга . Эти опухоли развиваются из нейроэктодермы головного и спинного мозга, автономной нервной системы и частично из нейроэндокринных образований. Соответственно различают центральные и периферические злокачественные нейроэпидермальные опухоли ( cPNET и pPNET ). По определению НПНО никогда не возникают из симпатической нервной системы и локализуются вне позвоночника ( Dehner L . P .,1986 и 1993; Coffin C . M ., 1989; Schmidt D et al ., 1991).
Наиболее часто первичный очаг локализуется в костях и мягких тканях грудной клетки, в брюшной полости, в тазу и нижних конечностях, однако описаны и изолированные поражения легкого, и других органов. Встречается в основном у больных 3-38 лет в основном у подростков и молодых людей, преимущественно у лиц женского пола. Некоторые авторы отмечают преимущественное правостороннее расположение опухоли. Описаны НПНО, возникшие из периферических нервов. Подобное наблюдение, по-видимому первым описал A . P . Stout еще в 1918 г. Злокачественную “ мелкокруглоклеточную ” опухоль торакопульмональной зоны как особую клинико-морфологическую нозологическую форму впервые выделил в 1979 г. крупный современный американский морфолог F . B . Askin . Он считал, что опухоль может исходить только из грудной стенки. В отличие от других форм НПНО она чаще встречалась у девочек и вызывала системные симптомы: лихорадку, потерю аппетита и массы тела, кашель, одышку. В настоящее время в основном пользуются термином “НПНО грудной стенки”. Другими словами, “опухоль Аскина ” – это атипичная форма саркомы Юинга с невральными признаками дифференцировки. Иммуногистохимически обычно удается доказать нейроэктодермальную принадлежность опухоли, а цитогенетически – связь с саркомой Юинга (см табл № 1).
Клинически НПНО проявляется быстро растущей болезненной опухолью с локальным инфильтрирующим ростом. Довольно долго считали, что незрелая опухоль малочувствительна к химиотерапии и облучению. Иногда первичный очаг проявляется множественными узлами, поражающими плевру.
До 1999 г. описано около 280 наблюдений НПНО ( Inada K . et al .1994, Shamberger R . C . et al .,1994, Sabana th an S et al .,1997) . В отечественной литературе этой опухолью заинтересовались сравнительно недавно. До лечения никто из отечественных онкологов ее не диагностировал, хотя давно опубликованы прекрасные обзоры зарубежной литературы по этому вопросу (Юрин А.Г., Иванова А.Ю., 1994 (?)., Смирнов А.В., Соловьев Ю.Н., 1995).
Наше сообщение представляет интерес, как с диагностической точки зрения, так и в отношении выбора метода лечения, а также его результатов. Подробный анализ возникающих при этом проблем поможет в онкологических клиниках выработать оптимальную схему диагностических и лечебных мероприятий в каждом индивидуальном случае.
Больной Б., студент 21 года . ( и /б 2001) поступил в больницу № 62 5.02.98 г. с жалобами на боли в области грудины и увеличение опухоли в области тела грудины.
В ноябре 1997 г. через 4 месяца после ушиба заметил небольшую опухоль в области грудины, которая стала быстро увеличиваться. Периодически появлялись боли в зоне 4-5 ребер справа и слева, отмечалось повышение температуры до 37,5 0 С. Больной подчеркивал , что опухоль периодически уменьшалась в размерах без лечения. Обратился к врачу в декабре 1997 г. В январе 1998 г. направлен к онкологу, затем в Московскую городскую больницу № 62.
В анамнезе - пролапс митрального клапана. Наследственность не отягощена. Ранее отмечал аллергическую реакцию на пенициллин.
В нижней трети грудины на уровне 4-5 ребер справа и 5 ребра слева определяется опухоль размерами 6 х 4 см, плотно-эластической консистенции с флюктуацией в центре.
Рентгенологически в средней трети переднего средостения определяется узловое образование, прилегающее к передней грудной стенке 9х4 см. А этом же уровне по передней поверхности грудной стенки определяется мягкотканный компонент 2х7 см полуовальной формы без четких границ. Заключение: опухоль грудной стенки с прорастанием в средостение.
На рентгенограммах черепа - признаки повышенного внутричерепного давления и увеличение турецкого седла 1,5х 1 см. В затылочно-теменной области справа определяется округлая тень 1,7 см в диаметре с плотной капсулой (киста).
При КТ начиная с уровня бифуркации трахеи определяется мягкотканное многоузловое образование размерами 9х7,5х6,6 см неоднородной структурой, плотность +50 Ед Хаунсфильда . Инфильтрирующая грудину (деструкция нижней трети тела). Имеется деструкция в нижней трети тела грудины, прилежащие реберные хрящи, подкожную клетчатку, прорастает в переднее средостение, интимно прилежит к передним отделам сердца и скорее всего прорастает перикард. Клетчатка верхнего отдела средостения неравномерно уплотнена с наличием увеличенных лимфатических узлов на этом фоне. Заключение: картина злокачественной опухоли грудной стенки, прорастающей в переднее средостение и, вероятно, перикард.
При эхокардиографии отмечен пролапс митрального клапана. Полости сердца и аорта – без особенностей. Умеренная гипертрофия миокарда левого желудочка. Параметры центральной гемодинамики – в пределах возрастной нормы. В надключичной области слева выявлен один уплощенный лимфатический узел диаметром до 1,8 см гиперпластического характера. Патологии почек, печени, селезенки, поджелудочной железы не выявлено.
ЭКГ - синусовая тахикардия, вертикальное положение электрической оси сердца. Повышенная нагрузка на правые отделы сердца.
Белковые фракции от 06.02.98 г. - слабо выраженная альбуминемия и умеренная гипергаммаглобулинемия . Коэффициент А /Г 1,29.
Сывороточные онкомаркеры : РЭА, СА 125, Cifra 21-1, в2- MG и Са 19-9 - в пределах нормы. Несколько повышен уровень нейронспецифической енолазы - 12 нг /мл
Аспирационная биопсия тонкой иглой № 2365-78: в большинстве препаратов - большое количество “ бластных ” клеток, принадлежащих скорее всего злокачественной опухоли (рис. 1).
12.02.98 г. - открытая биопсия: удалены фрагменты опухоли грудины. Создается впечатление, что опухоль прорастает все ткани до кожи. Гистология № 416/3937-41 от 12.02.98: кусочки мышечной и жировой ткани с воспалительным процессом. Элементов опухоли не обнаружено.
23.02.98 - повторная биопсия ( инцизионная первичного очага и прескаленная ): вертикальный разрез кожи над опухолью. Грудина разрушена, в нижней ее трети имеется опухоль типа “рыбьего мяса”. Вырезаны небольшие кусочки опухоли спереди и в области загрудинного пространства. В опухолевой массе имеются полости распада, содержащие детрит.
Гистологическое исследование № 503/4663-74 от 23.02.98 (препараты консультированы проф. И.Г.Ольховской и Ю.Н.Соловьева) фрагменты белесовато-розовой ткани до 1 см в диаметре - мелкоклеточная опухоль типа Аскина , лимфатические узлы с явлениями гиперплазии.
Иммуногистохимическое исследование препаратов с использованием реагентов фирмы “ DAKO ”: изучена экспрессия маркеров эпителиальной дифференцировки ( цитокератинов широкого спектра) АЕ 1 /АЕ3 – отрицательная реакция во всех препаратах. Общий лейкоцитарный антиген – отрицательная реакция в клетках опухоли и интенсивная в лейкоцитах паренхимы и стромы. SP -1 и ЭПА-1 (эмбриональный преальбумин ) – отрицательная реакция. Маркер глиальных клеток S -100 – положительная реакция приблизительно в 30% клеточных структур. Положительная реакция средней и слабой интенсивности на синаптофизин (маркер нейроэндокринных клеток) отмечена внутри примерно в 60% злокачественных элементов. Заключение: опухоль из мелких круглых клеток с признаками нейроэндокринной и гистиоидной дифференцировки
Диагноз: незрелая периферическая нейроэктодермальная опухоль грудной стенки с поражением тела грудины (опухоль Аскина ).
С 6 марта по май 1998 г. проведено 3 курса полихимиотерапии : суммарно винкристин 6 мг, циклофосфан 2,4 г, фарморубицин 340 мг, платидиам 150 мг. Переливалась кровь, плазма. Клинически отмечена положительная динамика, после первого курса химиотерапии опухоль уменьшилась на 1 см. При КТ размеры, форма и структура основной массы опухоли остались прежними. Однако по сравнению с данными предыдущего исследования экстраторакальный компонент образования существенно уменьшился в размерах.
24 июня 1998 г. выполнена резекция тела грудины, хрящевых отрезков 4-6 ребер с обеих сторон, пластика дефекта правосторонним кожно-мышечно-реберным торакодорзальным лоскутом. S -образным разрезом кожи от 3 ребра слева до реберной дуги справа, окаймляющим опухоль, рассечены кожа, подкожная клетчатка и мышцы. Произведена поднадхрящничная резекция хрящевых отрезков 2-6 ребер с обеих сторон. В области 2-го межреберья перевязаны внутригрудные сосуды. Внутригрудной компонент опухоли справа спаян с медиастинальной плеврой. Этот участок плевры резецирован. Средостенный компонент опухоли (без признаков инфильтрирующего роста) острым путем выделен с клетчаткой средостения. Резецированы межреберные мышцы 2-6 ребер с перевязкой межреберных сосудов. Дефект правой плевры ушит непрерывным швом. Плевральная полость дренирована двумя трубками. Больной повернут на левый бок. Справа выкроен торако-дорзальный кожно-мышечно-реберный лоскут на питающей ножке. Реберный фрагмент выделен из расщепленного 8 и 10 ребер. 9 ребро выделено поднадкостнично . Костно-мышечный дефект в области донорского лоскута ушит узловыми швамии с предварительной установкой дренажей. Фрагменты ребер донорского лоскута фиксированы проволокой к хрящевыми отрезками 3-5 ребер. Переднее средостение дренировано. Правая и левая реберные дуги фиксированы между собой атравматической нитью ( пролен ). Лоскут подшит отдельными узловыми швами к окружающим мышцам и коже.
Через 8 месяцев после операции рецидива и метастазов опухоли не обнаружено. Продолжает учебу в институте. Легочной недостаточности не отмечено. Косметический эффект хороший (рис. 3).
Диагностика НПНО трудна даже при использовании современных методов. Уже при обращении к врачу у 14-50% больных имеются отдаленные метастазы.
Рентгенологически обычно выявляется объемное образование грудной стенки, разрушающее ребра. Иногда НПНО проявляется медиастинальным образованием или в области позвоночника. В редких случаях очаг опухоли содержит обызвествление ( Askin 1979; Saifuddin A . et al . 1991)
Магнитно-резонансное исследование дает возможность получить на Т1-взвешенном изображении НПНО сигнал той же интенсивности, как и от мышц. Иногда видны участки кровоизлияний и некрозов. Большие опухоли выглядят как гетерогенные образования. НПНО небольших размеров обычно гомогенны . При контрастировании опухоли отмечается быстрое усиление контраста изображения ( Sabate J . M . et al .,1994).
Эхограф ия иногда выявляет кистозный компонент опухоли. Редко удается выявить участки обызвествления. При значительном распространении опухоли часто обнаруживается выпот в плевре.
При сцинтиграфии очаги НПНО накапливает 67 Ga и 201 Tl . В целях прослеживания эффекта лучевой и химиотерапии терапии более рационально использовать в качестве маркера 201 Tl ( Howman-Giles R. et al ., 1995).
Как правило, пункционную биопсию тонкой иглой приходится повторять в связи с недостаточным количеством материала или его неинформативностью . То же можно сказать и о трепан-биопсии . Даже открытая биопсия опухоли далеко не всегда позволяет уточнить морфологический диагноз. Во многих случаях гистологические препараты приходится посылать в крупные онкологические центры. Наиболее частый предположительный диагноз “ нейроэктодермальная опухоль карциноидного типа”.
Тем не менее, некоторые авторы имеют опыт цитологической диагностики НПНО. Цитологическая картина опухоли довольно подробно описана. Она мало отличается от клеточной структуры саркомы Юинга , а иногда и нейробластомы . Только иммуноцитохимический анализ и электронная микроскопия пунктата тонкой иглой дает возможность точно установить гистогенез опухоли ( Silverman J . F ., 1988; Kumar P . V ., 1993; R av insk y E . et al .,1997).
Макроскопическая картина НПНО не имеет специфических особенностей. Обычно выявляют мягкую беловато-серую опухоль 9-15 см в диаметре с очагами некроза. Как и при нейробластоме или саркоме Юинга для НПНО характерна высокая клеточность с относительно мономорфным рисунком из незрелых мелких круглых клеток, в основном без явных признаков нейродифференцировки . со скудной цитоплазмой и пузырьковидным гиперхромным ядром. Клетки образуют дольчатый рисунок среди фиброзно-сосудистой стромы в виде перегородок. Нередко клеточные скопления образуют плотные листки с альвеолярным рисунком и с полями некроза. Каждая из описанных структур повторяется в отдельных новообразованиях с разной частотой в зависимости от индивидуальных особенностей НПНО. Митозы встречаются с различной частотой. В отдельных участках препарата мелкие овальные злокачественные клетки располагаются радиально вокруг узких пространств, образуя розеткоподобные структуры.
Диагностический алгоритм строится на методе исключения. Классические псевдорозетки ( Хомер-Райта ) на гистологических срезах удается выявить с трудом, однако при тщательном просмотре всего препарата эти образования можно обнаружить. Иногда встречаются и истинные розетки Флекснера .
Уточняющее иммуногистохимическое исследование обычно включает окраски на нейроэндокринные маркеры ( нейрон-специфическая енолаза , хромогранин и синаптофизин ) для исключения карциноидной опухоли. Иногда отмечается слабо положительная реакция на специфический маркер саркомы Юинга HPA -71. При этом характерно отсутствие кератина и других признаков эпителиального происхождения опухоли. Большинство клеток имеют полигональную форму. Равномерное распределение хроматина. Ядра - с 1-4 ядрышками (см. табл. № 1). В нашем наблюдении отмечено некоторое повышение уровня нейронспецифической енолазы , а клетки опухоли содержали синаптофизин (эт от маркер может содержать также карциноид ). Аналогичные данные получили и другие исследователи ( Wick M . R . et al .,1988).
На ультраструктурном уровне удается выявить анастомозирующие отростки цитоплазмы, могут определяться плотные нейросекреторные гранулы, нейротубулы и нейрофиламенты в хорошо выраженном аппарате Гольджи . Значительное количество рибосом и полирибосом . Митохондрии разного размера собираются у одного полюса клетки, грубый эндоплазматический ретикулум проявляется в небольшом количестве. Плотные гранулы достигают 300-500 нм в диаметре.
В первую очередь следует исключить рабдомиосаркому , опухоль Юинга , метастазы недифференцированной нейробластомы , злокачественную лимфому . Известно, что эктопическая нейробластома может локализоваться в грудной стенке. Особое внимание следует уделять исключению этой патологии при паравертебральном и медиастинальном расположении НПНО. С другой стороны описана изолированная первичная НПНО легкого ( Cevallaro Catalan R . L ., Murphy Th .,1997).
H . Jurgens et al .( 1988) пересмотрели препараты всех НПНО из 23 учреждений. НПНО подтверждена в 42 наблюдениях. В 24 из них пришлось изменить диагноз. Прежнее заключение: у 16 больных – опухоль Юинга , у 5 – нейробластома , у 2 – рабдомиосаркома , у 1 – лимфома . Приблизительно в 2/3 наблюдений в клетках НПНО определяется нейрон-специфическая енолаза и положительная ШИК-реакция. D . Schmidt et al .( 1991) нейроэпителиальное происхождение опухоли считали доказанным, если получена положительная реакция на два разных маркера или при наличии розеток Homer - Wright ’ a . В случае затруднений удобно использовать диагностические параметры из таблицы № 1.
Таблица № 1 Дифференциальная диагностика сарком грудной стенки из мелких круглых клеток


- Публикации
- Словарь терминов
- Мы и СМИ
- Новости







Примитивные или зрелые злокачественные нейроэктодермальные новообразования (neuroectodermal tumor) развиваются не из эпителия, как большинство раковых клеток, а из нейроэктодермы — клеточного материала головного или спинного мозга, вегетативной нервной системы и нейроэндокринных образований.
В зависимости от степени дифференциации и очага поражения нейроэктодермальные опухоли разделяются на две обширные группы: примитивные нейроэктодермальные опухоли кости (опухоли Аскина), являющиеся атипичным проявлением саркомы Юинга, и нейроэктодермальные опухоли — новообразования мягких тканей организма, чаще всего поражающие центральную нервную систему, а также головной мозг.
И в том, и в другом случае нейроэктодермальные опухоли относятся к опаснейшим онкологическим заболеваниям, которые чаще всего встречаются в возрасте от 3 до 20 лет, особенно у мальчиков.
Примитивная нейроэктодермальная опухоль фенотипически почти идентична саркоме Юинга. Это рыхлое мягкое злокачественное новообразование светло-серого цвета с обширными участками кровоизлияний и некрозов. Гистологические исследования характеризуют раковые клетки этой группы несколько меньшим содержанием гликогена, а также наличием в продуцированной ткани так называемых розеток Хомера-Райта, сформированных фибриллярным компонентом, протекающим между клетками. Также в опухолевом веществе часто встречаются кисты, возможно появление участков обызвествления и псевдоостеоидных образований — игл как при остеогенной саркоме хотя нейроэктодермальные иглы отличаются более упорядоченной структурой.
Опухоль состоит из незрелых мелких слабодифференциированных, быстро пролиферирующих раковых клеток, отличающихся высокой вирулентностью и способностью к инфильтрации. Наиболее типичные участки локализации опухоли Аскина — ребра, лопатки, грудная стенка, область малого таза, берцовые и бедренные кости. Разрушая кортикальный слой кости, опухоль быстро прорастает в окружающие ее мягкие ткани. Метастазы, в отличие от саркомы Юинга, способны распространяться не только в печени и других органах, но также проникать в сосуды и лимфатические узлы. Возможна инфильтрация в кости черепа, что в большинстве случаев приводит к летальному исходу. Если при саркоме Юинга пятилетняя выживаемость без возникновения рецидива болезни составляет порядка 70%, то при опухоли Аскина — не более 10%.
Среди нейроэктодермальных новообразований, поражающих мягкие ткани (ЦНС и оболочки мозга), выделяют внешне- и внутричерепные. Последние наиболее опасны, так как даже доброкачественные опухоли головного мозга обычно приводят к сдавливанию последнего стенками черепа или перекрытию ликворопроводящих путей, что способно вызвать тяжелейшую гипоксию и интоксикацию мозга. В нейроонкологии известны такие заболевания как астроцитома, глиобластома, эпендимома, медуллобластома, папиллома. Медуллобластома, особенно часто встречающаяся у детей (мальчиков 2-7 лет), — нейроэктодермальная опухоль мозга, образованная наиболее незрелыми клетками — медуллобластами. Продуцированные клетки медуллобластомы мелкие, слабодифференциированные, отличаются высочайшей вирулентностью и способностью к инфильтрации. В ткани опухоли встречаются розетки Хомера-Райта, кисты, а также детрит. Локализуются, как правило, в черве мозжечка, поражая ствол ЦНС, прорастая в мягкий кортикальный слой мозга и распространяясь метастазами по ликворопроводящим путям.
Симптомокомплекс при нейроэктодемальных опухолях характеризуется быстрым и болезненным при пальпации ростом новообразования. Если на начальном этапе развития саркомы боли носят местный и периодический характер, как правило, усиливаясь по ночам, то впоследствии усиливаются и становятся общими, существенно снижая качество жизни больного. Другими характерными симптомами являются лихорадка, тяжелая интоксикация, бессонница на фоне общей анемии, потеря аппетита, снижение массы тела, кашель, одышка. Поражение центральной или вегетативной нервной системы дополняет комплекс нейрологическими симптомами, среди которых повышенная возбудимость, раздражительность, страх.
Прогноз для любого типа нейроэктодермальных новообразований до сегодняшего дня остается крайне неблагоприятным, так как они очень плохо поддаются первичной диагностике. Большинство больных диагностируется чаще всего уже с обширными метастазами. При медуллобластоме мозга у детей прогноз относительно благоприятен, только если опухоль еще не успела диссеминировать. Отсутствие или незначительность метастазов гарантируют пятилетнюю выживаемость для 70% больных, хотя по статистике более чем у половины больных по истечении пятилетнего периода могут наблюдаться рецидивы. Для примитивной костной опухоли Аскина полное излечение на ранней стадии гарантировано в 10-20% случаев, пятилетняя выживаемость — в 62-70%.
Имеющиеся на сегодняшний день методы диагностики нейроэктодермальных опухолей включают рентгенографию, гистологические исследования, биопсию, внутривенное контрастирование, компьютерную и магнитно-резонансную томографию, радиоизотопное сканирование. Эти и другие методы позволяют максимально точно определить первичную локализацию опухоли, обнаружить метастазы в мягких костных тканях, а также в лимфатических сосудах и ликворопроводящих путях. Магнитно-резонансная томография дает возможность наиболее подробно изучить мягкие ткани, костный и головной мозг. С помощью МРТ нередко удается выявить самые мелкие очаги нейроэктодермальных новообразований, что особенно важно для благоприятного прогноза заболевания.
Лечение при нейроэктодермальных опухолях, как и при других онкологических заболеваниях, основано на наиболее рациональных схемах лучевой и полихимиотерапии. Хирургическое вмешательство показано в любом случае, хотя больше половины из них оказываются неоперабельными из-за обширной диссеминации. Считается, что примитивная нейроэктодермальная опухоль, будучи незрелой, плохо поддается воздействию лучевой терапии, однако облучение общей дозой не менее 20-60 Гр в сочетании с тщательно подобранной химиотерапией — единственно возможный способ лечения детей. При опухолях типа медуллобластомы производят интенсивное облучение мозжечкового червя, а также всего головного мозга и канала ЦНС. При костных новообразованиях воздействуют на пораженный участок. В химиотерапии применяют цитостатики, винкористин, актиномицин-Д, циклофосфамид, адриамицин.
Все применяющиеся на сегодняшний день методы лечения онкологических заболеваний даже если и способствуют выздоровлению, сопряжены с различными, в том числе тяжелыми, побочными эффектами, так как, убивая раковые клетки, лучевая и химиотерапия убивает и здоровые. Онкологи всего мира ищут способ, как сделать воздействие противораковой терапии точно направленным. До сего времени это им так и не удалось, однако недавно американскими учеными был найден вирус, который пролиферирует и паразитирует исключительно на измененных раковых клетках, не причиняя абсолютно никакого вреда клеткам здоровым. Неужели долгожданное, столь желанное для всего человечества, универсальное лекарство от рака наконец-то найдено?
Помочь детям с заболеванием нейроэктодермальные опухоли
На данный момент на попечении нашего фонда нет детей с данным диагнозом. Однако вы можете помочь больным детям с другими диагнозами!
Этот термин охватывает большое количество разных видов опухолей, которые раньше имели самостоятельные названия, которые, однако, имеют общие патологические черты, которые указывают на их происхождение из примитивных нейроэктодермальных клеток (хотя действительный тип клеток, их которых они происходят, пока не установлен). В эту группу входят: медуллобластома (наиболее распространенная из ПНЭО), ретинобластома, пинеобластома, нейробластома, эстезионейробластома, эпендимобластома и полярная спонгиобластома.
Эти опухоли могут распространяться по ЦСЖ как спонтанно, так и в результате иатрогенных процедур (после операции или шунтирования, но последнее является редкой причиной диссеминации опухоли). Поэтому всем пациентам с ПНЭО необходимо проводить обследование СМ (МРТ с гадолиниумом обладает такой же чувствительностью для определения mts , как и миелография с ворорастворимым КВ) и цитологическое исследование ЦСЖ. После хирургического удаления опухоли показана профилактическая краниоспинальная ЛТ. У детей проведение краниальной ЛТ вызывает нарушения умственной деятельности и задержку роста. Если только это возможно, то, пока ребенку не исполнится 3 года, ее стараются не проводить. Возможны также mts за пределами нервной системы.
Медуллобластома
Медуллобластомы (МБС) составляют 15-20% внутричерепных опухолей у детей и являются наиболее частыми злокачественными мозговыми опухолями у детей. Пик встречаемости приходится на первую декаду. ♂:♀=2:1. Обычно МСБ возникают из червя мозжечка в области вершины крыши IV желудочка (фастигиум). Такая локализация предрасполагает к раннему возникновению окклюзионной ГЦФ. Основные симптомы, которыми проявляется опухоль: Г/Б, Т/Р, туловищная и аппендикулярная атаксия.
Обычно МБС имеет вид плотной массы, расположенной по средней линии, которая накапливает КВ при КТ.
МБС очень чувствительна к ЛТ и умеренно к ХТ.
Предвестниками плохого прогноза являются небольшой возраст пациента (особенно если mts встречаются у 5% пациентов, чем иногда способствует шунтирование (хотя это и не является частой причиной).
Диагностика
Метод выбора: хирургическое удаление максимально возможного количества опухоли (но так, чтобы это не привело к неврологическим нарушениям) с последующей краниоспинальной ЛТ (облучение необходимо в связи со склонностью к рецидивам и обсеменению). Лучше оставить небольшую часть опухоли в стволе мозга (обычно эти пациенты чувствуют себя неплохо), чем пытаться удалить любой ее остаток (возникновение неврологического дефицита при этом намного более вероятно).
ЛТ : оптимальный режим: 35-40 Гр на весь крайно-спинальный отдел + 10-15 Гр локально на опухолевое ложе (обычно это ЗЧЯ) и на любой участок СМ, где есть mts . Весь этот курс должен быть проведен в течение 6-7 нед. В возрасте
Химиотерапия : стандартного режима ХТ нет. В основном используются CCNU и винкристин, но обычно их используют для лечения рецидивов, пациентов с высоким риском и детей
Шунтирование: после резекции опухоли ЗЧЯ 30-40% детей требуется постоянное ВПШ. Риск обсеменения в результате произведенного шунтирования оценивается в 10-20%, но, вероятно, это преувеличение. В прошлом часто использовались опухолевые фильтры. В настоящее время их используют меньше, т.к. при этом возрастает количество закупорок системы.
Пациентов с остаточной опухолью на послеоперационных МРТ и негативными результатами исследования ЦСЖ расценивают как благоприятных; 5-летний срок выживания у них составляет 75%. Неблагоприятными считают пациентов, имеющих большую остаточную опухоль, диссеминацию в ГМ, СМ или ЦСЖ. Они имеют худший прогноз. 5-летний срок выживания для них составляет 35-50%.
Эпендимобластома
Эмбриональная форма эпендимальной опухоли с большим количеством клеток. Чаще всего возникает в возрасте
Саркому Юинга и примитивную нейроэктодермальную опухоль (PNET), которые являются первичными злокачественными образованиями из мелких круглых клеток и поражают кости и мягкие ткани, относят к одной группе опухолей.
Саркома Юинга и PNET имеют схожий нейрогенный фенотип, т.к. ассоциируются с одинаковой хромосомной транслокацией. Саркому Юинга и PNET рассматривают как варианты одной опухоли, различающиеся по дифференцировке. Опухоли с нейрогенной дифференцировкой относят к PNET, недифференцированные — к саркоме Юинга (данное разделение не имеет клинической значимости).
Саркома Юинга/PNET составляет 6-10% первичных злокачественных опухолей из костной ткани и занимает среди всех злокачественных опухолей костей у детей второе место по распространности после остеосаркомы. Саркома Юинга/PNET отличается самым ранним возрастом манифестации: большинство пациентов — дети 10-15 лет (80% опухолей развивается у пациентов моложе 20 лет). Мальчики болеют немного чаще, чем девочки, а лица с темным цветом кожи — значительно реже представителей европеоидной расы.
Большинство сарком Юинга/PNET сопровождается транслокацией, вовлекающей ген EWS, который расположен на 22-й хромосоме и кодирует факторы транскрипции семейства ETS. Чаще всего вовлекается ген FLI1 в результате транслокации t(11;22)(q24;ql2).
Ген, образованный слиянием указанных регионов, продуцирует химерный фактор транскрипции, нарушающий экспрессию сети генов-мишеней, что приводит к атипичной пролиферации клеток и их устойчивости к апоптозу. По данным других исследований, саркома Юинга/PNET может развиваться из мультипотентной мезенхимальной стволовой клетки.
а) Морфология. Саркома Юинга/PNET развивается в костномозговом канале и поражает кортикальный слой кости, периост и окружающие мягкие ткани. Опухоль представляет собой мягкую светло-коричневую массу, часто с очагами некроза и кровоизлияний. При микроскопии представлена тяжами мономорфных мелких округлых клеток, размером немного крупнее лимфоцитов. Клетки содержат небольшое количество светлой богатой гликогеном цитоплазмы.
Наличие розеток Гомера-Райта (опухолевые клетки располагаются вокруг центрального фибриллярного пространства) является признаком нейрогенной дифференцировки. Строма в опухолях скудная, несмотря на небольшие фиброзные прослойки. При достаточно богатой клеточности митотическая активность опухоли относительно низкая.
б) Клинические признаки. Саркома Юинга/PNET в основном развивается в диафизах длинных трубчатых костей, чаще в бедренной, и плоских костях таза. Проявляется в виде растущей болезненной опухоли, часто с классическими признаками воспаления (отек, повышение температуры, напряжение мягких тканей). У некоторых пациентов развивается паранеопластический синдром — субфебрильная лихорадка, повышение скорости оседания эритроцитов (СОЭ), анемия, лейкоцитоз, — что создает ложное впечатление инфекции.
На рентгенограмме выявляется деструктивная литическая опухоль с нечеткими краями, прорастающая в окружающие мягкие ткани. В результате реактивных изменений периоста формируются костные структуры по типу луковой шелухи.
Лечение комплексное и включает химиотерапию, хирургическое удаление опухоли, в некоторых случаях — облучение. Применение химиотерапии позволило улучшить прогноз с 5-15 до 75% 5-летней выживаемости. Не менее 50% пациентов проходят длительный курс лечения. Важным прогностическим признаком является выраженность некроза в опухоли после химиотерапии. Также для определения прогноза проводят генетическое исследование.
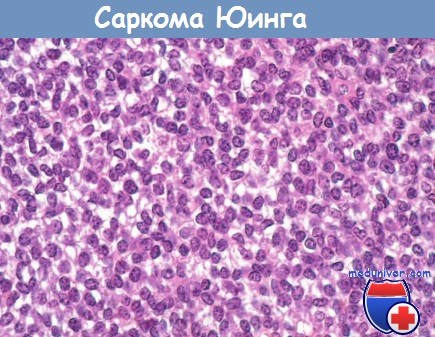
Саркома Юинга.
Видны тяжи мелких круглых клеток с небольшим количеством светлой цитоплазмы.
Читайте также:

