Планеты с хлором в атмосфере
Ученые, изучающие атмосферу над городом Барроу (Аляска), обнаружили высокую концентрацию хлора в воздухе, что может грозить экологической катастрофой. Это первое исследование такого рода в Арктике и первое беспрецедентное засвидетельствованное содержание молекулярного хлора в атмосфере, пишет информационный ресурс TG Daily.

Молекулярный хлор, высвобожденный из морской соли в результате таяния морских льдов, под воздействием солнечного света образует атомы хлора. Эти атомы обладают высокой реакционной способностью и могут окислять многие компоненты атмосферы, в том числе метан и элементарную ртуть, а также активировать бром. Окисленная ртуть имеет большую химическую активность и может накапливаться в арктической экосистеме.
Никто не ожидал увидеть в Барроу или в приполярных районах такой уровень хлора, — говорит профессор Грег Хью из Технологического института Джорджии в Атланте.
Исследование, проведенное при содействии Национального научного фонда в рамках международной междисциплинарной программы OASIS, было опубликовано в журнале Nature Geoscience.
Исследователи напрямую измерили уровень молекулярного хлора в Арктике весной 2009 года методом масс-спектрометрии с химической ионизацией. Сначала ученые скептически отнеслись к полученным данным и в течение нескольких лет проводили другие эксперименты, чтобы обеспечить точность сделанных выводов.
Уровень молекулярного хлора над Барроу составил 400 частиц на триллион – очень высокая концентрация, учитывая недолговечность атомов хлора в атмосферном воздухе из-за их сильных окислительных свойств и высокой реакционной способности с другой атмосферной химией.
Концентрация молекулярного хлора достигает своего пика ранним утром и к вечеру. Ночью она падает почти до нуля. Средние дневные уровни молекулярного хлора коррелировались с измерениями озона, предполагая, что в образовании молекулярного хлора принимали участие солнечный свет и озон.
Предыдущие исследования Арктики свидетельствуют о высоких уровнях окисленной ртути в Барроу и других приполярных районах. Основной причиной здешнего накопления элементарной ртути являются углеперерабатывающие заводы по всему миру. Весной количество озона и элементарной ртути в небе над городом уменьшается, ее замещают галогены – хлор и бром, поступающие туда с таянием морского льда.
Молекулярный хлор имеет высокую реактивность. Это окажет очень сильное влияние на химический состав атмосферы, — говорит Хью.
Исследование показало, что атомы хлора являются доминирующим окислителем в Барроу. Исследуемая область относится к региону с небольшим содержанием окислителей в атмосфере, что вызвано отсутствием там водяного пара и озона. Источником молекулярного хлора является хлорид натрия, который содержится в морской соли. Каким образом морская соль превращается в молекулярный хлор, ученым еще предстоит выяснить.
Нам действительно незнаком этот механизм. Он пока остается загадкой. Наблюдается кардинальное изменение морского льда, так что сейчас трудно что-либо прогнозировать, — говорит исследователь.
Ученым точно известно, что уменьшение полярного морского льда ускоряется. Таяние ледников может выбросить еще больше молекулярного хлора в атмосферу, что вызовет непредсказуемые изменения климата.

Нас с детства учили, что на Земле существует шесть континентов и шесть частей света, правда, они не строго соответствуют друг другу. Там, где Америка делится на северную и южную с точки зрения континентов, они составляют одну часть света — Америку. Евразия, наоборот, один континент, который делится на две части света: Европу и Азию. Вроде, все […]

По расчетам ученых, на нашей планете располагается более 500 тысяч островов. Большинство из них расположены вблизи Японии, Индонезии, Филиппин, Норвегии и других стран. В нашем представлении острова кажутся райскими местами, где растут пальмы и поют экзотические птицы. Однако, в мире существуют острова, на которые вы точно не хотели бы попасть. Ступив на эти клочки земли, […]

Многие люди просто не могут сесть в машину и не запустить навигатор, чтобы посмотреть, как и сколько придется ехать. Я — человек, который еще застал время, когда на машине надо было ездить с картой. Это было всего лет 10-15 назад, и поэтому я даже к простым навигаторам отношусь с большим уважением, хоть и считаю, что […]
В природе хлор встречается в газообразном состоянии и только в виде соединений с другими газами. В условиях, приближенных к нормальным, это ядовитый едкий газ зеленоватого цвета. Имеет больший вес, чем воздух. Обладает сладким запахом. Молекула хлора содержит два атома. В спокойном состоянии не горит, но при высоких температурах входит во взаимодействие с водородом, после чего возможен взрыв. В результате выделяется газ фосген. Очень ядовит. Так, даже при малой концентрации в воздухе (0,001 мг на 1 дм 3 ) может вызвать летальный исход. Основная характеристика неметалла хлора гласит, что он тяжелее воздуха, следовательно, всегда будет находиться у самого пола в виде желтовато-зеленой дымки.
Исторические факты
Впервые на практике это вещество было получено К. Шелее в 1774 г. путем соединения соляной кислоты и пиролюзита. Однако лишь в 1810 г. П. Дэви смог дать характеристику хлору и установить, что это отдельный химический элемент.

Стоит отметить, что в 1772 г. Джозеф Пристли смог получить хлороводород – соединение хлора с водородом, однако разделить эти два элемента химик не смог.
Химическая характеристика хлора
Хлор – химический элемент основной подгруппы VII группы таблицы Менделеева. Находится в третьем периоде и имеет атомный номер 17 (17 протонов в атомном ядре). Химически активный неметалл. Обозначается буквами Cl.
Является типичным представителем галогенов. Это газы, не имеющие цвета, но обладающие резким едким запахом. Как правило, токсичны. Все галогены хорошо разбавляются в воде. При контакте с влажным воздухом начинают дымиться.
Внешняя электронная конфигурация атома Cl 3s2Зр5. Следовательно, в соединениях химический элемент проявляет уровни окисления -1,+1, +3, +4, +5, +6 и +7. Ковалентный радиус атома 0,96Å, ионный радиус Cl- 1.83 Å, сродство атома к электрону 3,65 эв, уровень ионизации 12,87 эв.
Как указано выше, хлор представляет собой довольно активный неметалл, что позволяет создавать соединения практически с любыми металлами (в отдельных случаях при помощи нагревания или с помощью влаги, вытесняя при этом бром) и неметаллами. В порошкообразной форме реагирует с металлами только под действием высоких температур.
Максимальная температура горения - 2250 °С. С кислородом способен образовывать оксиды, гипохлориты, хлориты и хлораты. Все соединения, содержащие кислород, становятся взрывоопасными в условиях взаимодействия с окисляющимися веществами. Стоит отметить, что оксиды хлора могут произвольно взрываться, в то время как хлораты взрываются лишь при воздействии на них какими-либо инициаторами.
Характеристика хлора по положению в периодической системе:
• простое вещество;
• элемент семнадцатой группы периодической таблицы;
• третий период третьего ряда;
• седьмая группа главной подгруппы;
• атомный номер 17;
• обозначается символом Cl;
• химически активный неметалл;
• находится в группе галогенов;
• в условиях, приближенных к нормальным, это ядовитый газ желтовато-зелёного цвета с едким запахом;
• молекула хлора имеет 2 атома (формула Cl2).

Физические свойства хлора:
• температура кипения: -34,04 °С;
• температура плавления: -101,5 °С;
• плотность в газообразном состоянии - 3 ,214 г/л;
• плотность жидкого хлора (в период кипения) – 1,537 г/см 3 ;
• плотность твердого хлора – 1,9 г/см 3 ;
• удельный объем – 1,745 х 10 -3 л/г.
Хлор: характеристика температурных изменений
В газообразном состоянии имеет свойство легко сжижаться. При давлении в 8 атмосфер и температуре 20 °С выглядит как зеленовато-желтая жидкость. Обладает очень высокими коррозионными свойствами. Как показывает практика, этот химический элемент может сохранять жидкое состояние вплоть до критической температуры (143 °С), при условии увеличения давления.
Если его охладить до температуры -32 °С, он изменит свое агрегатное состояние на жидкое вне зависимости от атмосферного давления. При дальнейшем понижении температуры происходит кристаллизация (при показателе -101 °С).

Хлор в природе
В земной коре хлора содержится всего 0,017 %. Основная масса находится в вулканических газах. Как указано выше, вещество имеет большую химическую активность, вследствие чего в природе встречается в соединениях с другими элементами. При этом множество минералов содержат хлор. Характеристика элемента позволяет образовывать порядка ста различных минералов. Как правило, это хлориды металлов.
Также большое его количество находится в Мировом океане – почти 2 %. Это обусловлено тем, что хлориды очень активно растворяются и разносятся с помощью рек и морей. Возможен и обратный процесс. Хлор вымывается обратно на берег, а далее ветер разносит его по окрестностям. Именно поэтому наибольшая его концентрация наблюдается в прибрежных зонах. В засушливых районах планеты рассматриваемый нами газ образуется при помощи испарения воды, вследствие чего появляются солончаки. Ежегодно в мире добывают порядка 100 млн тонн данного вещества. Что, впрочем, неудивительно, ведь существует много месторождений, содержащих хлор. Характеристика его, однако, во многом зависит именно от его географического положения.
Методы получения хлора
Сегодня существует ряд методов получения хлора, из которых наиболее распространены следующие:
1. Диафрагменный. Является самым простым и менее затратным. Соляной раствор в диафрагменном электролизе поступает в пространство анода. Далее по стальной катодной сетке перетекает в диафрагму. В ней находится небольшое количество полимерных волокон. Важной особенностью этого устройства является противоток. Он направлен из анодного пространства в катодное, что позволяет отдельно получить хлор и щелоки.
2. Мембранный. Наиболее энергоэффективен, но сложноосуществим в организации. Схож с диафрагменным. Различие состоит в том, что анодное и катодное пространства полностью разделены мембраной. Следовательно, на выходе получаются два отдельных потока.
Стоит отметить, что характеристика хим. элемента (хлора), полученного данными методами, будет иной. Более "чистым" принято считать мембранный метод.
3. Ртутный метод с жидким катодом. По сравнению с остальными технологиями, этот вариант позволяет получать наиболее чистый хлор.
Принципиальная схема установки состоит из электролизера и соединенных между собой насоса и разлагателя амальгамы. В качестве катода служит перекачиваемая насосом ртуть вместе с раствором поваренной соли, а в качестве анода - угольные или графитовые электроды. Принцип действия установки следующий: из электролита выделяется хлор, который отводится из электролизера вместе с анолитом. Из последнего удаляют примеси и остатки хлора, донасыщают галитом и снова возвращают на электролиз.
Требования промышленной безопасности и нерентабельность производства привели к замене жидкого катода твердым.

Применение хлора в промышленных целях
Свойства хлора позволяют активно применять его в промышленности. С помощью этого химического элемента получают различные хлорорганические соединения (винилхлорид, хлоро-каучук и др.), лекарственные препараты, дезинфицирующие средства. Но самая большая ниша, занятая в промышленности, это производство соляной кислоты и извести.
Широко применяются методы очищения питьевой воды. На сегодняшний день пытаются отойти от этого метода, заменив его озонированием, поскольку рассматриваемое нами вещество негативно влияет на организм человека, к тому же хлорированная вода разрушает трубопроводы. Вызвано это тем, что в свободном состоянии Cl пагубно влияет на трубы, изготовленные из полиолефинов. Тем не менее большинство стран отдает предпочтение именно методу хлорирования.

Также хлор применяется в металлургии. С его помощью получают ряд редких металлов (ниобий, тантал, титан). В химической промышленности активно используют различные хлорорганические соединения для борьбы против сорняков и для других сельскохозяйственных целей, используется элемент и в качестве отбеливателя.
Благодаря своей химической структуре хлор разрушает большинство органических и неорганических красителей. Достигается это путем полного их обесцвечивания. Такой результат возможен лишь при условии присутствия воды, ведь процесс обесцвечивания происходит благодаря атомарному кислороду, который образуется после распада хлора: Cl2 + H2O → HCl + HClO → 2HCl + O. Данный способ нашел применение пару веков назад и пользуется популярностью и по сей день.
Очень популярно применение этого вещества для получения хлорорганических инсектицидов. Эти сельскохозяйственные препараты убивают вредоносные организмы, оставляя нетронутыми растения. Значительная часть всего добываемого на планете хлора уходит на сельскохозяйственные нужды.

Также используется он при производстве пластикатов и каучука. С их помощью изготавливают изоляцию проводов, канцелярские товары, аппаратуру, оболочки бытовой техники и т. д. Бытует мнение, что каучуки, полученные таким образом, вредят человеку, но это не подтверждено наукой.
Стоит отметить, что хлор (характеристика вещества была подробно раскрыта нами ранее) и его производные, такие как иприт и фосген, применяются и в военных целях для получения боевых отравляющих средств.
Хлор как яркий представитель неметаллов
Неметаллы – простые вещества, которые включают в себя газы и жидкости. В большинстве случаев они хуже проводят электрический ток, чем металлы, и имеют существенные различия в физико-механических характеристиках. При помощи высокого уровня ионизации способны образовывать ковалентные химические соединения. Ниже будет дана характеристика неметалла на примере хлора.
Как уже было сказано выше, этот химический элемент представляет собой газ. В нормальных условиях у него полностью отсутствуют свойства, сходные с таковыми у металлов. Без сторонней помощи не может взаимодействовать с кислородом, азотом, углеродом и др. Свои окислительные свойства проявляет в связях с простыми веществами и некоторыми сложными. Относится к галогенам, что ярко отражается на его химических особенностях. В соединениях с остальными представителями галогенов (бром, астат, йод), вытесняет их. В газообразном состоянии хлор (характеристика его - прямое тому подтверждение) хорошо растворяется. Является отличным дезинфектором. Убивает только живые организмы, что делает его незаменимым в сельском хозяйстве и медицине.
Применение в качестве отравляющего вещества
Характеристика атома хлора позволяет применять его как отравляющее средство. Впервые газ был применен Германией 22.04.1915 г., в ходе Первой мировой войны, вследствие чего погибло порядка 15 тыс. человек. На данный момент как отравляющее вещество не применяется.
Дадим краткую характеристику химического элемента как удушающего средства. Влияет на организм человека посредством удушения. Сначала оказывает раздражение верхних дыхательных путей и слизистой оболочки глаз. Начинается сильный кашель с приступами удушья. Далее, проникая в легкие, газ разъедает легочную ткань, что приводит к отеку. Важно! Хлор является быстродействующим веществом.
В зависимости от концентрации в воздухе, симптоматика бывает разной. При малом содержании у человека наблюдается покраснение слизистой оболочки глаз, легкая одышка. Содержание в атмосфере 1,5-2 г/м 3 вызывает тяжесть и острые ощущения в груди, резкую боль в верхних дыхательных путях. Также состояние может сопровождаться сильным слезотечением. После 10-15 минут нахождения в помещении с такой концентрацией хлора наступает сильный ожог легких и смерть. При более плотных концентрациях смерть возможна в течение минуты от паралича верхних дыхательных путей.

При работе с этим веществом рекомендуется использовать спецодежду, противогаз, перчатки.
Хлор в жизни организмов и растений
Хлор входит в состав практически всех живых организмов. Особенность состоит в том, что присутствует он не в чистом виде, а в виде соединений.
В организмах животных и человека ионы хлора поддерживают осмотическое равенство. Вызвано это тем, что они имеют наиболее подходящий радиус для проникновения в мембранные клетки. Наряду с ионами калия Cl регулирует водно-солевой баланс. В кишечнике ионы хлора создают благоприятную среду для действия протеолитических ферментов желудочного сока. Хлорные каналы предусмотрены во многих клетках нашего организма. Посредством их происходит межклеточный обмен жидкостями и поддерживается pH клетки. Порядка 85 % от общего объема этого элемента в организме пребывает в межклеточном пространстве. Выводится из организма по мочеиспускательным каналам. Вырабатывается женским организмом в процессе кормления грудью.
На данном этапе развития тяжело однозначно сказать, какие именно заболевания провоцирует хлор и его соединения. Связано это с недостатком исследований в этой области.
Также ионы хлора присутствуют в клетках растений. Он активно принимает участие в энергетическом обмене. Без этого элемента невозможен процесс фотосинтеза. С его помощью корни активно впитывают необходимые вещества. Но большая концентрация хлора в растениях способна оказывать пагубное влияние (замедление процесса фотосинтеза, остановка развития и роста).

Однако существуют такие представители флоры, которые смогли "подружиться" или хотя бы ужиться с данным элементом. Характеристика неметалла (хлора) содержит такой пункт, как способность вещества окислять почвы. В процессе эволюции упомянутые выше растения, называемые галофитами, заняли пустые солончаки, которые пустовали из-за переизбытка этого элемента. Они впитывают ионы хлора, а после избавляются от них при помощи листопада.
Транспортировка и хранение хлора
Существует несколько способов перемещать и хранить хлор. Характеристика элемента предполагает необходимость специальных баллонов с высоким давлением. Такие емкости имеют опознавательную маркировку – вертикальную зеленую линию. Ежемесячно баллоны необходимо тщательно промывать. При длительном хранении хлора в них образуется очень взрывоопасный осадок – трихлорид азота. При несоблюдении всех правил безопасности возможно самопроизвольное воспламенение и взрыв.

Изучение хлора
Будущим химикам должна быть известна характеристика хлора. По плану 9-классники могут даже ставить лабораторные опыты с этим веществом на основе базовых знаний по дисциплине. Естественно, преподаватель обязан провести инструктаж по технике безопасности.
Наряду с практическими работами повторяется теория. В частности, такой вопрос, как характеристика хлора по положению в периодической системе (описана в начале статьи).

В результате опытов выясняется, что элемент активно реагирует на органические соединения. Если поместить в банку с хлором вату, смоченную предварительно в скипидаре, то она мгновенно воспламенится, и из колбы резко повалит сажа. Эффектно тлеет желтоватым пламенем натрий, а на стенках химпосуды появляются кристаллы соли. Ученикам будет небезынтересно узнать, что, будучи ещё молодым химиком, Н. Н. Семенов (впоследствии лауреат Нобелевской премии), проведя такой опыт, собрал со стенок колбы соль и, посыпав ею хлеб, съел его. Химия оказалась права и не подвела ученого. В результате проведенного химиком опыта действительно получилась обычная поваренная соль!
Наверняка те, кто хоть раз в жизни видел своими глазами северное (или южное) полярное сияние, скажут, что это просто фантастическое зрелище. Чудо природы планетарного масштаба, грандиозное явление, которое человек может наблюдать на Земле невооруженным глазом. Свечение атмосферы на высотах в сотни и на удалении в тысячи километров настолько разноцветно и динамично, что производит впечатление чего-то живого, движущегося, дышащего…
Но только ли наша планета может похвастать этим грандиозным зрелищем? Могут ли, если не коренные жители, то будущие колонисты, к примеру Марса или спутников Юпитера, наблюдать что-либо подобное?
Что вообще нужно, чтобы на какой-либо планете возникли полярные сияния?
По определению, полярные сияния — это свечение (люминесценция) верхних слоёв атмосфер планет, обладающих магнитосферой, вследствие их взаимодействия с заряженными частицами солнечного ветра.
Итак, нам требуется:
1. Солнечный ветер, представляющий из себя поток заряженных частиц — протонов, электронов, ядер гелия и др. — Имеется всегда во всей Солнечной системе.
У планет или их спутников:
2. Атмосфера, с атомами которой будет взаимодействовать солнечный ветер.
3. Магнитное поле, направляющее заряженные частицы в определенную область планеты (не обязательно в полярную, — угол между магнитной осью и осью вращения планеты, может быть значительным.)
Посмотрим, как это работает на Земле.

Землю можно рассматривать как большой магнит, южный полюс которого располагается вблизи северного географического полюса, а северный — вблизи южного. Силовые геомагнитные линии Земли немного сжаты со стороны Солнца вследствие давления солнечного ветра и оттянуты в противоположном направлении, образуя у Земли магнитосферный хвост.
А как ведут себя частицы солнечного ветра при взаимодействии с магнитосферой планеты? — В околоземном пространстве все происходит как со сверхзвуковым самолетом. — Поток солнечного ветра на сверхзвуковой скорости (400-700 км\сек) набегает на магнитосферу планеты, в результате чего образуется так называемая, головная ударная волна. — (Скорость солнечного ветра на орбите Земли примерно в 10 раз больше скорости звука в околоземной плазме.)
Головная ударная волна — это, таким образом, магнитное препятствие, которое отклоняет заряженные частицы солнечного ветра по траекториям вокруг планеты. Налетая на нее, большинство заряженных частиц просто обтекает магнитосферу.
Некоторая часть солнечной плазмы попадает в магнитные ловушки радиационных поясов Земли,- заряженным частицам затруднительно двигаться поперек силовых линий и они просто наматываются на них и могут болтаться от полюса к полюсу десятилетиями.
А ещё часть беспрепятственно проникает в полярную ионосферу через полярные каспы — воронкообразные области, расширяющиеся от Земли до магнитопаузы, возникающие в результате взаимодействия солнечного ветра и магнитного поля Земли.

Магнитосфера Земли
Эти области представляют собой два овала (в северном и южном полушариях), удаленные от геомагнитных полюсов ночью приблизительно на 20°, а днем на 10°. Протяженность этих овальных областей по широте составляет всего несколько сот километров.
При интенсивной магнитной буре овал сильно смещается по направлению к экватору.
И если в периоды спокойного Солнца интенсивность полярных сияний мягко говоря невелика, дело усугубляется во время солнечной активности. Выбросы корональной массы (плазмы из короны Солнца) многократно увеличивают интенсивность солнечного ветра.
Поскольку солнечный ветер и выбросы корональной массы Солнца — это по большей части протоны и электроны, соответственно различают два типа полярных сияний.
вызываемые потоками электронов и преобладающие на Земле. Это всем привычные зеленые или фиолетово-малиновые дуги, лучистые полосы, ленты, занавесы и прочие образования, имеющие достаточно четко выраженную структуру.
Как образуются. — Электроны солнечной плазмы, прорвавшись в верхние слои атмосферы Земли, спускаются до высот 400—100 км над уровнем моря. Здесь под их действием происходит ионизация нейтральных атмосферных газов (кислорода и азота), а также возбуждение их атомов и молекул. В ответ на это молекулы, атомы и ионы кислорода и азота атмосферы излучают кванты света на строго определенной длине волны.

Это обуславливает цвет полярных сияний: например, за зеленый цвет отвечает кислород (его наиболее сильная линия), а за фиолетовый, синий или красный — азот. Вообще же, у каждого сияния своя неповторимая палитра цветов, зависящая от постоянно меняющегося процентного химического состава атмосферы.
Потоки электронов вызывают на Земле полярные сияния, регистрируемые не только в видимом диапазоне.
Редкие на Земле, но встречающиеся ещё только на Юпитере, — рентгеновские авроры.
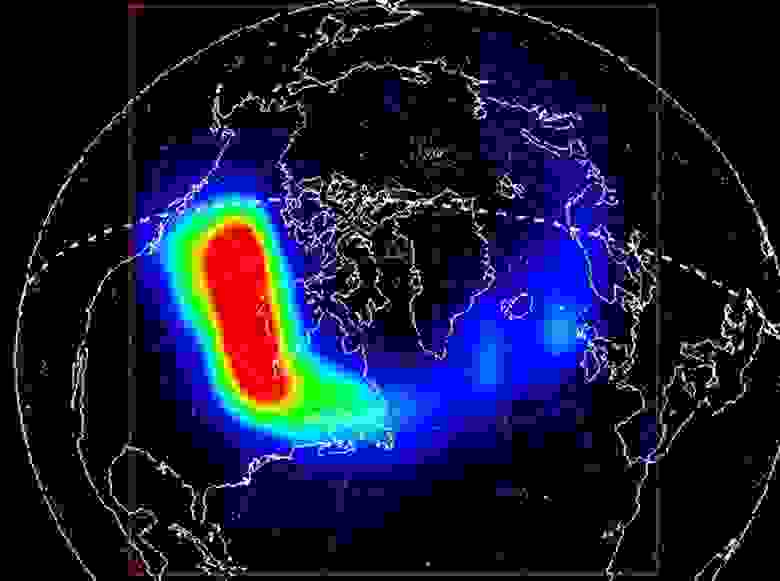
Сильнейшее рентгеновское полярное сияние, зафиксированное 11 апреля 1997 года орбитальным спутником Polar. На картинке видны рентгеновские лучи (в условных цветах), порожденные в верхней атмосфере и обусловленные потоками электронов высоких энергий.
Тоже достаточно редкое явление на Земле и его вклад в свечение неба Земли относительно невелик.
Протоны, попадая в атмосферу Земли, также сталкивается с молекулами и атомами атмосферных газов, возбуждая и ионизуя их. Но при этом протон может захватить свободный электрон и произойдет процесс перезарядки. В результате образуется нейтральный атом водорода, который может испускать фотоны в видимом и УФ-диапазонах.
Самая обычная форма протонных полярных сияний — довольно широкая дуга, вытянутая в направлении с востока на запад, шириной от 300 до 1000 км. Также встречаются арки и просто диффузные пятна.

Красная протонная арка, штат Мичиган
Теперь посмотрим, как обстоит дело с полярными сияниями на других планетах.
Несмотря на имеющееся магнитное поле, интенсивность которого, правда, в 100 раз меньше земного, атмосфера на планете фактически отсутствует. Она настолько разрежена, что сами частицы солнечного ветра и составляют атмосферу планеты, вкупе с атомами, выбитыми с поверхности. Атомы атмосферы чаще сталкиваются с планетой, чем друг с другом.
Не так все плохо, как могло бы показаться.
Ситуация, противоположная Меркурию — густая и плотная атмосфера и отсутствие глобального магнитного поля. Но несмотря на это, слабая магнитосфера у Венеры имеется — она индуцирована самим солнечным ветром, а не планетой.
В 2000-х аппарат Venus Express обнаружил, что за Венерой тянется магнитосферный хвост, аналогичный земному. В нем тоже происходит перезамыкание силовых линий магнитного поля. — Разнонаправленные линии движущейся солнечной плазмы оказываются слишком близко друг от друга и замыкаются.
Солнечный ветер, управляемый процессом перезамыкания, совершенно беспрепятственно взаимодействует с атмосферными газами Венеры. Поэтому полярное сияние здесь не совсем полярное, вернее, совсем не полярное, и представляет собой светлые и диффузные пятна различной формы и интенсивности. Иногда они затрагивают весь планетарный диск. Особенно хорошо видны на ночной стороне планеты.
На Марсе глобального магнитного поля тоже нет, однако наблюдается остаточная локальная намагниченность коры, особенно в горной местности южного полушария.
Атмосфера у Марса тонкая и разреженная, в основном состоящая из углекислого газа. При взаимодействии с электронами солнечного ветра, которые ускоряется вдоль линий локальных магнитных полей, можно наблюдать редкие и кратковременные ультрафиолетовые электронные полярные сияния.
14 августа 2004 года инструментом SPICAM на борту орбитальной станции Mars Express в районе Киммерийской земли было зафиксировано такое явление. Общий размер излучающей области составлял около 30 км в поперечнике, и примерно 8 км в высоту.

Локальные магнитные поля Марса
А вот протонные полярные сияния, впервые зафиксированные во время солнечной бури 12-13 сентября 2017 года орбитальным аппаратом MAVEN, не в пример более мощные и глобальные. Они могут охватывать практически всю планету.
Марс окружен обширной короной из нейтрального водорода. Протоны солнечного ветра, прошедшие процесс перезарядки в короне, уже в виде нейтральных атомов проникают сквозь головную ударную волну (она задерживает только заряженные частицы) и взаимодействуют с атомами и молекулами атмосферных газов в нижней термосфере (на высотах 110-130 км), порождая ультрафиолетовое свечение.
Так что во время солнечных бурь колонистам на Марсе лучше куда-то прятаться.

Ультрафиолетовые данные наложены на снимок Марса на ночной стороне до (слева) и во время (справа) события. Авроральное излучение кажется наиболее ярким на краю снимка планеты вдоль линии светящегося слоя атмосферы.
Четыре планеты-гиганта Солнечной системы имеют в наличии всё для появления полярных сияний — и мощные атмосферы, и сильные магнитные поля.
Неприятной особенностью наблюдений с Земли (и вообще из внутренних областей Солнечной системы) планет-гигантов является то, что они обращены к наблюдателю освещённой Солнцем стороной. Поэтому в видимом диапазоне их полярные сияния теряются в отражённом солнечном свете.
Нужно ли говорить, что самая большая планета Солнечной системы имеет и самые мощные полярные сияния? К тому же, в отличие от Земли, авроры Юпитера имеют постоянный характер.
Также удивительной особенностью аврор Юпитера является то, что они возникают не только из-за солнечного ветра, но и из-за потоков частиц, выбрасываемых спутниками планеты: Ио, Ганимедом и Европой (на этих спутниках тоже наблюдаются полярные сияния).
Особенно сильно сказывается присутствие Ио, поскольку этот спутник вулканически активен и у него есть своя ионосфера.
Маленькая Ио играет важную роль в формировании магнитного поля гиганта Юпитера. — Ее вулканы выбрасывают в атмосферу массу ионизированных и нейтральных серы, кислорода, хлора, атомарного натрия и калия, молекулярного диоксида серы, а также пыли хлорида натрия. Все это вещество вытягивается магнитосферой Юпитера из тонкой атмосферы Ио со скоростью 1 тонна в секунду.
При этом в зависимости от ионизации эта материя улетучивается или в разреженное нейтральное облако вокруг спутника (желтое пятно на рисунке), или в плазменный тор, окружающий весь Юпитер (красная область там же).
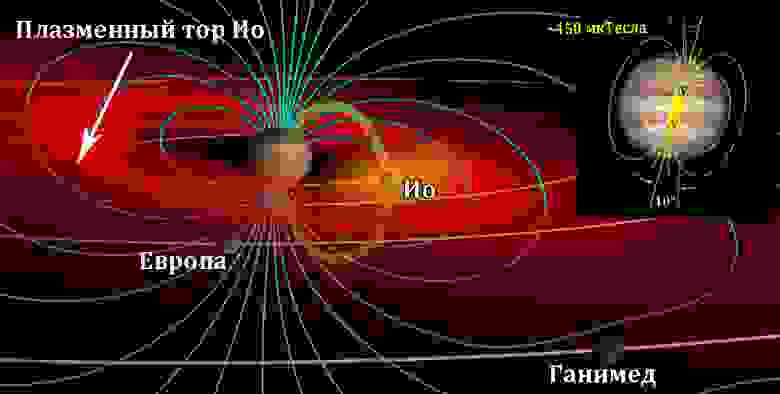
Схема магнитосферы Юпитера и воздействия Ио: плазменный тор (красное), нейтральное облако (жёлтое), потоковая трубка (зелёное) и линии магнитного поля (голубые)
Подобным же образом, но в гораздо меньшей степени, влияют на авроры Юпитера два других его спутника — Европа и Ганимед. Их горячие авроральные пятна образуются за счёт высокозаряженных ионов кислорода, серы и, возможно, углерода, которые активно обмениваются зарядами.

Авроральные или горячие пятна (в ультрафиолете) Ио, Ганимеда и Европы — следы магнитных силовых линий, соединяющих ионосферы спутников с ионосферой Юпитера.
Яркие пятна внутри основных колец, появляющиеся время от времени, как считается, связаны с взаимодействием магнитосферы и солнечного ветра.
К тому же, рентгеновское излучение Юпитера пульсирует. На южном полюсе — каждые 11 минут, а вот на северном сияние неустойчиво и меняет свою активность независимо и с другой периодичностью – в разные периоды времени – от 12 до 26 и даже до 40–45 минут.
Причины таких рассинхронизации и пульсации пока неясны.
И ещё вопрос, — как Юпитер наделяет частицы в своей магнитосфере огромными энергиями, необходимыми для создания постоянного потока рентгеновских лучей?
Взаимодействующие с солнечным ветром газы в верхних слоях атмосферы нагреваются, как и на Земле. Однако нагрев юпитерианской атмосферы происходит в два или три раза глубже, чем на Земле, достигая нижнего уровня стратосферы.
Ну и нельзя не отметить Ганимед — крупнейший спутник в Солнечной системе и единственный, имеющий собственную магнитосферу. Она очень мала и погружена в магнитосферу Юпитера. Однако наличие у Ганимеда ещё и слабой кислородной атмосферы обуславливают и наличие ультрафиолетовых полярных сияний.
По расчётам учёных, глубина океана – 100 километров, то есть он примерно в 10 раз глубже, чем океаны Земли. Правда, океан Ганимеда похоронен под 150-170-километровым панцирем льда.
На Сатурне тоже имеются полярные сияния, куда ж они денутся.
Часть этого водяной пара ионизируется и в объеме 100 кг в секунду пополняет магнитосферу Сатурна различными гидро-, водородными, кислородными и пр. ионами и радикалами.
Однако их не хватает, чтобы раздуть магнитосферу гиганта до размеров юпитерианской. Поэтому полярные сияния на Сатурне зависят гораздо сильнее, чем на Юпитере, от интенсивности солнечного ветра. В этом они схожи с земными.
Полярные сияния на Сатурне, как и на Земле, образуют замкнутые или неполные кольца вокруг магнитных полюсов.


И поскольку орбитальных миссий у ледяных гигантов не было, то в случае с Ураном первую аврору удалось зафиксировать только в 2011 году.
Читайте также:

