Пэт кт при мелкоклеточном раке
а) Терминология:
1. Сокращения:
• Мелкоклеточный рак легкого (МРЛ):
о Мелкоклеточный рак легкого ранней стадии (МРЛ-РС)
о Мелкоклеточный рак легкого поздней стадии (МРЛ-ПС)
2. Синоним:
• Овсяноклеточный рак легких
3. Определение:
• Первичная нейроэндокринная опухоль легких:
о По сравнению с другими нейроэндокринными опухолями и типами рака легких имеет более агрессивный характер роста
• Составляет до 13-15% от всех случаев рака легких
4. Сопутствующие синдромы:
• Синдром неадекватной секреции антидиуретического гормона (СНСАГ):
о Наиболее частый паранеопластический синдром, связанный с МРЛ
о Повышение секреции антидиуретического гормона:
- Гипонатриемия; нарушение экскреции воды
• Синдром Кушинга:
о Увеличение продукции адренокортикотропного гормона
- Слабость, гипергликемия, полиурия, гипокалиемический алкалоз
• Синдром Ламберта-Итона:
о Нарушение высвобождения ацетилхолина:
- Слабость проксимальных мышц
• Энцефаломиелит
• Энцефалит с поражением лимбической системы
• Акромегалия:
о Повышение продукции эктопического соматотропина
б) Лучевые признаки мелкоклеточного рака легкого:
1. Основные особенности:
• Оптимальные диагностические ориентиры:
о Узелок или объемное образование в легком центральной локализации
о Лимфаденопатия средостения, корней легких:
- Обрастание/инвазия структур средостения
• Локализация:
о Центральная
2. Рентгенография:
о Узелок или объемное образование в легком центральной локализации, распространяющиеся в средостение, корень легкого:
- Может приводить к развитию ателектаза и уменьшению объема легкого
- Обратный симптом Голдена при ателектазе верхней доли правого легкого
о Лимфаденопатия средостения, корней легких:
- Объемное образование (образования) в средостении
- Объемное образование (образования) в корне легкого
о Плевральный выпот
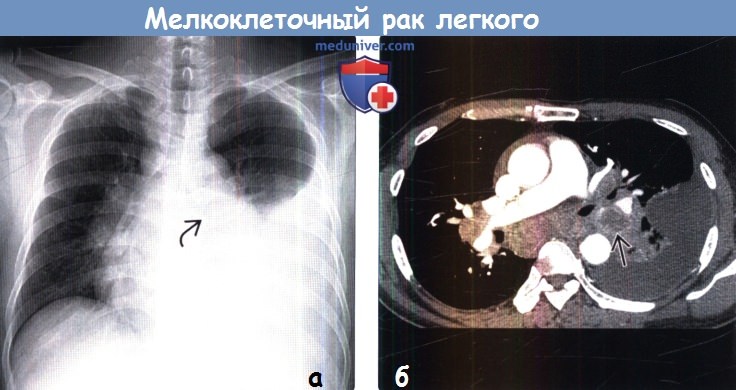
(а) У мужчины 62 лет с мелкоклеточным раком легкого (МРЛ) при рентгенографии органов грудной клетки в ПП проекции определяется лимфаденопатия средостения и корней обоих легких.
Выявляется обрыв левого нижнедолевого бронха. Большой плевральный выпот позволяет заподозрить метастатическое поражение плевры.
(б) У этого же пациента при КТ с контрастным усилением подтверждается наличие распространенной лимфаденопатии средостения и корней обоих легких.
Первичная злокачественная опухоль в нижней доле левого легкого полностью облитерирует левый нижнедолевой бронх, что привело к развитию ателектаза этой доли.
3. КТ:
• Нативная КТ:
о Узелок или объемное образование в легком центральной локализации:
- Может приводить к развитию ателектаза
- При наличии узелка лимфаденопатия отсутствует менее чем в 5% случаев
о Лимфаденопатия средостения (92%), корней легких (84%):
- Может быть единственным проявлением заболевания
- Патологические образования в легком могут не визуализироваться
о Узелок или объемное образование периферической локализации встречаются редко
о Обрастание структур средостения в 68% случаев
• КТ с контрастным усилением:
о Оценка вовлечения в опухолевый процесс:
- Сердце и перикард
- Крупные сосуды:
Обрастание легочных артерий, вен
- Синдром верхней полой вены:
Неполное контрастирование верхней полой вены или его отсутствие
Коллатеральные сосуды в грудной стенке, шее, средостении
о Выявление лимфаденопатии и метастазов:
- Метастазы за пределами грудной клетки:
Кости: 19-38%; печень: 17-34%; надпочечники: 10-1 7%; головной мозг: 14%
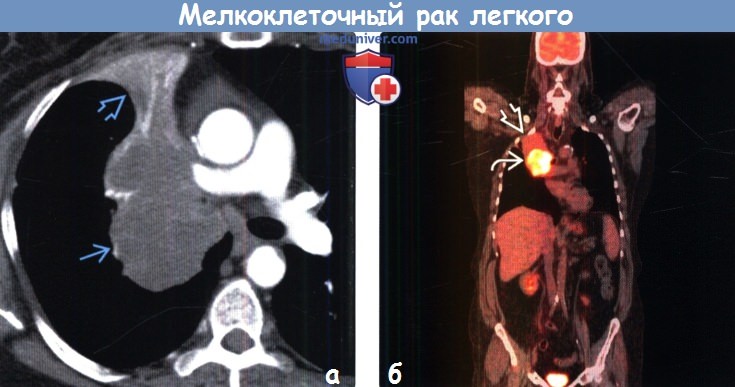
(а) У женщины 58 лет с мелкоклеточным раком легкого (МРЛ) при КТ с контрастным усилением определяется окклюзия правого верхнедолевого бронха крупным мягкотканным образованием, которая привела к развитию полного ателектаза верхней доли правого легкого мелкоклеточный рак легкого (МРЛ) центральной локализации может проявляться ателектазом доли или всего легкого.
(б) У этой же пациентки при ФДГ-ПЭТ/КТ на реконструкции в коронарной плоскости визуализируются интенсивно поглощающая ФДГ мелкоклеточный рак легкого (МРЛ) центральной локализации и ателектаз верхней доли правого легкого.
В данном случае ФДГ -ПЭТ/КТ позволяет осуществить точное стадирование опухоли и определить зону для последующего облучения.
3. МРТ:
• МРТ органов грудной клетки в рутинной практике не применяется
о Противопоказания к проведению внутривенного контрастирования:
- Тяжелые аллергические реакции
- Нарушение функции почек
о Показания:
- Выявление инвазии:
Сердце и перикард
Верхняя полая вена
Другие крупные сосуды
• Во всех случаях рекомендуется выполнять томографию головного мозга (предпочтительно МРТ):
о Метастазы выявляются у 10-15% пациентов без неврологических расстройств
4. Методы медицинской радиологии:
• ПЭТ/КТ:
о Большинство опухолей, пораженных лимфатических узлов и метастазов характеризуются интенсивным накоплением ФДГ:
- МРЛ характеризуется высоким уровнем метаболизма о Прекрасно подходит для первичного стадирования:
- В некоторых случаях данные ПЭТ/КТ позволяют изменить тактику лечения:
Коррекция всего плана лечения или только лучевой терапии
о Может применяться для оценки эффективности лечения и для рестадирования
5. Рекомендации к проведению лучевых исследований:
• Оптимальный метод:
о КТ с контрастным усилением для оценки первичной опухоли и ее взаимосвязи со структурами средостения
о ФДГ-ПЭТ/КТ для клинического стадирования
о Томография головного мозга (МРТ или КТ) у всех пациентов
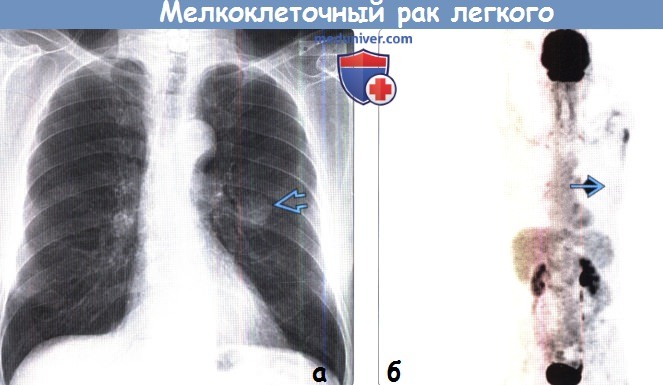
(а) У женщины 57 лет без жалоб при рентгенографии органов грудной клетки в ПП проекции вблизи корня левого легкого определяется узелок с четкими контурами без признаков обызвествления.
(б) У этой же пациентки при ФДГ-ПЭТ всего тела визуализируется интенсивный уровень поглощения ФДГ данным узелком. При биопсии был выявлен мелкоклеточный рак легкого (МРЛ).
В данном случае по данным ФДГ-ПЭТ было подтверждено наличие мелкоклеточного рака легкого ранней стадии (МРЛ-РС).
Несмотря на то что мелкоклеточный рак легкого (МРЛ) обычно не подлежит резекции, последняя может быть выполнена в случае выявления единичного узелка или объемного образования.
в) Дифференциальная диагностика мелкоклеточного рака легкого (МРЛ):
1. Первичная В-клеточная лимфома средостения:
• Наиболее часто встречается диффузная В-крупноклеточная лимфома:
о Тип неходжкинской лимфомы
о Растет из тимуса
• Пациенты 30-40 лет
• Системные проявления:
о Лихорадка, ночная потливость, потеря веса
• Объемное образование больших размеров в средостении
• Сопутствующая лимфаденопатия может выявляться в нижних отделах шеи и в грудной клетке
2. Плоскоклеточный рак:
• Пациенты 50-60 лет
• Развитие напрямую связано с курением
• Узелок или объемное образование центральной локализации о Могут формироваться полости
3. Карциноидная опухоль:
• Пациенты 40-50 лет
• Узелок, объемное образование в корне легкого или вблизи него:
о Может характеризоваться выраженным контрастированием
о Характер кальцификации
- Точечный или диффузный
• Полностью или частично расположена внутри бронха:
о Может приводить к развитию ателектаза и объемного уменьшения легкого различной степени выраженности
г) Патоморфология мелкоклеточного рака (МРЛ):
1. Основные особенности:
• Этиология:
о Развитие напрямую связано с курением
2. Стадирование, определение степени дифференцировки и классификация опухолей:
• В соответствии с классификацией, предложенной исследовательской группой по лечению рака легких при Управлении по делам ветеранов войн (VALSG, США):
о Первая классификация для клинического стадирования мелкоклеточного рака легких (МРЛ)
• Модифицированная классификация VALSG:
о По-прежнему используется некоторыми клиницистами для стадирования МРЛ
о Ранние стадии:
- Соответствуют стадиям I-III
- Опухоль охватывается одной зоной облучения
- Увеличение лимфатических узлов средостения (гомолатеральных или контралатеральных) и надключичных лимфатических узлов
- Плевральный выпот на стороне поражения
О Поздняя стадия:
- Соответствует стадии IV
- Требует более одной зоны облучения
- Наличие метастазов
о В соответствии с рекомендациями Международной ассоциации по изучению рака легких (IASLC) для стадирования мелкоклеточного рака легких (МРЛ) следует использовать классификацию TNM седьмого издания
д) Клинический аспект:
1. Проявление:
• Наиболее частые признаки:
о Кашель, боль в груди, одышка, гемофтиз
о Анорексия, потеря веса и утомляемость
• Другие симптомы:
о Синдром верхней полой вены
- Одышка, отечность лица, верхних конечностей, охриплость, стридор
о Паранеопластические синдромы
о Симптомы, связанные с наличием метастазов в органах за пределами грудной клетки:
- Головной мозг: атаксия, судороги, изменения психического состояния
- Кость: боли
2. Демографические данные:
• Возраст:
о 60-70 лет
• Пол:
о У мужчин встречается чаще, чем у женщин
3. Естественное течение заболевания и прогноз:
• Злокачественное новообразование с агрессивным характером роста; большее время удвоения:
о Большая скорость метастатической диссеминации
• Низкий показатель пятилетней выживаемости:
о Мелкоклеточный рак легкого ранней стадии (МРЛ-РС): 10-15%
о Мелкоклеточный рак легкого поздней стадии (МРЛ-ПС): 1 -2%
3. Лечение:
• Мелкоклеточный рак легкого ранней стадии (МРЛ-РС):
о Химиотерапия в сочетании с ранним параллельным облучением грудной клетки
• Мелкоклеточный рак легкого поздней стадии (МРЛ-ПС):
о Системная химиотерапия
• Большинство опухолей резекции не подлежат:
о Ее выполнение возможно в случае опухолей, представленных узелком в легочной ткани или объемным образованием с четким контуром
• Профилактическое облучение головного мозга:
о У пациентов с мелкоклеточным раком легкого (МРЛ) всех стадий после выполнения химиотерапии в случае ее эффективности
е) Диагностические пункты:
1. Следует учитывать:
• При выявлении у курильщиков и ранее куривших лиц крупного объемного образования или лимфаденопатии средостения или корней легких следует заподозрить мелкоклеточный рак легкого (МРЛ).
2. Ключевые моменты при интерпретации изображений:
• Всем пациентам рекомендуется проводить томографию головного мозга (МРТ или КТ).
3. Ключевые моменты диагностического заключения:
• В 60-70% случаев на момент выявления имеются метастазы.
ж) Список литературы:
1. Carter BW et al: Small cell lung carcinoma: staging, imaging, and treatment considerations. Radiographics. 34(6):1707—21, 2014
2. Lococo F et al: PET/CT assessment of neuroendocrine tumors of the lung with special emphasis on bronchial carcinoids. Tumour Biol. 35(9):8369-77, 2014
3. Rekhtman N: Neuroendocrine tumors of the lung: an update. Arch Pathol Lab Med. 134(11): 1628-38, 2010
4. Micke P et al: Staging small cell lung cancer: Veterans Administration Lung Study Group versus International Association for the Study of Lung Cancer-what limits limited disease? Lung Cancer. 37(3):271-6, 2002
5. Nicholson SA et al: Small cell lung carcinoma (SCLC): a clinicopathologic study of 100 cases with surgical specimens. Am J Surg Pathol. 26(9): 1184-97, 2002
- Вернуться в оглавление раздела "Лучевая медицина"
Редактор: Искандер Милевски. Дата публикации: 26.1.2019
Введение. Малый клеточный рак легкого (SCLC) представляет собой агрессивную форму рака легких с плохим прогнозом. Для планирования терапии необходима адекватная постановка и терапевтическая оценка. Было показано, что флуородоксиглюкоза (ФДГ) -позитронная эмиссионная томография (ПЭТ) / компьютерная томография (КТ) полезна для оценки постановки и терапии. В оценке оценки ответа были сопоставлены критерии Европейской организации исследований и лечения рака (EORTC) и Positron Emission Tomography Criteria in Solid Tumors (PERCIST), а прогностические факторы были определены в когорте пациентов с SCLC. Методы. В исследование было включено 29 пациентов с SCLC. Шестнадцать пациентов имели обширное заболевание, а 13 имели ограниченное заболевание. У всех пациентов была химиотерапия, у 21 — торакальная лучевая терапия. ФДГ-ПЭТ / КТ-сканирование проводили до и после терапии для оценки реакции на лечение. Метаболические ответы оценивались с использованием критериев EORTC и критериев PERCIST. Одномерный и многомерный анализ проводили с использованием модели Кокса для исследования взаимосвязи между свободным от прогрессирования и общим временем выживания с рядом ковариатов. Результаты. Было достигнуто идеальное соответствие между критериями EORTC и PERCIST. Восемь пациентов имели полный метаболический ответ (CMR), 9 имели частичный метаболический ответ (ПМР), 5 имели стабильное метаболическое заболевание (SMD) и 7 имели прогрессирующее метаболическое заболевание (ПМД). Общее время выживания у пациентов с КДПГ было значительно больше по сравнению с пациентами, у которых не было CMR. Первоначальная или отсроченная CMR и посттерапевтическая стандартизированная величина поглощения, скорректированная на скудную массу тела, были в значительной степени связаны с общей выживаемостью. Вывод: CMR на пост-терапевтический ФДГ-ПЭТ / КТ у пациентов с SCLC является важным прогностическим фактором и может помочь в принятии решений для терапевтического управления.
Рак легких является основной причиной смерти от рака в Соединенных Штатах для мужчин и женщин. Оценочное количество новых случаев в 2010 году составило 222 520 [1]. От 10 до 15% рака легких — это мелкоклеточный рак легкого (SCLC). SCLC более агрессивен, чем немелкоклеточный рак легкого (НМРЛ), и требует специального терапевтического подхода. Первоначальная постановка с фторооксиглюкозой (ФДГ) -позитронная эмиссионная томография (ПЭТ) / компьютерная томография (КТ) является чувствительной и специфичной для SCLC, за исключением оценки метастазов в головной мозг. Это также приводит к улучшению управления пациентами по сравнению с традиционными изображениями [2]. SCLC классифицируется как ограниченное заболевание (LD) или обширное заболевание (ED). Терапия состоит из комбинированной химиотерапии и торакальной лучевой терапии (ТРТ) для пациентов с ЛД и системной химиотерапии для пациентов с ЭД. SCLC является хемочувствительным, и большинство пациентов демонстрируют четкий ответ на терапию. К сожалению, большинство пациентов рецидивируют вскоре после окончания терапии. Точная оценка ответа на терапию имеет важное значение для выявления пациентов, не принимающих решения, и предотвращения неэффективной терапии и ее возможных побочных эффектов. Идентификация пациентов с большей вероятностью рецидива может привести к дальнейшему лечению, например, к консолидации или более близкому наблюдению.
2 наиболее широко используемых набора критериев для оценки ответа на терапию ФДГ-ПЭТ в твердых опухолях являются критериями Европейской организации исследований и лечения рака (EORTC) на основе стандартизированной оценки потребления (SUV), которая стала стандартом для оценки метаболического ответа опухоли и последующего наблюдения в твердых опухолях с 1999 года [3] и критериев ответа на эмиссионную томографию позитронов в критериях твердых опухолей (PERCIST), описанных Wahl et al. [4] в 2009 году. Критерии PERCIST основаны на сочетании критериев радиологического критерия оценки в критериях жестких опухолей (RECIST) [5] и критериев EORTC с той разницей, что внедорожник должен быть скорректирован на скудную массу тела (масса сухожилия тела SUL или SUV ). Оба эти критерия позволяют измерять реакцию опухоли в отсутствие анатомического изменения посредством оценки метаболической активности.
Мы сравнили критерии EORTC и PERCIST у населения пациентов с SCLC и оценили, как метаболический ответ был связан с выживаемостью без прогрессирования и общей выживаемостью.
Двадцать девять последовательных пациентов с SCLC, относящихся к многодисциплинарному собранию легочной больницы Университета Лиможа, были включены ретроспективно. В период с октября 2005 года по июль 2010 года у всех пациентов было проведено по меньшей мере 2 обследования ФДГ-ПЭТ / КТ (ПЭТ 1 и ПЭТ 2). Характеристики пациентов, включая возраст, стадию заболевания, лечение и ответ на терапию, приведены в таблице 1.
Таблица 1 Характеристики пациента
A, надпочечник; B, кости; NM, узловые метастазы; L, печень; EP, этопозид и цисплатин; КАВ, циклофосфамид, адриамицин и винкристин; CMR, полный метаболический ответ; ПМР, частичный метаболический ответ; SMD, стабильное метаболическое заболевание; PMD, прогрессирующая метаболическая болезнь.
Все пациенты получали химиотерапию. Двадцать четыре пациента (82,8%) имели химиотерапию первой линии с цисплатином и этопозидом (ЕР) в среднем в 4,2 цикла. Четыре пациента начали ЭП до ПЭТ 1. У трех пациентов (10,3%) было в среднем 3 цикла карбоплатина и этопозида (СР) между ПЭТ 1 и ПЭТ 2. У двух пациентов (6,9%) были циклофосфамид, адриамицин и винкристин (КАВ), как химиотерапию второй линии. Ранее считалось, что они достигли полной ремиссии.
Двадцать один пациент (72,4%) имел ТРТ со средней дозой 54 Гр. Шестнадцать пациентов (55,2%) имели ТРТ между ПЭТ-1 и ПЭТ-2, 2 пациентами (те, кто лечился КАВ) до того, как ПЭТ-1 и 3 пациента (10,3%) имели ТРТ после ПЭТ-2. Двенадцать пациентов (41,4%) имели профилактическое церебральное лучевая терапия со средней дозой 24 Гр. Восемь пациентов не имели ТРТ, 7 из-за ЭД и 1 из-за опухоли, которая считалась слишком большой, чтобы извлечь выгоду из ТРТ.
У двух пациентов была операция после того, как у ПЭТ 2: 1 была правильная медиальная лобэктомия для сохранения изолированной метаболически активной опухоли после химиотерапии, а у другого пациента была сарреналэктомия для рецидива изолированной железы.
ПЭТ / КТ проводили на Biograph 6 (Siemens Medical Solution, Эрланген, Германия). Пациенты отдыхали в течение 80 минут перед сканированием. Инъекционная активность составляла 5,55 МБк / кг. Время на кровать составляло 3 мин, толщина среза ТТ составляла 3 мм. Было проведено 90 попыток ПЭТ / КТ, в среднем по 3.1 ПЭТ / КТ на пациента (диапазон 2-8). Для каждого пациента только первый и второй ПЭТ использовались для определения метаболического ответа с помощью критериев EORTC и PERCIST. Средний интервал между ПЭТ-1 и ПЭТ-2 составил 5,9 месяца (диапазон 4,3-7,5 месяцев и медиана 5,2 месяца).
Сканирование FDG-PET / CT было интерпретировано двумя опытными ослепшими врачами ядерной медицины. ПЭТ 1 и ПЭТ 2 сравнивали для каждого пациента с использованием критериев EORTC и PERCIST.
Визуальный анализ и количественные измерения с использованием максимального внедорожника (SUVmax) на основных опухолевых мишенях выполнялись в соответствии с руководящими принципами EORTC. Для каждого целевого поражения рассчитывали вариацию SUVmax между PET 1 и PET 2. Ответы на терапию определяли как: полный метаболический ответ (CMR), частичный метаболический ответ (PMR), стабильное метаболическое заболевание (SMD) и прогрессирующее метаболическое заболевание (PMD). Согласно критериям EORTC [3], PMD определяли как увеличение внедорожника> 25% в пределах области опухоли, определенной на базовом сканировании, видимое увеличение степени поглощения опухоли FDG (20% в самом длинном измерении) или появление нового поглощения ФДГ при метастатических поражениях. SMD определяли как увеличение опухолевого FDG внедорожника 25% после более чем одного цикла лечения. CMR определяли как полное разрешение поглощения ФДГ в объеме опухоли, так что он был неотличим от окружающей нормальной ткани.
Количественные измерения SULpeak были рассчитаны в соответствии с критериями PERCIST [6]. Вкратце, CMR определяли как визуальное исчезновение всей метаболически активной опухоли. ПМР определяли как более 30% и снижение на 0,8 единицы в SULpeak между наиболее интенсивным поражением до лечения и наиболее интенсивным поражением после лечения, хотя и не обязательно одним и тем же поражением. Более 30% и 0,8-позиционное увеличение SULpeak или новых повреждений, если это подтверждено, было определено как PMD. Рассчитаны значения SULpeak и SULtotal (сумма SUL для 1-5 повреждений) между PET 1 и PET 2.
Отсроченная CMR определялась как CMR после химиотерапии второй линии.
Перспективные переменные, изучаемые для их потенциального воздействия на прогноз, были обычными факторами, такими как возраст, пол, состояние метастазов, этап или внедорожник, и впервые проверенные ковариаты в SCLC, такие как SUL и типы ответов в соответствии с критериями оценки EORTC и PERCIST.
Статистический анализ выполнялся с помощью программного обеспечения Medcalc® (Mariakerke, Belgium) версии 11.3.6. Во-первых, был выполнен тест каппа [6] для измерения согласованности между наблюдателем и межпользователем для метаболического ответа (т. Е. CMR, PMR, SMD и PMD) между критериями EORTC и PERCIST. Во-вторых, влияние различных метаболических реакций (изучалось как CMR, PMR, SMD и PMD) на общую выживаемость было исследовано с использованием графиков Каплана-Мейера, нескорректированных для ковариатов и групп, которые сравнивались с использованием логарифмического теста. В-третьих, влияние метаболических реакций, скорректированных на предсказательные ковариаты на прогрессирующую и общую выживаемость, исследовалось с использованием модели пропорциональной опасности Кокса; ковариаты были исследованы в одномерном анализе, а те, которые связаны с величиной Р 2.5 считался положительным. Выживаемость без прогрессирования была значительно выше для пациентов с ПЭТ-отрицательным эффектом, чем для пациентов с ПЭТ-положительным. Несмотря на то что статистически не статистически значимое, среднее среднее время выживания для ПЭТ-отрицательных пациентов (29,2 месяца) было больше, чем у пациентов с ПЭТ-положительным (10,3 месяца). Fischer и др. [9] проспективно исследовали 20 пациентов с использованием ПЭТ / КТ; КТ был диагностическим и контрастным. Терапевтический ответ оценивали на КТ в соответствии с критериями RECIST и на PET / CT в соответствии с критериями, описанными MacManus и др. [10]. Метаболические изменения на ПЭТ были значительно коррелированы с изменениями размеров на КТ. Не было обнаружено различий между визуальным и полуколичественным анализом данных ПЭТ.
Наше исследование является первым, кто использует стандартизированные критерии для оценки терапевтического ответа у пациентов с SCLC. Несмотря на то, что в 4 отчетах, упомянутых ранее, была обнаружена более высокая выживаемость у пациентов с метаболическим ответом на ФДГ-ПЭТ, используемые критерии были разными в каждом исследовании, что ограничивало возможности потенциальных сравнений и будущих метаанализов.
Мы обнаружили, что CMR (независимо от того, была ли начальная или отсроченная) независимым прогностическим фактором, значительно связанным с общей выживаемостью. Насколько нам известно, это исследование впервые исследует метаболические реакции как прогностический фактор у пациентов с SCLC. Высокий пост-терапевтический эффект SULtotal также выявил пациентов с худшим прогнозом. FDG-PET / CT может сыграть определенную роль в идентификации пациентов, которые выиграют от более агрессивной терапии, особенно если они представляют LD. Однако CMR — это качественное открытие. Неясно, насколько полезной количественная оценка ответа на терапию с критериями EORTC и PERCIST является в этой популяции пациентов, поскольку не было существенной разницы в общей выживаемости между группами PMR, SMD и PMD.
Предыдущие отчеты упоминали прогностическую ценность ФДГ-ПЭТ у пациентов с SCLC. Lee et al. [11] сообщил, что метаболическая активность опухоли, оцененная SUVmax, является значительным прогностическим фактором, способным идентифицировать подгруппы пациентов с худшим прогнозом. Пандит и др. [12] оценили 46 пациентов с SCLC с помощью ФДГ-ПЭТ, в том числе 38 пациентов, получавших лечение для повторного или остаточного заболевания. Пациенты с отрицательным ПЭТ-сканированием имели значительно более длительное время выживания, чем пациенты с положительным сканированием
Одним из основных ограничений нашего исследования является небольшой размер популяции пациентов. SCLC не так часто встречается, как NSCLC, и значение FDG-PET / CT в этом показании не изучено как широко; и труднее проводить крупные проспективные исследования. Другим важным ограничением является терапевтическая гетерогенность с точки зрения различных схем химиотерапии, комбинации химиотерапии и TRT и времени терапии относительно ПЭТ-сканирования. Это частая ошибка в ретроспективных исследованиях, возможно, более остро здесь вызвана агрессивностью SCLC и ограниченной эффективностью доступных методов лечения. Несмотря на эту неоднородность, это исследование показывает важные результаты, в частности сильную прогностическую роль CMR независимо от лечения. Имеющаяся литература также, по-видимому, указывает на то, что ФДГ-ПЭТ / КТ может играть роль в управлении пациентами для терапевтической оценки и наблюдения за пациентами с SCLC. Эти результаты должны быть подтверждены большим проспективным исследованием.
Достигнуто идеальное соответствие между критериями EORTC и PERCIST. Полный метаболический ответ на пост-терапевтический ФДГ-ПЭТ / КТ у пациентов с SCLC является важным прогностическим фактором и может помочь в принятии решений для терапевтического управления. Субкатегоризация пациентов, не находящихся в CMR (в PMR, SMD и PMD), по-видимому, не имеет прогностической ценности.
Т. Вагнер работал консультантом фармацевтической компании IBA. У других авторов нет конфликта интересов.
Рак легкого является ведущей причиной смерти от рака во всем мире и обусловливает 1,59 миллионов смертей в год. Несмотря на прогресс, достигнутый в лечении пациентов, страдающих этой болезнью, пятилетняя выживаемость все еще остается невысокой, составляя приблизительно 15–16%. Основным фактором риска развития рака является табакокурение, повышающим вероятность его возникновения более чем в десять раз по сравнению с некурящими людьми. Другими состояниями, при которых повышен развития новообразования, являются идиопатический легочный фиброз и воздействие канцерогенов, например, асбеста.
Правильное определение стадии является крайне важным и необходимым моментом, позволяющим правильно спланировать лечение и оценить выживаемость. У больных раком легких является методом выбора при определении стадии опухоли, более эффективным, чем другие лучевые методы, такие как КТ или рентгенография. Благодаря возможности одновременной оценки анатомических и функциональных изменений, ПЭТ-КТ позволяет добиться большей точности по сравнению с ПЭТ и КТ в отдельности.
Этот метод диагностики позволяет более четко определить первичную опухоль, отличить опухолевую ткань от участков ателектаза и фиброзных изменений, расположенных рядом. Доказана высокая эффективность в оценке состояния лимфоузлов, а также обнаружения отдаленных метастазов. Также была подтверждена ценность этого метода как инструмента прогнозирования выживаемости путем оценки метаболизма в опухоли при первичном исследовании и в определении раннего (промежуточного) и завершающего ответа на химиотерапию. В последних литературных источниках этот метод был упомянут как рекомендуемый с экономической точки зрения.
Что такое ПЭТ-КТ?
ПЭТ-КТ является комбинированным методом визуализации, позволяющим совместить информацию об анатомических изменениях, полученную с помощью КТ, и данные об изменениях метаболизма, полученные при использовании ПЭТ; при этом исследовании существует возможность просмотра данных методов по отдельности, либо при наложении друг на друга на трехмерных реконструкциях или плоских (двухмерных) срезах. Чаще всего применяется радиофармпрепарат F18-фтордезоксиглюкова (ФДГ), использование которого позволяет обнаружить как первичную опухоль, так и метастазы. Это происходит потому, что большинство патологических очагов злокачественной природы в легких захватывают глюкозу, и видны на сканах в виде ярких участков. При ПЭТ-КТ обычно не используются йодсодержащие контрастные средства, в то же время возможно дополнительное КТ-сканирование с применением контрастных веществ. Использование йодсодержащего контрастного вещества улучшает визуализацию сосудов средостения и позволяет лучше определить их отношение к опухоли, помогает также оценить средостение и плевру, дает возможность исключить сопутствующую тромбоэмболию легочной артерии (если была выполнена КТ-ангиопульмонография).
Стадии рака легкого
В первичном обследовании пациента, страдающего раком легкого, должны принимать участие несколько специалистов: опытный рентгенолог, специалист по ядерной медицине (радионуклидным методам — сцинтиграфии и ПЭТ), рентгенохирург (специалист в области интервенционной радиологии), пульмонолог, торакальный хирург; необходимо также использовать точные и экономически эффективные методы диагностики. Существующие на данный момент руководства содержат рекомендации, что методы нужно выполнять любому пациенту, у которого имеется высокий риск рака, предпочтительно с выполнением гистологического исследования и взятием образцов ткани. Это позволяет не только установить точный гистологический вариант опухоли, но и правильно стадировать заболевание. Во многих случаях предпочтительнее выполнить биопсию подозрительных лимфоузлов средостения, а не первичной опухоли, что позволяет лучше оценить стадию (например, при биопсии лимофузла с выполнением ПЭТ ставится стадия T2N2, в то время как без ее использования – T2Nx). Кроме того, для опухолей, осложненных обструктивной пневмонией, и образований с выраженными некротическими изменениями, данные играют важную роль для определения области биопсии.
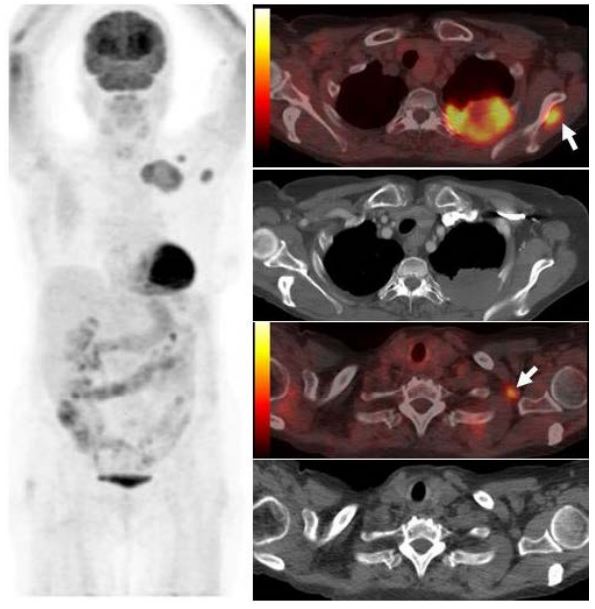
Опухоль левого легкого с частичным некрозом и деструкцией ребер. Визуализируются два метастаза в подключичных лимфоузлах и в мышцах (стрелки), которые на КТ не видны. Необходимо выполнить трансторакальную биопсию той части опухоли, которая расположена в периферических отделах, чтобы получить образец жизнеспособных тканей.
Варианты рака легкого
В 85–95% случаев рак легкого является немелкоклеточным и представляет собой аденокарциному, плоскоклеточный рак или крупноклеточный рак. Аденокарцинома может возникать как у курящих, так и некурящих пациентов; обычно представляет собой периферическую опухоль; рано дает отдаленные метастазы. Степень захвата аденокарциномой F18-ФДГ имеет тенденцию быть ниже по сравнению с опухолями иного гистологического строения; некоторые опухоли, характеризующиеся низким уровнем метаболизма глюкозы, могут обуславливать ложноотрицательный результат.
Плоскоклеточный рак тесно связан с курением, в большинстве случаев является центральным. Крупноклеточный рак обычно представляет собой периферическое объемное образование в легочной ткани большого размера с наличием метастазов на момент установления диагноза. Крупноклеточный и плоскоклеточный рак характеризуются повышенным накоплением F18-ФДГ. Стадирование немелкоклеточного рака легкого осуществляется в соответствии со шкалой TNM; таким образом, информация о стадии заболевания дает возможность планирования лечения и прогнозирования выживаемости.
Остальные 10–15% случаев обусловлены мелкоклеточным раком, биологически более агрессивным, при котором стадирование, лечение и прогноз отличаются от таковых при немелкоклеточном раке. Этот тип рака очень тесно связан с курением. Выделяют две стадии заболевания: ограниченную, при которой опухоль располагается в половине грудной клетки на стороне поражения, в том числе в средостении и ипсилатеральной надключичной области; и распространенную, когда опухоль распространяется за пределы одной половины грудной клетки. Поскольку мелкоклеточный рак легочной ткани в корне отличается от немелкоклеточного, его диагностика при помощи будет обсуждаться в специально отведенной главе в конце этой статьи.
Визуализация первичной опухоли: Т-стадия
С помощью КТ можно достоверно оценить размер опухоли практически во всех случаях. Тем не менее, при наличии обусловленных опухолью осложнений, например, ателектаза легкого или обструктивной пневмонии, истинный размер первичной опухоли оценить сложнее. Позволяет отличить паренхиму спавшегося участка легочной ткани от злокачественной опухоли, т. к. опухоль характеризуется интенсивным захватом ФДГ, а спавшееся легкое — нет. Также он помогает оценить опухолевую инвазию (прорастание) в плевру и средостение. Накопление плеврой ФДГ всегда является патологическим, и при наличии новообразования органов дыхания крайне подозрительно на метастатическое поражение. При прорастании опухоли в средостение необходимо выполнять КТ с внутривенным введением йодсодержащего контрастного вещества с целью определения взаимоотношения опухоли, крупных кровеносных сосудов и перикарда.
ПЭТ-КТ лимфоузлов: N-стадия
С помощью ПЭТ можно обнаружить метастатическое поражение лимфоузлов корней легких и средостения лучше, чем с помощью любого другого метода, так как метаболически активные лимфоузлы при ПЭТ-КТ, даже малого размера, характеризуются повышенным захватом ФДГ. Это справедливо и для тех случаев, когда морфологические признаки злокачественного поражения узлов могут не обнаруживаться на КТ-изображениях. Также метод позволяет оценить увеличенные лимфоузлы, не накапливающие или минимально накапливающие радиофармпрепарат, которые часто носят реактивный характер или отражают остаточные изменения в отсутствие опухолевого поражения. При определении стадии N чувствительность составляет 81% против 61% у КТ, и специфичность 90%, в то время как КТ характеризуется специфичностью 79%.
Наибольшее преимущество в оценке средостения — это возможность исключить злокачественное поражение любого лимфоузла с высокой степенью точности. То есть, отсутствие интенсивного захвата ФДГ лимфоузлом достоверно говорит об истинном отсутствии метастазов (прогностическое значение отрицательного результата равно 99%). В то же время не все лимфоузлы средостения, характеризующиеся повышенным метаболизмом, обязательно являются злокачественными; ложноположительный результат может быть обусловлен воспалительными изменениями. Это объясняет, почему изменения со стороны средостения должны оцениваться количественно с использованием SUV (стандартизированного уровня накопления). Пороговое значение SUV max в пределах 4,0–5,3 позволяет рассматривать изменения со стороны лимфоузлов средостения как положительные (то есть, метастатическое поражение есть).
Лучшее картирование лимфоузлов средостения позволяет избежать медиастиноскопии, ограничившись трансбронхиальной игольной аспирацией под контролем УЗИ, особенно в труднодоступных областях, таких как аортопульмональное окно или область, находящаяся позади бифуркации трахеи.
Особенное значение в стадировании поражения лимфатических узлов имеет на ранних стадиях заболевания (I и II), что позволяет избежать ненужной торакотомии.
Оценка метастазов: M-стадия
У 40–50% пациентов, страдающих раком органов дыхания, в момент установления диагноза присутствуют метастазы. Наличие отдаленных метастазов в корне меняет план лечения этих пациентов, делая оперативное вмешательство намного более сложным, что приводит к гораздо более неблагоприятному прогнозу. ПЭТ-КТ имеет неоспоримые преимущества в диагностике метастазов по сравнению с традиционными методами исследования, особенно в случаях одновременного метастатического поражения множества органов, часто без какой-то определенной локализации вследствие диссеминации процесса. Повышенное накопление ФДГ в метастазах рака легкого и возможность исследования всего тела делают методом выбора при выявлении метастазов (вне головного мозга). Также метод позволяет выявить отдаленные метастазы, о которых до проведения исследования ничего не было известно, вплоть до 30% всех случаев.
Самые частые вторичные изменения при раке легкого – метастазы в кости, которые имеют место у 8–27% пациентов на момент установления диагноза. Вторичные изменения костей лучше обнаруживаются при помощи ПЭТ, чем при использовании других методов диагностики. Так, больше чем в половине случаев костных метастазов поражается только костный мозг и не происходит существенного нарушения костной структуры, из-за чего при помощи рентгенографии и КТ их не удается обнаружить, и даже сцинтиграфия скелета с использованием метилендифосфоната Tc-99m оказывается малоспецифичной при обнаружении этого типа поражений. Метастазы в кости могут иметь исключительно литический характер и интенсивно накапливать ФДГ, но в то же время гиперфиксация препарата в очагах поражения может и не определяться.
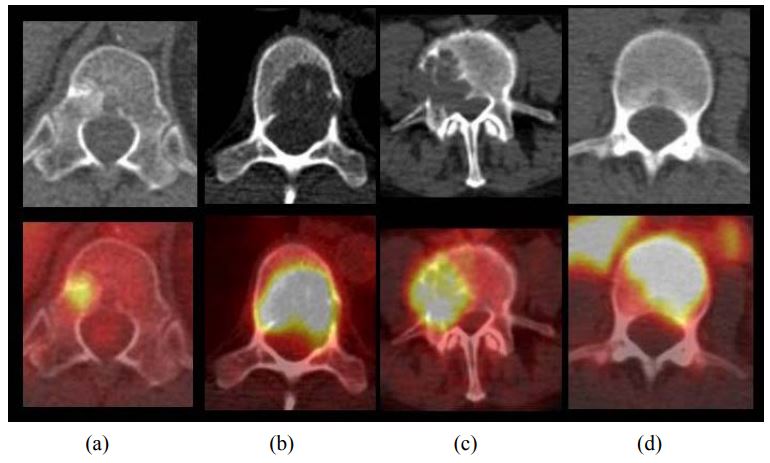
Типы метастазов в кости при раке легкого. (a) Остеобластический. (b) Остеолитический. (c) Смешанный. (d) Поражение костного мозга.
У пациентов, страдающих раком легкого, часто возникают метастазы в органы брюшной полости. Чаще всего поражаются печень и надпочечники. Поскольку также могут встречаться доброкачественные изменения печени и надпочечников, необходимо использовать диагностические методы, позволяющие распознать их и отличить от метастазов. В случаях изменений со стороны надпочечников, умеренное или выраженное накопление ФДГ обладает высокой прогностической ценностью положительного результата для метастазов. Чувствительность и специфичность ПЭТ с использованием SUV (стандартизированного уровня накопления) в целом в популяции составляет 87% и 87%, в то время как у пациентов с раком легкого 94% и 82% соответственно. Лучшим пороговым значением SUV max, позволяющим дифференцировать злокачественные и доброкачественные поражения, по-видимому, является 2,5.
В случаях метастазов в печень, практически все доброкачественные поражения (кисты, гемангиомы, фокальная нодулярная гиперплазия) характеризуются меньшим или идентичным по сравнению с паренхимой печени уровнем накопления ФДГ. Любой узел, любые объемные образования, накапливающие ФДГ интенсивнее, чем нормальная паренхима печени, крайне подозрительны на злокачественные изменения.
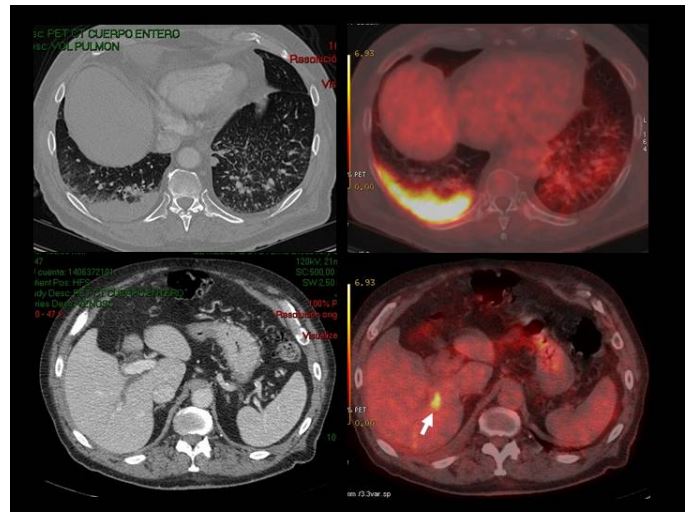
Метастазы в печени при аденокарциноме правого легкого. Определяется один метастаз в печени, который не виден на КТ с контрастным усилением.
Для обнаружения метастазов в надпочечники, почки и кости, в случаях, когда невозможно проведение, приемлемой альтернативой является МРТ всего тела с выполнением программы DWI. Позволяет оценить метастазы в областях, изменения в которых не стадируются при традиционных методах диагностики, например, в коже, скелетных мышцах, мягких тканях, поджелудочной железе, почках.
Второе мнение по ПЭТ-КТ
Необходимым условием достоверного определения стадии злокачественного новообразования является правильная оценка результатов ПЭТ-исследования. При неоднозначных или противоречивых результатах рекомендуется получить второе мнение специализированного радиолога. Повторный экспертный анализ исследования в профильном центре позволяет избежать ошибки интерпретации снимков, сделать более обоснованные выводы о стадии процесса, наличии или отсутствии метастазов, вторичных очагов в лимфатических узлов. Это исключительно важно и планировании тактики операции, химио- и лучевого лечения.
Стадирование метастазов в головной мозг
Даже несмотря на то, что вторичные изменения головного мозга не так часто встречаются у пациентов с раковыми опухолями легких, они имеют большое значение, поскольку их наличие приводит к высокому уровню заболеваемости и смертности, чего в некоторых случаях можно избежать или минимизировать путем подбора соответствующего лечения. Поскольку головной мозг характеризуется высоким базовым метаболизмом глюкозы, вторичные очаги в нем могут быть замаскированы, а чувствительность ПЭТ-исследования в обнаружении метастазов – ограничена. В связи с этим, в соответствии с существующими на данный момент протоколами рекомендуется дополнительное использование МРТ. В случаях, когда провести МРТ невозможно, можно сделать КТ с внутривенным контрастным усилением. Это дает схожие результаты с МРТ головного мозга.
Одновременное присутствие легочной и внелегочной опухоли
У 1–8% пациентов, страдающих раком легкого, на момент установления диагноза обнаруживается рак иной локализации. Большинство этих новообразований также тесно связаны с табакокурением. И, действительно, у 6,5% хронических курильщиков, которым была выставлена та или иная стадия рака любого типа, на момент установления диагноза обнаруживался одновременно существующий рак других органов и систем.
В случаях множественного рака используемые диагностические критерии являются следующими:
- Оба очага гистологически различны.
- Гистологический тип один и тот же, но нет поражения лимфоузлов и экстраторакальных метастазов.
На основании этих критериев, частота синхронного множественного рака легкого, описанная в литературе, составляет 0,5–3,3%. Наиболее часто одновременно существующие раковые опухоли, обнаруживаемые у пациентов, страдающих раком легкого, располагается в молочных железах, в голове и шее, пищеводе и щитовидной железе. Более чем 80% этих синхронных поражений обнаруживаются на ранней стадии, что предполагает возможность лечения, устраняющего причину заболевания. Тем не менее, возможность лечения в значительной степени зависит от того, насколько далеко зашла раковая опухоль на момент установления диагноза.
ПЭТ-КТ: планирование лучевой терапии
Возможность ПЭТ различить метаболически активную ткань опухоли от ателектаза, обструктивной пневмонии или фиброзных изменений имеет решающее значение в определении объема опухоли. Это очень полезно при планировании лучевой терапии, так как позволяет скорректировать форму и размер облучаемого объема тканей и уменьшить степень облучения непораженных опухолью органов (например, пищевода, сердца, спинного мозга), находящихся вблизи опухоли. Кроме того, использование ПЭТ значительно изменяет поле облучения по сравнению с КТ. Так, использование ПЭТ в дополнение к традиционным методам диагностики приводило к изменению объема облучаемых тканей более чем у 20% пациентов, и изменение стадии происходило в 20–50% случаев. В различных источниках описывается, что изменения планируемого целевого объема достигают 50% у пациентов с немелкоклеточным раком.
Контроль лечения и прогноз рака легкого
Наиболее важный прогностический фактор опухоли, подвергаемой хирургическому лечению — это степень ее диссеминации на время установления диагноза. В случает отсутствия метастазов пятилетняя выживаемость равна 57–67%; в случае вторичного поражения лимфоузлов ворот легкого — 47% , при поражении лимфоузлов средостения на стороне, противоположной опухоли — 23%. Обнаружение отдаленных метастазов является одним из основных критериев невозможности удаления опухоли хирургическим путем. Ввиду важности изложенных фактов особое значение принимает второе мнение по ПЭТ.
Василий Вишняков, врач-радиолог
При подготовке текста использованы материалы:
Читайте также:

