Первичные или метастатические опухоли
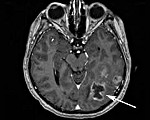
Метастатические опухоли мозга – вторичные очаги, возникающие вследствие местного агрессивного роста, гематогенного и лимфогенного метастазирования злокачественных новообразований других локализаций. У 30% больных протекают бессимптомно. В остальных случаях опухоли головного мозга проявляются головными болями, головокружениями, тошнотой, рвотой, очаговой симптоматикой, психическими и эмоциональными нарушениями. При поражении спинного мозга возникают боли, чувствительные и двигательные расстройства. Диагноз выставляется с учетом анамнеза, симптомов, КТ, МРТ и других исследований. Лечение – радиотерапия, реже оперативное удаление или химиотерапия.

- Причины
- Симптомы метастатических опухолей головного мозга
- Симптомы метастатических опухолей спинного мозга
- Диагностика метастатических опухолей мозга
- Лечение метастатических опухолей
- Прогноз
- Цены на лечение
Общие сведения
Метастатические опухоли мозга – группа злокачественных новообразований различного происхождения, возникших в спинном либо головном мозге в результате распространения клеток первичной опухоли. Метастазы в головной мозг выявляются у каждого пятого онкологического больного. Метастатическое поражение спинного мозга по различным данным наблюдается у 30-70% пациентов. По данным исследователей, вторичные поражения ЦНС встречаются примерно в 10 раз чаще первичных.
Пик заболеваемости приходится на 50-70 лет, мужчины и женщины страдают одинаково часто. Иногда симптомы метастатической опухоли мозга становятся первым сигналом о появлении другого новообразования. К примеру, 10% пациентов с раком легких впервые обращаются за помощью из-за возникновения неврологических расстройств. Прогноз обычно неблагоприятный, вторичное поражение мозга является одной из ведущих причин смертности при злокачественных опухолях. Лечение осуществляют специалисты в сфере онкологии и неврологии.

Причины
Метастазы в ЦНС могут возникать при злокачественных новообразованиях любой локализации. От 30 до 60% от общего количества метастатических опухолей мозга появляются при раке легких, от 20 до 30% - при новообразованиях молочной железы. Третье место по распространенности занимают метастазы при меланомах (10%), четвертое – при раке толстого кишечника (5%). Реже метастатические опухоли мозга встречаются при лимфомах, саркоме и новообразованиях щитовидной железы.
Иногда причиной вторичных процессов в головном мозге становится инфильтративный рост новообразований назофарингеальной области. Вторичное поражение спинного мозга в результате агрессивного роста первичного очага может выявляться при новообразованиях позвонков, абдоминальной форме лимфомы Беркитта и других объемных процессах, локализующихся рядом со спинномозговым каналом. В числе редких онкологических заболеваний, иногда осложняющихся метастатическими опухолями мозга – тератома яичка и хориокарцинома. По неизвестным причинам в мозг редко метастазируют злокачественные опухоли яичников, шейки матки и мочевого пузыря.
80% метастатических опухолей головного мозга располагаются в зоне больших полушарий, 15% – в мозжечке, 5% - в стволе мозга. Большинство вторичных очагов в спинном мозге локализуются на уровне нижних грудных либо верхних поясничных позвонков. Поражения твердой мозговой оболочки составляют около 10% от общего количества метастатических опухолей мозга. Более 70% метастазов множественные, что ухудшает прогноз. Гистологическое строение вторичной опухоли – как у первичного новообразования. Симптомы обусловлены как непосредственным давлением узла на нервные структуры, так и перифокальным отеком окружающих тканей.
Симптомы метастатических опухолей головного мозга
Метастатическая опухоль мозга проявляется головными болями, головокружениями, тошнотой, рвотой, припадками, нарушениями сознания, сенсорными расстройствами и очаговой неврологической симптоматикой. Возможны психические и эмоциональные нарушения: эмоциональная неустойчивость, сонливость, заторможенность, когнитивные расстройства, личностные изменения и т. д. Выраженность симптомов метастатической опухоли мозга сильно варьирует – от незначительных нарушений памяти или настроения до тяжелых эпиприпадков.
Распирающие головные боли, тошнота и расстройства сознания свидетельствуют о повышении внутричерепного давления. Особенно упорная тошнота наблюдается у детей. У 30% больных метастатическими опухолями мозга выявляются эпилептиформные судороги, от них страдают преимущественно люди старше 45 лет. Очаговая симптоматика различается. Возможны снижение либо потеря чувствительности, нарушения зрения, нарушения слуха, параличи и парезы конечностей. Расстройства возникают на стороне, противоположной расположению метастатической опухоли мозга.
Динамика неврологических расстройств также различается. У одних пациентов наблюдается постепенное усугубление нарушений, у других расстройства развиваются внезапно, по типу инсульта. Причиной внезапного появления симптомов может стать кровоизлияние в метастатическую опухоль мозга либо эмболия сосуда фрагментом новообразования. Иногда наблюдается ремитирующее течение заболевания, при котором очаговые и внемозговые нарушения волнообразно усиливаются и ослабевают.
Симптомы метастатических опухолей спинного мозга
Первым проявлением метастатической опухоли мозга обычно становятся боли. Вначале болевой синдром неинтенсивный и непостоянный, возникает только при кашле и резких движениях. В последующем боли усиливаются, появляются спонтанно, беспокоят постоянно, не исчезают даже после сна или продолжительного отдыха. Выявляются прогрессирующие нарушения чувствительности и двигательные расстройства. Развивается гиперестезия, сменяющаяся гипестезией, а затем анестезией.
Пациенты с метастатическими опухолями мозга отмечают мышечную слабость и быструю утомляемость при физических нагрузках. Со временем мышечная слабость переходит в парезы, а парезы – в параличи. Зона чувствительных и двигательных нарушений определяется уровнем и локализацией метастатической опухоли мозга. При поражении боковых отделов может выявляться синдром Броун-Секара. При опухолях в задних либо передних отделах обычно наблюдаются симметричные расстройства.
При поражениях шейного отдела возникает спастическая тетраплегия, при новообразованиях грудного отдела – спастическая нижняя параплегия, при процессах в поясничном отделе – вялая нижняя параплегия, при метастазах в зоне крестца – паралич мышц-сгибателей нижних конечностей. Для всех метастатических опухолей мозга характерны нарастающие тазовые расстройства. Возможно быстрое образование пролежней, особенно – при поражении нижних отделов спинного мозга.
Диагностика метастатических опухолей мозга
Диагноз устанавливается онкологом и нейрохирургом с учетом клинических проявлений и данных дополнительных исследований. Важную роль играют анамнестические данные: подозрение на злокачественную опухоль либо наличие уже диагностированного новообразования внемозговой локализации, а также состояние после оперативного или консервативного лечения по поводу данной патологии. Необходимо учитывать, что иногда симптомы метастатической опухоли мозга становятся первым проявлением патологического процесса в другом органе.
Настораживающими признаками в отношении новообразований головного мозга являются головные боли, тошнота, эпилептиформные припадки (обнаруживаются у 35% пациентов) и прогрессирующая очаговая симптоматика. Подозрение на вторичный процесс в спинном мозге возникает при продолжительных нарастающих болях, двигательных и чувствительных нарушениях и расстройствах деятельности тазовых органов. Основные инструментальные методы диагностики метастатических опухолей мозга – КТ и МРТ. Обычно исследования начинают с более доступной КТ головного мозга и КТ позвоночника, а полную информацию о количестве, размере и расположении очагов получают при проведении МРТ с контрастным усилением. При поражении спинного мозга также информативна люмбальная пункция с ликвородинамическими пробами.

Лечение метастатических опухолей
Пациентам назначают противосудорожные препараты, стероиды, обезболивающие и психотропные средства. Основным методом лечения метастатических новообразований головного мозга обычно становится радиотерапия, которая используется отдельно, в сочетании с химиотерапией либо хирургическим вмешательством. Показанием к оперативному лечению является наличие операбельного солитарного метастаза (вторичного очага при невыявляемом первичном процессе) либо одиночного метастаза при контролируемом первичном новообразовании.
Обычно операции выполняют при метастатических опухолях мозга, расположенных в мозжечке, височных и лобных долях, то есть, в зонах с относительно невысоким операционным риском. После операции назначают радиотерапию либо химиотерапию. Иногда целью хирургического лечения является не удаление метастатической опухоли мозга, а экстренное снижение опасного для жизни внутричерепного давления. При необходимости подобные вмешательства могут проводиться многократно.
Химиотерапия обычно неэффективна. Исключением являются ситуации, когда первичное новообразование хорошо реагирует на цитостатики, например, при раке молочной железы, мелкоклеточном раке легкого либо лимфоме. Пациентам с метастатической опухолью мозга, чувствительной к химиотерапии, назначают лекарственные средства, способные проникать через гематоэнцефалический барьер. Химиотерапию обязательно дополняют другими способами лечения (обычно – радиотерапией).
Перспективным современным методом лечения метастатических опухолей мозга является 3D-конформная лучевая терапия – облучение тонкими пучками радиации, направленными на опухоль. Эта методика позволяет обеспечить максимальное воздействие на опухоль при минимальной лучевой нагрузке на здоровые ткани. Процедура проводится под контролем МРТ либо КТ. Метод имеет ряд преимуществ перед традиционными операциями (безболезненность, неинвазивность, отсутствие наркоза и послеоперационного периода). Показан при множественных метастатических опухолях мозга и при высоком операционном риске, обусловленном особенностями расположения метастаза.
При вторичных очагах в спинном мозге применяют те же методы, что при поражении головного мозга. Назначение кортикостероидных препаратов позволяет уменьшить боли у 85% больных, радиотерапия – у 70% больных. У половины пациентов на фоне радиотерапии отмечается улучшение двигательных функций. Оперативные вмешательства осуществляют при нечувствительности метастатических опухолей мозга к радиотерапии, при прогрессировании неврологических расстройств либо сдавлении нервной ткани отломком кости. Выполняют переднюю декомпрессию либо ламинэктомию. После операции назначают локальную радиотерапию (за исключением новообразований, нечувствительных к лучевой терапии).
Прогноз
Прогноз при метастатических опухолях мозга обычно неблагоприятный. Средняя продолжительность жизни с момента выявления вторичного очага составляет 6-8 недель. При солитарных метастазах и одиночных метастазах в сочетании с первичными новообразованиями, хорошо реагирующими на терапию, своевременно начатое лечение позволяет продлить среднюю продолжительность жизни больных с метастатическими опухолями мозга до 10 месяцев с момента постановки диагноза.
В последние десятилетия усилия многих онкологов были направлены на установление детальных механизмов зарождения раковой опухоли, регуляции ее активного роста и процессов формирования благоприятного для нее микроокружения из клеток стромы, соединительнотканного каркаса органа. Со временем стало понятно, что основная угроза рака заключена в его способности к распространению по организму.
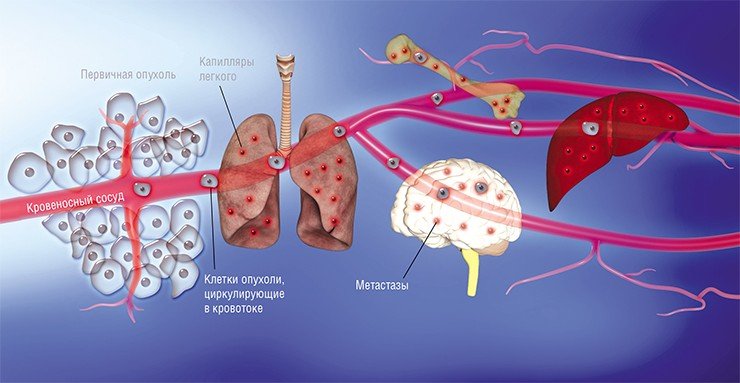
Наконец в 1970-е гг. благодаря экспериментам на лабораторных мышах, которым делались инъекции раковых клеток, меченных радиоактивными изотопами, американский исследователь И. Фидлер смог доказать, что на результат метастазирования влияет природа раковых клеток: клетки меланомы метастазировали в легкие, но не в печень, в сосудах которой они не выживали. Позднее были установлены и другие факты, подтверждающие, что раковые клетки разной природы метастазируют преимущественно в определенные органы, иногда даже и в определенной последовательности. Например, клетки рака молочной железы формируют метастазы сначала в костях, печени, лимфатических узлах и легких, и лишь потом уже – в мозге. Явление специфичного распределения метастазов по организму назвали органотропией метастазирования.
И сегодня в онкологии все еще остается много вопросов без ответов. Например, отличаются ли метастазные раковые клетки от других клеток первичной опухоли? Что лежит в основе органотропии? И главное: как метастазам удается выжить после удаления первичной опухоли и проведения химиотерапии?
Метастазы: от генетики до эпигенетики
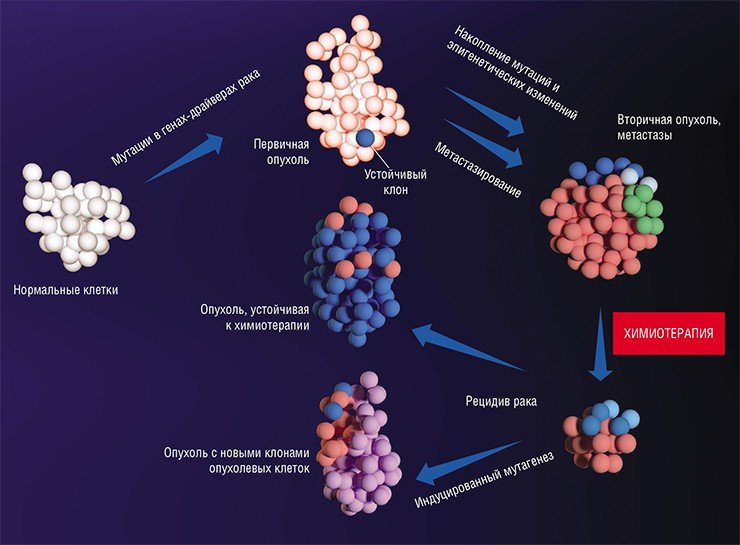
Интересно, что был обнаружен как минимум один ген – FBXW7, мутации в котором противодействуют метастазированию (Mlecnik et al., 2016). Происходит это за счет усиления провоспалительной реакции, увеличения численности и роста активности T-лимфоцитов, что стимулирует формирование иммунных реакций по отношению к опухолевым клеткам. Таким образом, появление мутаций в гене FBXW7 раковых клеток предотвращает развитие характерной для опухолей иммуносупрессии.
После формирования преметастазных ниш с благоприятным клеточным окружением некоторые раковые клетки покидают первичную опухоль и формируют микрометастазы в других тканях и органах. Финальный этап формирования вторичного очага может занимать от нескольких месяцев до нескольких лет
До сих пор мы говорили о непосредственных изменениях в самой структуре ДНК. Следующая ступень в регуляции экспрессии генов – эпигенетические изменения, связанные с метилированием ДНК и гистонов (ДНК-связывающих белков). По своей природе такие изменения более пластичны по сравнению с генетическими: они подвержены влиянию клеточных каскадов передачи сигнала, подстраивающихся под действие внешних факторов.
На развилке метаболических путей
Эпигенетическая регуляция – один из важнейших механизмов программирования клеточного метаболизма. С ростом опухоли внутри нее образуются области, куда не доходят кровеносные сосуды и где возникает кислородная недостаточность (гипоксия). В результате деметилирования ДНК в раковых клетках начинает активно работать ген, кодирующий белок HIF‑1-альфа, который так и называется – фактор, индуцируемый гипоксией. Усиленное образование этого белка, в свою очередь, влияет на уровень экспрессии генов множества метаболических ферментов и белков-транспортеров, что приводит к комплексным изменениям метаболизма раковых клеток.
Как известно, клеточный метаболизм включает процессы расщепления соединений с выделением энергии (катаболизм) и их образования с использованием энергии (анаболизм). Энергетический обмен клетки обеспечивается благодаря клеточному дыханию, в котором выделяют гликолиз (ферментативный распад глюкозы), цикл трикарбоновых кислот (окислительные превращения промежуточных продуктов распада и синтеза белков, жиров и углеводов) и окислительное фосфорилирование (запасание энергии в результате окисления молекул органических веществ).
Раковые клетки по-своему приспосабливают энергетический обмен к условиям недостатка кислорода. В первичной опухоли они в основном используют анаэробный гликолиз, а не окислительное фосфорилирование, как в нормальных клетках. Это усиленное поглощение и расщепление глюкозы до молочной кислоты, которая выделяется раковыми клетками, названо эффектом Варбурга. Такая адаптация позволяет раковым клеткам успешно выживать и активно размножаться при недостатке кислорода.
Но все это относится к первичной опухоли, для клеток же метастазов особенности генерирования энергии до сих пор мало изучены. Тем не менее, используя клетки рака молочной железы, обладающие широкой органотропией при метастазировании, ученые обнаружили различия в метаболизме первичной опухоли и метастазов. Раковые клетки, колонизировавшие кости и легкие, более активно использовали окислительное фосфорилирование, а колонизировавшие печень – гликолиз. Когда раковые клетки колонизировали все возможные органы-мишени, в них активировались оба метаболических пути (Rosen, Jordan, 2009). Похоже, что такая метаболическая пластичность помогает раковым клеткам осваивать новые ниши.
Почему же метастазам в одном случае выгоднее использовать преимущественно один вид метаболизма, а в другом – другой? Ответ на этот вопрос, как и на вопрос о роли различных факторов в регуляции метаболической пластичности раковых клеток, еще только предстоит узнать.
Несмотря на всю свою адаптационную пластичность, метастазные раковые клетки не могут в одиночку справиться со столь непростой задачей – освоением совершенно незнакомого места обитания.
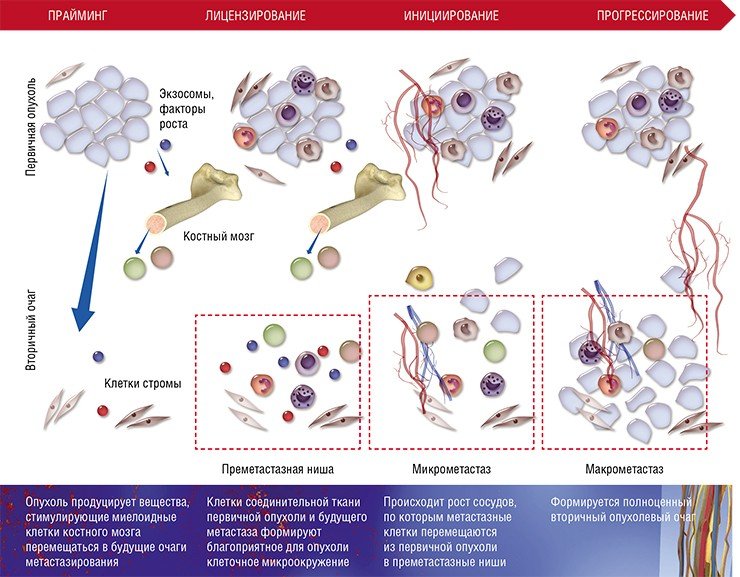
Хотя описанная выше схема характерна для большинства органов, у нее имеются особенности в зависимости от места (органа), где формируются метастазы. Например, в печени и легких в процессе создания преметастазной ниши активно участвуют еще одни клетки крови – нейтрофильные гранулоциты. Известно, что лейкоциты этого вида помогают раковым клеткам интегрироваться в новую нишу, секретируя протеазы и цитокины и непосредственно контактируя с раковыми клетками при выходе из капилляров.
Основная же функция лизилоксидазы заключается в формировании поперечных связей между коллагеновыми волокнами соединительной ткани. При развитии гипоксии раковые клетки молочной железы увеличивают синтез этого фермента, что способствует ремоделированию внеклеточного матрикса при подготовке уже другой преметастазной ниши – в легких.
При некоторых типах рака (например, меланоме) для успешного метастазирования в лимфатические узлы и органы необходимо, чтобы в их преметастазной нише сформировались новые лимфатические сосуды. Недавно было установлено, что такой лимфангиогенез начинается на ранних стадиях роста первичной опухоли, а медиатором его запуска является белковый фактор роста мидкин, секретируемый клетками меланомы (Olmeda et al., 2017).
Ученые провели интересный эксперимент: выделив экзосомы от раковых клеток разного происхождения (рака груди, поджелудочной железы и др.), они ввели их в кровоток лабораторных мышей, которым были привиты опухоли другого типа (Hoshino et al., 2015). Оказалось, что с помощью экзосом можно перепрограммировать распределение метастазов по органам.
Подведем итог. Все описанные механизмы метастазирования, безусловно, усложняют картину течения онкозаболеваний и тактики их лечения. Особого внимания требует гетерогенность первичной опухоли и метастазов по ряду самых разных признаков, из чего следует необходимость использовать комбинированное и таргетное (направленное) лечение на разных стадиях течения болезни. Подтверждение этому – результаты одного из последних исследований, базирующихся на лечении онкологического пациента с рецидивами между курсами длительной иммунотерапии (Jiménez-Sánchez et al., 2017). Сравнение популяций T-лимфоцитов из микроокружения разных метастазов показало, что они гетерогенны. Следовательно, первичная, вторичные и последующие опухоли по-разному отвечают на лечение.
Alderton G. K. Tumour evolution: epigenetic and genetic heterogeneity in metastasis // Nat Rev Cancer. 2017. V. 17. N. 2. P. 141.
Cox T. R., Rumney R. M. H., Schoof E. M., et al. The hypoxic cancer secretome induces premetastatic bone lesions through lysyl oxidase // Nature. 2015. V. 522. N. 7554. P. 106—110.
Jiménez-Sánchez A., Memon D., Pourpe S., et al. Heterogeneous Tumor-Immune Microenvironments among Differentially Growing Metastases in an Ovarian Cancer Patient // Cell. 2017. V. 170. N. 5. P. 927—938.e20.
Hoshino A., Costa-Silva B., Shen T.-L., et al. Tumour exosome integrins determine organotropic metastasis // Nature. 2015. V. 527 N. 7578. P. 329—335.
Mlecnik B., Bindea G., Kirilovsky A., et al. The tumor microenvironment and Immunoscore are critical determinants of dissemination to distant metastasis // Sci Transl Med. 2016. V. 8. N. 327. P. 327ra26-327ra26.
Olmeda D., Cerezo-Wallis D., Riveiro-Falkenbach E., et al. Whole-body imaging of lymphovascular niches identifies pre-metastatic roles of midkine // Nature. 2017. V. 546 N. 7660. P. 676—680.
Rosen J. M., Jordan C. T. The increasing complexity of the cancer stem cell paradigm // Science. 2009. V. 324. N. 5935. P. 1670–1673.
Yates L. R., Knappskog S., Wedge D., et al. Genomic Evolution of Breast Cancer Metastasis and Relapse // Cancer Cell. 2017. V. 32. N. 2. P. 169—184.e7
Опухоль кости – рост патологических клеток в кости. Опухоль кости может быть доброкачественной или злокачественной.

Доброкачественные опухоли кости относительно широко распространены, злокачественные встречаются редко. Доброкачественные или злокачественные опухоли могут быть первичными, если они исходят непосредственно из клеток кости, или вторичными (метастатическими), когда злокачественные опухоли из другого органа (например, молочной железы или предстательной железы) распространяются на кости. У детей злокачественные опухоли кости чаще первичные; у взрослых – как правило, метастатические.
Наиболее частый симптом опухолей костей – боль в кости. Кроме того, иногда заметны увеличение кости в объеме или припухлость. Нередко опухоль, особенно если она злокачественная, ослабляет кость, в результате чего при малой нагрузке или даже в покое может возникнуть перелом (патологический перелом).
При постоянных болях в суставе или конечности больному необходимо назначить рентгенологическое исследование. Однако рентгенография показывает только наличие опухоли и обычно не позволяет определить, доброкачественная она или злокачественная. Компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) часто помогают установить точное расположение и размер опухоли, но тоже не дают возможности поставить окончательный диагноз.
Для точной диагностики, как правило, требуется взятие образца ткани опухоли для исследования под микроскопом (биопсия). При многих опухолях кусочек ткани можно получить, введя иглу в опухоль (аспирационная биопсия); однако нередко это возможно сделать только хирургическим путем (открытая инцизионная биопсия). При выявлении злокачественной опухоли чрезвычайно важно срочно начать лечение, которое может включать лекарственную терапию, операцию и лучевую терапию.
Доброкачественные опухоли костей
Остеохондромы (костно-хрящевые экзостозы) – наиболее широко распространенный тип доброкачественных опухолей кости. Чаще всего остеохондромы встречаются у молодых людей в возрасте от 10 до 20 лет. Эти опухоли растут на поверхности кости и представляют собой твердые выросты. У больного может быть одна или несколько опухолей; тенденция к развитию нескольких опухолей иногда наследуется. Примерно у 10% людей, имеющих более одной остеохондромы, в течение жизни развивается злокачественная опухоль кости, называемая хондросаркомой. У людей, имеющих только одну остеохондрому, развитие хондросаркомы маловероятно.
Доброкачественные хондромы чаще всего встречаются у молодых людей в возрасте от 10 до 30 лет и развиваются в центральной части кости. Эти опухоли часто обнаруживаются при рентгенологическом исследовании, назначенном по другим поводам. На рентгенограмме они имеют характерный внешний вид, что нередко позволяет поставить точный диагноз. Некоторые хондромы сопровождаются болями. Если боли отсутствуют, хондрому не требуется удалять или лечить. Однако следует периодически повторять рентгенологическое исследование, чтобы контролировать рост опухоли. Если опухоль невозможно точно диагностировать по рентгенограмме или если она сопровождается болью, может быть необходима биопсия, чтобы определить, доброкачественным или злокачественным является данное новообразование.
Хондробластомы – редкие опухоли, которые развиваются в конечных отделах костей. Они чаще возникают у молодых людей в возрасте от 10 до 20 лет. Эти опухоли могут вызывать боли, благодаря чему их и обнаруживают. Лечение заключается в хирургическом удалении опухоли; иногда опухоли рецидивируют после операции.
Хондромиксоидные фибромы – очень редкие опухоли, которые возникают у людей моложе 30 лет и, как правило, сопровождаются болью. Хондромиксоидные фибромы имеют характерный внешний вид на рентгенограмме. Лечение заключается в хирургическом удалении опухоли.
Остеоидные остеомы – очень маленькие опухоли, которые обычно развиваются в костях рук или ног, но могут возникать и в других костях. Они, как правило, сопровождаются болью, которая усиливается ночью и отчасти снимается небольшими дозами аспирина. Иногда атрофируются мышцы, окружающие опухоль; это состояние нередко проходит после удаления опухоли. Для определения точного расположения опухоли назначают сканирование костей с использованием радиоактивных изотопов. Иногда для определения локализации опухоли могут потребоваться дополнительные исследования, например КТ и специальные рентгенологические методы. Хирургическое удаление опухоли – единственный способ радикально устранить боль. Некоторые люди не соглашаются на операцию и предпочитают постоянно принимать аспирин.
Гигантоклеточные опухоли чаще всего встречаются у людей после 20-30 лет. Эти опухоли обычно начинают развиваться в конечных отделах костей и могут прорастать в смежные ткани. Как правило, опухоли сопровождаются болью. Лечение зависит от размера опухоли. При хирургическом удалении опухоли образовавшийся дефект заполняют костным трансплантатом или синтетическим костным цементом, чтобы сохранить структуру кости. Иногда при очень крупных опухолях требуется удаление всего пораженного сегмента кости. Примерно у 10% людей опухоли рецидивируют после операции. Иногда гигантоклеточные опухоли перерождаются в злокачественные.

Первичные злокачественные опухоли костей
Множественная миелома, наиболее широко распространенный вид первичной злокачественной опухоли кости, исходит из клеток костного мозга, вырабатывающих клетки крови. Чаще всего она возникает у людей пожилого возраста. Эта опухоль может поражать одну или несколько костей; соответственно боль возникает или в одном месте, или одновременно в нескольких местах. Лечение должно быть комплексным и часто включает химиотерапию, лучевую терапию и хирургическую операцию.
Остеосаркома (остеогенная саркома) – вторая по распространенности первичная злокачественная опухоль костей. Остеогенная саркома наиболее часто встречается у людей в возрасте от 10 до 20 лет, но может возникать в любом возрасте. Этот тип опухоли иногда развивается у пожилых людей, страдающих болезнью Педжета. Около половины остеосарком развивается в области коленного сустава, а вообще они могут исходить из любой кости. Эти опухоли имеют тенденцию к метастазированию в легкие. Обычно остеосаркомы вызывают боль и припухлость ткани (отек). Диагноз ставится на основании результатов биопсии.
Лечение остеогенных сарком обычно включает химиотерапию и операцию. Сначала, как правило, назначается химиотерапия; часто боль стихает уже на этом этапе лечения. Затем опухоль удаляют хирургическим путем. Около 75% оперированных больных живут по крайней мере 5 лет после установления диагноза. Поскольку хирургические методы постоянно совершенствуются, в настоящее время обычно удается сохранить пораженную конечность, в прошлом же ее часто приходилось ампутировать.
Фибросаркомы и злокачественные фиброзные гистиоцитомы похожи на остеогенные саркомы по внешнему виду, локализации и симптомам. Лечение аналогично.
Хондросаркомы – опухоли, состоящие из злокачественных хрящевых клеток. Многие хондросаркомы растут очень медленно и часто радикально излечиваются оперативным путем. Однако некоторые из них – высокозлокачественные и имеют тенденцию к быстрому метастазированию (распространению). Диагноз ставится на основании результатов биопсии. Хондросаркома должна быть удалена полностью, поскольку химиотерапия и лучевая терапия при данной опухоли неэффективны. Необходимость в ампутации конечности возникает редко. Если вся опухоль удалена, более 75% больных полностью излечиваются.
Опухоль Юинга (саркома Юинга) поражает чаще мужчин, чем женщин, в основном в возрасте от 10 до 20 лет. Большинство этих опухолей развивается в костях рук или ног, но они могут возникать в любой кости. Боль и припухлость (отек) – наиболее частые симптомы. Опухоль достигает иногда весьма больших размеров и порой поражает кость по всей длине. КТ и МРТ нередко помогают определить размеры опухоли, но для точной диагностики требуется биопсия. Лечение включает хирургическую операцию, химиотерапию и лучевую терапию, что позволяет вылечивать более 60% пациентов с саркомой Юинга.
Злокачественная лимфома кости (ретикулярноклеточная саркома) чаще всего поражает людей в возрасте 40-60 лет. Она может исходить из любой кости или из другого органа и затем метастазировать в кости. Обычно эта опухоль вызывает боль и припухлость, а поврежденная кость легко ломается. Лечение заключается в сочетанном проведении химиотерапии и лучевой терапии, что не менее эффективно, чем хирургическое удаление опухоли. Ампутация требуется редко.
Метастатические опухоли кости
Метастатические опухоли кости – злокачественные опухоли, которые распространились в кость из первичного очага, расположенного в другом органе.
Наиболее часто метастазируют в кости злокачественные опухоли молочной железы, легких, предстательной железы, почек и щитовидной железы. Метастазы могут распространяться на любую кость, но обычно поражаются кости в области локтя и колена. Если у человека, который лечится или лечился раньше по поводу злокачественной опухоли, появляется боль или припухлость кости, врач обычно назначает обследование для выявления метастатической опухоли. Эти опухоли обнаруживаются при рентгенологическом исследовании, а также при сканировании с использованием радиоактивных изотопов. Бывает, что симптомы метастатической опухоли кости появляются раньше, чем обнаруживается первичный очаг опухоли. Обычно это боли или перелом кости в месте поражения опухолью. Определить расположение первичной злокачественной опухоли позволяют результаты биопсии.
Лечение зависит от вида злокачественной опухоли. Иногда эффективна химиотерапия, иногда – лучевая терапия, в некоторых случаях применяется их комбинация, а иногда ни одно из этих средств не помогает.
Читайте также:

