Первичная опухоль это рак
Рак является одним из самых страшных заболеваний современности, и количество людей, страдающих от него, неуклонно растет. Вопросов о раке у обычных людей появляется много, и специалисты из Лондонского центра по исследованию и диагностике рака ответили на самые распространенные из них.
Сколько видов рака существует?
Всего известно около 200 разновидностей раковых заболеваний, некоторые из них встречаются реже, другие чаще. Не всегда боль является первым симптомом заболевания. Сами по себе раковые клетки не причиняют боль, но когда из-за них появляется опухоль, она может давить на органы человека, либо блокировать дыхательные пути. В таком случае появляется боль. Если болезнь развилась и распространилась на кости, то боль может быть симптомом.
Как рак убивает?
На ранних стадиях рак не убивает, смертельным он становится на последних. При определенных разновидностях рака выживают более 90 процентов пациентов.
Некоторые виды рака убивают посредством разрушения жизненно важных органов. Например, если он поражает легкое, то возникают проблемы с дыханием. Рак может заблокировать работу пищеварительной системы, и в таком случае организм не может всасывать питательные вещества. Если рак поражает кости или печень, то нарушается химический баланс организма.
Сколько стадий рака существует?
Специалисты выделяют четыре стадии рака:
первая стадия – локальный рак, то есть опасные клетки пока не распространяется за пределы очага заболевания.
вторая стадия означает, что опухоль, по сравнению с первой стадией, увеличилась. Может также означать, что раковые клетки распространились на соседние лимфатические узлы, могли проникнуть в кровь, повышая риск развития рака в любом органе.
третья стадия – опухоль большего размера, чем в первых двух стадиях. Раковые клетки распространились в соседние лимфатические узлы, и начинают проникать в расположенные рядом ткани и органы.
четвертая стадия, вторичный или метастатический рак. Раковые клетки распространились на другие органы тела. Люди живут и с четвертой стадией, но в этих случаях врачи чаще держат заболевание под контролем, а не вылечивают.
Можно ли определить, как давно начали развиваться раковые клетки?
Все пациенты задают этот вопрос. В случае с раком кожи можно удалить пораженный участок, и определить начало развития рака. С другими видами рака это сделать невозможно: он может развиваться годами до появления симптомов.
Если у пациента был уже рак, повышается ли риск развития рака другого типа?
Риск развития рака незначительно повышается из-за лечения на начальных стадиях. Если это была радиотерапия, особенно при раке груди, яичек и кожи, то она убивает раковые клетки, но, в то же время, повреждает здоровые клетки, которые могут мутировать в канцерогенные. Но этот риск незначительный.
Влияют ли раса и цвет кожи на риск развития рака?
В общем, нет, но некоторые виды рака чаще встречаются у "цветных" людей. Например, рак простаты чаще выявляют у жителей района Карибского моря, а рак крови – у чернокожих.
Какие виды рака наследственные?
Ученые обнаружили гены, ответственные за рак яичников, груди, матки и кишечника. Даже если у вас есть такие гены, это не означает, что рак у вас обязательно будет развиваться, но вы будете входить в группу повышенного риска его развития. Если вы захотите, вы можете пройти обследование и выяснить, передался ли вам этот ген. Рак простаты, яичек и поджелудочной железы также может наблюдаться у нескольких поколений, но их ген не обнаружен.
Какая разница между первичным и вторичным раком?
Рак называется первичным, если он локальный, то есть раковые клетки остаются в пределах очага заболевания. Вторичный рак наблюдается при отделении раковых клеток от первичной опухоли, их проникновении через кровеносную систему или лимфатические узлы в другой орган, и их развитии на новом месте.
Вторичный рак – это развитая форма рака, которую лечить сложнее. Когда раковые клетки попадают в кровь, опухоль может развиться на новом месте. В таких случаях доктора могут замедлить рост опухоли либо смягчить боль.
Почему нельзя лечить рак трансплантацией органов?
В случае, когда рак распространяется на другие органы, нет никакого смысла в трансплантации органа-очага заболевания, так как раковые клетки, уже проникшие в другие органы, будут развиваться на новом месте. К тому же, пациенту нужно будет пройти курс лечения против отторжения трансплантированного органа, что ослабит иммунную систему, которая борется с раком.
Можно ли заразиться раком от кого-то?
Нет, развитие раковых клеток – это внутренний процесс, и заразиться раковыми клетками невозможно.
Что происходит, когда семейный врач диагностирует рак?
Он должен направить пациента к специалисту. В большинстве случаев требуется хирургическое вмешательство, поэтому вначале пациент встретится с хирургом, затем специалист в области онкологических заболеваний решит, требуется ли терапия (химиотерапия, гормональная терапия) после операции. Если возникнет необходимость, пациента могут направить на радиотерапию к клиническому онкологу.
Могут ли диета и физические упражнения помочь в борьбе с раком?
Сбалансированная диета означает, что состояние здоровья пациента улучшиться перед началом лечения рака. Иммунная система сможет бороться с инфекцией, и выздоровление наступит раньше. Физические упражнения позволят чувствовать себя лучше, но нужно следовать предписаниям врача, и не переусердствовать с ними.
Влияет ли рак на способность иметь детей?
Это зависит от способа лечения рака: некоторые виды химио- и радиотерапии влияют на способность иметь детей. В случае с мужчинами это проще: они могут сдать сперму, а процедура замораживания яичниковой ткани женщин гораздо сложнее.
Почему нельзя оперировать при некоторых видах рака?
Если опухоль находится близко к основным органам, кровеносным сосудам, или у позвоночника, оперировать в таких случаях очень сложно. На последних стадиях, когда рак распространяется за пределы очага заболевания, оперирование неуместно.
Рак крови или костного мозга невозможно оперировать: в таких случаях применяют химиотерапию, радиотерапию, гормональное или биологическое лечение.
При каких видах рака выживаемость выше?
Выживаемость выше при раке яичек и простаты у мужчин, и у женщин с раком груди и матки, так как их можно раньше удалить.

Первично множественные опухоли – неоплазии, возникающие одновременно или через определенный промежуток времени и не являющиеся метастазами друг друга. Могут быть доброкачественными или злокачественными, мультицентрически располагаться в одном органе, возникать в парных органах, локализоваться в пределах одной системы или нескольких систем. Возникают в результате соматических мутаций или наследственных генетических аномалий. Диагностируются на основании клинических симптомов, лабораторных и инструментальных исследований. Тактика лечения определяется типом, распространенностью, локализацией и степенью злокачественности новообразований.

- Причины
- Классификация
- Диагностика
- Лечение первично множественных опухолей
- Цены на лечение
Общие сведения
Первично множественные опухоли – две или более неоплазии различного генеза, одновременно либо последовательно развившиеся в одном или нескольких органах. В большинстве случаев диагностируются два новообразования. Три узла обнаруживаются у 5-8% пациентов. Случаи четырех и более неоплазий являются крайне редкими и рассматриваются как казуистические. В последние десятилетия отмечается резкое увеличение количества первично множественных опухолей, однако истинная частота их развития пока является предметом исследований.
Согласно статистическим данным, первично множественные опухоли выявляются у 13% пациентов с онкологическими заболеваниями, однако некоторые специалисты указывают, что эта цифра может быть заниженной из-за возможных диагностических ошибок (при определении независимого процесса, как метастаза первичного новообразования) и гибели некоторых больных до появления симптомов второй неоплазии. Лечение первично множественных опухолей осуществляют онкологи, гастроэнтерологи, эндокринологи, маммологи, гинекологи и специалисты в других сферах медицины (в зависимости от локализации новообразований).
Первое упоминание о множественных неоплазиях встречается в трудах Авиценны, который более тысячи лет назад описал двухсторонний рак молочных желез. В XIX веке описания первично множественных опухолей стали все чаще встречаться в специализированной литературе. Наиболее существенный вклад в определение понятия и изучение данной патологии внес немецкий хирург Бильрот. В частности, он первым дал определение подобным патологическим состояниям, отнеся к первично множественным опухолям новообразования различной структуры, локализующиеся в разных органах и дающие собственные метастазы.
В первой половине XX века формулировка Бильтота была пересмотрена. В настоящее время первично множественными опухолями считаются неоплазии, которые могут располагаться в одном или в разных органах. Основным условием отнесения заболеваний к этой категории является одновременное или последовательное появление в организме нескольких независимых друг от друга очагов трансформации клеток. Второе и последующие новообразования не должны возникать в результате контактного распространения, лимфогенного или гематогенного метастазирования.

Причины
Непосредственной причиной развития солитарных и первично множественных опухолей являются генетические мутации, обусловленные несколькими факторами. С учетом особенностей этиопатогенеза различают три основных типа неоплазий: возникшие в результате спонтанных соматических мутаций, образовавшиеся вследствие индуцированных соматических мутаций, являющиеся результатом передающихся по наследству генетических мутаций. Следует учитывать, что подобное разделение является достаточно условным. На практике, скорее, можно выделить преобладающую причину развития, которая сочетается с другими, менее значимыми факторами.
При первично множественных опухолях перечисленные мутации могут сочетаться. Возможны любые комбинации, например, первое новообразование развивается спонтанно, второе – в результате индукции; первое является наследственным, второе – индуцированным; оба рака имеют одну и ту же природу (наследственность, воздействие экзогенных факторов) и т. д. При этом у больных первично множественными опухолями отмечается преобладание индуцированных и наследственных мутаций.
В числе наиболее значимых факторов, индуцирующих развитие первично множественных опухолей, рассматривают курение, проживание в неблагоприятных экологических зонах, профессиональные вредности (контакт с химическими мутагенами на некоторых производствах, превышение установленных нагрузок у радиологов), многократные рентгенологические обследования, лучевую терапию и химиотерапию предшествующих онкологических заболеваний. Вероятность возникновения первично множественных опухолей также повышается при нарушениях питания, иммунодефицитных состояниях, гормональных расстройствах и некоторых эндемических заболеваниях.
В список наследственных синдромов, сопровождающихся облигатным развитием или повышенной вероятностью возникновения онкологических поражений, включают более 100 заболеваний. Первично множественные опухоли развиваются или могут развиться при трети таких заболеваний. Наиболее известными синдромами являются МЭН-1, МЭН-2 и МЭН-3, при которых выявляются множественные эндокринные неоплазии. Кроме того, первично множественные опухоли могут диагностироваться при синдроме Линча, синдроме Гарднера, болезни Гиппеля-Линдау, синдроме Пейтца-Егерса и других.
Классификация
Существует несколько классификаций, созданных на разных этапах изучения данной патологии. Современные специалисты обычно используют классификацию Бебякина, разработанную в 1974 году. Согласно этой классификации выделяют следующие типы первично множественных опухолей:
- С учетом сочетаний: все неоплазии имеют доброкачественный характер; выявляются доброкачественные и злокачественные новообразования; все опухоли протекают злокачественно.
- С учетом последовательности обнаружения: синхронные первично множественные опухоли (обнаруженные одновременно или практически одновременно), метахронные (диагностированные с интервалом 6 и более месяцев), метахронно-синхронные и синхронно-метахронные.
- С учетом функциональных взаимосвязей: гормональнозависимые, функциональнозависимые, несистематизированные.
- С учетом происхождения из определенной ткани: первично множественные опухоли одинакового происхождения и разного происхождения.
- С учетом гистологических особенностей: одинаковой гистологической структуры, разной гистологической структуры.
- С учетом локализации: расположенные в одном органе или парных органах; поражающие несколько органов одной системы; локализующихся в органах различных систем.
Диагностика
Основой успешной диагностики первично множественных неоплазий является комплексный подход, разработанный с учетом особенностей возникновения и течения этой группы заболеваний. Одной из наиболее распространенных проблем при обнаружении первично множественных опухолей является отсутствие четкой клинической картины, характерной для каждого новообразования. Проявления неоплазий могут накладываться друг на друга, симптомы одного из поражений могут быть слабо выраженными, маскироваться под неопухолевое заболевание или имитировать признаки отдаленных метастазов.
Хотя бы частично решить эту проблему позволяют продуманные планы первичного и последующих обследований, составленные с учетом возможности развития первично множественных опухолей. Так, при локализации солитарного новообразования в зоне молочной железы специалисты уделяют пристальное внимание состоянию второй молочной железы и внутренних женских половых органов, при расположении неоплазии в области желудка – состоянию толстого кишечника, кожи, яичников, матки и молочных желез и т. д. План обследования в каждом конкретном случае составляется индивидуально. Решающую роль при постановке диагноза обычно играют радиологические методики (рентгенография, КТ), УЗИ, МРТ и гистологические исследования.
Вероятность развития первично множественных опухолей у онкологических больных в 6 раз выше, чем в среднем по популяции. С учетом этого обстоятельства, все пациенты с такими заболеваниями после лечения должны находиться под диспансерным наблюдением и проходить регулярные обследования. Такая мера позволяет выявлять рецидивы первичной неоплазии и диагностировать метахронные первично множественные опухоли. Риск развития второго онкологического поражения увеличивается в возрасте 55-70 лет, что должно учитываться при планировании обследования пациентов.
Лечение первично множественных опухолей
Лечение синхронных неоплазий осуществляется одновременно. В зависимости от локализации новообразований и состояния больного хирургическое вмешательство может проводиться единовременно либо быть поэтапным. При планировании очередности операций при первично множественных опухолях учитывают степень распространенности каждого онкологического процесса. В ряде случаев по поводу одного новообразования может быть проведено радикальное лечение, по поводу другого – симптоматическое или паллиативное.
При выборе консервативных методик ориентируются на чувствительность каждой опухоли к радиотерапии и различным химиопрепаратам. Тактика лечения метахронных первично множественных опухолей соответствует тактике лечения солитарных новообразований аналогичных стадий и локализаций. Прогноз определяется видом, расположением, стадией и степенью злокачественности первично множественных опухолей. Отдаленные результаты лечения метахронных неоплазий примерно совпадают с результатами терапии одиночных образований. При синхронных процессах прогноз ухудшается.
Метастазы
Метастазами принято называть те злокачественные опухоли, которые возникают в различных органах и тканях организма под воздействием уже существующей первичной опухоли как до излечения, так и после излечения больного.
Возникновение метастазов онкологи связывают с распространением оторвавшихся от опухоли злокачественных клеток по лимфатическим и кровеносным сосудам.
Причины и механизм возникновения метастазов, в общих чертах, они представляют себе следующим образом.
При развитии опухоли от нее в большом количестве отторгаются погибшие и живые злокачественные клетки, которые с током лимфы попадают в первый расположенный вблизи регионарный лимфатический узел.
Далее злокачественные клетки, пройдя по лимфатическим ссудам и узлам, через грудной проток попадают в кровеносные сосуды и гоком крови переносятся в различные органы и ткани. Оседая в них, постоянно делящиеся злокачественные клетки могут стать зародышами новой опухоли.
Вот как об этом пишут Г.Н. Лобко и Г.М. Порубова: «Попадая в кровеносную или лимфатическую систему, опухолевые клетки подвергаются юздействию разнообразных факторов: механическому действию потока и иного численным воздействиям со стороны системы противоопухолевой шщиты организма (клеточные и гумморальные антитела, комплемент, естественные киллеры, свободные и фиксированные фагоциты и т. д.).
Прошедшие этот жесткий комплекс селектирующих воздействий и выжившие опухолевые клетки оседают в отдаленных органах, прикрепляются к эндотелиальным клеткам, проникают внутрь паренхимы органа и пролиферируя, дают начало вторичным новообразованиям.
Отсюда вытекает вывод, что попавшая в какой-то орган или ткань раковая клетка сама по себе не может дать метастаз. По-видимому, необходимы еще какие-то условия для возникновения метастаза и даже, может быть, достаточные и без внедрения в паренхиму органа злокачественное клетки. Это в большой мере подтверждает тот факт, что метастазы имеют латентный период, т. е., как писал академик И.В. Давыдовский: «. время наступления метастазирования чрезвычайно колеблется даже при раках одной и той же локализации.
Рецидивы
Как видим из определения академика И.В. Давыдовского, рецидивы как и первичные опухоли и метастазы, имеют такой же латентный период, изменяющийся в широких пределах в зависимости от каждого конкретного случая. И причину возникновения рецидивов, как и метастазов, онкологи связывают с наличием в органе или ткани злокачественных клеток.
Как видим, и рецидивы, и метастазы имеют определенную общность с первичной опухолью по различным параметрам и характеристикам возникновения и развития. Это и неопределенность в истинных причинах возникновения опухолей, метастазов и рецидивов; это и латентный период, изменяющийся в неопределенно широких пределах; это и трудности в диагностике начала развития; это и закономерности развития; это и изменения свойств и характеристик в процессе развития; это и печальные последствия для организма.
Анализ проблем
Достоверность их основана на результатах экспериментов и клинических наблюдений и уже никем не подвергаются сомнению:
3. Почему-то в развитых странах люди чаще заболевают раком, чем в слаборазвитых странах.
4. Раковая болезнь чаще всего проявляется уже в зрелом или в старческом возрасте. Однако в последние годы она все чаще и чаще поражает молодых, и даже детей.
5. Домашние животные чаще болеют раком, чем дикие. И у домашних питомцев легче вызвать опухоль искусственным путем.
6. Рак у здорового человека не возникает. Раковое заболевание возникает на старых рубцах, при других заболеваниях, в том числе и инфекционных. Но раковая болезнь не заразна.
7. С начала воздействия на организм раковызывающих факторов и до клинического проявления болезни имеется скрытый предраковый период, во время которого болезнь никак не проявляется (латентный период). Этот предраковый период может длиться месяцы, годы к даже десятилетия.
11. По мере развития опухоли могут происходить изменения содержания генома и числа хромосом клеток в широких пределах.
12. Раковые клетки слабо активизируют иммунную систему, в результате чего они способны преодолевать защитные барьеры и с током крови распространяться по всему организму.
14. В процессе развития резистентности наблюдаются существенные изменения генома и хромосомного набора в клетке.
16. Раковые опухоли часто вызывают вторичные опухоли (метастазы) в других органах и тканях через некоторый период.
17. Скрытый (латентный) период метастазирования колеблется в широких пределах даже при раках одной и той же локализации (месяцы — годы).
18. После оперативного вмешательства, биопсий, травм латентный период метастазирования резко укорачивается.
19. После излечения раковой болезни через некоторый латентный период часто возникают рецидивы, т. е. вторичные злокачественные опухоли на том же самом месте, где была первичная опухоль.
Таким образом, современная онкология с уверенностью заявляет: есть такие факты! И этого уже не мало для определенного представления о картине раковых заболеваний, позволяющего разрабатывать методы, препараты и технику для лечения раковых болезней.
А так как опухолевые клетки называют злокачественными для организма больного, то в основном все методики базируются на уничтожении злокачественной опухоли и ее клеток любым путем — удаление опухоли хирургическим путем, уничтожение облучением или химиопрепаратами. Таким образом первичная опухоль уничтожается и больной как будто излечивается.
Не нарушается ли главный принцип врачевателя — не навреди! Ведь еще в 1961 году академик И.В, Давыдовский писал: «Иногда латентный период развития метастазов после оперативного вмешательства резко укорачивается. Создается впечатление, что травма или сама вызывает обильное матастазирование, или ускоряет рост ранее возникших метастазов.
Объективно получается, что при лечении истинная причина рака не ликвидируется. Она остается в организме и через некоторый латентный период вновь вызывает раковое заболевание, а лечение даже как бы помогает этому, также как и воздействие различных канцерогенов — механические, химические, лучевые раздражения. И к моему изумлению, логика привела меня к парадоксальному выводу: само лечение злокачественной опухоли может стать канцерогеном, вызывающим раковые заболевания — метастазы, рецидивы. Они — не просто возврат первичной опухоли, они — новые раковые заболевания, хотя и повторные.
Таким образом, главной проблемой онкологии является обоснованное определение биологической причины раковой болезни. Это проблема проблем онкологии, ибо только знание истинной причины рака позволит решить и все остальные крупные проблемы: предраковый период, развитие опухоли, резистентность, реверсии, метастазы, рецидивы, методы лечения и профилактики.
В последние десятилетия усилия многих онкологов были направлены на установление детальных механизмов зарождения раковой опухоли, регуляции ее активного роста и процессов формирования благоприятного для нее микроокружения из клеток стромы, соединительнотканного каркаса органа. Со временем стало понятно, что основная угроза рака заключена в его способности к распространению по организму.
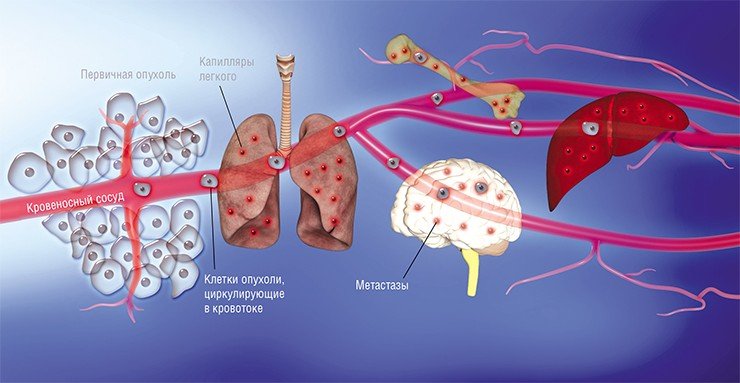
Наконец в 1970-е гг. благодаря экспериментам на лабораторных мышах, которым делались инъекции раковых клеток, меченных радиоактивными изотопами, американский исследователь И. Фидлер смог доказать, что на результат метастазирования влияет природа раковых клеток: клетки меланомы метастазировали в легкие, но не в печень, в сосудах которой они не выживали. Позднее были установлены и другие факты, подтверждающие, что раковые клетки разной природы метастазируют преимущественно в определенные органы, иногда даже и в определенной последовательности. Например, клетки рака молочной железы формируют метастазы сначала в костях, печени, лимфатических узлах и легких, и лишь потом уже – в мозге. Явление специфичного распределения метастазов по организму назвали органотропией метастазирования.
И сегодня в онкологии все еще остается много вопросов без ответов. Например, отличаются ли метастазные раковые клетки от других клеток первичной опухоли? Что лежит в основе органотропии? И главное: как метастазам удается выжить после удаления первичной опухоли и проведения химиотерапии?
Метастазы: от генетики до эпигенетики
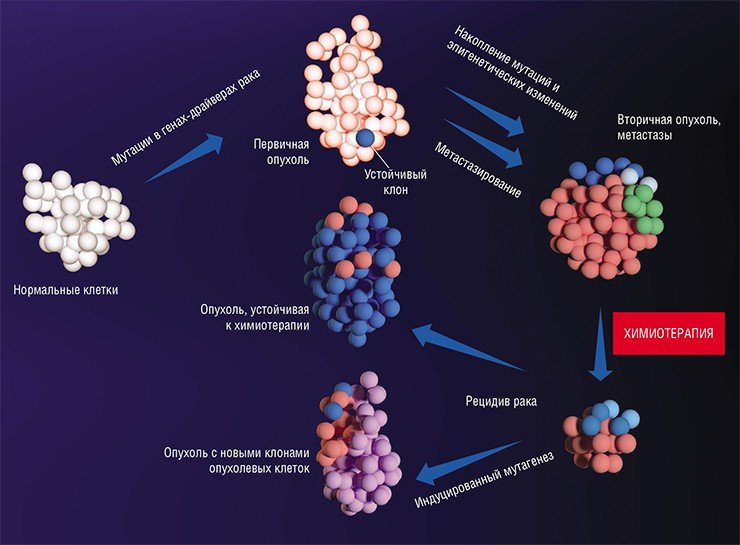
Интересно, что был обнаружен как минимум один ген – FBXW7, мутации в котором противодействуют метастазированию (Mlecnik et al., 2016). Происходит это за счет усиления провоспалительной реакции, увеличения численности и роста активности T-лимфоцитов, что стимулирует формирование иммунных реакций по отношению к опухолевым клеткам. Таким образом, появление мутаций в гене FBXW7 раковых клеток предотвращает развитие характерной для опухолей иммуносупрессии.
После формирования преметастазных ниш с благоприятным клеточным окружением некоторые раковые клетки покидают первичную опухоль и формируют микрометастазы в других тканях и органах. Финальный этап формирования вторичного очага может занимать от нескольких месяцев до нескольких лет
До сих пор мы говорили о непосредственных изменениях в самой структуре ДНК. Следующая ступень в регуляции экспрессии генов – эпигенетические изменения, связанные с метилированием ДНК и гистонов (ДНК-связывающих белков). По своей природе такие изменения более пластичны по сравнению с генетическими: они подвержены влиянию клеточных каскадов передачи сигнала, подстраивающихся под действие внешних факторов.
На развилке метаболических путей
Эпигенетическая регуляция – один из важнейших механизмов программирования клеточного метаболизма. С ростом опухоли внутри нее образуются области, куда не доходят кровеносные сосуды и где возникает кислородная недостаточность (гипоксия). В результате деметилирования ДНК в раковых клетках начинает активно работать ген, кодирующий белок HIF‑1-альфа, который так и называется – фактор, индуцируемый гипоксией. Усиленное образование этого белка, в свою очередь, влияет на уровень экспрессии генов множества метаболических ферментов и белков-транспортеров, что приводит к комплексным изменениям метаболизма раковых клеток.
Как известно, клеточный метаболизм включает процессы расщепления соединений с выделением энергии (катаболизм) и их образования с использованием энергии (анаболизм). Энергетический обмен клетки обеспечивается благодаря клеточному дыханию, в котором выделяют гликолиз (ферментативный распад глюкозы), цикл трикарбоновых кислот (окислительные превращения промежуточных продуктов распада и синтеза белков, жиров и углеводов) и окислительное фосфорилирование (запасание энергии в результате окисления молекул органических веществ).
Раковые клетки по-своему приспосабливают энергетический обмен к условиям недостатка кислорода. В первичной опухоли они в основном используют анаэробный гликолиз, а не окислительное фосфорилирование, как в нормальных клетках. Это усиленное поглощение и расщепление глюкозы до молочной кислоты, которая выделяется раковыми клетками, названо эффектом Варбурга. Такая адаптация позволяет раковым клеткам успешно выживать и активно размножаться при недостатке кислорода.
Но все это относится к первичной опухоли, для клеток же метастазов особенности генерирования энергии до сих пор мало изучены. Тем не менее, используя клетки рака молочной железы, обладающие широкой органотропией при метастазировании, ученые обнаружили различия в метаболизме первичной опухоли и метастазов. Раковые клетки, колонизировавшие кости и легкие, более активно использовали окислительное фосфорилирование, а колонизировавшие печень – гликолиз. Когда раковые клетки колонизировали все возможные органы-мишени, в них активировались оба метаболических пути (Rosen, Jordan, 2009). Похоже, что такая метаболическая пластичность помогает раковым клеткам осваивать новые ниши.
Почему же метастазам в одном случае выгоднее использовать преимущественно один вид метаболизма, а в другом – другой? Ответ на этот вопрос, как и на вопрос о роли различных факторов в регуляции метаболической пластичности раковых клеток, еще только предстоит узнать.
Несмотря на всю свою адаптационную пластичность, метастазные раковые клетки не могут в одиночку справиться со столь непростой задачей – освоением совершенно незнакомого места обитания.
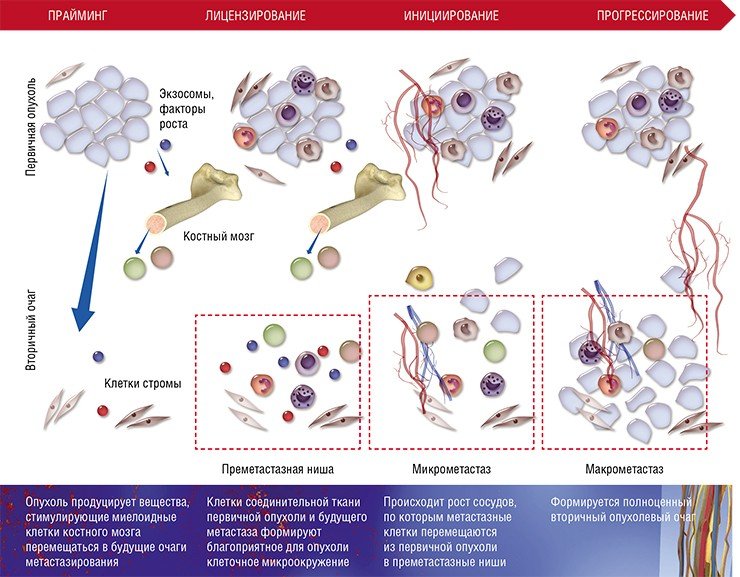
Хотя описанная выше схема характерна для большинства органов, у нее имеются особенности в зависимости от места (органа), где формируются метастазы. Например, в печени и легких в процессе создания преметастазной ниши активно участвуют еще одни клетки крови – нейтрофильные гранулоциты. Известно, что лейкоциты этого вида помогают раковым клеткам интегрироваться в новую нишу, секретируя протеазы и цитокины и непосредственно контактируя с раковыми клетками при выходе из капилляров.
Основная же функция лизилоксидазы заключается в формировании поперечных связей между коллагеновыми волокнами соединительной ткани. При развитии гипоксии раковые клетки молочной железы увеличивают синтез этого фермента, что способствует ремоделированию внеклеточного матрикса при подготовке уже другой преметастазной ниши – в легких.
При некоторых типах рака (например, меланоме) для успешного метастазирования в лимфатические узлы и органы необходимо, чтобы в их преметастазной нише сформировались новые лимфатические сосуды. Недавно было установлено, что такой лимфангиогенез начинается на ранних стадиях роста первичной опухоли, а медиатором его запуска является белковый фактор роста мидкин, секретируемый клетками меланомы (Olmeda et al., 2017).
Ученые провели интересный эксперимент: выделив экзосомы от раковых клеток разного происхождения (рака груди, поджелудочной железы и др.), они ввели их в кровоток лабораторных мышей, которым были привиты опухоли другого типа (Hoshino et al., 2015). Оказалось, что с помощью экзосом можно перепрограммировать распределение метастазов по органам.
Подведем итог. Все описанные механизмы метастазирования, безусловно, усложняют картину течения онкозаболеваний и тактики их лечения. Особого внимания требует гетерогенность первичной опухоли и метастазов по ряду самых разных признаков, из чего следует необходимость использовать комбинированное и таргетное (направленное) лечение на разных стадиях течения болезни. Подтверждение этому – результаты одного из последних исследований, базирующихся на лечении онкологического пациента с рецидивами между курсами длительной иммунотерапии (Jiménez-Sánchez et al., 2017). Сравнение популяций T-лимфоцитов из микроокружения разных метастазов показало, что они гетерогенны. Следовательно, первичная, вторичные и последующие опухоли по-разному отвечают на лечение.
Alderton G. K. Tumour evolution: epigenetic and genetic heterogeneity in metastasis // Nat Rev Cancer. 2017. V. 17. N. 2. P. 141.
Cox T. R., Rumney R. M. H., Schoof E. M., et al. The hypoxic cancer secretome induces premetastatic bone lesions through lysyl oxidase // Nature. 2015. V. 522. N. 7554. P. 106—110.
Jiménez-Sánchez A., Memon D., Pourpe S., et al. Heterogeneous Tumor-Immune Microenvironments among Differentially Growing Metastases in an Ovarian Cancer Patient // Cell. 2017. V. 170. N. 5. P. 927—938.e20.
Hoshino A., Costa-Silva B., Shen T.-L., et al. Tumour exosome integrins determine organotropic metastasis // Nature. 2015. V. 527 N. 7578. P. 329—335.
Mlecnik B., Bindea G., Kirilovsky A., et al. The tumor microenvironment and Immunoscore are critical determinants of dissemination to distant metastasis // Sci Transl Med. 2016. V. 8. N. 327. P. 327ra26-327ra26.
Olmeda D., Cerezo-Wallis D., Riveiro-Falkenbach E., et al. Whole-body imaging of lymphovascular niches identifies pre-metastatic roles of midkine // Nature. 2017. V. 546 N. 7660. P. 676—680.
Rosen J. M., Jordan C. T. The increasing complexity of the cancer stem cell paradigm // Science. 2009. V. 324. N. 5935. P. 1670–1673.
Yates L. R., Knappskog S., Wedge D., et al. Genomic Evolution of Breast Cancer Metastasis and Relapse // Cancer Cell. 2017. V. 32. N. 2. P. 169—184.e7
Читайте также:

