Pd 1 лекарство от рака записаться на клинические испытания
Профессор Скворцова В.И. сообщила, что в России появилось лекарство от рака, которое меняет принципы лечения онкологии. Задача ученых - перепрограммировать иммунитет больного так, чтобы он вновь мог уничтожать раковые клетки, стала реальностью.
Для участия в онкоисследовании периодически проводится набор пациентов, у которых нет положительного результата от традиционных методов лечения. Данное лекарство от рака, это прорыв, революционное открытие в системе онкотерапии.
Новое российское лекарство от рака PD 1
Профессор В. И. Скворцова представила новое лекарство от рака анти PD 1 для лечения онкологических заболеваний. Эффективность PD 1 доказали результаты доклинических исследований. Проведённые испытания позволяют дать надежду на излечение вдвое большему количеству онкобольных, чем при химиотерапии. Препарат клеточной терапии способен полностью излечить онкозаболевания, ранее не поддававшиеся лечению.
Принцип действия
Клеточная терапия — это создание лекарственных вакцин на основе биологических тканей (крови или опухолевых клеток), которые забираются у больного, генетически модифицируются и инъекционно вводятся обратно. Результатом является улучшение состояние пациента, полное или частичное уничтожение первичной опухоли и метастазов.
Препарат обладает уникальностью по продолжительности действия, эффект не прекращается и после курса приема. Положительная динамика наблюдается даже у пациентов с 4 стадией рака, при заболеваниях глиобластоме мозга, негативный рак
Пример излечения от рака 4-ой стадии
По мнению доктора медицинских наук, профессора Скворцовой В.И. применение вакцины способно предотвратить развитие опухоли в 40% случаев. Фактически PD 1 - это шанс для онкобольных, которым не помогает химиотерапия.
Прогнозируют, что в следующем году новый препарат появится в производстве. Решение по организации лечения принимается после рассмотрения медицинских документов пациента, которые необходимо выслать на электронную почту.
Дендритные биовакцины
Методика позволяет снизить количество раковых клеток примерно в два раза и перевести онкологическое заболевание в хроническую форму на любой стадии рака, медиана продолжительности жизни может значительно увеличиться. Периодическое применение дендритной противоопухолевой вакцины позволяет вести полноценный образ жизни даже при 4-ой стадии рака.
Приглашаем пациентов принять участие в новых методах лечения онкологических заболеваний.
Новые технологии приходят в Россию.
Приглашаем пациентов принять участие в новых методах лечения онкологических заболеваний, а также в клинических испытаниях препаратов на основе Т-клеток (LAK-терапия). Терапия проводится в различных научно-исследовательских онкологических центрах, в зависимости от вида опухоли.
Отзыв о методе профессора Скворцовой В.И.
Комментарий о клеточных технологиях главного онколога России, академика Давыдова М.И.
Для подбора эффективного метода лечения вы можете обратиться за
- методы инновационной терапии;
- возможности участия в экспериментальной терапии;
- как получить квоту на бесплатное лечение в онкоцентр;
- организационные вопросы.
После консультации пациенту назначается день и время прибытия на лечение, отделение терапии, по возможности назначается лечащий доктор.

Причиной смерти пациента-испытателя назвали неожиданную реакцию организма на экспериментальный препарат производства "Биокад". Ранее фармзавод удостоился похвалы Минздрава за "фантастические результаты" в лечении опухолей. Лекарство должно было появиться на рынке ещё год назад. Не остановит ли смерть добровольца исследования и когда ждать отечественное лекарство от рака — в расследовании Лайфа.
Одна из самых секретных разработок российской медицины попала в неприятную историю, которая могла бы так и остаться в стенах петербургской лаборатории. Рассказываем, как российские учёные изобретали молекулу для лечения меланомы и рака лёгких и с какими трудностями столкнулись.
1. Экспериментальный препарат стал главной темой онкологического конгресса
В ноябре 2018 года состоялся XXII Российский онкологический конгресс. Представители фармзавода "Биокад" и врачи рассказали об успешных испытаниях на людях новейшего отечественного лекарства от рака. Он заставляет иммунные клетки атаковать опухоль.
Речь о препарате под кодовым названием BCD-100. Это одна из самых засекреченных разработок отечественной фармацевтики — не разглашают даже имена учёных, разработавших молекулу (основное действующее вещество).
Препарат показал ошеломляющие результаты в лечении неоперабельной меланомы. Когда опухоль даёт метастазы, зловредные клетки проникают в окружающие органы и там формируют вторичные очаги болезни. Справиться с метастазирующей меланомой гораздо труднее. Однако BCD-100 сумел полностью убрать подобные опухоли у 7% пациентов. Ещё у 29% пациентов размер опухоли уменьшился не меньше чем на треть. В исследовании участвовало 126 онкобольных с неоперабельной меланомой. Испытания финансировал сам "Биокад".
Меланома (рак кожи)
Не самый частый, но один из самых агрессивных видов рака (≈74 тысяч больных в РФ). С 1950-х мировая заболеваемость выросла на 600%
Однако пациентов ждут серьёзные побочные эффекты, которые стали сюрпризом и для врачей — препарат-то новый.
"Внедрение [иммунотерапии], по-русски сказать, взорвало химиотерапевтам мозг. Мы столкнулись со спектром сложных и не понятных для нас [побочных] реакций. Может поражаться любой орган: начиная от щитовидной железы и заканчивая воспалением сосудов".
онколог центра им. Блохина Михаил Федянин
Но в декабре 2018 года НИИ онкологии им. Н.Н.Петрова (Санкт-Петербург) презентовал новые данные о результатах того же исследования.
У пациентов, принимавших BCD-100, чаще воспалялась щитовидная железа, чем у пациентов, принимающих аналогичные зарубежные препараты. Об этом заявил на конференции Федянин, то же впоследствии подтвердил и химиотерапевт из НИИ онкологии им. Н.Н. Петрова Алексей Новик. Его выступление находится в открытом доступе. Однако другие показатели побочных явлений не сильно отличались от уже выпущенных на рынок аналогов, так что Новик осторожно назвал BCD-100 "не менее безопасным", чем ему подобные.
2. Летальный исход, о котором умолчали
В ноябрьском выступлении доктор Федянин коротко обмолвился: были описаны смертельные случаи после приёма подобных препаратов. Одна из причин летальности — воспаление сердечной мышцы (миокардит).
Ни Федянин, ни Новик подолгу не останавливались на опасностях подобного рода препаратов. Врачи не упомянули и о смертельном случае с одним из пациентов-добровольцев. А самое главное, этого не сделала медицинский директор фармзавода "Биокад" Юлия Линькова.
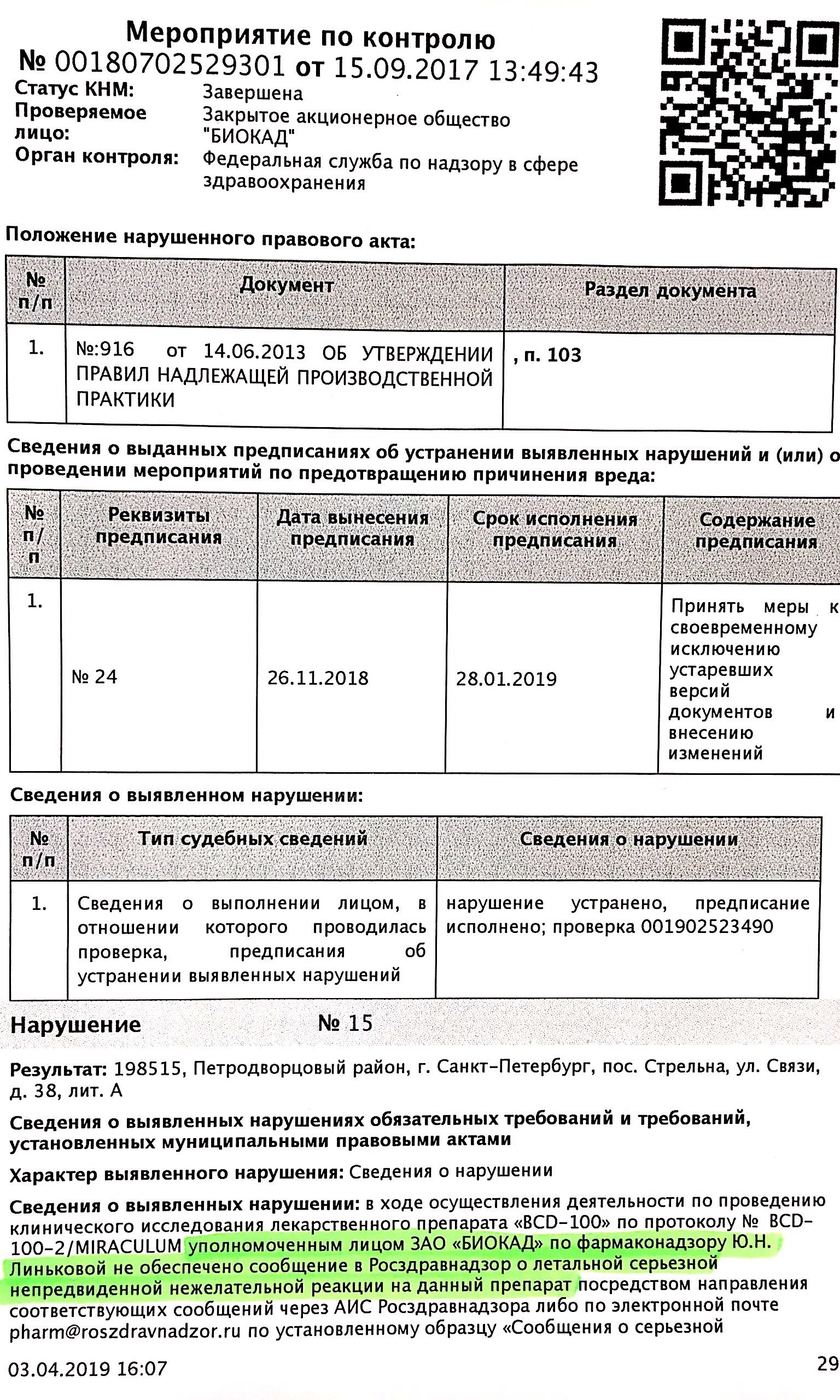
Представители завода "Биокад" вовремя не проинформировали государственные службы о смерти пациента из-за приёма BCD-100. Об этом говорится в материалах проверки Росздравнадзора, которые попали в Лайф из прокуратуры.
"В ходе клинического исследования препарата BCD-100 по протоколу Miraculum уполномоченное лицо ЗАО "Биокад" Юлия Линькова [не сообщила] в Росздравнадзор о летальной непредвиденной нежелательной реакции на данный препарат".
Материалы проверки Росздравнадзора от 26.11.18
Линькова обязана была уведомить о произошедшем либо через защищённую информационную систему Росздравнадзора, либо просто по электронной почте.
В том же предписании Росздравнадзор отмечает, что ни в 2017-м, ни в 2018-м в адрес ведомства вообще не поступало данных о безопасности трёх других препаратов, которые разрабатывает "Биокад".
Недавние исследования показали — больше половины российских медиков не сообщают в Росздравнадзор о побочных эффектах на препараты, с которыми столкнулись их пациенты. Ещё 8% вообще считают, что рассказывать о нежелательных реакциях нецелесообразно.
3. В надежде на "чудо"
Ещё в 2016 году министр здравоохранения Вероника Скворцова назвала результаты использования BCD-100 фантастическими. Протоколу, по которому исследовали лекарство, даже придумали соответствующее метафорическое название. С латыни "miraculum" переводится как " чудо". И действительно, с некоторыми пациентами BCD-100 сотворил чудо.
У 64-летней пациентки из Питера был опухолевый очаг в лёгком
Через несколько месяцев после приёма BCD-100 опухоль заметно уменьшилась в объемах. Это видно на снимках НМИЦ им. Н.Н.Петрова.
Но для других пациентов чудо обернулось проблемами или трагедией. Побочные эффекты от BCD-100 испытывали 80% пациентов, заявил на ноябрьской конференции доктор Федянин.
Чтобы разобраться, как работает BCD-100, важно понимать принцип работы иммунной системы человека.
Очень упрощённо иммунитет можно описать как систему "свой-чужой". Некоторые клетки крови умеют распознавать чужеродные бактерии и опасные тела и уничтожать их. Такой тип иммунных клеток называют Т-лимфоцитами. Получается эдакий "иммунный спецназ", который способен проникать через стенки сосудов в окружающие ткани и проводить там боевые действия против чужаков.
На поверхности Т-лимфоцита живёт белок PD-1, который отвечает за восприятие чужеродных клеток. Раковые же клетки "прячутся" от лимфоцитов, обманывая белок PD-1. Лимфоциты начинают думать, что раковая клетка — "своя", и не трогают смертельную опухоль.
Учёные по всему миру ломают головы над тем, как взломать маскировку и обучить лимфоциты распознавать в раковой клетке врага. Как уверяют создатели Miraculum, именно это им и удалось.

Создатели препарата рассчитывают, что его можно будет использовать не только для лечения меланомы и рака лёгких, но и других видов онкологии.
Поначалу на заводе "Биокад" рассчитывали выпустить лекарство на рынок в 2018 году. Сейчас сроки отодвинулись до 2022 года. Причин может быть множество: от недостаточного финансирования до неожиданно вскрывшихся проблем при использовании препарата.
В одном из интервью представители завода сравнивали цены на зарубежные аналогичные препараты. Выходило, что лечиться израильскими либо японскими средствами стоит примерно 9 миллионов рублей за курс. Отечественные разработчики обещали существенно меньшую цену за курс BCD-100. Возможно, в разы.
Хронология разработки препарата
4. Человечество писало кровью правила исследований препаратов
Лайф попросил эксперта, который много лет занимается клиническими исследованиями, рассказать о морально-этической стороне испытаний препаратов на людях. Вот что рассказала исполнительный директор Ассоциации организаций по клиническим исследованиям Светлана Завидова.
"Человечество двигалось к системе регулирования через лекарственные трагедии. Где-то, конечно, своим умом доходили, но в основном двигателем послужил негативный опыт, который и приводил к разработке тех или иных правил. Правила писали "на крови".
Светлана Завидова, Ассоциация по клиническим исследованиям
Один из первых мировых законодательных актов на тему регулирования исследований препаратов появился в США в 1938 году. Взяться за его разработку пришлось после того, как из-за неподтверждённого по критериям безопасности препарата сульфаниламида погибло 107 человек, большинство из которых — дети. Именно после этой трагедии фармпроизводителей обязали подтверждать безопасность лекарств. В том числе и на пациентах.
Исследования на людях идут в три фазы и длятся годами. В первую, как правило, включают только здоровых добровольцев. Вторая фаза — это испытания на пациентах, страдающих от конкретного заболевания. Обычно в них участвует несколько сотен человек. Третья фаза — самая масштабная: здесь в выборку могут включить несколько тысяч больных. Именно на третьей фазе появляется большинство данных о побочных реакциях и их частоте. Все добровольцы подписывают информированное согласие, соглашаясь на все риски (вплоть до летального исхода). Для многих пациентов участие в испытаниях — последний шанс.
Только при успешном завершении третьей стадии препарат регистрируют в госорганах и завозят в аптеки.
Второй случай изучают в медвузах как пример халатного отношения к безопасности препарата в угоду его продаваемости. Препарат талидомид в середине ХХ века был одним из самых продаваемых успокоительных и снотворных. Особенно его рекомендовали беременным и кормящим матерям, чтобы справляться с ночной бессонницей, утренней тошнотой и беспокойством. При этом никакие тесты влияния таблеток на плод не проводились. Препарат активно продавался в Европе. Через несколько лет стали чаще рождаться дети с патологиями: у новорожденных не было рук, ног либо ушей.
Ещё год потребовался властям нескольких стран, чтобы увязать страшную статистику с популярностью талидомида. Всё это время компания-производитель не признавала связи между этими событиями и продолжала рекламировать лекарство как безопасное.
5. Биокад: мы ничего не пытались скрыть!
Действия петербургской фармацевтической компании, которая не сообщила в Росздравнадзор о смерти пациента, на первый взгляд выглядят попыткой скрыть негатив во избежание репутационных и иных потерь. Однако в "Биокаде" заявляют, что специально ничего не утаивали.
"Первично полученные данные не соответствовали определению "Серьёзная непредвиденная нежелательная реакция". После получения дополнительных сведений информация была передана в Росздравнадзор".
Юридический департамент ЗАО "Биокад"
— Предположение о том, что ЗАО "Биокад" пыталось скрыть летальный случай, не соответствует действительности, поскольку данная информация сообщалась в ряд компетентных органов и учреждений, — добавили представители фармзавода. — Компания провела внутреннюю проверку, по результатам которой были детализированы внутренние процедуры.
Один из корпусов завода "Биокад" в Петербурге.
Компания "Биокад" создана в 2001 году. Это одна из крупнейших биотехнологических компаний России, где разрабатывают, изучают и производят новые типы лекарств. В штате трудятся более 1800 человек. Компания фокусируется на препаратах для терапии онкологических и аутоиммунных заболеваний, также ведёт разработки в области терапии других социально значимых заболеваний.
19 апреля 2019 года Национальный медицинский исследовательский центр радиологии Минздрава сообщил об увеличении числа онкобольных в стране. На первом месте в России рак лёгких. Каждый год онкологией заболевают около 600 тысяч человек. Всего в России на онкологическом учёте стоят 3,6 миллиона человек.

вместе создадим единую базу клинических исследований в онкологии
- Руководства ESMO
- Помощь пациентам в период пандемии COVID-19
- Руководства RUSSCO
- Школа жизни онкологического пациента во время коронавируса (интервью члена Правления RUSSCO, проф. Н.В. Жукова)
Клинические исследования, которые проходят в данный момент
Многоцентровое, рандомизированное, открытое клиническое исследование фазы 3 в трех группах применения препаратов энкорафениб, цетуксимаб совместно с биниметинибом или без него, по сравнению с применением препаратов иринотекан/цетуксимаб или инфузионной терапии с применением 5-фторурацила (5-ФУ)/ фолиновой кислоты (ФК)/ иринотекана (FOLFIRI)/ цетуксимаба с определением безопасной дозы введения комбинации препаратов энкорафениб, бениметиниб, цетуксимаб для лечения пациентов с метастатическим коларектальным раком с мутацией BRAF V600E
Рандомизированное двойное слепое плацебо-контролируемое исследование для сравнения двух гуманизированных моноклональных антител направленного специфического действия против фактора роста эндотелия сосудов, применяемых в сочетании с химиотерапией по модифицированной схеме FOLFOX6 у пациентов с нерезектабельной метастатической колоректальной опухолью
TASCO1
Открытое рандомизированное исследование II фазы по оценке эффективности комбинации препарата TAS-102 с бевацизумабом и комбинации капецитабина с бевацизумабом у пациентов с метастатическим колоректальным раком, ранее не получавших лечение по поводу распространенного опухолевого процесса и которым не показано проведение интенсивной химиотерапии
Двойное слепое рандомизированное плацебо-контролируемое исследование III фазы препарата нинтеданиб в комбинации с оптимальной поддерживающий терапией (ОПТ), по сравнению с плацебо в комбинации с ОПТ, у пациентов с колоректальным раком, устойчивым к стандартному лечению
Рандомизированное двойное слепое плацебо-контролируемое многоцентровое международное исследование III фазы дурвалумаба или комбинации дурвалумаба с тремелимумабом в качестве консолидирующей терапии у пациентов с локализованным мелкоклеточным раком легкого I-III стадии, у которых не произошло прогрессирование после одновременной химиолучевой терапии (ADRIATIC)
Рандомизированное двойное слепое плацебо-контролируемое многоцентровое международное исследование III фазы дурвалумаба или комбинации дурвалумаба с тремелимумабом в качестве консолидирующей терапии у пациентов с локализованным мелкоклеточным раком легкого I-III стадии, у которых не произошло прогрессирование после одновременной химиолучевой терапии (ADRIATIC)
База, на которой проводится исследование:
Международное, рандомизированное, открытое исследование 3 фазы препарата REGN2810 (анти-PD 1 антитело) по сравнению с химиотерапией препаратами платины в качестве первой линии терапии у пациентов с распространенным или метастатическим PD-L1-положительным немелкоклеточным раком легких
Рандомизированное, открытое исследование 3 фазы комбинации препарата REGN2810 (анти-PD 1 антитело), ипилимумаба и двухкомпонентной схемы химиотерапии производными платины в терапии первой линии пациентам с распространенным или метастатическим немелкоклеточным раком легкого и уровнем экспрессии в опухоли PD-L1 менее или равно 50%
Открытое многоцентровое исследование III фазы, проводимое для сравнения действия препарата авелумаб с действием двухкомпонентной химиотерапией препаратами платины при их применением в качестве первой линией терапии рецидивирующего или PD-L1-положительного немелкоклеточного рака легкого IV стадии
Протокол № EMR 100070-005
Многоцентровое исследование 2 фазы с целью изучения пероральной терапии ингибитором cMET, препаратом INC280 у взрослых пациентов с распространенным немелкоклеточным раком легкого при немутантном статусе EGFR (WT)
2) Аболмасов Александр Евгеньевич
+7 (925) 928-51-59
Открытое многоцентровое рандомизированное исследование 3 фазы по изучению эффективности и безопасности препарата BGB-A317 (анти-PD1 антитела) по сравнению с доцетакселом у пациентов с немелкоклеточным раком легкого и прогрессированием заболевания после курса платиносодержащей химиотерапии
Рандомизированное открытое исследование фазы 3 применения Бригатиниба (Алунбриг™) в сравнении с Алектинибом (Алеценса ® ) у пациентов с распространенным ALK-позитивным немелкоклеточным раком легких, у которых возникла прогрессия заболевания на фоне применения Кризотиниба (Ксалкори ® )
Многоцентровое рандомизированное, двойное слепое, плацебо-контролируемое исследование III фазы, проводимое с целью оценки эффективности и безопасности анаморелина гидрохлорида, применяемого для восполнения дефицита массы тела и лечения анорексии, развившихся на фоне распространенного немелкоклеточного рака легкого у взрослых пациентов
Двойное слепое, рандомизированное, проводимое в параллельных группах исследование 3-й фазы с использованием активного препарата в качестве контроля с целью сравнения эффективности и безопасности препарата CT-P16 и разрешенного в ЕС препарата Авастин, применяемых в качестве первой линии терапии метастатического или рецидивирующего неплоскоклеточного немелкоклеточного рака легкого
Протокол № CT-P16 3.1
Рандомизированное, двойное слепое, многоцентровое исследование III фазы для оценки эффективности, безопасности, фармакокинетики и иммуногенности исследуемого препарата SB8 (предлагаемого биоаналога бевацизумаба) в сравнении с препаратом Авастин ® у пациентов с метастатическим или рецидивирующим неплоскоклеточным немелкоклеточным раком легкого
2) Козлов Вадим Викторович
+7 (913) 463-828-6
2) Бабина Ксения Геннадьевна
+7 (968) 267-77-76
Открытое исследование препарата афатиниб у пациентов с местнораспространенным или метастатическим немелкоклеточным раком легкого с мутацией рецептора эпидермального фактора роста, ранее не получавших лечение или предварительно получавших химиотерапию
Рандомизированное, двойное-слепое, плацебо-контролируемое исследование III фазы по изучению ARQ 197 плюс эрлотиниб vs эрлотиниб у ранее леченых пациентов с местно-распространенным или метастатическим неплоскоклеточным немелкоклеточным раком легкого
Программа расширенного доступа к ИПИЛИМУМАБУ для больных глиобластомой и глиомой
Mногоцентровое, рандомизированное, открытое исследование III фазы Атезолизумаба (антитело к PD-L1) в комбинации с адъювантной химиотерапией на основе антрациклина/таксана в сравнении только с химиотерапией у пациентов с операбельным трижды негативным раком молочной железы
Двойное слепое рандомизированное исследование III фазы, проводимое в параллельных группах, по сравнению эффективности, безопасности и иммуногенности TX05 и препарата Герцептин ® у пациентов с ранней стадией HER2-положительного рака молочной железы
Двойное слепое продолженное исследование для проведения адъювантной монотерапии препаратом Герцептин ® или препаратом TX05 для продолжения оценки безопасности и иммуногенности у пациентов с ранней стадией HER2-положительного рака молочной железы после проведения неоадъювантной терапии и хирургической резекции в рамках протокола TX05-03
Рандомизированное открытое исследование 3 фазы по оценке препарата абемациклиб в комбинации со стандартной адъювантной эндокринной терапией по сравнению с применением только стандартной адъювантной эндокринной терапии у больных раком молочной железы на ранней стадии, с высоким риском развития рецидива, поражением регионарных лимфатических узлов, с положительным статусом гормональных рецепторов и отрицательным статусом рецептора эпидермального фактора роста человека 2-го типа
Рандомизированное, многоцентровое, открытое, III фазы исследование лапатиниба плюс капецитабин или трастузумаб плюс капецитабин упациенток с Her2/neu позитивным метастатическим раком молочной железы ранее получавших антрациклины и таксаны
Международное проспективное открытое многоцентровое неинтервенционное исследование OPTIMIS.
Изучение результатов лечения больных гепатоцеллюлярным раком, получавших или не получавших сорафениб после трансартериальной химиоэмболизации (ТАХЭ), и влияние времени начала терапии сорафенибом
Многоцентровое открытое исследование 1b фазы с эскалацией дозы по изучению безопасности и переносимости препарата квинакрин у пациентов с опухолевыми заболеваниями печени различного происхождения
Многоцентровое рандомизированное открытое исследование (3 фаза) эффективности и безопасности Ленватиниба (E7080) в сравнении с Сорафенибом в первой линии лечения больных неоперабельным печеночно-клеточным раком
Рандомизированное многоцентровое двойное слепое исследование III фазы препарата регорафениб у больных ГЦР, ранее получавших сорафениб
Рандомизированное, двойное-слепое исследование II фазы по сравнительной оценке режимов рамуцирумаба в комбинации с цисплатином и гемцитабином; мерестиниба в комбинации с цисплатином и гемцитабином или плацебо в комбинации с цисплатином и гемцитабином в качестве первой линии терапии у пациентов с распространенным или метастатическим раком желчевыводящих путей
JAVELIN BLADDER 100
Многоцентровое, международное, открытое, рандомизированное, проводимое в параллельных группах исследование 3-й фазы, в котором Авелумаб (MSB0010718C) в комбинации с наилучшей симптоматической терапией сравнивается с наилучшей симптоматической терапией в качестве поддерживающего лечения у пациентов с местно-распространённым или метастатическим уротелиальным раком, который не прогрессировал после завершения первой линии химиотерапии на основе препаратов платины
2) Аболмасов Александр Евгеньевич
+7 (925) 928-51-59
Многоцентровое, рандомизированное, двойное слепое исследование III фазы для оценки эффективности и безопасности препарата BIBIF 1120 в комбинации с карбоплатином и паклитакселом в сравнении сплацебо в комбинации с карбопалином и паклитакселом у пациентов с распространенным раком яичников
Многоцентровое, двойное слепое, плацебо-контролируемое, рандомизированное исследование II фазы по изучению омрабулина у больных с чувствительным к препаратом платины рецидивирующим раком яичников, получающих карбоплатин/паклитаксел
MK1775 в сочетании с карбоплатином и паклитакселом при платиночувствительном раке яичников
Эффективность и безопасность Пембролизумаба у пациентов с прогрессией распространенного рака яичников (KEYNOTE 100)
Рандомизированное двойное слепое плацебо-контролируемое исследование III фазы эффективности и безопасности копанлесиба в комбинации с ритуксимабом у пациентов с рецедивами индолетных В-клеточных лимфом (иНХЛ) – CHRONOS-3
Исследование II/III фазы по оценке продолжительности тяжелой нейтропении при лечении плинабулином в сравнении с пэгфилграстимом у пациентов с солидными опухолями, получающих миелосупрессивную химиотерапию доцетакселом
Мультинозологичное исследование: анализ предиктивных биомаркеров для применения пембролизумаба при распространенных солидных опухолях (KEYNOTE 158)
* Критерии включения и исключения представлены не в полном объёме
Как найти клинические испытания препаратов?
Попадание в группу клинических испытаний препарата, может стать одним из выходов из ситуации, когда нужное Вам лекарство не получается получить по ряду причин – дороговизна, отсутствие в наличии в аптеках или вообще в стране.
Не факт, что Вы туда попадете – Ваш диагноз, состояние здоровья, курс лечения, который Вы получили до использования нового препарата, а также целый ряд дополнитеьных критериев отбора усложняют задачу, но попробовать стоит.
Поиск можно проводить по любой стране, где проводились клинические испытания, и препаратам от всех форм рака.Мы рассмотрим для примера поиск для клинических исследований препаратов от меланомы.
Принимая участие в КИ, необходимо оплатить только обследования.

Далее на открывшейся странице в графе SearchTerms пишем melanoma, в графе Recruitment выбираем Recruiting. Чтобы привязать поиск к нужной стране, в блоке Locations выбираем от одной до трех стран. В данном случае мы указали Russian Federation и Israel.

Прокручиваем страницы вниз и нажимаем Search.
Видим список всех КИ.Здесь необходимо обратить внимание на мутацию гена. Изучаем список и открываем в новом окне подходящие исследования.

Кликнув по одному из исследований, откроется страница с подробной информацией о нем. Переведите ее.

Как быстро найти больницу, в которой проходит КИ? Прокрутите страницу вниз и найдите блок Contacts and StudyLocation.

В этом блоке стоит плюс и надпись Show … Study Locations. В данном случае их 50. Кликаете на надпись.

В списке стран ищем нужную, она выделена жирным шрифтом и цветом.

Также указаны город, где находится больница, индекс больницы и контактные данные.

Прокручиваем страницу вправо, здесь написано, принимают ли пациентов в КИ: Not yet recruiting / Recruiting. В данном случае принимают.


Найдите индекс и получите адрес необходимой клиники.
Что касается наиболее крупных израильских больниц, то это Шиба, Асута, Ихилов. Их легко найти в интернет поиске.
Программа MERC для больных меланомой на поздних стадиях
Это шанс для пациентов, которым нужно срочное лечение, а другие средства не помогают. На сайте есть контактные данные для получения детальной информации: тел. +44 (0)1932 824 123 или e-mail mk3475row@idispharma.com
Рекомендации для участниковклинических испытаний по меланоме:
- Вряд ли в больнице вам предложат принять участие в клиническом исследовании. Всю информацию о нем придется искать самостоятельно, а затем обратиться в больницу и показать, что вы знаете, что у них проводят клиническое исследование и хотите в нем участвовать.
- Настраивайтесь на положительный результат, верьте в способность вашего организма побороть заболевание. Воспринимайте таблетки, как помощник в этой борьбе, но не как исцеляющее средство.
- Ранее проходившие клиническое исследование не рекомендуют давить врачам на жалость. Старайтесь показать, что вы справляетесь, готовы бороться с болезнью и перенесете лечение, даже если оно тяжелое. Потому что больше захотят помогать тем, кто не унывает и всеми силами старается выздороветь.
Я больше скажу. На примере близкого человека.
Август месяц в онкодиспансере. Химиотерапевт (с небольшим стажем радоты около 1 года), дает на подпись договор, тут же его забирает ни копий ничего, кроме выписок от врача, что получает пациентка таргетную терапию, так как опухоль на легком не операбельна и т.д. и отпускает домой выписав дорогущий препарат не прошедший в России клинические испытания пациенту, расписывая теоретически правила приема препарата, с условием – курс пропьете и по результатам анализов подкорректируем дозировку препарата. Проходит 13 дней утром на тощак женщина принимала капсулы причем по схеме прописанной лечащим врачем:
посадила поджелудочную железу, (при условие ко всему – диабетик),
печень,
гастроэзофагит, – стала питаться только водой и сухарями, отказалась от воды, слегка еще могла пить минералку,
появилась аллергия, поехала к врачу.
Врача поменяли, чистку организма сделали, контроль и наблюдение в стационаре назначили.
А к тому же оказалось, что за исследования должны денежную дотацию производить из резервного фонда, а ей даже это ни кто и не сказал, вот вам и поддержка онкобольных.
Причем дозировку пересмотрели, она оказалась в разы завышенной.
Hei!Jeg har et bad, med et stort vindu. Jeg synes det blir så mørkt og stusslig å ha peerrennsi, men må ha noe som hindrer innsyn så jeg kan bruke badet uten å bli blottlagt for nabolaget. Har du tips til hva jeg kan gjøre for å hindre innsyn uten at det blir kjerring aktig og fælt?!
В-четвертых, будьте готовы к большому объему дополнительной работы во время исследования, продумайте, кто сможет участвовать в исследовании, какие функции эти сотрудники должны выполнять и имеют ли они необходимую подготовку, желание и время. Зачем врачу участвовать в клинических исследованиях? Оставаться в клинике допоздна и вносить результаты обследований в базу данных на английском языке, несколько раз в неделю согласовывать с курьерами отправку биообразцов в центральную лабораторию где-нибудь в Шотландии, заполняя при этом пять копий накладной… Опытные исследователи в качестве стимулов называют хорошую оплату и возможность ознакомиться с международными стандартами диагностики и лечения, применить их на практике. Однако, чтобы попасть в клиническое исследование, одного желания недостаточно. Выбор центра для размещения исследования всегда происходит на пересечении требований компании-спонсора и возможностей врача-исследователя.
Читайте также:

