Паклитаксел при трижды негативном раке
- Recent Entries
- Archive
- Friends
- Profile
- Memories
Книга про трижды негативный РМЖ: продолжение истории
Первая линия химиотерапии: антрациклины (адриамицин/доксорубицин + цитоксан/циклофосфамид + таксаны (паклитаксел). Таксаны показывают лучшие результаты при еженедельном введении. При задетых л/у добавляют препараты платины (карбоплатин или цисплатин). По результатам некоторых исследований, цисплатин более эффективен при ТНРМЖ с мутацией BRCA1.
Автор ссылается на 21 исследование (36 тыс. женщин) с ранними стадиями РМЖ. Результаты были опубликованы в 2009 году. Оценивалось воздействие таксанов. Выводы: таксаны однозначно улучшают результаты химиотерапии. Проценты улучшений разные: женщины до 50 лет добавление таксанов снижает риск рецидива на 37%; от 50 до 69 – на 20%.
Если после первой лечении возникает рецидив, то к делу должны подключаться другие химиопрепараты: варианты платины, антиметаболиты (Кселода) и ингибиторы микротрубочек (Икземпра – Ixempra). Икземпра и Кселода по отдельности показывали хорошие результаты при ТНРМЖ. А комбинация Икземпра + Кселода вообще удваивала выживаемость без прогрессирования при ТНРМЖ.
Авастин (Бевацизумаб). Это лекарство нового поколения, которое блокирует рост кровеносных сосудов в опухоли и она погибает. Авастин применяют вместе с химией при метастатическом РМЖ. По результатам исследований, он более эффективен именно при триппле, чем при гормональном РМЖ. Но вообще мнения о нем в отношении РМЖ разделяются: в США считают, что не так он и хорош, а в Европе назначают вместе с таксолом. В 2009 году опубликовали результаты исследования: авастин + таксол удваивали выживаемость без прогрессирования в сравнении с таксолом моно, и в большей степени выигрывали женщины с ТНРМЖ.
Нексавар (Сорафениб). Принцип действия – подавляет рецепторы Her1 на поверхности опухолевых клеток, не дает им размножаться. Используется при лечении других форм рака, но идут испытания в отношении ТНРМЖ (по идее, должен при нем работать). Было исследование, в котором пациенткам с ТНРМЖ давали Сорафениб + цисплатин, а затем паклитаксел – ответ был хороший.
Тарцева (Эрлотиниб), Эрбитукс (Цетуксимаб), Вектибикс (Панитумумаб). Эти лекарства одобрены для лечения других видов рака, но участвуют в испытаниях по РМЖ. По ним надеются получить хорошие результаты конкретно для ТНРМЖ.
А ЧТО ВПЕРЕДИ?
Инипариб
По результатам одного исследования, препарат достоверно увеличил общую выживаемость у женщин с метастатическим ТНРМЖ в сочетании с гемцитабином и платиной. В другой фазе исследования такого сильного положительного эффекта не отметили, исследования продолжаются.
Эрибулин (Халавен).
Ингибитор микротрубочек, активно испытывается. Особенно хорошо работал там, где ранее не справились таксаны, и в случаях с ТНРМЖ.
Вакцина
Компания Vaxon Biotech испытывает препарат Vx-001 – вакцину, которая, возможно, будет эффективной против ТНРМЖ с возможностью внедрения в практику к 2020 году.
Препараты на основе инсулина
Во многих случаях в клетках ТНРМЖ встречается повышенная экспрессия инсулиноподобного рецептора IGF-1R. Некоторые исследователи видят в этом путь к новому лекарству от ТНРМЖ.

- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Рак молочной железы является наиболее часто встречающимся злокачественным заболеванием у женщин и, по данным мировой статистики, достигает 22,9%. Заболеваемость РМЖ неуклонно возрастает, несмотря на снижение смертности от него благодаря внедрению скрининга и эффективной системной химиотерапии [1,2,3].
Трижды негативный РМЖ (ТНРМЖ) составляет около 8–20% всех опухолей молочной железы; встречается чаще у женщин молодого возраста (до 50 лет) до наступления менопаузы, у женщин с ранним менархе, первой беременностью в более раннем возрасте, коротким периодом грудного вскармливания, повышенным индексом массы тела [4,5,6,7].
ТНРМЖ характеризуется отсутствием экспрессии РЭ, РП и , что существенно затрудняет лечение этого типа рака. Он представляет собой подтип опухолей с высоким риском прогрессирования заболевания, а также особым характером метастазирования, что приводит к раннему поражению внутренних органов и ЦНС. По результатам крупнейшего исследования, в которое были включены 12 858 больных ТНРМЖ, наиболее частой локализацией гематогенных метастазов оказались: головной мозг и легкие (соотношение вероятностей составило 5,32 и 2,27 соответственно), а метастатическое поражение костей оказалось в конце списка с отношением вероятностей — 0,23 [8,9,10,11].
Цель исследования
Анализ непосредственных и отдаленных результатов комплексного лечения больных ТНРМЖ.
Материалы и методы
В исследование было включено 128 больных с операбельным ТНРМЖ со сроком наблюдения 5 лет, находившихся на обследовании и лечении в ГБУЗ ОКД № 1 ДЗМ в период с 2006 по 2008 г. При составлении характеристики пациенток было выявлено, что медиана возраста больных составила 57 лет (от 31 года до 83 лет).
По данным гистологического исследования, у пациенток преимущественно встречался инфильтративный протоковый рак — 107 (83,6%).
Инфильтративный дольковый рак был верифицирован — у 14 (10,9%) больных, а инфильтративный — у 7 (5,5%) пациенток.
В подавляющем количестве случаев у больных была 3 степень злокачественности опухоли — 69 (53,9%) пациенток. 2 степень злокачественности опухоли — у 56 (43,8%) больных, а 1 степень — у 3 (2,3%) пациенток.
Большинство пациентов, по данным иммуногистохимического исследования, имели высокий индекс пролиферативной активности ( > 19%) — 119 (93%). В 9 случаях (7%) индекс пролиферативной активности был меньше 19. Таким образом, пациентки, включенные в исследование, характеризовались совокупностью неблагоприятных признаков: в 93% случаев опухоли характеризовались высоким индексом пролиферативной активности и в 97,7% случаев — 2–3 степенью злокачественности (рис. 1).
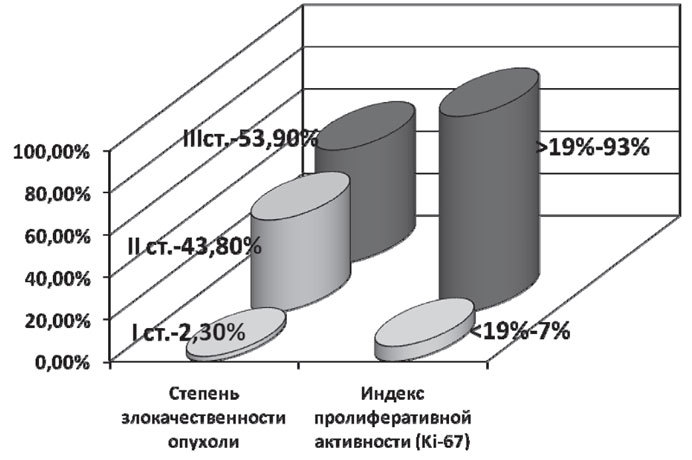
Рис. 1. Частота неблагоприятных признаков у больных с ТНРМЖ
На хирургическом этапе комплексного лечения пациенток с ТНРМЖ были выполнены четыре вида оперативных вмешательств: радикальная резекция молочной железы, радикальная мастэктомия по Мадден, радикальная мастэктомия по Пейти, радикальная мастэктомия по Холстеду.
В 97 случаях (75,8%) из 128 хирургическое лечение было проведено на первом этапе комплексного лечения. Распределение по стадиям этих пациенток представлено на рисунке 2.
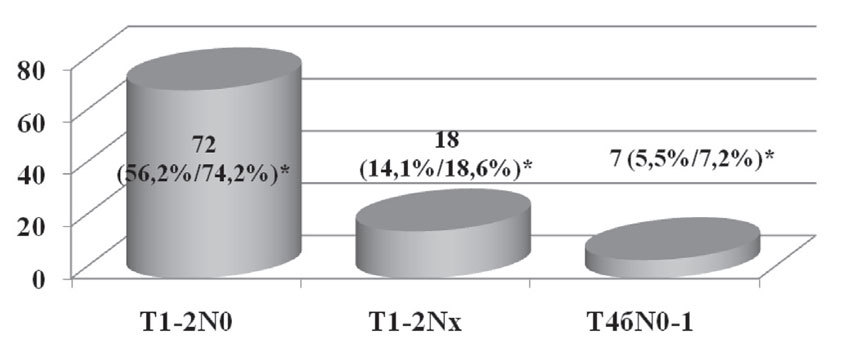
Рис. 2. Пациентки, которым хирургическое лечение было проведено на первом этапе комплексного лечения в зависимости от стадии заболевания
* % от общего числа пациенток / % от числа пациенток, которым проводилось хирургическое лечение не первом этапе
Неоадъювантная химиотерапия как составляющая комплексного лечения была проведена 31 пациентке (24,2%) по следующим показаниям: наличие верифицированных метастазов в регионарные (подмышечные и/или подключичные) лимфоузлы и/или форма рака молочной железы (рис. 3).
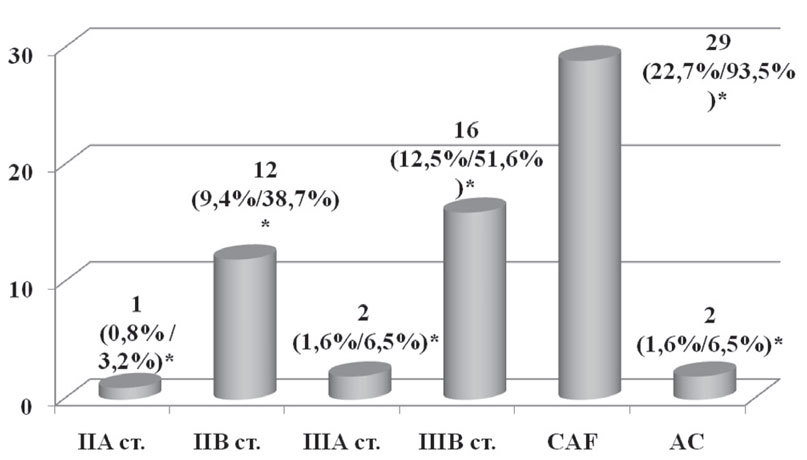
Рис. 3. Неоадъювантная химиотерапия в зависимости от стадии заболевания и схемы химиотерапии
*— % от общего числа пациенток / % от числа пациенток, которым проводилась неоадъювантная химиотерапия
Для проведения неоадъювантной химиотерапии применялись две схемы химиотерапии:
- схема — CAF (циклофосфан 600 мг/м2 + доксорубицин 50 мг/м2 + 600 мг/м2) была применена 29 пациенткам, из них в 28 случаях было проведено 2 курса и 1–3 курса химиотерапии;
- схема — AC (доксорубицин 50 мг/м2 + циклофосфан 600 мг/м2) была назначена 2 пациенткам, которым было проведено 4 курса химиотерапии.
Адъювантная химиотерапия была проведена 70 (54,7%) пациенткам при различных стадиях заболевания (рис. 4). Применялись 4 схемы адъювантной химиотерапии:
- схема — CAF (циклофосфан 600 мг/м2 + доксорубицин 50 мг/м2 + 600 мг/м2), была проведена 46 пациенткам (65,8%), из них 38 больным (54,3%) было выполнено 4 курса и 8 (11,5%) — 6 курсов химиотерапии;
- 2 схема — AC (циклофосфан 600 мг/м2 + доксорубицин 50 мг/м2), была назначена 16 пациенткам (22,8%), из них 11 (15,7%) — 4 курса и 5 (7,1%) — 6 курсов химиотерапии;
- схема — 600 мг/м2 + доксорубицин 50 мг/м2, была применена 5 пациенткам (7,1%), в количестве 4 курсов химиотерапии;
- схема — абитаксел 175 мг/м2 + доксорубицин 50 мг/м2, была проведена 3 пациенткам (4,3%), в количестве 4 курсов химиотерапии.
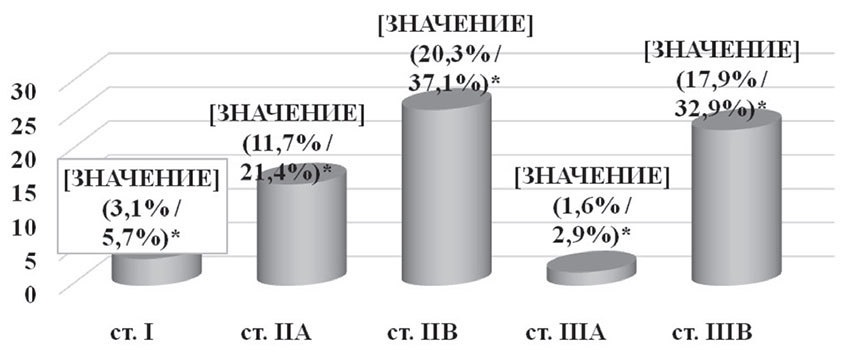
Рис. 4. Адъювантная химиотерапия в зависимости от стадии заболевания
*— % от общего числа пациенток / % от числа пациенток, которым проводилась адъювантная химиотерапия
Лучевая терапия как составляющая комплексного лечения пациенток с ТНРМЖ проводилась как в предоперационном, так и в послеоперационном периоде.
Основными показаниями к назначению лучевой терапии являлись: возможность выполнения органосохраняющего хирургического лечения (радикальная резекция молочной железы); наличие метастазов в 4 и более регионарных (подмышечных и/или подключичных) лимфоузлах, не спаянных между собой; наличие метастатического конгломерата лимфоузлов до начала лечения; форма РМЖ.
Предоперационная лучевая терапия была проведена 2 пациенткам (1,6% от общего числа).
Одной больной (0,8% от общего числа) с РМЖ стадии II В. — T2N1M0 с целью уменьшения размеров первичной опухоли в суммарной очаговой дозе (СОД) — 20 Гр.
Другой пациентке (0,8% от общего числа) — при РМЖ стадии IIIБ — T4бN2M0 с целью уменьшения отека молочной железы, по результатам проведения неоадъювантной химиотерапии была выявлена стабилизация, в СОД — 25 Гр.
Послеоперационная лучевая терапия была проведена 39 пациенткам (30,5%).
Результаты исследования
Проведение комплексного лечения пациенток с ТНРМЖ обусловило необходимость оценки его непосредственных и отдаленных результатов.
При проведении хирургического этапа лечения пациенток с ТНРМЖ нами в послеоперационном периоде был отмечен ряд осложнений, которые были обусловлены прежде всего объемом выполненных оперативных вмешательств. В основном у пациенток были зафиксированы случаи развития лимфостаза верхней конечности — 35 случаев (27,3%); длительной лимфорреи — 18 случаев (14,1%); краевого некроза лоскута (после радикальной мастэктомии), в результате которого заживление послеоперационный раны происходило частично за счет вторичного натяжения — 2 случая (1,6%) (рис. 5).
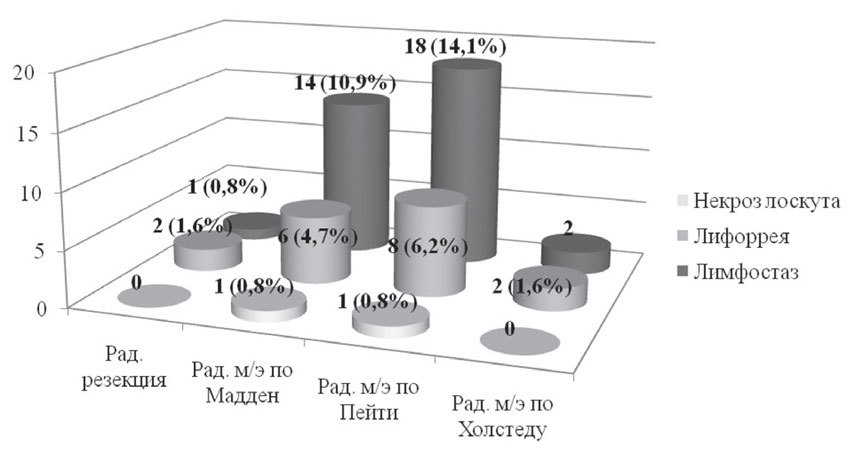
Рис. 5. Характер ранних послеоперационных осложнений в зависимости от вида хирургического вмешательства
Оценка эффективности неоадъювантной химиотерапии проводилась на основании результатов контрольного обследования (маммография и УЗИ молочных желез, подмышечных, над- и подключичных лимфоузлов) и данных о степени лечебного патоморфоза в опухоли, полученных в результате гистологического исследования операционного материала.
У 11 пациенток (35,5%) на фоне проведенной химиотерапии был достигнут полный регресс опухоли (лечебный патоморфоз степени); у 10 (32,2%) — частичная регрессия (патоморфоз степени); у 6 (19,4%) — стабилизация (патоморфоз степени); у 4 пациенток (12,9%) отмечено прогрессирование заболевания (патоморфоз степени) (рис. 6).
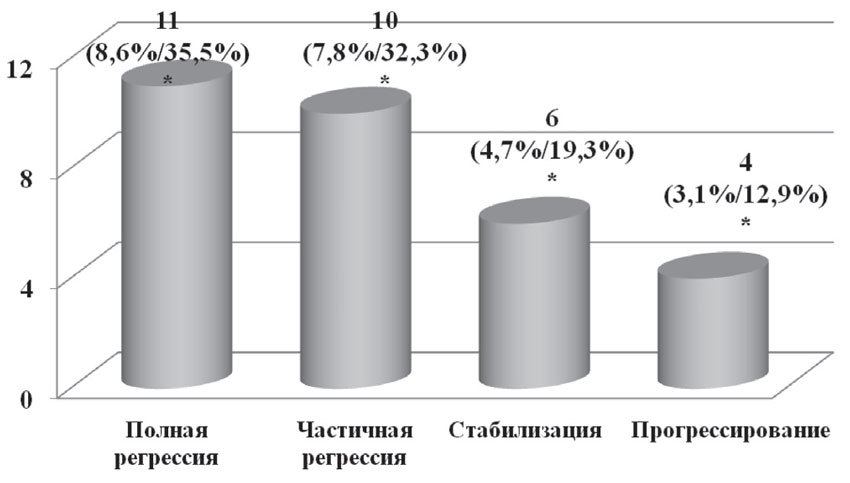
Рис. 6. Данные о лечебном эффекте неоадъювантной химиотерапии
*— % от общего числа пациенток/% от числа пациенток, у которых была выявлена данная степень лечебного патоморфоза опухоли при данной степени заболевания
Помимо оценки эффективности неоадъювантной химиотерапии были проанализированы ее побочные эффекты, которые отмечались у всех (100%) пациенток. Основными проявлениями токсичности были гематологическая токсичность (лейкопения и тромбоцитопения), тошнота, рвота, стоматит, синдром и др. Вышеуказанные побочные эффекты требовали коррегирующей симптоматической терапии, но не привели к отсрочке или отмене лечения (рис. 7).
Аналогичные результаты были получены и при оценке токсичности вышеуказанных схем адъювантной химиотерапии (рис. 7).
В двух случаях проведения предоперационной лучевой терапии был получен хороший лечебный эффект в виде частичной регрессии опухоли. Одной больной была проведена дистанционная гамматерапия в суммарной очаговой дозе 20 Гр по поводу РМЖ IIб ст., второй 25 Гр — IIIб ст.
У 39 пациенток (30,5%) на фоне проведения послеоперационной лучевой терапии отмечались следующие побочные реакции: повреждения кожи I степени были зарегистрированы у 14 больных (11,0%); cтепени — у 3 (2,4%); лучевые повреждения подкожной клетчатки I cтепени — у 34 пациенток (26,6%), а степени — у 5 (4%).
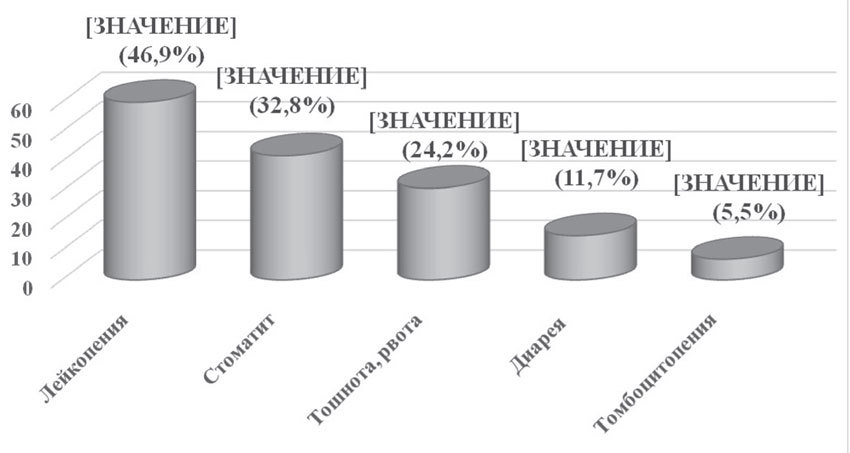
Рис. 7. Токсические реакции изученных режимов неоадъювантной и адъювантной химиотерапии
С целью оценки отдаленных результатов комплексного лечения пациенток с ТНРМЖ у 128 больных были прослежены сроки появления местных рецидивов и гематогенных метастазов в течение 5–6 лет, а также их локализация. Помимо этого была проведена оценка сроков безрецидивной и общей выживаемости (рис. 8). Все полученные данные были обработаны в программе IBM SPSS Statistics, а также при помощи расчетов по методу , что и позволило проанализировать результаты комплексного лечения пациенток с ТНРМЖ.
Из 128 пациенток у 3 (2,3%) на втором году наблюдения был выявлен локальный рецидив, медиана их появления составила 15 месяцев и 7 дней. Этим больным было проведено комплексное лечение по поводу РМЖ IIIб стадии.

Рис. 8. Отдаленные результаты комплексного лечения
В результате наблюдения в течение 5 лет у 31 пациентки (24,2%) были диагностированы гематогенные метастазы. Следует отметить, что большая их часть была выявлена на 2–3 годах наблюдения, в среднем — через 23 месяца и 6 дней от начала лечения. Локализация гематогенных метастазов была достаточно разнообразной: в 9 случаях (7,03%) гематогенные метастазы были диагностированы в костях, в 5 случаях (3,91%) — в легких, в 5 случаях (3,91%) — в надключичных лимфоузлах, в 4 случаях (3,13%) — в печени, в 3 случаях (2,34%) — в плевре, по одному случаю (0,78%) — в коже и головном мозге. У 3 пациенток (2,34%) были выявлены сочетанные метастазы: в головной мозг и кости, легкие и кости, кожу и плевру (рис. 9).
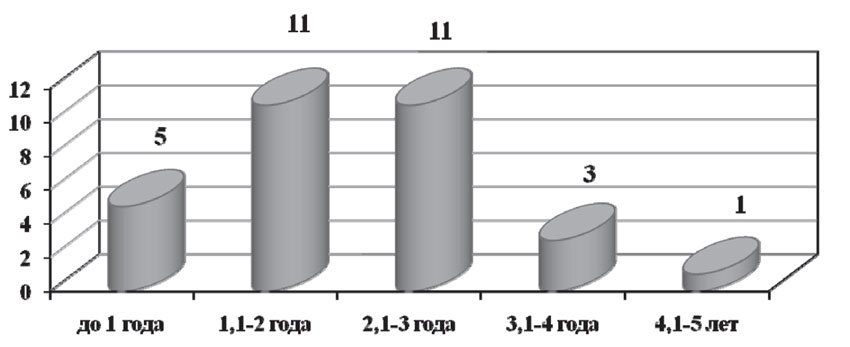
Рис. 9. Число больных с гематогенными метастазами на разных сроках наблюдения
Пятилетняя безрецидивная выживаемость у пациенток, получавших комплексное лечение по поводу ТНРМЖ, составила 75,8%: при I стадии — 28 больных (84,9%), при IIа — 34 пациентки (80,9%), при IIб — 23 случая (82,1%), при IIIа — 2 случая (100%), при IIIб — 10 больных (43,5%) (рис. 10).
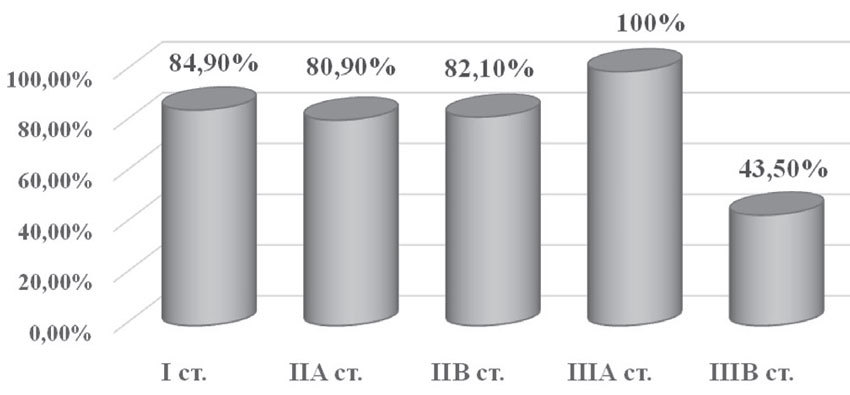
Рис. 10. Пятилетняя безрецидивная выживаемость в зависимости от стадии заболевания
Общая пятилетняя выживаемость составила 77,3%: при I стадии — 28 больных (84,9%), при IIа — 36 пациенток (90,5%), при IIб — 23 случая (82,1%), при IIIа — 2 случая (100%), при IIIб — 10 больных (43,5%). Смерть на первом году наблюдения была зафиксирована у 1 больной (0,8%) (рис. 11).
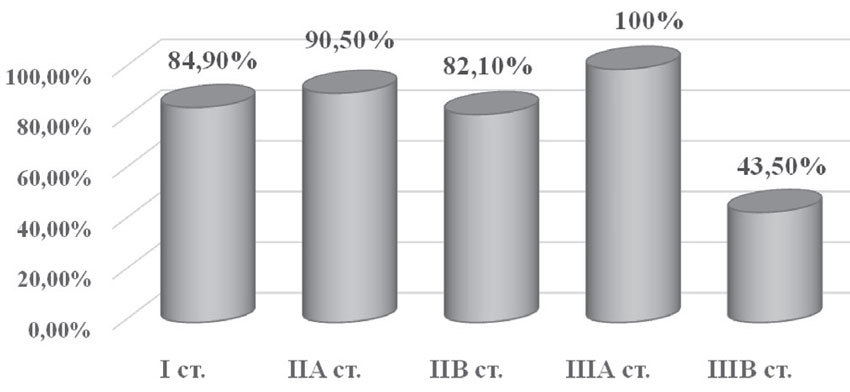
Рис. 11. Общая пятилетняя выживаемость в зависимости от стадии заболевания
Заключение
Полученные результаты свидетельствуют о высокой степени эффективности примененных нами способов диагностики и схем комплексного лечения больных с операбельной формой ТНРМЖ.
Лечение трижды негативного рака молочной железы
Трижды негативный рак молочной железы не содержит рецепторов эстрогенов и прогестерона, а также амплифицированного гена Her2. Это означает, что он имеет очень малое количество точек воздействия для его лечения. Долгое время он считался практически неизлечимым, сегодня имеются методы дающие пациенткам надежду.
По материалам беседы с профессором Мерц, заведующим отделения ультразвуковой гинекологической клинической диагностики.
Как часто врачи диагностируют трижды негативный рак молочной железы? Существуют ли определенные группы женщин, у которых этот вид рака наблюдается чаще?
Трижды негативный рак молочной железы встречается у 10-15 процентов заболевших пациенток. Чаще эта форма рака поражает молодых женщин. Тесная взаимосвязь имеется между трижды негативным раком и мутацией гена BRCA1. У пациенток с мутацией гена BRCA1 в большинстве случаев диагностируется трижды негативный рак молочной железы.
Какая терапия назначается на ранних стадиях заболевания?
В основном пациентки с трижды негативным раком молочной железы получают так называемую неоадъювантную химиотерапию, т.е. терапию, которая проводится перед операцией. Это дает возможность точного контроля реакции заболевания на лечение. Примерно у трети пациенток к началу операции опухолевые клетки в молочной железе
после химиотерапии не определяются. Это называют полной ремиссией патологического процесса. В таком случае рецидивы заболевания маловероятны.
Как Вы оцениваете применение Карбоплатина при трижды негативном раке молочной железы?
Значение Карбоплатина при трижды негативном раке молочной железы сегодня, как и вчера, подтверждено недостаточно. Но стоит отметить, что проводимые онкологические исследования доказывают, что применение химиотерапии с карбоплатином перед операцией увеличивает положительную реакцию на терапию и процент выживаемости пациенток при трижды негативном раке молочной железы. И это касается не только, как считалось ранее, пациенток с мутацией гена BRCA1. Поэтому платино-содержащую химиотерапию следует чаще назначать пациенткам с ТНРМЖ, учитывая естественно возможные побочные действия.
Имеются ли другие терапевтические возможности на ранних стадиях заболевания?
В настоящее время тестирование проходят несколько новых медикаментов для лечения трижды негативного рака молочной железы. Некоторые (как например, ингибиторы PARP( поли(АДФ-рибоза)-полимеразы) уже доступны в рамках клинических исследований.
Каково положение при метастазированной стадии заболевания?
Проводятся ли в настоящее время исследования в области трижды негативного рака молочной железы?
Да, особенно в направлении использования ингибиторов контрольных пунктов, а также ингибиторов PARP( поли(АДФ-рибоза)-полимеразы). На Конгрессе по поводу прогрессивного рака молочной железы в Лиссабоне были представлены данные о том, что шесть процентов трижды негативных опухолей обнаруживают рецепторы андрогенов. Ингибиторы андрогенов успешно применяются при лечении рака простаты. И как показывают исследования пациентки, у которых обнаруживаются рецепторы андрогенов, также могли бы получать эффект от использования этих препаратов.
Каково Ваше мнение? Являются ли ингибиторы андрогенов, учитывая их низкие побочные эффекты, одним из возможных видов лечения?
Данные по антиандрогенам действительно являются многообещающими, немаловажным является и то, что медикаменты уже допущены к применению, хотя и не использовались для лечения рака груди. С одной стороны в отношении терапии антиандрогенами имеется много открытых вопросов: мы не знаем, например, при каком количестве адрогеновых рецепторов в клетке, следует назначать терапию. С другой стороны есть пациентки с прогрессивной и устойчивой к химиотерапии стадией заболевания, при лечении которых следует принимать во внимание наличие подобной терапии.

Одним из наиболее эффективных химиотерапевтических препаратов, используемых при раке молочной железы, является Таксол/Taxol (паклитаксел/paclitaxel). Помимо злокачественных опухолей молочной железы, этот цитостатический противораковый препарат часто применяют для лечения рака яичника, шейки матки, эндометрия, легких, рото- и носоглотки, гортани, пищевода, предстательной железы, саркомы Капоши.
Другие названия: Таксол, Паксен, Абитаксел, Ютаксан, Интаксел, Митотакс, Паклитера, Таксакад, Синдаксел.
Если вам или вашим знакомым назначен паклитаксел — есть несколько важных моментов касательно данного препарата, о которых следует знать.
Показания к применению
Паклитаксел является универсальным препаратом. Он применяется как на ранних стадиях, так и при лечении 4 стадии рака молочной железы (метастатический рак). В основном, он назначается после комбинации, в которую входят один из антрациклинов (доксорубицин или эпирубицин) и циклофосфан — химиотерапевтическая схема ACx4→Px4.
Также паклитаксел может использоваться в схемах неоадъювантной химиотерапии (назначается перед операцией). Основная цель это химиотерапии — сократить размеры опухоли перед операцией.
Помимо рака молочной железы и яичников, паклитаксел помогает бороться и с другими злокачественными заболеваниями, например, раком легких и саркомой Капоши. Саркома Капоши — злокачественная опухоль стенок кровеносных сосудов, видимая сквозь кожу и слизистые оболочки. Распространённость этого заболевания в целом невелика. Однако заболеваемость среди больных ВИЧ-инфекцией достигает 40—60 %.
Как действует паклитаксел
Опухолевые клетки в процессе размножения проходят стадию митоза. То есть деления ядра, в результате которого получаются две генетически идентичные дочерние клетки. Паклитаксел является ингибитором митоза. Проникая в клетку, он разрушает микротрубочки, которые обеспечивают расхождение хромосом к полюсам клетки при митозе. Вмешавшись в процесс деления клеток, паклитаксел его останавливает.
Пока вы будете получать паклитаксел, вам периодически придётся сдавать анализы и приходить некоторые исследования. Во-первых, чтобы узнать, как ваш организм реагирует на препарат, врач будет периодически назначать общий анализ крови, а также тесты для оценки функционального состояния ваших почек и печени. Во-вторых, ему необходимо будет оценить эффективность, проводимого лечения. Для этого могут потребоваться компьютерная томография, ультразвуковое исследование и так далее.
Подготовка, как вводится и дозы
Паклитаксел представляет собой прозрачную бесцветную жидкость, которая смешивается с Кремофором (Cremophor EL, полиоксиэтилированное касторовое масло) и вводится путем инфузии. То есть полученный раствор вводят непосредственно в вену. Он плотный и вязкий, поэтому для его ведения необходима специальная помпа. Поэтому вы сможете получать препарат только в больнице.
Паклитаксел может использоваться в виде высокодозной химиотерапии (большая доза вводится один раз каждые две или три недели), а также в низких дозах один раз в неделю. Паклитаксел, который вводится раз в неделю переносятся легче, чем тот, который вводится один раз в 3 недели. Иногда используют длительную инфузию паклитаксела (препарат вводится в течение 24 часов).
Ваш рост и вес, общее состояние здоровья, диагноз — это то, что в основном определяет, какую дозу препарата назначит врач.
Вводить препарат должна специально обученная медсестра. Неправильное введение Таксола может привести к повреждению тканей.
Бенадрил (дифенгидрамин) вводят до и во время инфузии Таксола, чтобы снизить риск развития аллергической реакции.
Как переносится паклитаксел и побочные эффекты
Большинство пациентов хорошо переносят паклитаксел, особенно, когда он вводится в низких дозах. При использовании паклитаксела возможны следующие побочные эффекты:
- Периферическая невропатия (повреждение нерва).
- Малокровие (состояние, для которого характерно уменьшение количества эритроцитов).
- Нейтропения (снижение числа нейтрофилов. Выраженное снижение приводит к повышению риска развития бактериальной и грибковой инфекции).
- Мышечные боли.
- Боли в костях.
- Выпадение волос.
- Повышенная усталость.
- Тошнота.
- Рвота.
- Диарея легкой степени тяжести.
- Мукозит (раздражение слизистой оболочки полости рта).
- Аменорея (отсутствие менструации).
- Ломкость и пожелтение ногтей.
Существуют способы, с помощью которых можно предотвратить некоторые из вышеописанных проблем. К примеру, перед тем как вы начнёте лечение, ваш врач может посоветовать вам приём аминокислоты L-глютамин для предотвращения нейропатии. Помимо этого, чтобы увеличить количество лейкоцитов в крови, могут быть использованы нейпоген (филграстим) и неуласта (пэгфилграстим).
Кроме того, чтобы исключить риск неблагоприятного взаимодействия, вам будет рекомендовано не употреблять алкоголь во время курса химиотерапевтического лечения, а также избегать медикаментов, содержащих аспирин.
Побочный эффект исчезают обычно сразу после окончания химиотерапии. Однако возможны и долгосрочные последствия химиотерапии, в частности, периферическая невропатия иногда может стать постоянной, а усталость может беспокоить на протяжении нескольких лет.
Риски и противопоказания
Паклитаксел — это препарат категории D риска при беременности, то есть он может нанести вред растущему и развивающемуся плоду. Поэтому не должен использоваться, если женщина беременна. Если вы не беременны и ведете половую жизнь, вам придется использовать противозачаточные средства в период приема Таксола.
Препарат может попадать в грудное молоко, поэтому вы не сможете кормить грудью.
Паклитаксел может стать причиной бесплодия. Поговорите с врачом перед началом терапии, если вы планируете беременность.
Если у вас поднимется температура, появятся озноб или вы заметите покраснение или припухлость в области прокола иглы, то немедленно сообщите об этом доктором.
Возможна аллергическая реакция на паклитаксел или Кремофор EL.
Несколько слов от OncoInfo
Список использованных источников:

Тройной негативный подтип рака молочной железы (ТНРМЖ) диагностируется в 15% случаев заболевания 1 , однако на него приходится около 40% летальных исходов от этого новообразования 1-4 . Клетки ТНРМЖ не содержат рецепторов эстрогенов и прогестерона, а также амплифицированного гена HER2, что делает заболевание малочувствительным к проведению гормональной и таргетной терапии 5 . ТНРМЖ характеризуется агрессивным течением и частыми рецидивами. 6-8
Помимо этого, специалисты выделяют PD-L1-положительный подтип заболевания, течение которого сопряжено с наиболее неблагоприятным исходом. 9
В отличие от других подтипов рака молочной железы, для ТНРМЖ характерно мультиорганное метастазирование (легкие — 32%, головной мозг — 9%, кости — 36%, печень — 22%). 10 Кроме того, ТНРМЖ чаще диагностируется в более молодом возрасте (средний возраст постановки диагноза 53 года). 11
До недавнего времени для пациенток с ТНРМЖ была показана только химиотерапия. 12 Однако наука не стоит на месте, ученые продолжают поиски уязвимых точек коварного заболевания, в результате в арсенале онкологов появилась комбинация атезолизумаба с наб-паклитакселом. Ее эффективность и безопасность для терапии ТНРМЖ оцениваются в продолжающемся клиническом исследовании III фазы IMpassion130, результаты которого и стали предметом обсуждения на симпозиуме.
С его данными участников мероприятия ознакомила научный сотрудник отделения клинической фармакологии и химиотерапии НИИ клинической онкологии НМИЦ онкологии им. Н.Н. Блохина Мона Фролова. По ее словам, в исследование были включены 902 пациентки с местнораспространенным или метастатическим ТНРМЖ, не получавшие предшествующего системного лечения. Участниц разделили на две группы, в первой назначили атезолизумаб в комбинации с наб-паклитакселом, во второй — плацебо и наб-паклитаксел.
Рациональность иммунотерапии у больных ТНРМЖ определяют три фактора: мутационная нагрузка, инфильтрация опухоли Т-лимфоцитами и экспрессия PD-L1. Так, у 41% участников исследования экспрессия PD-L1 оказалась положительной.
В ходе исследования в группе применения атезолизумаба в комбинации с наб-паклитакселом было показано достоверное снижение риска прогрессирования или смерти на 38%, а также клинически значимое увеличение общей выживаемости на 7 месяцев (25 мес. против 18 мес.) по сравнению с монотерапией наб-паклитакселом у пациенток с экспрессией PD-L1 более 1%. 15-16
Что касается безопасности комбинации, включавшей атезолизумаб и наб-паклитаксел, то она соответствовала известному профилю безопасности препаратов в отдельности; новые сигналы безопасности при применении комбинации не выявлены [16].
Атезолизумаб (Тецентрик®) стал первым зарегистрированным в России иммуноонкологическим препаратом, одобренным для применения в комбинации с наб-паклитакселом для первой линии терапии PD-L1-положительного неоперабельного распространенного ТНРМЖ. 13 По данному показанию препарат включен в клинические рекомендации, разработанные Ассоциацией онкологов России (АОР), Российским обществом клинической онкологии (RUSSCO), Российским обществом онкомаммологов (РООМ). 14
Профессор кафедры онкологии и паллиативной медицины Российской медицинской академии последипломного образования Ирина Колядина сосредоточилась в своем выступлении на особенностях выявления биомаркера PD-L1 в терапии ТНРМЖ.
Нюанс первый: где определять PD-L1 экспрессию? Так, если при немелкоклеточном раке легкого ее можно выделять как в опухолевых клетках, так и в лимфоцитах, инфильтрирующих опухоль, то в случае с ТНРМЖ PD-L1 статус определяется на иммунокомпетентных клетках и только в 2% — на опухолевых (в 9% случаев наблюдается сочетанная экспрессия).
Нюанс второй: важен ли уровень PD-L1 экспрессии? В рамках исследования IMpassion130 PD-L1 экспрессия выявилась у 41% пациентов, при этом у 27% из них она составляла 1-5 %, у 14% — более 5%. Но, как показывает анализ, выигрыш от комбинации атезолизумаба с наб-паклитакселом имели все пациенты независимо от уровня PD-L1 экспрессии. А это обстоятельство свидетельствует, что уже сам факт наличия экспрессии позволяет назначать эффективную терапию и существенно снижает риск рецидива и смерти.
Нюанс третий: какой материал выбрать для определения PD-L1 экспрессии — первичный или метастатический? Согласно исследованию IMpassion130, клиническая активность наблюдалась у пациентов с выявленной экспрессией PD-L1 вне зависимости от того, был ли образец первичным или метастатическим.
Нюанс четвертый: нужно ли выбирать конкретный диагностический тест для определения PD-L1 статуса? Как известно, сегодня достаточно соответствующих тестов, главное различие которых состоит в выборе мишеней для определения PD-L1 экспрессии. Большая их часть предназначена для проведения тестирования и на опухолевых, и на иммунокомпетентных клетках. Притом, что в случае ТНРМЖ принципиально важно определять PD-L1 экспрессию именно на иммунокомпетентных клетках. Как показало исследование IMpassion130, тест SP142 обладает наибольшей чувствительностью и специфичностью к иммунокомпетентным клеткам. 16,19 Этому условию отвечает единственный тест SP142 VENTANA, доступный для российских специалистов в рамках проведения научного исследования RUSSCO.
Ряд клинических случаев ТНРМЖ у пациенток 42—58 лет представила на суд участников симпозиума заместитель директора Московского клинического научного центра им. А.С. Логинова Людмила Жукова. При этом практикующие онкологи имели возможность с помощью интерактивных пультов выбирать наиболее эффективный вариант терапии для каждого профиля пациенток. В частности, учитывая данные исследования IMpassion130, принимать решение, какой диагностический тест необходимо провести на конкретном этапе заболевания, на каких клетках определять PD-L1 экспрессию, какие препараты назначать для лечения.
Разбирая клинические случаи, профессор Жукова обратила внимание на упущенные возможности, когда PD-L1-положительным пациенткам с диагнозом тройной негативный рак молочной железы, не выясняя их статус, проводили хирургические операции, адъювантное лечение и лучевую терапию. Отметив, что в этих случаях все заканчивалось рецидивом болезни, специалист подчеркнула, что чем раньше начинается иммунная терапия, тем больше выживаемость.
Атезолизумаб представляет собой моноклональное антитело, направленное на взаимодействие с белком под названием PD-L1. Связываясь с PD-L1, экспрессируемым на опухолевых и инфильтрирующих опухоль иммунных клетках, атезолизумаб предотвращает взаимодействие PD-L1 с PD-1 и B7.1. Блокируя PD-L1, атезолизумаб нормализует активацию Т-клеток.
Кроме того, атезолизумаб не нарушает механизм защиты нормальных тканей от аутоиммунных реакций за счет сохранения взаимодействия PD-1 и PD-L2. Большая безопасность ингибиторов PD-L1 (в т.ч. атезолизумаба) была подтверждена в мета-анализе 125 клинических исследований иммунотерапии, включающем более 20 000 пациентов. 17 Препарат одобрен в России к применению как в виде монотерапии, так и в комбинации с таргетной терапией и/или химиотерапией при различных формах немелкоклеточного и мелкоклеточного рака легкого, некоторых типах метастатического уротелиального рака и при PD-L1-положительном метастатическом трижды негативном раке молочной железы. 18
Ирина Колядина, профессор кафедры онкологии и паллиативной медицины Российской медицинской академии последипломного образования:
Читайте также:





