Овариальная супрессия при раке молочной железы
С 9 по 13 декабря в г. Сан-Антонио (США) прошел очередной симпозиум SABCS (San Antonio Breast Cancer Symposium) – крупнейшая в мире конференция, посвященная раку грудной железы (РГЖ). Ежегодно мероприятие посещают тысячи делегатов со всего мира, чтобы обменяться последними новациями в изучении РГЖ, а также достижениями в диагностике и лечении этого заболевания.
Преодоление резистентности к гормональной терапии
На протяжении последних нескольких лет в фокусе SABCS был HER2-положительный РГЖ, в лечении которого выраженный эффект продемонстрировали различные таргетные препараты. Однако в этом году значительно больше внимания было уделено РГЖ, положительному по эстрогеновым рецепторам (ER+). Следует отметить, что ER+ заболевание выявляется примерно у 75 % пациенток, в то время как HER2 – только у 20–25 %.
Первоочередную роль в лечении ER+ РГЖ играет гормональная терапия такими препаратами, как тамоксифен и ингибиторы ароматазы. Тем не менее значимой проблемой при использовании этого метода лечения является развитие резистентности. Проведенные исследования позволили обнаружить ряд сигнальных путей, в частности пути PI3-киназы, принимающие участие в формировании резистентности. Соответственно, ингибирование этих путей может восстанавливать чувствительность опухоли к гормональной терапии.
Ингибиторы PI3-киназы – относительно новый класс препаратов, которые могут занять свою нишу в лечении РГЖ. На симпозиуме были представлены предварительные результаты рандомизированного клинического исследования ингибитора PI3-киназы пиктилисиба, который при добавлении к фулвестранту обеспечивал значительное увеличение выживаемости без прогрессирования у пациенток с метастатическим РГЖ, прогрессировавшим после первой линии терапии ингибиторами ароматазы (абстракт S2-02). Примечательно, что польза от добавления пиктилисиба наблюдалась независимо от мутационного статуса PI3KCA (ранее считалось, что мутации PI3-киназы, обнаруживаемые примерно у 40 % пациенток с ER+ РГЖ, могут быть ответственны за развитие резистентности).
Овариальная супрессия
Большой интерес у участников симпозиума вызвала презентация результатов исследования SOFT, касающихся целесообразности добавления овариальной супрессии к терапии тамоксифеном у относительно молодых пациенток с гормонорецептор-положительным РГЖ (абстракт S3-08). Было установлено, что после медианы наблюдения 67 мес добавление овариальной супрессии к тамоксифену не привело к улучшению исходов в общей популяции SOFT. Однако в подгруппе пациенток, которые получали химиотерапию и сохранили пременопаузальный статус, добавление овариальной супрессии к гормональной терапии улучшало исходы РГЖ.
Овариальная супрессия обусловливала увеличение частоты развития побочных эффектов, в первую очередь проявлений симптомов менопаузы (приливов, повышенного потоотделения, нарушений в сексуальной сфере, депрессии).
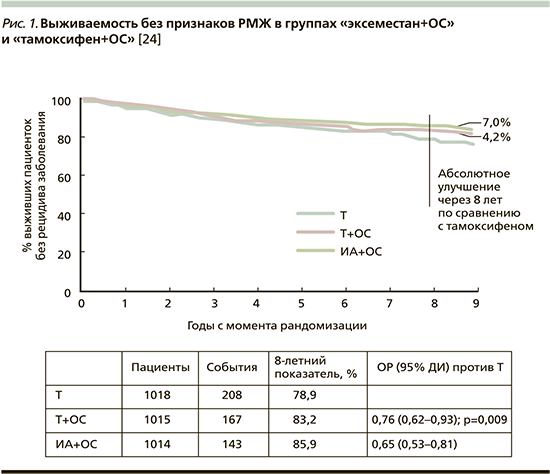
Ранее на конгрессе Американского общества клинической онкологии (ASCO 2014) были представлены результаты объединенного анализа исследований SOFT и TEXT, показавшие, что при добавлении овариальной супрессии к гормональной терапии ингибитор ароматазы экземестан значительно эффективнее предотвращает рецидив РГЖ по сравнению с тамоксифеном.
Первые данные по ингибированию программированной смерти при РГЖ
Инновационные препараты, действующие в качестве ингибиторов сигнальных путей программированной смерти, продемонстрировали впечатляющие результаты в лечении меланомы и ряда других злокачественных опухолей. Эти лекарственные средства, также называемые ингибиторами иммунных контрольных точек (чекпоинтов), могут быть эффективными даже при наиболее трудно поддающихся лечению новообразованиях.
В исследовании 1b фазы ингибитор иммунных чекпоинтов пембролизумаб хорошо переносился и показал значительную терапевтическую активность у пациенток с рецидивным или метастатическим тройным негативным РГЖ, ранее получавших несколько линий лечения (абстракт S1-09).
Долгосрочная химиопрофилактика РГЖ
На SABCS 2014 впервые были представлены результаты по долгосрочному применению тамоксифена с целью профилактики РГЖ у женщин с высоким риском развития этого заболевания (абстракт S3-07). В исследовании IBIS-1, стартовавшемв1992г.,принялиучастие7154пре-ипостменопаузальных пациентки в возрасте от 30 до 70 лет с высоким риском РГЖ преимущественно в связи с отягощенным семейным анамнезом. Участниц рандомизировали для получения тамоксифена 20 мг/сут или плацебо на протяжении 5 лет. После медианы наблюдения 16 лет (максимальный показатель 22 года) был зафиксирован 601 случай РГЖ – 250 (7,0 %) в группе тамоксифена и 351 (9,8 %) в группе плацебо. Относительный риск (ОР) РГЖ при лечении тамоксифеном составил 0,71 (р 60 % клеток в опухоли представлено TIL) и низкого уровня (
Т.Ю. Семиглазова (1, 2), И.В. Берлев (1, 2), Е.А. Ульрих (1, 3), В.В. Семиглазов (1, 3), А.Э. Протасова (2, 4), Н.А. Бриш (1), Е.А. Коробейникова (1), Ю.В. Алексеева (1), Л.В. Филатова (1, 2), А.И. Семенова (1), Д.Х. Латипова (1), Г.М. Телетаева (1), Е.В. Ткаченко (1), В.В. Клименко (1), Г.А. Дашян (1), С.А. Проценко (1), Р.М. Палтуев (1), А.Ф. Урманчеева (1, 2), П.В. Криворотько (1, 2), В.Ф. Семиглазов (1, 2)
1 Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова, Санкт-Петербург, Россия; 2 Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия; 3 Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург, Россия; 4 Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
1. Beatson G., Edin M. On the treatment of inoperable 10 cases of carcinoma of the mamma: Suggestions for a new method of treatment of illustrative cases. Lancet. 1896:104–7.
2. Ulrich P. Testosterone (hormone mâle) et son rôle possible dans le traitement de certains cancers du Sein, Unio. Internat. Contra Cancrum. 1939;4:377.
3. Horwitz K., Wei L., Sedlacer S., d’Arville C.N. Progestin action and progesterone receptor structure in human breast cancer: a review. Recent Prog. Horm. Res. 1985;41:249–316.
4. Klijn J.G.M., de Jong F.H. Treatment with luteinising hormone releasing hormone analogue (Buserelin) in premenopausal patients with metastatic breast cancer. Lancet. 1982:1213–16.
5. Покровский В.М., Коротько Г.Ф. Физиология человека. 2-е изд., перераб. и доп. М.: 2003. 656 с.
6. Стенина М.Б., Жукова Л.Г., Королева И.А., и др. Практические рекомендации по лекарственному лечению инвазивного рака молочной железы. Злокачественные опухоли. Практические рекомендации RUSSCO. 2017;7:105–34.
7. Семиглазов В.Ф., Палтуев Р.М., Манихас А.Г. и др. Клинические рекомендации РООМ по диагностике и лечению РМЖ. Санкт-Петербург, 2017.
8. Fornier M.N., Modi S., Panageas K.S., et al. Incidence of chemotherapy-induced, long-term amenorrhea in patients with breast carcinoma age 40 years and younger after adjuvant anthracycline and taxane. Cancer. 2005;104(8):1575–79.
9. Abusief M.E., Missmer S.A., Ginsburg E.S., et al. The effects of paclitaxel, dose density, and trastuzumab on treatment-related amenorrhea in premenopausal women with breast cancer. Cancer. 2010;116(4):791–98.
10. Swain S., Land S.R., Ritter M., et al. Amenorrhea in premenopausal women on the doxorubicin-and-cyclophosphamide-followed-by-docetaxel arm of NSABP B-30 trial Breast Cancer. Res. Treat. 2009;113:315–20.
11. Hellemond I., Vriens I., Peer P., et al. Ovarian function recovery during anastrozole in breast cancer patients with chemotherapy-induced ovarian function failure. J. Natl. Cancer Inst. 2017 Dec 1;109(12).
12. de Pedro M., Otero B., Martín B. Fertility preservation and breast cancer: a review. Ecancermedicalscience. 2015;9:503.
13. Kim S., Klemp J., Fabian C. Breast cancer and fertility preservation. Fertil. Steril. 2011;95(5):1535–43.
14. Letourneau J.M., Smith J.F., Ebbel E.E., et al. Racial, socioeconomic, and demographic disparities in access to fertility preservation in young women diagnosed with cancer. Cancer. 2012;118(18):4579–88.
15. Del Mastro L, Boni L., Michelotti A., et al. Effect of the gonadotropin releasing hormone analogue triptorelin on the occurence of chemotherapy-induced early menopause in premenopausal women with breast cancer: a randomized trial. JAMA. 2011;306(3):269–76.
16. Lambertini M., Ceppi M., Poggio F., et al. Ovarian suppression using luteinizing hormone releasing hormone agonists during chemotherapy to preserve ovarian function and fertility of breast cancer patients: a metaanalysis of randomized studies. Ann. Oncol. 2015;26(12):2408–19.
17. Venturelli М., Guaitoli G., Omarini C., Moscetti L. Spotlight on triptorelin in the treatment of premenopausal women with early-stage breast cancer. Breast Cancer. 2018;10:39–49.
18. Lambertini M. Cancer and fertility preservation: international recommendations from an expert meeting. BMC Medicine. 2016;14:1.
19. Lambertini M. Pooled analysis of five randomized trials investigating temporary ovarian suppression with gonadotropin-releasing hormone analogs during chemotherapy as a strategy to preserve ovarian function and fertility in premenopausal early breast cancer patients. San Antonio Breast Cancer Symposium. 2017. Abstract GS4-01.
20. Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomised trials. Lancet 2005;365(9472):1687–717.
21. Coates A., Winer E., Goldhirsch A., et al.; Panel Members. Tailoring therapies improving the management of early breast cancer: St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015. Ann. Oncol. 2015;26:1533–46.
22. Gradishar W., Anderson B., Balassanian R. NCCN guidelines Breast Cancer version 1.2016. J. Natl. Compr. Canc. Netw. 2015;13(12):1475–85.
23. Senkus E., Kyriakides S., Ohno S., et al.; ESMO Guidelines Committee. Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol. 2015;26 (Suppl. 5):v8–30.
24. Burstein H.J., Lacchetti C., Anderson H. Adjuvant Endocrine Therapy for Women With Hormone Receptor–Positive Breast Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update on Ovarian Suppression. J. Clin. Oncol. 2016;34:1689–701.
25. Francis P.A., Regan M.M., Fleming G.F., et al.; SOFT Investigators; International Breast Cancer Study Group. Adjuvant ovarian suppression in premenopausal breast cancer. N. Engl. J. Med. 2015;372:436–46.
26. Pagani О., Regan M.M., Walley B.A. et al; TEXT and SOFT Investigators; International Breast Cancer Study Group. Adjuvant exemestane with ovarian suppression in premenopausal breast cancer. N. Engl. J. Med. 2014;371:107–18.
27. Regan M.M., Francis P.A., Pagani O., et al. Absolute Benefit of Adjuvant Endocrine Therapies for Premenopausal Women With Hormone Receptor–Positive, Human Epidermal Growth Factor Receptor 2–Negative Early Breast Cancer: TEXT and SOFT Trials. J. Clin. Oncol. 2016;34:2221–31.
28. Fleming G, Francis PA, Láng I, et al. Randomized comparison of adjuvant tamoxifen (T) plus ovarian function suppression (OFS) versus tamoxifen in premenopausal women with hormone receptor-positive (HR+) early breast cancer (BC): Update of the SOFT trial. SABCS. 2017. Abstract 844 GS4-03.
29. Francis P. on behalf of Pagani O., Regan M.M., Fleming G.F., et at. Randomized comparison of adjuvant aromatase inhibitor exemestane (E) plus ovarian function suppression (OFS) vs tamoxifen (T) plus OFS in premenopausal women with hormone receptor positive (HR+) early breast cancer (BC): Update of the combined TEXT and SOFT trials. SABCS. 2014. Abstract 844 GS4-02.
30. Ribi K., Luo W., Bernhard J., et al. Adjuvant tamoxifen plus ovarian function suppression versus tamoxifen alone in premenopausal women with early breast cancer: patient-reported outcomes in the suppression of ovarian function trial. Clin. Oncol. 2016;34:1601–10.
31. Hadji P., Coleman R.E., Wilson C., et al. Management of Aromatase Inhibitor-Associated Bone Loss (AIBL) in postmenopausal women with hormone sensitive breast cancer: Joint position statement of the IOF, CABS, ECTS, IEG, ESCEO, IMS, and SIOG. J. Bone Oncol. 2017;7:1–12.
32. Coleman R., Body J.J., Aapro M., et al.; ESMO Guidelines Working Group. Bone health in cancer patients: ESMO clinical practice guidelines. Ann. Oncol. 2014;25(Suppl. 3):124–37.
33. Committee on Gynecologic Practice ACOG Tamoxifen and uterine cancer. Comm. Opin. 2014;601:1–4.












Овариальная супрессия агонистами гонадотропин-релизинг гормона при раннем раке молочной железы
Эволюция эндокринной терапии рака молочной железы (РМЖ) насчитывает более 120 лет (овариэктомия, применение тестостерона, тамоксифена). В 1982 г. впервые описано применение агонистов гонадотропин-релизинг гормона (аГнРГ) вместо оварио-
эктомии у женщин с метастатическим РМЖ и сохраненной менструальной функцией. В 2017 г. было доказано (объединенный анализ исследований SOFT/TEXT), что у пременопаузальных больных ранним гормонопозитивным РМЖ с сохраняющимся пременопаузальным уровнем эстрогенов после адъювантной химиотерапии (ХТ) и метастатическим поражением ≥4 лимфатических узлов и/или степенью злокачественности G3 добавление овариальной супрессии к адъювантной гормонотерапии снижает риск смерти, рецидива и контралатерального РМЖ по сравнению с монотерапией тамоксифеном. В качестве овариальной супрессии в исследованиях TEXT/SOFT в отношении большинства пациенток был использован аГнРГ трипторелин. Важно отметить, что при завершении лекарственной овариальной супрессии у молодых женщин восстанавливается исходное качество жизни, нормализуется менструальный цикл, исчезают симптомы менопаузы, вызванные введением аГнРГ. Преимущества применения аГнРГ заключаются не только в восстановлении фертильности у молодых пациенток, но и в улучшении ее показателей в отличие от больных, не получавших дополнительно аГнРГ.
Эволюция эндокринной терапии рака молочной железы (РМЖ) насчитывает более 120 лет, с того момента как в 1896 г. G. Beatson впервые осуществил овариальную супрессию больным РМЖ путем хирургической кастрации – овариэктомии [1]. В 1939 г. P. Ulrich первым описал положительный опыт применения тестостерона двумя больными РМЖ [2]. В 1962 г. с помощью радиоактивного эстрадиола были обнаружены рецепторы к эстрагенам, позднее, в 1985 г., стали определять и рецепторы к прогестерону [3]. В 1971 г. Walpole и Cole в ходе клинических исследований впервые установили эффективность тамоксифена. В 1977 г. FDA зарегестрировала тамоксифен в качестве препарата для лечения метатстатического РМЖ, с того момента начался современный этап лекарственной терапии РМЖ.
В 1982 г. J. Klijn описал применение агонистов гонадотропин-релизинг гормона (аГнРГ) вместо овариоэктомии у женщин с метастатическим РМЖ и сохраненной менструальной функцией [4].
В настоящее время, согласно современным клиническим рекомендациям, у женщин в постменопаузе с первично операбельным РМЖ в качестве адъювантной гормональной терапии применяются селективные антиэстрогены (тамоксифен) и ингибиторы ароматазы (ИА). Механизм действия ИА состоит в том, что за счет блокировки фермента ароматазы снижается синтез эстрогенов в перефирических тканях, что приводит к повышению синтеза эстрогенов в яичниках. Следовательно, ИА противопоказаны при сохранной функции яичников и могут назначаться только больным, достигшим стойкой менопаузы, в т.ч. с помощью медикаментозной или хирургической овариальной супрессии (ОС). При назначении ИА в пременопаузе необходимо использовать их только в комбинации с ОС [6, 7].
Термин ОС подразумевает необратимость воздействия, т.е. хирургическую кастрацию или облучение [6].
К обратимым методам подавления функции яичников относится лекарственный метод посредством применения аГнРГ, но при этом не всегда обеспечивается полное подавление функции яичников, особенно у женщин молодого возраста. Так как определение ФСГ в период лечения аГнРГ неинформативно, для подтверждения полной ОС необходимо определение эстрадиола в сыворотке крови. Прием ИА следует начинать через 6 недель после первого введения аГнРГ.
Бесплодие после ХТ у женщин репродуктивного возраста встречается с частотой от 30 до 70%. До наступления пубертатного периода воздействие ХТ на яичники менее выражено. Широко известно, что ХТ разрушает овариальный резерв яичников, цитостатики вызывают деструкцию в ядрах клеток гранулезы, приводят к атрезии ооцита. Таким образом, подавление оогенеза с помощью аГнРГ может оказать защитное действие на фолликулогенез.
Многие исследования международного уровня доказали зависимость наступления аменории от возраста и выбора схемы ХТ. В процессе лечения женщине детородного возраста необходимо назначать надежные средства контрацепции как в период лекарственной терапии, так и в ближайший срок после ее окончания. Врачам следует предупреждать пациентов о возможном негативном влиянии лекарственного лечения на функцию яичников и фертильность. Данные о возможности сохранения фертильности с помощью аГнРГ противоречивы, поэтому до начала лечения молодым женщинам, планирующим беременность в перспективе, необходимо рекомендовать консультацию врача-репродуктолога для решения вопроса о возможных вариантах реализации детородной функции.
Самая низкая частота развития аменореи (13–15%) наблюдается у женщин моложе 40 лет, тогда как в возрасте старше 50 лет частота наступления менопаузы достигает 97% [8–10].
Исходя из данных этого исследования, следует сделать вывод, согласно которому при назначении гормональной терапии ИА необходимо определять уровни эстрадиола и ФСГ в крови, это связано с тем, что аменорея после проведения ХТ не является достаточным признаком достижения стойкой менопаузы. С учетом данных исследований, а также уровня заболеваемости РМЖ и структуры заболевания по возрасту можно предполагать, что назначение препаратов, приводящих к ОС, показано приблизительно 10% больным РМЖ [12–13].
Место аГнРГ в международных рекомендациях по сохранению фертильности у женщин со злокачественным новообразованием
Следует помнить, что задачей лечения больных ранним РМЖ в пременопаузе служит не только достижение клинического эффекта, но и сохранение фертильной функции с восстановлением исходного качества жизни по завершении адъювантной ХТ, что достижимо при применении лекарственной ОС с помощью аГнРГ: трипторелин 3,75 мг внутримышечно 1 раз в 28 дней; гозерелин 3,6 мг внутримышечно 1 раз в 28 дней; бусерелин 3,75 мг внутримышечно 1 раз в 28 дней; лейпрорелин 3,75 мг внутримышечно 1 раз в 28 дней.
По данным исследования J.M. Letourneau et al. (2012), около 47% молодых женщин, страдающих ранним РМЖ, хотели бы реализовать свою репродуктивную функцию после окончания лечения [14].
В последние годы было проведено множество крупных рандомизированных клинических исследований пациенток с РМЖ, получающих ОС с помощью аГнРГ на фоне адъювантной ХТ с целью оценки наиболее безопасной стратегии сохранения фертильной функции.
Эта информация подтверждается данными мета-анализа 12 рандомизированных клинических исследований, опубликованного в 2015 г.: ОС с помощью аГнРГ значительно снижает риск развития преждевременной недостаточности яичников (ОР=0,36; p 0
- Химиотерапия при раке желудка
- Химиотерапия при раке толстой кишки
- Химиотерапия при раке легких
- Химиотерапия при раке молочной железы
- Химиотерапия без выпадения волос
- Гормональная терапия при раке молочной железы
- Гормональная терапия при раке щитовидной железы
- Описание
- Цены
- Врачи
Лечение рака молочной железы — это комплекс различных видов противоопухолевого лечения (хирургическое, химиотерапия, лучевая терапия).
Лечение может сильно отличаться в зависимости от стадии и типа злокачественного новообразования.
Необходимость и последовательность каждого из этапов лечения определяется врачом-онкологом с привлечением хирургов и специалистов по лучевой терапии. Помимо химиотерапии, лекарственная терапия рака молочной железы может включать гормонотерапию, таргетную терапию, а также остеомодифицирующую терапию.
Течение, прогноз и лечение рака молочной железы зависят не только от стадии заболевания, но и от биологического подтипа опухоли. Чтобы отнести злокачественное образование к тому или иному типу и определить чувствительность раковых клеток к гормонотерапии, лучевой терапии, химиотерапии и таргетной терапии проводится специальное исследование — иммуногистохимическое (ИГХ). Для него используются гистологические препараты, которые были изготовлены из материала, полученного при биопсии или операции.
Этот диагностический метод позволяет выявить:
- уровень экспрессии к рецепторам эстрогена и прогестерона (определяет чувствительность к гормонотерапии);
- гиперэкспрессию HER2/neu рецептора к эпителиальному фактору роста (определяет чувствительность к таргетной терапии). Встречается примерно в 30% случаев РМЖ, они имеют менее благоприятное течение;
- индекс митотической активности Ki67 (маркер агрессивности опухоли).
В зависимости от результатов ИГХ выделяют следующие подтипы рака молочной железы:
- люминальный А (высокая экспрессия РЭ и РП, Ki67 менее 20%, отсутствие гиперэкспрессии гена Her2);
- люминальный В (низкая экспрессия РЭ, положительная экспрессия РП, Ki67 более 20%, отсутствие гиперэкспрессии гена Her2);
- люминальный В, Her2-позитивный (положительная экспрессия РЭ и РП, наличие гиперэкспрессии гена Her2);
- нелюминальный, Her2-позитивный (отрицательная экспрессия РЭ и РП, наличие гиперэкспрессии гена Her2);
- тройной негативный (базалоподобный).
Принципиально следует отличать ранний рак молочной железы, местнораспространенный и метастатический.
Лечение раннего рака молочной железы (до IIA стадии и некоторых типов IIB) можно начинать с хирургического этапа (за исключением тройного негативного и Her2-позитивного рака).
Для местнораспространенного рака сначала проводится химиотерапия и далее, по возможности, хирургическое лечение.
При метастатическом раке хирургическое лечение не проводится.
Стадия определяется по системе TNM, где T обозначает размер первичной опухоли, N — статус лимфатических узлов, M — наличие или отсутствие отдаленных метастазов. Для раннего рака характерны малый размер первичной опухоли (до 5 см) без вовлечения или с минимальным вовлечением регионарных лимфатических узлов.
Хирургическое лечение
Большинство женщин с раком молочной железы нуждаются в хирургическом лечении.
При раннем раке молочной железы может быть проведено органосохранное лечение — с сохранением части молочной железы, что особенно важно с точки зрения косметического результата.
Виды органосохранных операций:
- удаление опухоли в пределах здоровых тканей с исследованием краев резекции (лампэктомия);
- различные виды резекций, наиболее часто выполняется радикальная резекция молочной железы.
Во всех случаях рака молочной железы необходима операция на лимфатических узлах подмышечной области (лимфаденэктомия). При этом происходит удаление всех аксиллярных (подмышечных) лимфатических узлов, что крайне необходимо для их оценки — определения стадии заболевания и прогноза. Операция называется аксиллярная лимфаденэктомия.
При органосохранных операциях может быть выполнена менее травматичная операция — биопсия сторожевого (или сигнального) лимфатического узла. Это первый лимфатический узел на пути лимфооттока, в него метастазы опухоли распространяются в первую очередь. Если он не поражен, это свидетельствует о том, что другие лимфатические узлы этой группы также не поражены. Специальные методы позволяют найти сторожевой лимфатический узел и взять его на анализ — при отсутствии в нем метастазов проведение полной лимфаденэктомии, возможно, не потребуется.
Органосохранное лечение возможно также при изначально местнораспространенном раке, который хорошо ответил на химиотерапию.
При более распространенных стадиях рака молочной железы обычно проводится радикальная мастэктомия. Во время операции удаляется вся ткань молочной железы с кожей над ней, а также проводится полноценная лимфаденэктомия. Такие операции оставляют выраженный косметический дефект. В связи с чем во многих случаях проводятся онкопластические операции (подразумевающие реконструктивный этап), например, подкожная мастэктомия (кожесохраняющая) с установкой силиконового импланта. Также на первом этапе может быть установлен экспандер — специальный вид импланта, который на протяжении нескольких месяцев наполняется жидкостью с помощью шприца через специальную мембрану. Задача экспандера — растянуть местные ткани. Через некоторое время проводится операция по замене экспандера на эндопротез.
В тех случаях, когда одномоментная пластика или онкопластическая операция по тем или иным причинам невозможны, проводится отсроченная реконструктивная операция, которая может использовать аутологичные (собственные) ткани, перемещенные с других участков тела — например, с включением кожи живота, подкожной клетчатки и фрагмента прямой мышцы живота (DIEP-лоскут). В таком случае из донорских тканей формируется каркас будущей груди, в который помещается силиконовый имплант. Сегодня существуют различные варианты подобных лоскутов (DIEP-лоскут, TRAM и пр.).
Вид операции определяется врачом хирургом-онкомаммологом с учетом размера, стадии и биологического типа опухоли, а также с учетом предпочтений пациентки.
Системное (лекарственное) лечение рака молочной железы
Химиотерапия — базовый вид лекарственного лечения почти для всех пациентов с раком молочной железы. Он подразумевает использование специальных цитостатических препаратов, которые циркулируют по всему организму и уничтожают опухолевые клетки.
В зависимости от цели и времени проведения по отношению к другим методам лечения (хирургического, лучевого), а также стадии рака молочной железы различают разные типы химиотерапии.
Неоадьювантная химиотерапия (НАХТ). Проводится перед операцией в рамках комбинированного лечения, когда операция запланирована (при исходно операбельном раке), или предполагается (при первично неоперабельном раке), что под воздействием химиотерапии опухоль перейдет в операбельное состояние. НАХТ назначается при местнораспространенном раке и в ряде случаев при раннем раке молочной железы.
Еще одна цель неоадъювантной химиотерапии — оценить чувствительность рака к противоопухолевому лечению. После химиотерапии проводится операция, а во время гистологического исследования оценивается реакция опухоли на предшествующее лечение.
Лечебная химиотерапия. К сожалению, не все случаи рака молочной железы диагностируются на ранней стадии, и нередко на момент установления диагноза у пациента уже присутствуют отдаленные метастазы. В этом случае основным методом лечения является химиотерапия. Хирургическое лечение первичной опухоли в молочной железе на этой стадии не проводится, за исключением так называемых санационных операций (связанных с кровотечением или нагноением). Задача лечебной химиотерапии — максимальное продление жизни пациента и поддержка качества жизни, в связи с чем этот тип химиотерапии также называют паллиативной. Однако во многих случаях с ее помощью может быть достигнута длительная ремиссия и даже полный ответ.
В клинике Рассвет при химиотерапии рака молочной железы можно воспользоваться услугой гипотермии кожи головы с помощью специального холодового шлема. Это позволяет сохранить волосы у большинства пациенток и снизить дискомфорт от последствий лечения, что крайне важно с точки зрения качества жизни и психоэмоционального состояния. Данная процедура используется также при других видах рака, но для рака молочной железы были получены самые убедительные результаты. Это стало причиной включения гипотермии в международные клинические рекомендации по лечению РМЖ.
Рак молочной железы был первой болезнью, для лечения которой стали применять таргетную терапию — относительно новый вид лечения, направленный на конкретные клеточные мишени.
Помимо анти-HER2-терапии, сегодня используются и другие клеточные мишени. Среди наиболее изученных — так называемые циклинзависимые киназы CDK4/6, ингибирование которых позволяет получить впечатляющие результаты у женщин с метастатическим гормоноположительным, HER2-негативным раком молочной железы.
В случаях, когда опухоль является гормоночувствительной, то есть экспрессирует на поверхности клеток рецепторы эстрогена и прогестерона (люминальный А и люминальный В подтипы), применяется терапия, направленная на устранение эстрогенов из организма.
Почему это важно? Эстроген (главный женский половой гормон), помимо прочего, имеет в качестве одного из органов-мишеней молочную железу, заставляя ее клетки делиться и преумножаться, что в свою очередь стимулирует рост опухолевых клеток.
Как работает гормонотерапия рака молочной железы? Существует несколько типов препаратов, воздействующих на разные звенья. Блокирование рецепторов к эстрогену на поверхности раковых клеток осуществляется с помощью антиэстрогеновых препаратов. Таким образом клетки не реагируют на эстрогены в крови.
У женщин с гормоночувствительным раком молочной железы в пременопаузе, то есть с сохранной функцией яичников, рекомендуется овариальная супрессия. Ранее это достигалось с помощью овариэктомии (удаление яичников) или воздействием лучевой терапии на яичники (прекращение их функции). В современной онкологии принято использовать медикаментозное выключение яичников (блокирование выработки эстрогенов) с помощью специальных гормонов — агонистов гонадотропин-рилизинг факторов. Эффект метода обратим, и женщина после такого лечения может вернуться к детородной функции. В клинике Рассвет мы применяем только медикаментозный способ овариальной супрессии.
Вид терапии, который используются у пациенток с раком молочной железы в качестве профилактики и лечения так называемых костных событий (метастазов в кости, переломов костей).
Рак молочной железы (в случаях, когда речь идет о прогрессировании или изначально метастатической форме) наиболее часто метастазирует в кости скелета. Это связывают со схожестью структуры ткани молочной железы и костного мозга — метастазы находят более благоприятную среду, максимально похожую на ту, где они появились изначально. При этом формируется порочный круг, результатом которого является разрушение костной ткани с формированием полостей (пустот) — остеокластических метастазов. Именно в этой зоне может возникнуть перелом, что обычно проявляется выраженным болевым синдромом и ограничением в движении. Очень часто это становится причиной прекращения лечения, в связи с нетранспортабельностью пациента.
Задача остеомодифицирующей терапии — прекращение разрушения костной ткани.
Остеомодифицирующая терапия проводится не только при метастазировании рака. Ее препараты широко используются в лечении остеопороза (снижение минерализации костной ткани), которая возникает у большинства женщин в постменопаузе. Но интересно другое. Эта группа препаратов показала свою эффективность в качестве профилактики костных событий у женщин, получивших радикальное лечение рака молочной железы. Как показали недавно проведенные исследования, подобный подход не только улучшает состояние костной ткани, которое неизбежно страдает на фоне гормональной терапии, но и улучшает показатели общей и безрецидивной выживаемости.
Лучевая терапия (ЛТ) является одним из 3 основных методов лечения онкологических заболеваний. Метод основан на воздействии радиации на облучаемые участки тела, в результате чего опухолевые клетки повреждаются и погибают. Чем больше доза радиации, тем выше повреждение.
В настоящий момент для лучевой терапии все чаще используются линейные ускорители электронов. Менее распространены (уходят в прошлое) гамма-терапевтические установки и рентгенотерапия. Это позволяет лучше контролировать дозовое распределение между мишенью (облучаемая зона) и нормальными тканями, через которые неизбежно проходят лучи. Современные аппараты позволяют подводить максимальное облучение к опухоли, учитывая ее конфигурацию, и минимально повреждать окружающие ткани. Для этого используются специальные поворотные излучатели, которые модулируют пучок особым образом (IMRT).
Лучевая терапия используется в большинстве случаев лечения рака молочной железы в рамках комбинированного или комплексного лечения.
Основная роль ЛТ в лечении рака молочной железы — закрепление эффекта лечения за счет облучения места, где ранее была опухоль (выполняется после операции) и зон регионарного лимфооттока (подмышечные, над- и подключичные зоны, внутригрудные лимфатические узлы).
Таким образом лучевая терапия в основном снижает риск развития локального и регионального (то есть на месте опухоли и в регионарных зонах) рецидива, но может использовать в случае отдаленного метастазирования с паллиативной целью. Так, при поражении метастазами позвоночника проводится облучение пораженных отделов, чтобы снизить риск перелома.
Клиника Рассвет работает с надежными и проверенными центрами лучевой терапии, а их доктора, лучевые терапевты являются частью нашей мультидисциплинарной команды по лечению онкологических заболеваний.
Лечение рака молочной железы в клинике Рассвет
Лечение рака молочной железы — сложный, комбинированный процесс, требующий глубокого погружения в историю конкретного пациента, с учетом множества индивидуальных особенностей. Врачи клиники Рассвет обладают всеми необходимыми компетенциями, опытом зарубежных стажировок, что позволяет использовать самые передовые средства для лечения этого заболевания.
Читайте также:

