Отдел иммунологии и онкологии
Результатом становится персонализированная медицина – персонализированные протоколы лечения рака, разработка лекарств и противоопухолевых вакцин, целевая идентификация и целевая ратификация, фенотипические исследования поведения клеточных сообществ в опухолевом микроокружении и др.
Основные направления научной деятельности
- Исследование молекулярно-генетических и иммунобиологических свойств опухолевой ткани, в том числе метастатических образований, на базе уникального оборудования с целью создания принципиально новых технологий.
- Исследование и разработка биотехнологических принципов и технологических решений создания эффективных и безопасных способов терапии злокачественных новообразований.
- Разработка математических моделей и программно-алгоритмического обеспечения оценки противоопухолевого иммунобиологического ответа у больных злокачественными новообразованиями в процессе изучения эффективности новых методов системной терапии.
- Исследование и моделирование опухолевого микроокружения, функций стволовых раковых клеток, субпопуляций клеток иммунной системы, фибробластов, эпителиальных клеток и др.
- Исследование иммунобиологического и метаболического гомеостаза у больных злокачественными новообразованиями на уникальном высокотехнологичном оборудовании с целью разработки новых способов персонализированной медицины.
- Изучение, разработка и создание клеточных препаратов с принципиально новыми противоопухолевыми свойствами на основе достижений молекулярной генетики и клеточной иммунобиологии.
Основные научные достижения:
- Разработаны и внедрены новейшие высокотехнологичные методы приготовления противоопухолевых вакцин, вакцин для лечения рассеянного склероза, оценки клинической и лабораторной эффективности вакцинотерапии.
- Особое внимание уделено:
- методическим особенностям получения первичных культур и клеточных линий злокачественных новообразований человека;
- иммунологической и молекулярно-биологической характеристике;
- методам трансфекции иммунореактивных генов в опухолевые клетки;
- дифференцировке антиген-специфических костномозговых дендритных клеток;
- получению клона антиген-специфических цитотоксических Т-лимфоцитов;
- разработке дозы, режима и способа вакцинотерапии;
- оценке клеточного и гуморального поствакцинального (антиген-специфического) иммунного ответа;
- использованию терапевтических вакцин в сочетании с иммунологическими адъювантами, низкими дозами цитостатиков, плазмаферезом, фотодинамической терапией;
Институт стал одним из основных центров развития противоопухолевой вакцинотерапии в России.
За время работы отдела:
- пролечено более 500 больных злокачественными новообразованиями;
- обоснованы и разработаны современные методы вакцинотерапии;
- изучено влияние на отдельные звенья иммунной системы, а также клиническая эффективность методов вакцинотерапии на основе костномозговых дендритных клеток, немодифицированных опухолевых клеток с иммунологическими адъювантами, геномодифицированных опухолевых клеток;
- произведена оценка токсичности и клинической эффективности различных методов вакцинотерапии;
- определены показания и противопоказания к проведению различных вариантов вакцинотерапии;
- определено место современной вакцинотерапии в комплексном лечении больных меланомой кожи и раком почки.
Сотрудниками Научного отдела иммунологии установлено, что:
Доктор медицинских наук Балдуева Ирина Александровна является основателем метода онкоиммунологии (дендритной вакцины) в РФ. Разработка и введение в клиническую практику медикаментов, стимулирующих защитную способность организма для противодействия злокачественному процессу, позволило онкоиммунологии стать одним из наиболее перспективных методов развития в области терапии онкологических заболеваний, несмотря на то, что раньше в ней сомневались даже доктора. Деятельность Балдуевой Ирины Александровны направлена на иммунотерапию меланомы, саркомы, молочной железы, легких и печени.
Кому назначают клеточную иммунотерапию?
Иммунная защита организма действует в постоянном режиме, защищая от определённых чужеродных элементов – будь то вирус или собственные клетки тела, подвергшиеся мутации и превратившиеся в злокачественные клетки опухоли. Однако запущенный процесс онкологии, а также влияние химио-лучевой терапии приводит к тому, что иммунитет пациента существенно ослабевает, нарушаются звенья иммунной системы. Все это препятствует организму противостоять развитию опухолевого процесса.
В клинике проводится несколько тестирований противоопухолевых вакцин, созданных командой специалистов, управление и контроль за тестированием которых осуществляет Ирина Балдуева. При первом обращении пациента в онкоцентр рекомендуется проведение консультации у онкоиммунолога. Помимо этого, следует сдать определенный перечень анализов, среди которых: кровь на биохимию: печеночные пробы, ГГТ, билирубин, креатинин, расширенный иммунный статус.
Контроль лимфоцитов
Количество лимфоцитов в крови у человека играет большую роль, поскольку оно оказывает влияние на быстроту реакции организма, а также на последующую борьбу с патологией. Большее значение имеет именно численность зрелых лимфоцитов, поскольку они, в первую очередь, приступают к борьбе.
Для выяснения необходимости иммунотерапии следует пройти очную консультацию. Прием Ирина Александровна Балдуева проводит только по предварительной записи и при наличии необходимых анализов.
Для каждого пациента подбирается определенная вакцина
Основным направлением деятельности И.А. Балдуевой является изучение иммуногенности недоброкачественных опухолей и их метастазов. Для определения того, насколько эффективным может оказаться влияние иммунной системы на злокачественный процесс, и подготовки наиболее подходящей вакцины, эксперты внимательно исследуют опухолевые клетки пациента.
Размельчив полученный биологический материал при помощи специальной машины, специалисты стараются максимально подробно дать характеристику опухоли, выявив все свойства её поведения, а также факторы, которые она продуцирует. Процесс воссоздания клеток иммунной системы, способен возвратить к жизни уже ни на что не реагирующую иммунную систему.
Противораковая вакцина разрабатывается в индивидуальном порядке, за основу берутся собственные клетки крови пациента. Далее клетки вводятся в подкожно или в опухолевые ткани. Задача – восстановить работу иммунной системы, клетки которой (Т- лимфоциты), распознав врага, мгновенно приступят к уничтожению. Доктор, в свою очередь, будет наблюдать за развитием противоопухолевого иммунного ответа в организме пациента.
Для подбора эффективного метода лечения вы можете обратиться за
- методы инновационной терапии;
- возможности участия в экспериментальной терапии;
- как получить квоту на бесплатное лечение в онкоцентр;
- организационные вопросы.
После консультации пациенту назначается день и время прибытия на лечение, отделение терапии, по возможности назначается лечащий доктор.
Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева – уникальное государственное научно-исследовательское, лечебное учреждение, а также образовательная база ряда ведущих ВУЗов страны.
Показать полностью… Здесь гармонично сочетаются многолетний опыт врача с инновациями в области медицины, науки и техники.
НМИЦ ДГОИ им. Дмитрия Рогачева был создан в 1991 году, как НИИ детской гематологии.
В Центре в условиях круглосуточного и дневного стационара, а также в амбулатории оказывается специализированная высокотехнологичная медицинская помощь детям всех субъектов Российской Федерации в возрасте от 7 дней до 18 лет.
В НМИЦ ДГОИ им. Дмитрия Рогачева осуществляется разработка и внедрение в практику единых международнопризнанных протоколов лечения болезней крови, иммунной системы злокачественных новообразований и других тяжелых заболеваний детского возраста.
В клинике проходят уникальные операции по трансплантации клеток костного мозга от родственных и неродственных доноров, проживающих по всему миру.
Больные дети, прибывающие в Центр Дмитрия Рогачева из других регионов страны и проходящие лечение в дневном стационаре, проживают в пансионате, входящий в архитектурный комплекс на улице Саморы Машела. Одновременно в комфортабельных номерах пансионата могут разместиться 132 пациента в сопровождении мамы или папы.
Также жителям Москвы доступны услуги по диагностике и консультации врача по широкому спектру заболеваний в консультационно-поликлиническом отделении Центра.
НМИЦ ДГОИ им. Дмитрия Рогачева располагает современным лечебным и диагностическим оборудованием, применяются высокоэффективные лекарственные средства.
Центр имени Дмитрия Рогачева активно сотрудничает с региональными и федеральными медицинскими организациями. При непосредственном участии ведущих специалистов научно-клинического центра Дмитрия Рогачева по всей России создаются десятки региональных лечебных учреждений, практикующих в области детской гематологии, онкологии и иммунологии.
- Записи сообщества
- Поиск



Сегодня в НМИЦ ДГОИ им. Дмитрия Рогачева состоялся доклад Генерального директора Центра Галины Анатольевны Новичковой об итогах работы Центра за 2019 год.
Огромный труд проделан врачами и учеными центра для спасения наших маленьких пациентов, мы не останавливаемся, а движемся только вперёд.

О том, как новый корпус Центра Дмитрия Рогачева поможет тяжелобольным детям смотрите в специальном репортаже

В НМИЦ ДГОИ им. Дмитрия Рогачева стартовал проект онлайн-трансляций операций и лекций
С 2018 года #Центр им. #ДмитрияРогачева перешел на обновленный международный протокол лечения опухолей почек у детей – SIOP RTSG (Umbrella). Это международный протокол, который стандартизирует лечение всех видов злокачественных поражений почек у детей, в нем сформулированы показания к органосохраняющим и #миниинвазивным вмешательствам.
Показать полностью…
Группа торакоабдоминальной хирургии отделения онкологии и детской хирургии центра представила современный взгляд на минимально инвазивные, в том числе лапароскопические, #операции у #детей.
Принято решение продемонстрировать эти наблюдения, потому что лапароскопические (через небольшие проколы) и малоинвазивные хирургические операции длительное время остаются предметом дискуссий.
Операцию выполняли специалисты НМИЦ ДГОИ им. Дмитрия Рогачева: #ДмитрийАхаладзе, кандидат медицинских наук, руководитель группы торакоабдоминальной хирургии отделения онкологии и детской хирургии, и Николай Меркулов, врач-детский хирург, уролог.
Во время трансляции были освещены технические особенности, показания и противопоказания к операции, а также даны ответы на вопросы зрителей.
По словам хирургов, детская онкология отличается от взрослой – у детей чаще встречаются эмбриональные опухоли. Сейчас малоинвазивная хирургия открывает новые горизонты в медицине, помогая совершенствовать методы лечения детей с онкологическими заболеваниями. Такая трансляция рассчитана на обмен опытом между врачами – хирургами и онкологами в вопросе детской онкохирургии. Подобные мероприятия планируется проводить на регулярной основе.
Не дозвонились? Поможем найти врача в Москве. Приём в ближайшее время, скидки до 30%
- Акции
- Новости
- Видео
- Отзывы
Преимуществами метода цитокинотерапии являются:
- Избирательное воздействие на злокачественные клетки (эффективность метода составляет 30-60% в зависимости от стадии заболевания, локализации опухоли, морфологии, состояния пациента и т.д.);
- профилактика рецидивов и метастазов опухоли;
- синергичный противоопухолевый эффект в комбинации с химиопрепаратами или лучевой терапией (эффективность при сочетании двух методов увеличивается на 15-20%);
- отсутствие токсического действия и применение у пациентов с выраженной сопутствующей патологией (сердечно-сосудистой, почечной, печеночной и т.д.)
- снижение побочных эффектов традиционной противоопухолевой химиотерапии (угнетения кроветворения, иммуносупрессии), коррекция общетоксических эффектов;
- простота введения препаратов – подкожно и внутримышечно (лечение проводится амбулаторно);
- профилактика и лечение сопутствующих инфекционных осложнений. Цитокинотерапия – это щадящее лечение, при котором здоровые клетки не повреждаются.
Широкие возможности для цитокинотерапии открылись при появлении новых, более эффективных цитокинов - отечественных препаратов РЕФНОТ® и ИНГАРОН®, которые являются лекарством прямого противоопухолевого действия, эффективно стимулируют противоопухолевый иммунитет и отличаются высоким лечебным эффектом и низкой токсичностью. Данные препараты прошли клинические испытания и получили официальное разрешение Министерства здравоохранения РФ для применения в лечении злокачественных новообразований. Сегодня Клиника онкоиммунологии и цитокинотерапии занимается лечением и реабилитацией людей больных раком, даже в тех случаях, когда пациенту отказывают в лечении онкодиспансеры. Как правило, таких пациентов можно и нужно лечить как химиотерапией, так и цитокинотерапией.
В клинике занимаются обследованием и лечением пациентов с такими диагнозами, как:
- опухоли желудочно-кишечного тракта
- рак легких
- рак молочной железы
- опухоли женской репродуктивной системы
- опухоли головы и шеи
- гемобластозы
- меланома, плоскоклеточный рак кожи, базалиома
- саркомы костей и мягких тканей
Услуги Клиники онкоиммунологии и цитокинотерапии:
- Онколог
- Онкопсихолог
- Иммунолог
- Мамолог
- Гематолог
- Эндокринолог
- Флеболог
- Невролог
- Кардиолог
- ЭхоКГ
- ЭКГ с расшифровкой
- Гинеколог
- Уролог
- Лабораторные исследования
- УЗИ
Отзывы Клиника онкоиммунологии и цитокинотерапии
Здравствуйте. Очень расстроена посещением этой клиники, после единственного первичного приёма!
Попытаюсь объяснить. Шесть лет я сражаюсь с этой ЗАРАЗОЙ под названием онкология (ненавижу слово РАК!).
Не собираюсь утомлять и рассказывать свою историю, ни кому это не интересно, просто хочу сказать, что прежде всего это БЕЗУМНО тяжело в моральном плане! От сознания, что это НАВСЕГДА, что не можешь довериться какому то одному врачу, потому что у каждого своё мнение и никаких гарантий - отговорка для подстраховки!
Процесс записи на приём в эту клинику был намного серьёзнее, чем он сам. Я привезла анализы, снимки(а всё это недёшево стоит!) когда врач спросила о цели моего приезда, я ответила, что хочу услышать мнение специалиста. Она вскользь пробежала глазами по бумагам и поведала мне о том, о чём я давно знаю. Потом за 2500 руб(столько стоит приём, но дело не в деньгах) она прорекламировала ваш препарат, нисколько не заинтересовав в его применении лично меня! Да-да, ЛИЧНО меня! Вы занимаетесь серьёзной областью медицины, где нужен индивидуальный подход к каждому пациенту(ведь у каждого своя история), начиная с первичного приёма! Сложилось впечатление, что абсолютно всё равно, вернётся к вам человек или нет. Вы не проводили статистику?
Во-первых, отзыв касается только одного врача(даже не помню имени отчества), ни в коем случае не хочу обидеть остальных.
Во-вторых, ничего не говорю о действии препарата(может для меня это вообще панацея), не пробовала.
И кто-то скажет, тогда зачем все эти излияния? Да потому что для меня это ОЧЕНЬ важно! Уверена, что со мной согласятся многие, даже готовые платить деньги!
Всем огромных сил, терпения, веры и крепкого здоровья!
Центр детской гематологии, онкологии и иммунологии Рогачёва , Москва: 211 врачей, 120 отзывов о клинике и ее врачах, цены от 180 до 19000 руб., телефон , официальный сайт, 21 место в рейтинге НИИ Москвы (60/100), адрес - Москва, ул. Саморы Машела, д. 1 .

Врачи центра детской гематологии, онкологии и иммунологии Рогачёва





Информация
Описание
Центр детской гематологии, онкологии и иммунологии Москвы – уникальное научно-исследовательское, образовательное и лечебное учреждение, открытое в 1991 году. Центр осуществляет разработку и внедрение в практику протоколов лечения заболеваний крови, злокачественных новообразований, болезней иммунной системы и других тяжелых патологий детского возраста. В клинике центра проводят уникальные операции по трансплантации клеток костного мозга.
В структуре ДГОИ им.Д.Рогачева функционируют следующие подразделения: научные отделы, административно-управленческие отделы, отдел клинической онкологии, отдел хирургии детей и подростков, отдел интенсивной терапии и ТГСК (трансплантации гемопоэтических стволовых клеток), отдел гематологии/онкологии подростков и молодежи, отдел лучевой диагностики, отдел лучевой терапии, отдел детской гематологии и редких заболеваний, отдел клинической иммунологии, отдел молекулярной и экспериментальной медицины.
В центре детской гематологии, онкологии и иммунологии Рогачёва предоставляют следующие виды медицинской помощи:
диагностическую помощь: лучевую диагностику (магнитно-резонансную компьютерную томографию, ультразвуковые, радионуклидные и рентгенологические исследования), функциональную диагностику, лабораторную диагностику (широкий спектр исследований в т.ч. иммунологические, молекулярные, бактериологические, вирусологические, общеклинические, генетические, микробиологические и биохимические исследования);
амбулаторно-поликлиническую помощь: консультации врачей-специалистов – педиатра, онколога, гематолога, невролога, стоматолога, нефролога, акушера-гинеколога, гастроэнтеролога, хирурга, эндокринолога, уролога-андролога, дерматовенеролога, кардиолога, психолога, офтальмолога, аллерголога-иммунолога, отоларинголога;
стационарную помощь по профилям: гематология, хирургия, педиатрия, онкология, онкогематология, иммунология, лучевая терапия, трансплантация гемопоэтических стволовых клеток.

Адоптивная иммунотерапия - прорывная запатентованная методика лечения рака с использованием цитокин-активированных лимфоцитов, естественных киллеров (NK-клетки).

Эксклюзивная уникальная методика
Применима на всех этапах лечения
Эффективна в случае диссеминированного процесса

Адоптивная иммунотерапия – это персонализированный вид неспецифической клеточной иммунотерапии активированными лимфоцитами. При данной методике иммунные клетки забираются из периферической крови пациента и обрабатываются цитокинами для повышения их функциональной активности. Затем клетки возвращаются пациенту, что приводит к активации различных звеньев иммунитета, усилению иммунного ответа в отношении злокачественной опухоли, преодолению существующей опухолевой иммуносупрессии, снижению выраженности болевого синдрома, улучшению качества жизни онкологического больного.
NK-клетки (естественные клетки – киллеры) - это особая популяция клеток крови, способная уничтожить опухолевую клетку (развивается так называемый цитотоксический эффект). Данные клетки составляют не более 10-15% среди всех лимфоцитов. С использованием специальных методик количество NK-клеток может быть значительно увеличено и их введение пациенту позволяет добиться усиления противоопухолевого эффекта.
Благодаря запатентованной технологии – адоптивной иммунотерапии, проводится in vitro активация клеток иммунной системы (Т-клетки, NKT- лимфоциты, NK-клетки) с использованием цитокин-активированных лимфоцитов, естественных киллеров (NK-клетки).


Подготовкой к проведению адоптивной иммунотерапии служит детальное иммунологическое исследование – иммунограмма.
Процедура получения активированных клеток иммунной системы включает в себя следующие этапы:
- У больного/донора забирается венозная периферическая кровь;
- Из периферической крови в стерильных условиях выделяются мононуклеарные клетки;
- С учетом количества этих клеток они помещаются в полную питательную среду с добавлением IL-2 и IL-15 и инкубируются в течение 14 дней в термостате;
- Ежедневно осуществляется контроль эффективности роста и активации иммунных клеток в суспензионной культуре, проводится оценка морфологии клеточных культур.
5. Осуществляется контроль на стерильность препарата;
6. Оценивается жизнеспособность и функциональная активность клеток;
7. Каждые 72 часа культивирования часть суспензионных цитокин-активированных иммунных клеток в количестве от 2 до 10 млн собирается и вводится пацинту паравертебрально внутрикожно в 2-4 точки;
8. Введение клеток стандартно осуществляется на 3, 5, 7, 9 и 11 дни, далее лечение продолжается по индивидуальной схеме без длительных перерывов;
9. При необходимости часть активированных клеток помещается на хранение в жидкий азот (онкобиобанк).

Вопрос о назначении адоптивной иммунотерапии рассматривается в каждом случае индивидуально в составе консилиума врачей-специалистов. Проведение данного вида клеточной иммунотерапии возможно, как в амбулаторных условиях, так и в условиях стационара.
Клиника онкоиммунологии и цитокинотерапии является уникальным центром лечение онкологических заболеваний. Это единственное медицинское учреждение в Европе, которое занимается вопросами рака по инновационным методикам онкологичекской иммунологии и цитокинотерапии. Методика, на которой зиждется идеология центра – это терапия новообразований с помощью собственных сил и ресурсов организма больного. Активация протекторных систем организма человека происходит путем синтезирования особых белков – цитокинов. Такой подход позволяет не затронуть клетки, которые здоровые и не поражены опухолью. Метод цитокинотерапии позволил создать препараты РЕФНОТ и ИНГАРОН, которые активно применяются в антираковой терапии. Они низкотоксичные, высокоэффективны и значительно повышают защитные функции организма (противоопухолевый иммунитет). Цитокинотерапия – это мягкое, атравматичное для здоровых клеток лечении раковых новообразований.
Препараты ИНГАРОН и РЕФНОТ прошли клинические испытания и получили положительное заключение МЗ РФ для терапии онкологии.
Медицинский центр цитокинотерапии оказывают помощь больным, которые получили отказ в других онкоцентрах. Методика, которая применяется, позволяет эффективно лечить даже сложные стадии заболевания. Высокую эффективность показывает комбинированный метод из химиотрепаии и цитокинотерапии. Он дает возможность продлить качество жизни тяжелобольных, стабилизовать состояние пациентов средней тяжести заболевания.
Что лечат в клинике
- Опухоли половой системы женщин – матки (шейки и тела), вульвы, яичников.
- Опухоли желудочно-кишечного тракта – желудка, толстого кишечника, тонкого кишечника, пищевода, печени, поджелудочной железы.
- Новообразования костей (маркомы) и мягких тканей.
- Опухоли молочных желез.
- Опухоли мочевыводящей системы – почки, мочеточники, простата.
- Опухоли легких.
- Новообразования головы и шеи.
- Опухоли кожи (меланома, базалиома, низкодифференциальный плоскоклеточный рак).
- Гемобластозы.
Преимущества метода цитокинотерапии
- Профилактика рецидива болезни.
- Профилактика метстазирвоания.
- Профилактика сопутствующих заболеваний и пациента.
- Направленное действие на патогенные клетки с эффективностью в 30-60% (показатель зависит о нескольких факторов – стадии заболевания, состояния пациента, индивидуальной восприимчивости к терапии, морфологии, размещения новообразования).
- Отсутствие деструктивной составляющей при лечении у больных с другими патологиями или хроническими заболеваниями (сердечно-сосудистые заболевания, печеночная недостаточность, почечная недостаточность).
- Отсутствие токсического действия на системы и органы пациента.
- Минимизация негативного воздействия на организм после проведении химиотерапии (иммуносупрессия, нарушение процесса кроветворения).
- Коррекция токсического воздействия общего характера.
- Увеличение эффективности лечения на 15-20% при совмещение с другими методиками – лучевой или химиотерапией.
- Безболезненный и простой ввод лекарственных препаратов в организм пациента с помощью внутримышечных или подкожных инъекций.
Одной из частых причин того, что в онкоцентрах отказывают больным в применении химиотерапии является наличие у пациента других хронических заболеваний или проблем со здоровьем, как то – печеночная или почечная недостаточность, сердечно-сосудистые болезни. Однако, в современных клиниках Западной Европы, Канады и США применяются щадящие химиотерапевтические лекарства, которые подойдут даже для пациентов с сопутствующими заболеваниями. Именно их и применяют в клинике КОиЦ.
Такой подход позволяет добиться следующих результатов :
Применяемая в КОиЦ методика позволяет бороться со всеми видами онкологических заболеваний, кроме рака щитовидки и гематологических типов.
Кроме метода цитокинотерапии в клиники используют :
В клинике онкоиммунологии и цитокинотерапии работают опытные онкологи, кандидаты медицинских наук, доктора медицинских наук, врачи высшей категории. Все специалисты имеют опыт работы в ведущих онкоцентрах Российской Федерации, многие врачи проходили стажировку в европейских центрах. Некоторые онкологи являются действующими участниками мировых онкологических сообществ, имеют научные публикации, ведут активную работу над развитием онкологического дела в России.
Среди услуг центра - осмотр больных, консультация родственников, экспертное имение о плане лечения, заочные врачебные консилиумы, прием иногородних. Для больных и родственников работает помощь окнопсизологов.

- Об Институте
- Структура Института
- Научно-исследовательские подразделения
- О подразделении
- Исследования
- Результаты
- Достижения
- Продукты
- Услуги
- Сотрудники
- Публикации
- Проекты
- Контакты
- Файлы и документы
- Инструкции
Основной целью исследований Отдела является разработка технологий получения соединений для высоко точной диагностики и эффективной терапии социально значимых заболеваний, в первую очередь, онкологических, а также разработка подходов к направленной регуляции различных звеньев иммунной системы человека, в том числе, к иммунокоррекции аллергий и использованию стресс-индуцируемых протеинов для иммунодиагностики и иммунотерапии. В результате исследований будут заложены фундаментальные основы конструирования гибридных белков и мультифункциональных гибридных наноконструкций, предназначенных для диагностики и комплексного лечения рака с учетом молекулярного профиля заболевания, а также для иммунотерапии аллергий и других аутоиммунных заболеваний.
В рамках программы Отдела будут совершенствоваться новые направления, связанные с тераностикой онкологических и аутоиммунных заболеваний. Планируется получить целый ряд уникальных мультифункциональных гибридных наноконструкций, а также инновационных рекомбинантных белков для диагностики и терапии рака, которые трансформируются в коммерческие продукты в рамках тесного взаимодействия с Центром НТИ ИБХ РАН.
Для реализации стратегических направлений исследований будет запущена программа модернизации приборного парка лабораторий, входящих в Отдел. В рамках Отдела реализуются темы ГЗ №0101-2019-0027.
Избранные публикации (показать все)
Все публикации (показать избранные)
Петров Рэм Викторович
- Москва, ул. Миклухо-Маклая, 16/10 На карте
- ИБХ РАН, корп. , комн.
- Тел.:
- Эл. почта:petrov@pran.ru
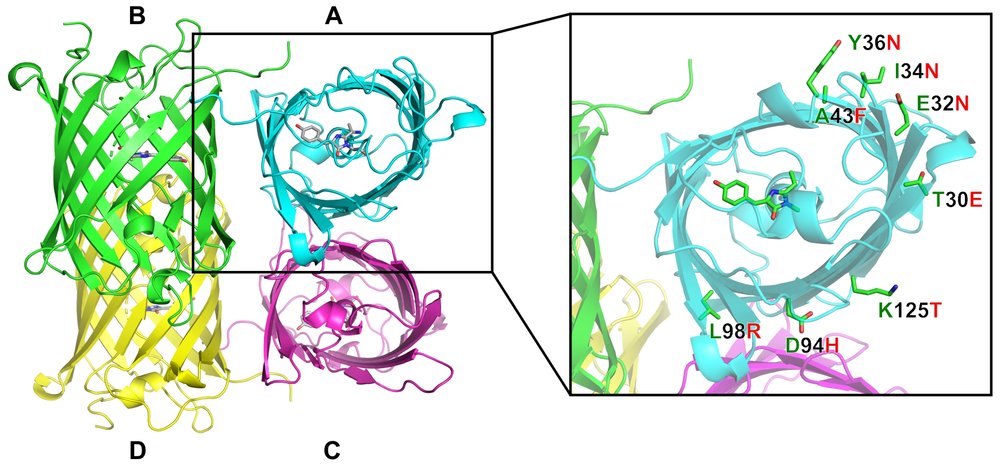
Изучены факторы, влияющие на превращение зеленого флуоресцентного белка в красный
![]()
На примере двух высокогомологичных флуоресцентных белков из Zoanthus sp. (zoanGFP и zoan2RFP) определены аминокислотные остатки (а.к.о.), участвующие в превращении белка с зеленой флуоресценцией (GFP) в красный флуоресцентный белок (RFP). Нами был проведен мутагенез zoanGFP, в результате которого внутренние аминокислоты (а.к.о.) оказались идентичными zoan2RFP. Однако полученный мутант zoanGFPmut претерпевал лишь частичное превращение в красную форму. С целью выяснения дополнительных факторов, влияющих на созревание RFP, с помощью сравнительной молекулярной динамики zoanGFPmut и zoan2RFP были выявлены а.к.о. на поверхности белка, потенциально влияющие на расположение и подвижность а.к.о. вокруг хромофора. Сайт-направленный мутагенез этих внешних а.к.о. подтвердил их важную роль в биосинтезе хромофора RFP.
- Pakhomov AA, Frolova AY, Tabakmakher VM, Chugunov AO, Efremov RG, Martynov VI (2020). Impact of external amino acids on fluorescent protein chromophore biosynthesis revealed by molecular dynamics and mutagenesis studies. J Photochem Photobiol B 206 , 111853
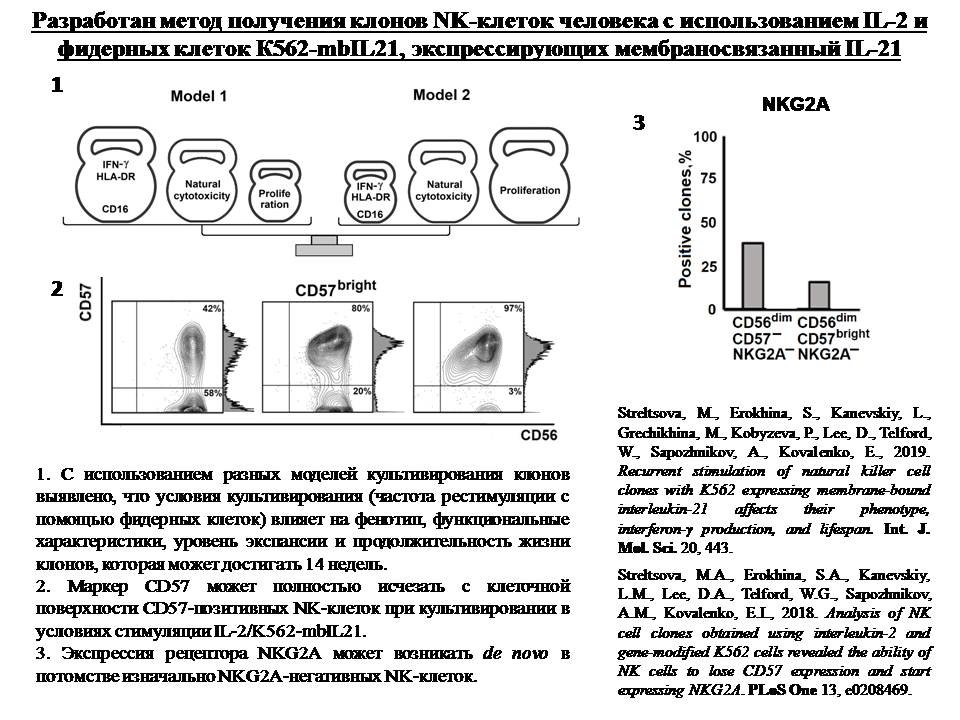
Разработан метод получения клонов NK-клеток человека с использованием IL-2 и фидерных клеток К562-mbIL21, экспрессирующих мембраносвязанный IL-21
![]()
1. С использованием разных моделей культивирования клонов выявлено, что условия культивирования (частота рестимуляции с помощью фидерных клеток) влияет на фенотип, функциональные характеристики, уровень экспансии и продолжительность жизни клонов, которая может достигать 14 недель.
2. Маркер CD57 может полностью исчезать с клеточной поверхности CD57-позитивных NK-клеток при культивировании в условиях стимуляции IL-2/K562-mbIL21.
3. Экспрессия рецептора NKG2A может возникать de novo в потомстве изначально NKG2A-негативных NK-клеток.- Streltsova MA, Erokhina SA, Kanevskiy LM, Grechikhina MV, Kobyzeva PA, Lee DA , Telford WG , Sapozhnikov AM, Kovalenko EI (2019). Recurrent Stimulation of Natural Killer Cell Clones with K562 Expressing Membrane-Bound Interleukin-21 Affects Their Phenotype, Interferon-γ Production, and Lifespan. Int J Mol Sci 20 (2) ,
- Streltsova MA, Erokhina SA, Kanevskiy LM, Lee DA , Telford WG , Sapozhnikov AM, Kovalenko EI (2018). Analysis of NK cell clones obtained using interleukin-2 and gene-modified K562 cells revealed the ability of. PLoS One 13 (12) , e0208469
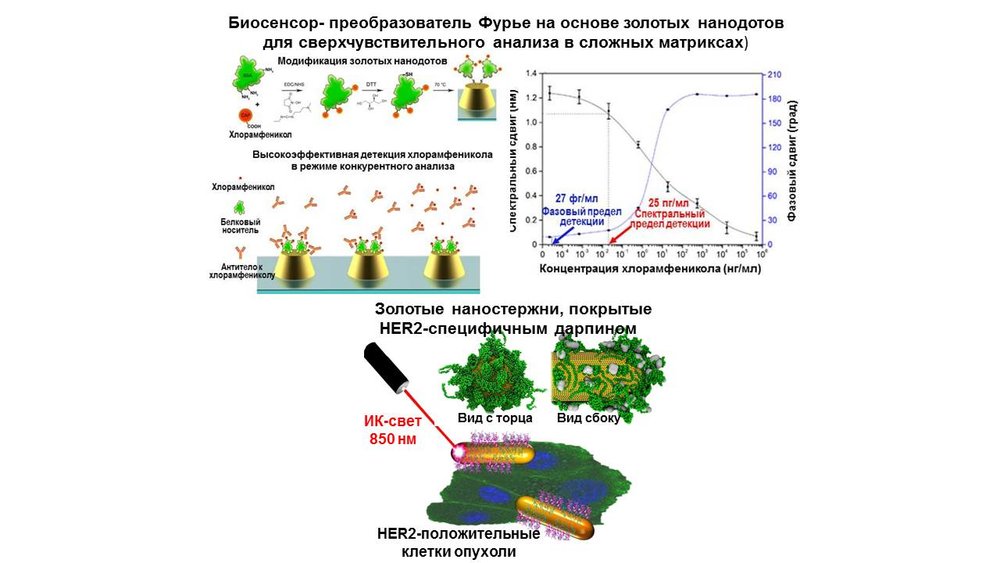
Золотые наноструктуры для биомедицинского применения.
![]()
- Proshkina G, Deyev S, Ryabova A , Tavanti F , Menziani MC , Cohen R , Katrivas L , Kotlyar A (2019). DARPin_9-29-Targeted Mini Gold Nanorods Specifically Eliminate HER2-Overexpressing Cancer Cells. ACS Appl Mater Interfaces 11 (38) , 34645–34651
- Kabashin AV , Kravets VG , Wu F , Imaizumi S , Shipunova VO, Deyev SM, Grigorenko AN (2019). Phase-Responsive Fourier Nanotransducers for Probing 2D Materials and Functional Interfaces. Adv Funct Mater 29 (26) ,
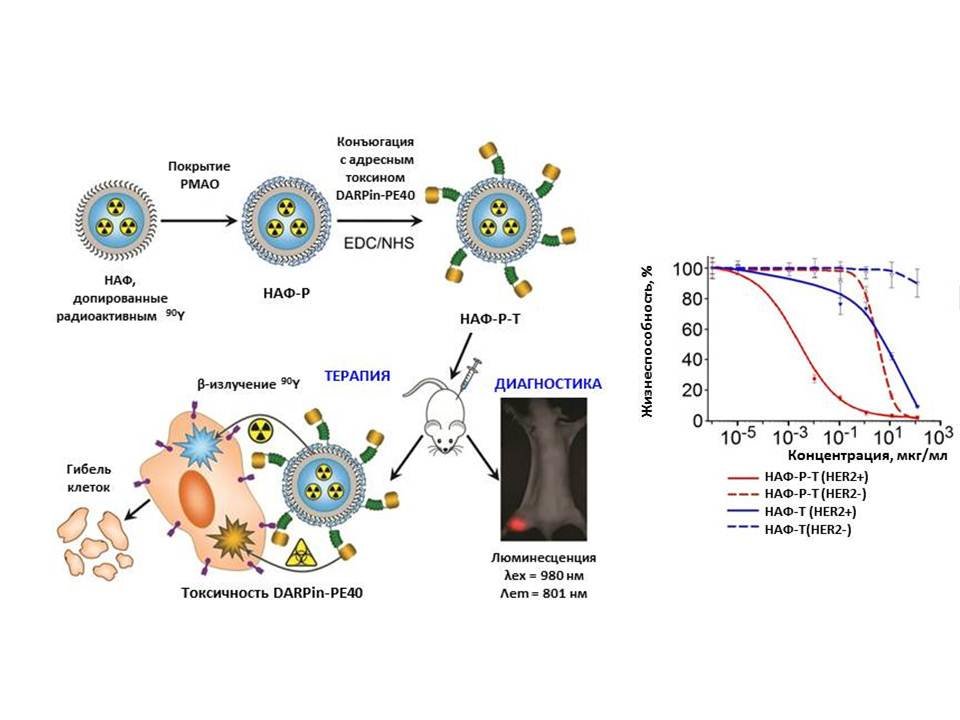
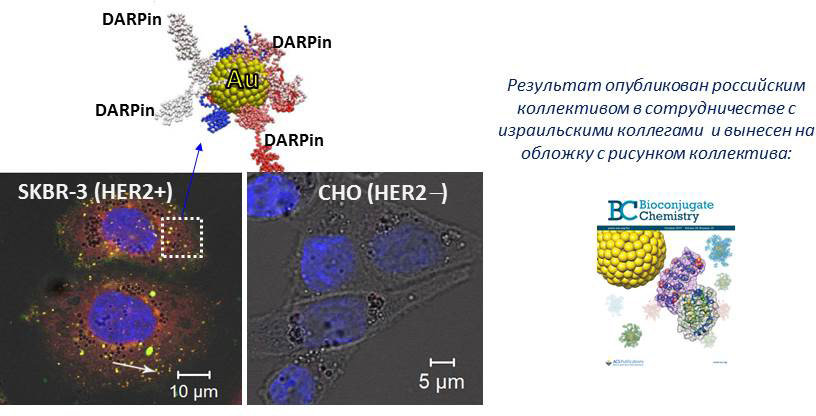
Гибридные наночастицы для комбинированной терапии и диагностики рака на основе антистоксовых нанофосфоров (НАФ), радиоактивного изотопа (90Y) и адресного токсина DARPin-PE40.
![]()
Для тераностики рака получены радиоактивные гибридные наночастицы НАФ-Р-Т, включающие антистоксовые нанофосфоры (НАФ), допированные радиоактивным изотопом иттрием-90, и фрагмент псевдомонадного экзотоксина А, снабженного искусственным адресным полипептидом DARPin, специфичным к опухолевому рецептору HER2. На мышах с привитой аденокарциномой молочной железы человека показаны высокая эффективность комбинированной терапии полученным комплексом и высокая контрастность изображения in vitro и in vivo. Показано, что синергический эффект одновременного применения радионуклида и адресного токсина с результирующим значением IC50 = 0.0024 мкг/мл в 2200 раз сильнее, чем при их раздельном применении. Результаты опубликованы в Proc. Natl. Acad. Sci. USA, 2018. Совместно с ННГУ им. Н.И. Лобачевского
- Shilova ON, Shilov ES , Lieber A , Deyev SM (2018). Disassembling a cancer puzzle: Cell junctions and plasma membrane as targets for anticancer therapy. J Control Release 286 , 125–136
- Guryev EL , Volodina NO , Shilyagina NY , Gudkov SV , Balalaeva IV , Volovetskiy AB , Lyubeshkin AV , Sen AV , Ermilov SA , Vodeneev VA , Petrov RV, Zvyagin AV, Alferov ZI , Deyev SM (2018). Radioactive (90Y) upconversion nanoparticles conjugated with recombinant targeted toxin for synergistic nanotheranostics of cancer. Proc Natl Acad Sci U S A 115 (39) , 9690–9695
- Sokolova EA, Vodeneev VA , Deyev SM, Balalaeva IV (2018). 3D in vitro models of tumors expressing EGFR family receptors: a potent tool for studying receptor biology and targeted drug development. Drug Discov Today 24 (1) , 99–111
- Shipunova VO, Zelepukin IV, Stremovskiy OA, Nikitin MP, Care A , Sunna A , Zvyagin AV, Deyev SM (2018). Versatile Platform for Nanoparticle Surface Bioengineering Based on SiO2-Binding Peptide and Proteinaceous Barnase, Barstar Interface. ACS Appl Mater Interfaces 10 (20) , 17437–17447
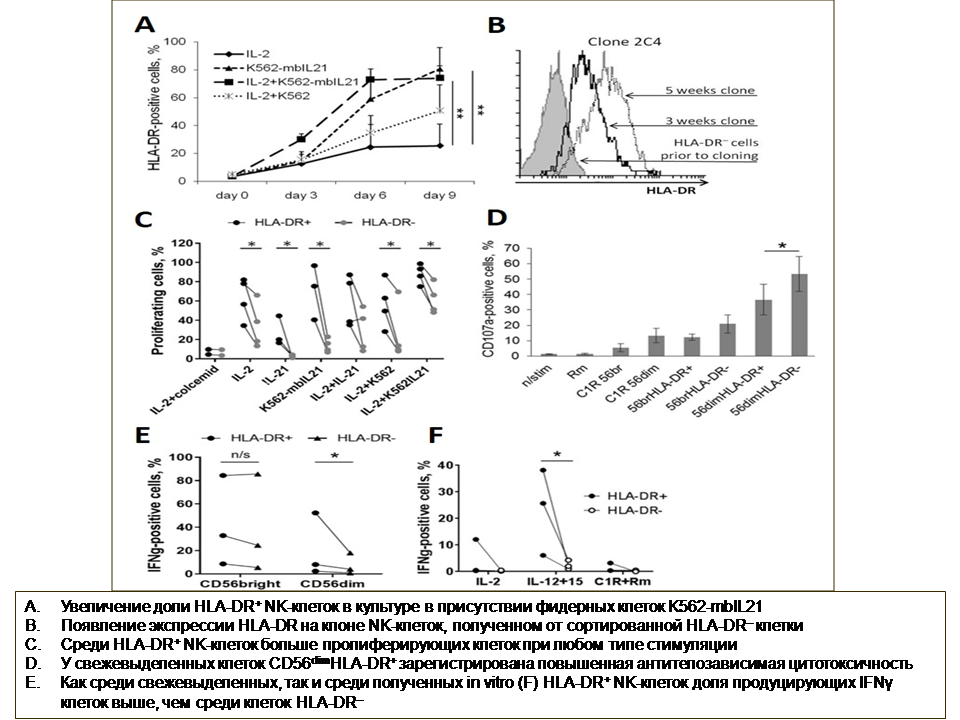
СУБПОПУЛЯЦИЯ HLA-DR-ПОЗИТИВНЫХ NK-КЛЕТОК ХАРАКТЕРИЗУЕТСЯ ВЫСОКОЙ ПРОЛИФЕРАТИВНОЙ И ФУНКЦИОНАЛЬНОЙ АКТИВНОСТЬЮ
![]()
С целью получения клинически значимых клонов цитотоксических лимфоцитов разработан метод экспансии NK-клеток с использованием облученных клеток K562-mbIL21, экспрессирующих мембраносвязанную форму IL-21. Охарактеризовано распределение в периферической крови и функциональные особенности NK-клеток HLA-DR+, преобладающих в популяциях NK-клеток, полученных при использовании данного метода стимуляции.
- Erokhina SA, Streltsova MA, Kanevskiy LM, Telford WG , Sapozhnikov AM, Kovalenko EI (2017). HLA-DR+NK cells are mostly characterized by less mature phenotype and high functional activity. Immunol Cell Biol 96 (2) , 212–228
Золотые гибридные наночастицы для фототермической терапии рака.
![]()
Сконструированы новые агенты для тераностики рака на основе гибридных наночастиц с различным механизмом действия. Наибольший интерес в качестве перспективных агентов для фототермической терапии рака представляют 5 нм наночастицы коллоидного золота, конъюгированные с HER2-специфичным адресным полипептидом неиммуноглобулиновой природы DARPin. Золотые наночастицы, покрытые белковой шубой, обладают высокой стабильностью в физиологических условиях, селективно связываются с HER2-положительными раковыми клетками и интернализуются посредством рецептор-опосредованного эндоцитоза.
Работа поддержана грантом РНФ №14-24-00106.- Deyev S, Proshkina G, Ryabova A , Tavanti F , Menziani MC , Eidelshtein G , Avishai G , Kotlyar A (2017). Synthesis, Characterization, and Selective Delivery of DARPin-Gold Nanoparticle Conjugates to Cancer Cells. Bioconjug Chem 28 (10) , 2569–2574
- Mironova KE, Khochenkov DA , Generalova AN, Rocheva VV , Sholina NV , Nechaev AV , Semchishen VA , Deyev SM, Zvyagin AV, Khaydukov EV (2017). Ultraviolet phototoxicity of upconversion nanoparticles illuminated with near-infrared light. Nanoscale 9 (39) , 14921–14928
- Semenova G, Stepanova DS , Dubyk C , Handorf E , Deyev SM, Lazar AJ , Chernoff J (2017). Targeting group i p21-activated kinases to control malignant peripheral nerve sheath tumor growth and metastasis. Oncogene 36 (38) , 5421–5431
- Sokolova E, Guryev E , Yudintsev A , Vodeneev V , Deyev S, Balalaeva I (2017). HER2-specific recombinant immunotoxin 4D5scFv-PE40 passes through retrograde trafficking route and forces cells to enter apoptosis. Oncotarget 8 (13) , 22048–22058
- Liang L , Lu Y , Zhang R , Care A , Ortega TA , Deyev SM, Qian Y , Zvyagin AV (2017). Deep-penetrating photodynamic therapy with KillerRed mediated by upconversion nanoparticles. Acta Biomater 51 , 461–470
Флуорогенный маркер для моментального окрашивания и визуализации мембран живых клеток
![]()
На основе органического соединения создан новый флуорогенный маркер для окрашивания мембран живых клеток. В отличие от существующих в настоящее время коммерческих клеточных маркеров, полученный флуорогенный маркер не флуоресцирует в водной среде, а приобретает флуоресценцию только при помещении его в неполярную среду, например, в клеточную мембрану. Это свойство позволяет моментально окрашивать клетки без последующей отмывки от несвязавшейся метки. Этот маркер может быть использован для визуализация живых клеток с помощью флуоресцентной микроскопии и в проточной цитометрии.
- Pakhomov AA, Deyev IE, Ratnikova NM, Chumakov SP, Mironiuk VB , Kononevich YN , Muzafarov AM , Martynov VI (2017). BODIPY-based dye for no-wash live-cell staining and imaging. Biotechniques 63 (2) , 77–79
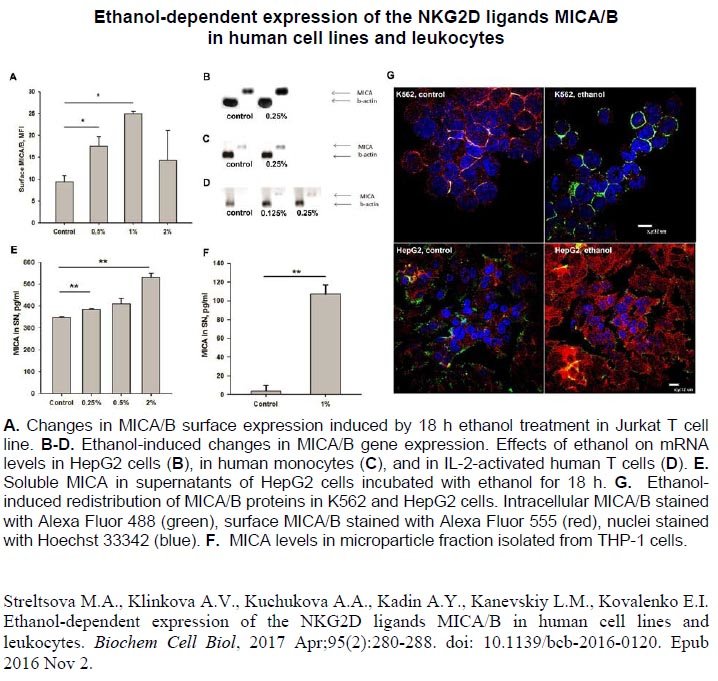
Этанол влияет на экспрессию стресс-индуцируемых белков MICA/B
![]()
Стресс-индуцируемые белки MICA и MICB осуществляют регуляцию цитотоксических лимфоцитов за счет взаимодействия с экспрессирумым этими клетками рецептором NKG2D. В мембраносвязанной форме белки MICA/B вызывают, как правило, активацию лимфоцитов, тогда как внеклеточные варианты MICA/B, часто выявляемые в сыворотке крови опухолевых больных, приводят к ингибированию их активности. Нами показано, что обработка клеток этанолом, в том числе в физиологических дозах, вызывает высвобождение MICA/B, как в растворимой форме, так и в составе микрочастиц, а также перераспределение внутриклеточного пула с перемещением внутриклеточных белков MICA/B на плазматическую мембрану. Другим важным аспектом действия этанола на клеточные линии и лейкоциты человеческой крови является индукция экспрессии генов и синтезе белков MICA/B. Изменения в экспрессии белков MICA/B, индуцированные этанолом, могут приводить к изменениям в функционировании NKG2D-позитивных лимфоцитов и, как следствие, других иммунных реакций при потреблении алкоголя.
- Streltsova MA, Klinkova AV, Kuchukova AA, Kadin AY , Kanevskiy LM, Kovalenko EI (2017). Ethanol-dependent expression of the NKG2D ligands MICA/B in human cell lines and leukocytes. Can J Biochem Cell Biol 95 (2) , 280–288
- Клинкова АВ, Кузьмина ЕГ , Абакушина ЕВ , Каневский ЛМ, Неприна ГС , Павлов ВВ , Коваленко ЕИ (2016). Циркулирующий белок MICА у больных злокачественными лимфомами. 18 (2) , 151–162
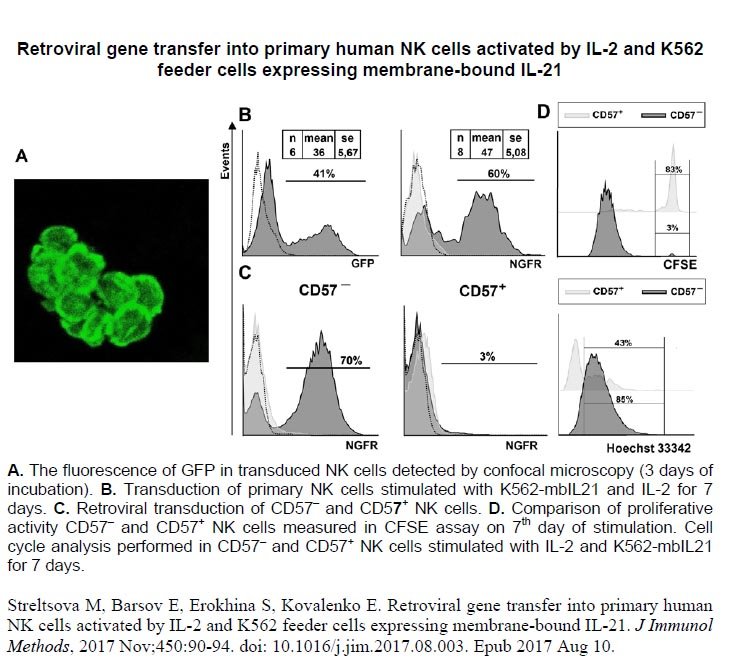
Ретровирусная генная трансдукция NK-клеток человека, активированных с помощью фидерных клеток K562, экспрессирующих мембраносвязанный интерлейкин-21
![]()
Натуральные киллеры, или NK-клетки, способны быстро распознавать и элиминировать опухолевые клетки, что делает их объектом потенциального терапевтического применения. Генетическая модификация NK-клеток может существенно увеличить их противоопухолевую активность. Однако, этому препятствуют определенные технические проблемы. Нами была осуществлена эффективная трансдукция человеческих NK-клеток ex vivo, активированных комбинацией IL-2 и облученных фидерных клеток K562, экспрессирующих на своей поверхности IL-21. Активированные NK-клетки экспрессировали активирующие рецепторы NKG2D, NKp30, CD16 и были высокопозитивны по HLA-DR. Полученная клеточная субпопуляция оказалась чувствительной к трансдукции с помощью ретровирусных векторов экспрессирующих как GFP, так и NGFR. Субпопуляция более зрелых CD57+ NK-клеток была в целом более устойчивой к ретровирусной трансдукции из-за слабой пролиферативной активности в ответ на данную стимуляцию. Полученные результаты могут быть использованы для дальнейшей работы по генетической инженерии NK-клеток с целью их потенциального противоопухолевого применения.
- Streltsova MA, Barsov E , Erokhina SA, Kovalenko EI (2017). Retroviral gene transfer into primary human NK cells activated by IL-2 and K562 feeder cells expressing membrane-bound IL-21. Immunotechnology 450 , 90–94
Показано, что на ранних стадиях формирования аллергии возможно прямое переключение В-клеток на синтез IgE антител
Анализ продукции IgG, IgA и IgE антител к двум аллергенам Der f 2 из клещей домашней пыли (КДП) и Alt a 1 из гриба A. alternata в сыворотках детей не старше 7 лет с аллергией показал повышение продукции только аллерген-специфических IgE антител, но не других классов, что свидетельствует о прямом переключении В-клеток на синтез IgE на ранних стадиях формирования аллергии. Отсутствие аллерген-специфических антител прочих классов показывает локальное формирование IgE продуцирующих клеток вне центральных и периферических органов иммунной системы.
- Svirshchevskaya E, Fattakhova G, Khlgatian S , Chudakov D, Kashirina E, Ryazantsev D, Kotsareva O, Zavriev S (2016). Direct versus sequential immunoglobulin switch in allergy and antiviral responses. Clin Immunol 170 , 31–38
В мышиной модели аллергического воспаления дыхательных путей продемонстрирован анти-воспалительный эффект экзогенных HSP70, свидетельствующий о комплексном иммунорегуляторном действии этих протеинов
В настоящее время появились свидетельства о том, что многие описанные в литературе иммуностимулирующие эффекты HSP70 обусловлены контаминацией препаратов рекомбинантного белка бактериальным эндотоксином. Тщательная элиминация примеси ЛПС может привести к инверсии иммуномодулирующего действия HSP70, к проявлению противовоспалительной, иммуносупрессирующей активности этого протеина. Проведенный нами в мышиной модели аллергического воспаления дыхательных путей анализ иммуномодулирующих эффектов экзогенного HSP70, выделенного из органов сингенных мышей, подтвердил возможность иммуносупрессирующего действия этого протеина, что свидетельствует о комплексном иммунорегуляторном действии внеклеточной формы HSP70.
Shevchenko M.A., Troyanova N.I., Servuli E.A., Bolkhovitina E.L., Fedorina A.S., Sapozhnikov A.M. Study of immunomodulatory effects of extracellular HSP70 in a mouse model of allergic airway inflammation. Biochemistry (Moscow), 2016, Vol. 81, No. 11, pp. 1384-1395.
Охарактеризована локализация положительно- и отрицательно заряженных наночастиц хитозана в опухолевых клетках
Совместно с Институтом биоинженерии ФИЦ Биотехнологии РАН, Москва
На примере разнозаряженных производных хитозана и наночастиц на их основе показано, что положительно заряженные производные транспортируются в митохондрии клеток, а отрицательно заряженные – в лизосомы, что сопровождается нейтрализацией заряда хитозанов. Аккумуляция хитозанов с любым зарядом вызывает изменение потенциала и экзоцитоз митохондрий и лизосом, что не ассоциировано с гибелью клеток. Положительно заряженные производные хитозана и наночастицы на их основе можно использовать для разработки систем доставки лекарств для лечения патологий с дисфункцией митохондрий, а отрицательно заряженные – для доставки противоопухолевых препаратов.
- Научно-исследовательские подразделения
Читайте также: