Осуществить превращения с хлором
Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений
Cl2 -> HCl -> NaCl -> AgCl.
Укажите основные физические и химические свойства хлорида серебра. Приведите способы получения этого соединения.
Цепочка превращений:
Cl2 -> HCl -> NaCl -> AgCl.
В результате сгорания водорода в токе хлора или при взаимодействии этих веществ на свету происходит образование сложного соединения — хлороводорода:
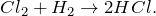
При действии на разбавленную соляную кислоту разбавленного раствора гидроксида натрия происходит образование средней соли хлорида натрия:
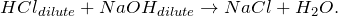
Получение хлорида серебра из хлорида натрия возможно несколькими способами: путем смешения насыщенных растворов нитрита серебра и хлорида натрия (1), а также разбавленного раствора хлорида натрия с нитратом серебра (2):
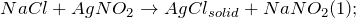
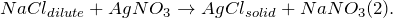
Хлорид серебра разлагается на свету с образованием металлического серебра:
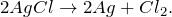
Реагирует с концентрированными растворами щелочей, гидратом аммиака.
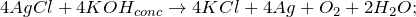
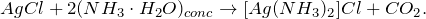
Переводится в раствор за счет комплексообразования.
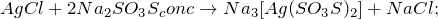
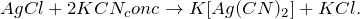
При сплавлении с карбонатом натрия (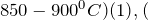
> 324^<0>C$) (2):
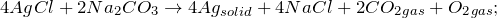
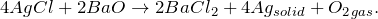
Хлорид серебра получают по реакциям обмена, сокращенное ионное уравнение которых соответствует указанному ниже:
Хлор — элемент 3-го периода и VII А-группы Периодической системы, порядковый номер 17. Электронная формула атома [10Ne ]3s 2 Зр 5 , характерные степени окисления 0, -1, + 1, +5 и +7. Наиболее устойчиво состояние Cl -1 . Шкала степеней окисления хлора:
+ 1 – Cl2O , ClO — , HClO , NaClO , Ca(ClO)2
— 1 – Cl — , HCl, KCl , PCl5
Хлор обладает высокой электроотрицательностью (2,83), проявляет неметаллические свойства. Входит в состав многих веществ — оксидов, кислот, солей, бинарных соединений.
В природе — двенадцатый по химической распространенности элемент (пятый среди неметаллов). Встречается только в химически связанном виде. Третий по содержанию элемент в природных водах (после О и Н), особенно много хлора в морской воде (до 2 % по массе). Жизненно важный элемент для всех организмов.
Хлор С12 . Простое вещество. Желто-зеленый газ с резким удушливым запахом. Молекула Сl2 неполярна, содержит σ-связь С1-С1. Термически устойчив, негорюч на воздухе; смесь с водородом взрывается на свету (водород сгорает в хлоре):
Хорошо растворим в воде, подвергается в ней дисмутации на 50 % и полностью — в щелочном растворе:
Хлор очень сильный окислитель по отношению к металлам и неметаллам:
Сl2 + РЬ→PbCl2 (300 °С)
Реакции с соединениями других галогенов:
Качественная реакция — взаимодействие недостатка СL2 с КI (см. выше) и обнаружение йода по синему окрашиванию после добавления раствора крахмала.
Получение хлора в промышленности:
2NаСl (расплав)→ 2Nа + Сl2 (электролиз)
2NaCl+ 2Н2O→Н2↑ + Сl2↑ + 2NаОН (электролиз)
и в лаборатории:
(аналогично с участием других окислителей; подробнее см. реакции для НСl и NaСl).
Хлор относится к продуктам основного химического производства, используется для получения брома и йода, хлоридов и кислородсодержащих производных, для отбеливания бумаги, как дезинфицирующее средство для питьевой воды. Ядовит.
Качественная реакция на ион Сl — — образование белых осадков АgСl и Нg2Сl2, которые не переводятся в раствор действием разбавленной азотной кислоты.
Хлороводород служит сырьем в производстве хлоридов, хлорорганических продуктов, используется (в виде раствора) при травлении металлов, разложении минералов и руд. Уравнения важнейших реакций:
Получение НСl в промышленности — сжигание Н2 в Сl2 (см.), в лаборатории — вытеснение из хлоридов серной кислотой:
Хлорид натрия NaСl. Бескислородная соль. Бытовое название поваренная соль. Белый, слабогигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, растворимость мало зависит от температуры, раствор имеет характерный соленый вкус. Гидролизу не подвергается. Слабый восстановитель. Вступает в реакции ионного обмена. Подвергается электролизу в расплаве и растворе.
Применяется для получения водорода, натрия и хлора, соды, едкого натра и хлороводорода, как компонент охлаждающих смесей, пищевой продукт и консервирующее средство.
В природе — основная часть залежей каменной соли, или галита, и сильвинита (вместе с КСl),рапы соляных озер, минеральных примесей морской воды (содержание NaСl=2,7%). В промышленности получают выпариванием природных рассолов.
Уравнения важнейших реакций:
NaCl(ж)→2Na+Cl2↑ (850°С, электролиз )
2NаСl + 2Н2O→Н2↑ + Сl2↑ + 2NаОН (электролиз )
2NаСl(р,20%)→ Сl2↑+ 2Nа(Нg) “амальгама”(электролиз ,на Hg-катоде)
Хлорид калия КСl. Бескислородная соль. Белый, негигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, раствор имеет горький вкус, гидролиза нет. Вступает в реакции ионного обмена. Применяется как калийное удобрение, для получения К, КОН и Сl2. В природе основная составная часть (наравне с NаСl) залежей сильвинита.
Уравнения важнейших реакций одинаковы с таковыми для NаСl.
Уравнения важнейших реакций:
СаСl2(ж) → Са + Сl2 ↑(электролиз ,800°С)
Качественная реакция на ион Аl 3+ — образование осадка АlРO4, который переводится в раствор концентрированной серной кислотой.
Применяется как сырье в производстве алюминия, катализатор в органическом синтезе и при крекинге нефти, переносчик хлора в органических реакциях. Уравнения важнейших реакций:
АlСl3 . 6Н2O →АlСl(ОН)2 (100-200°С, —HCl,H2O)→Аl2O3(250-450°С, -HCl,H2O)
2АlСl3→2Аl + 3Сl2↑(электролиз,800 °С ,в расплаве NаСl)
Получение АlСl в промышленности — хлорирование каолина, глинозёма или боксита в присутствии кокса:
Хлорид железа(II) FеСl2. Бескислородная соль. Белый (гидрат голубовато-зеленый), гигроскопичный. Плавится и кипит без разложения. При сильном нагревании летуч в потоке НСl. Связи Fе — Сl преимущественно ковалентные, пар состоит из мономеров FеСl2 (линейное строение, sр-гибридизация) и димеров Fе2Сl4. Чувствителен к кислороду воздуха (темнеет). Хорошо растворим в воде (с сильным экзо-эффектом), полностью диссоциирует на ионы, слабо гидролизуется по катиону. При кипячении раствора разлагается. Реагирует с кислотами, щелочами, гидратом аммиака. Типичный восстановитель. Вступает в реакции ионного обмена и комплексообразования.
Применяется для синтеза FеСl и Fе2О3, как катализатор в органическом синтезе, компонент лекарственных средств против анемии.
Уравнения важнейших реакций:
FеСl2 (конц.) + Н2O=FеСl(ОН)↓ + НСl↑ (кипячение)
FеСl2 + 2NаОН (разб.) = Fе(ОН)2↓+ 2NaСl (в атм. N2)
FеСl2 + Н2 = 2НСl + Fе (особо чистое,выше 500 °С)
5Fе 2+ + 8Н + + МnО — 4 = 5Fе 3+ + Мn 2+ + 4Н2O
6Fе 2+ + 14Н + + Сr2O7 2- = 6Fе 3+ + 2Сr 3+ +7Н2O
Fе 2+ + S 2- (разб.) = FеS↓
FеСl2 →Fе↓ + Сl2↑ (90°С, в разб. НСl, электролиз)
Получение: взаимодействие Fе с соляной кислотой:
(в промышленности используют хлороводород и ведут процесс при 500 °С).
Хлорид железа(III) FеСl3. Бескислородная соль. Черно-коричневый (темно-красный в проходящем свете, зеленый в отраженном), гидрат темно-желтый. При плавлении переходит в красную жидкость. Весьма летуч, при сильном нагревании разлагается. Связи Fе — Сl преимущественно ковалентные. Пар состоит из мономеров FеСl3 (треугольное строение, sр 2 -гибридизация, преобладают выше 750 °С) и димеров Fе2Сl6 (точнее, Сl2FеСl2FеСl2, строение — два тетраэдра с общим ребром, sр 3 -гибридизация, преобладают при 316-750 °С). Кристаллогидрат FеСl . 6Н2O имеет строение [Fе(Н2O)4Сl2]Сl • 2Н2O. Хорошо растворим в воде, раствор окрашен в желтый цвет; сильно гидролизован по катиону. Разлагается в горячей воде, реагирует со щелочами. Слабый окислитель и восстановитель.
Применяется как хлорагент, катализатор в органическом синтезе, протрава при крашении тканей, коагулянт при очистке питьевой воды, травитель медных пластин в гальванопластике, компонент кровоостанавливающих препаратов.
Уравнения важнейших реакций:
FеСl3 + 3NaОН (разб.) = FеО(ОН)↓ + Н2O + 3NаСl (50 °С)
Хлорид аммония NН4Сl. Бескислородная соль, техническое название нашатырь. Белый, летучий, термически неустойчивый. Хорошо растворим в воде (с заметным эндо-эффектом, Q = -16 кДж), гидролизуется по катиону. Разлагается щелочами при кипячении раствора, переводит в раствор магний и гидроксид магния. Вступает в реакцию кон мутации с нитратами.
Качественная реакция на ион NН4 + — выделение NН3 при кипячении со щелочами или при нагревании с гашёной известью.
Применяется в неорганическом синтезе, в частности для создания слабокислотной среды, как компонент азотных удобрений, сухих гальванических элементов, при пайке медных и лужении стальных изделий.
Уравнения важнейших реакций:
Получение: взаимодействие NH3 с НСl в газовой фазе или NН3 Н2О с НСl в растворе.
Гипохлорит кальция Са(СlО)2. Соль хлорноватистой кислоты НСlO. Белый, при нагревании разлагается без плавления. Хорошо растворим в холодной воде (образуется бесцветный раствор), гидролизуется по аниону. Реакционноспособный, полностью разлагается горячей водой, кислотами. Сильный окислитель. При стоянии раствор поглощает углекислый газ из воздуха. Является активной составной частью хлорной (белильной) извести — смеси неопределенного состава с СаСl2 и Са(ОН)2. Уравнения важнейших реакций:
Хлорат калия КСlO3. Соль хлорноватой кислоты НСlO3, наиболее известная соль кислородсодержащих кислот хлора. Техническое название — бертоллетова соль (по имени ее первооткрывателя К.-Л. Бертолле, 1786). Белый, плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (образуется бесцветный раствор), гидролиза нет. Разлагается концентрированными кислотами. Сильный окислитель при сплавлении.
Применяется как компонент взрывчатых и пиротехнических смесей, головок спичек, в лаборатории — твердый источник кислорода.
Уравнения важнейших реакций:
4КСlO3 = ЗКСlO4 + КСl (400 °С)
2КСlO3 = 2КСl + 3O2 (150-300 °С, кат. МпO2)
(диоксид хлора на свету взрывается: 2СlO2(Г) = Сl2 + 2O2)
2КСlO3 + Е2(изб.) = 2КЕO3 + Сl2↑ (в разб. НNO3, Е = Вr, I)
Получение КСlO3в промышленности — электролиз горячего раствора КСl (продукт КСlO3 выделяется на аноде):
Бромид калия КВr. Бескислородная соль. Белый, негигроскопичный, плавится без разложения. Хорошо растворим в воде, гидролиза нет. Восстановитель (более слабый, чем
Качественная реакция на ион Вr — вытеснение брома из раствора КВr хлором и экстракция брома в органический растворитель, например ССl4 (в результате водный слой обесцвечивается, органический слой окрашивается в бурый цвет).
Применяется как компонент травителей при гравировке по металлам, составная часть фотоэмульсий, лекарственное средство.
Уравнения важнейших реакций:
5Вr — + 6Н + + ВrО3 — = 3Вr 2 + 3Н2O
КВr + 3Н2O→3Н2↑ + КВrО3 (60-80 °С, электролиз)
Иодид калия КI. Бескислородная соль. Белый, негигроскопичный. При хранении на свету желтеет. Хорошо растворим в воде, гидролиза нет. Типичный восстановитель. Водный раствор КI хорошо растворяет I2 за счет комплексообразования.
Качественная реакция на ион I — вытеснение иода из раствора КI недостатком хлора и экстракция иода в органический растворитель, например ССl4 (в результате водный слой обесцвечивается, органический слой окрашивается в фиолетовый цвет).
Уравнения важнейших реакций:
10I — + 16Н + + 2МnO4 — = 5I2↓ + 2Мn 2+ + 8Н2O
I — + Аg + = АgI (желт.)↓
Хлор — элемент 3-го периода и VII А-группы Периодической системы, порядковый номер 17. Электронная формула атома [10Ne ]3s 2 Зр 5 , характерные степени окисления 0, -1, + 1, +5 и +7. Наиболее устойчиво состояние Cl -1 . Шкала степеней окисления хлора:
+ 1 – Cl2O , ClO — , HClO , NaClO , Ca(ClO)2
— 1 – Cl — , HCl, KCl , PCl5
Хлор обладает высокой электроотрицательностью (2,83), проявляет неметаллические свойства. Входит в состав многих веществ — оксидов, кислот, солей, бинарных соединений.
В природе — двенадцатый по химической распространенности элемент (пятый среди неметаллов). Встречается только в химически связанном виде. Третий по содержанию элемент в природных водах (после О и Н), особенно много хлора в морской воде (до 2 % по массе). Жизненно важный элемент для всех организмов.
Хлор С12 . Простое вещество. Желто-зеленый газ с резким удушливым запахом. Молекула Сl2 неполярна, содержит σ-связь С1-С1. Термически устойчив, негорюч на воздухе; смесь с водородом взрывается на свету (водород сгорает в хлоре):
Хорошо растворим в воде, подвергается в ней дисмутации на 50 % и полностью — в щелочном растворе:
Хлор очень сильный окислитель по отношению к металлам и неметаллам:
Сl2 + РЬ→PbCl2 (300 °С)
Реакции с соединениями других галогенов:
Качественная реакция — взаимодействие недостатка СL2 с КI (см. выше) и обнаружение йода по синему окрашиванию после добавления раствора крахмала.
Получение хлора в промышленности:
2NаСl (расплав)→ 2Nа + Сl2 (электролиз)
2NaCl+ 2Н2O→Н2↑ + Сl2↑ + 2NаОН (электролиз)
и в лаборатории:
(аналогично с участием других окислителей; подробнее см. реакции для НСl и NaСl).
Хлор относится к продуктам основного химического производства, используется для получения брома и йода, хлоридов и кислородсодержащих производных, для отбеливания бумаги, как дезинфицирующее средство для питьевой воды. Ядовит.
Качественная реакция на ион Сl — — образование белых осадков АgСl и Нg2Сl2, которые не переводятся в раствор действием разбавленной азотной кислоты.
Хлороводород служит сырьем в производстве хлоридов, хлорорганических продуктов, используется (в виде раствора) при травлении металлов, разложении минералов и руд. Уравнения важнейших реакций:
Получение НСl в промышленности — сжигание Н2 в Сl2 (см.), в лаборатории — вытеснение из хлоридов серной кислотой:
Хлорид натрия NaСl. Бескислородная соль. Бытовое название поваренная соль. Белый, слабогигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, растворимость мало зависит от температуры, раствор имеет характерный соленый вкус. Гидролизу не подвергается. Слабый восстановитель. Вступает в реакции ионного обмена. Подвергается электролизу в расплаве и растворе.
Применяется для получения водорода, натрия и хлора, соды, едкого натра и хлороводорода, как компонент охлаждающих смесей, пищевой продукт и консервирующее средство.
В природе — основная часть залежей каменной соли, или галита, и сильвинита (вместе с КСl),рапы соляных озер, минеральных примесей морской воды (содержание NaСl=2,7%). В промышленности получают выпариванием природных рассолов.
Уравнения важнейших реакций:
NaCl(ж)→2Na+Cl2↑ (850°С, электролиз )
2NаСl + 2Н2O→Н2↑ + Сl2↑ + 2NаОН (электролиз )
2NаСl(р,20%)→ Сl2↑+ 2Nа(Нg) “амальгама”(электролиз ,на Hg-катоде)
Хлорид калия КСl. Бескислородная соль. Белый, негигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, раствор имеет горький вкус, гидролиза нет. Вступает в реакции ионного обмена. Применяется как калийное удобрение, для получения К, КОН и Сl2. В природе основная составная часть (наравне с NаСl) залежей сильвинита.
Уравнения важнейших реакций одинаковы с таковыми для NаСl.
Уравнения важнейших реакций:
СаСl2(ж) → Са + Сl2 ↑(электролиз ,800°С)
Качественная реакция на ион Аl 3+ — образование осадка АlРO4, который переводится в раствор концентрированной серной кислотой.
Применяется как сырье в производстве алюминия, катализатор в органическом синтезе и при крекинге нефти, переносчик хлора в органических реакциях. Уравнения важнейших реакций:
АlСl3 . 6Н2O →АlСl(ОН)2 (100-200°С, —HCl,H2O)→Аl2O3(250-450°С, -HCl,H2O)
2АlСl3→2Аl + 3Сl2↑(электролиз,800 °С ,в расплаве NаСl)
Получение АlСl в промышленности — хлорирование каолина, глинозёма или боксита в присутствии кокса:
Хлорид железа(II) FеСl2. Бескислородная соль. Белый (гидрат голубовато-зеленый), гигроскопичный. Плавится и кипит без разложения. При сильном нагревании летуч в потоке НСl. Связи Fе — Сl преимущественно ковалентные, пар состоит из мономеров FеСl2 (линейное строение, sр-гибридизация) и димеров Fе2Сl4. Чувствителен к кислороду воздуха (темнеет). Хорошо растворим в воде (с сильным экзо-эффектом), полностью диссоциирует на ионы, слабо гидролизуется по катиону. При кипячении раствора разлагается. Реагирует с кислотами, щелочами, гидратом аммиака. Типичный восстановитель. Вступает в реакции ионного обмена и комплексообразования.
Применяется для синтеза FеСl и Fе2О3, как катализатор в органическом синтезе, компонент лекарственных средств против анемии.
Уравнения важнейших реакций:
FеСl2 (конц.) + Н2O=FеСl(ОН)↓ + НСl↑ (кипячение)
FеСl2 + 2NаОН (разб.) = Fе(ОН)2↓+ 2NaСl (в атм. N2)
FеСl2 + Н2 = 2НСl + Fе (особо чистое,выше 500 °С)
5Fе 2+ + 8Н + + МnО — 4 = 5Fе 3+ + Мn 2+ + 4Н2O
6Fе 2+ + 14Н + + Сr2O7 2- = 6Fе 3+ + 2Сr 3+ +7Н2O
Fе 2+ + S 2- (разб.) = FеS↓
FеСl2 →Fе↓ + Сl2↑ (90°С, в разб. НСl, электролиз)
Получение: взаимодействие Fе с соляной кислотой:
(в промышленности используют хлороводород и ведут процесс при 500 °С).
Хлорид железа(III) FеСl3. Бескислородная соль. Черно-коричневый (темно-красный в проходящем свете, зеленый в отраженном), гидрат темно-желтый. При плавлении переходит в красную жидкость. Весьма летуч, при сильном нагревании разлагается. Связи Fе — Сl преимущественно ковалентные. Пар состоит из мономеров FеСl3 (треугольное строение, sр 2 -гибридизация, преобладают выше 750 °С) и димеров Fе2Сl6 (точнее, Сl2FеСl2FеСl2, строение — два тетраэдра с общим ребром, sр 3 -гибридизация, преобладают при 316-750 °С). Кристаллогидрат FеСl . 6Н2O имеет строение [Fе(Н2O)4Сl2]Сl • 2Н2O. Хорошо растворим в воде, раствор окрашен в желтый цвет; сильно гидролизован по катиону. Разлагается в горячей воде, реагирует со щелочами. Слабый окислитель и восстановитель.
Применяется как хлорагент, катализатор в органическом синтезе, протрава при крашении тканей, коагулянт при очистке питьевой воды, травитель медных пластин в гальванопластике, компонент кровоостанавливающих препаратов.
Уравнения важнейших реакций:
FеСl3 + 3NaОН (разб.) = FеО(ОН)↓ + Н2O + 3NаСl (50 °С)
Хлорид аммония NН4Сl. Бескислородная соль, техническое название нашатырь. Белый, летучий, термически неустойчивый. Хорошо растворим в воде (с заметным эндо-эффектом, Q = -16 кДж), гидролизуется по катиону. Разлагается щелочами при кипячении раствора, переводит в раствор магний и гидроксид магния. Вступает в реакцию кон мутации с нитратами.
Качественная реакция на ион NН4 + — выделение NН3 при кипячении со щелочами или при нагревании с гашёной известью.
Применяется в неорганическом синтезе, в частности для создания слабокислотной среды, как компонент азотных удобрений, сухих гальванических элементов, при пайке медных и лужении стальных изделий.
Уравнения важнейших реакций:
Получение: взаимодействие NH3 с НСl в газовой фазе или NН3 Н2О с НСl в растворе.
Гипохлорит кальция Са(СlО)2. Соль хлорноватистой кислоты НСlO. Белый, при нагревании разлагается без плавления. Хорошо растворим в холодной воде (образуется бесцветный раствор), гидролизуется по аниону. Реакционноспособный, полностью разлагается горячей водой, кислотами. Сильный окислитель. При стоянии раствор поглощает углекислый газ из воздуха. Является активной составной частью хлорной (белильной) извести — смеси неопределенного состава с СаСl2 и Са(ОН)2. Уравнения важнейших реакций:
Хлорат калия КСlO3. Соль хлорноватой кислоты НСlO3, наиболее известная соль кислородсодержащих кислот хлора. Техническое название — бертоллетова соль (по имени ее первооткрывателя К.-Л. Бертолле, 1786). Белый, плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (образуется бесцветный раствор), гидролиза нет. Разлагается концентрированными кислотами. Сильный окислитель при сплавлении.
Применяется как компонент взрывчатых и пиротехнических смесей, головок спичек, в лаборатории — твердый источник кислорода.
Уравнения важнейших реакций:
4КСlO3 = ЗКСlO4 + КСl (400 °С)
2КСlO3 = 2КСl + 3O2 (150-300 °С, кат. МпO2)
(диоксид хлора на свету взрывается: 2СlO2(Г) = Сl2 + 2O2)
2КСlO3 + Е2(изб.) = 2КЕO3 + Сl2↑ (в разб. НNO3, Е = Вr, I)
Получение КСlO3в промышленности — электролиз горячего раствора КСl (продукт КСlO3 выделяется на аноде):
Бромид калия КВr. Бескислородная соль. Белый, негигроскопичный, плавится без разложения. Хорошо растворим в воде, гидролиза нет. Восстановитель (более слабый, чем
Качественная реакция на ион Вr — вытеснение брома из раствора КВr хлором и экстракция брома в органический растворитель, например ССl4 (в результате водный слой обесцвечивается, органический слой окрашивается в бурый цвет).
Применяется как компонент травителей при гравировке по металлам, составная часть фотоэмульсий, лекарственное средство.
Уравнения важнейших реакций:
5Вr — + 6Н + + ВrО3 — = 3Вr 2 + 3Н2O
КВr + 3Н2O→3Н2↑ + КВrО3 (60-80 °С, электролиз)
Иодид калия КI. Бескислородная соль. Белый, негигроскопичный. При хранении на свету желтеет. Хорошо растворим в воде, гидролиза нет. Типичный восстановитель. Водный раствор КI хорошо растворяет I2 за счет комплексообразования.
Качественная реакция на ион I — вытеснение иода из раствора КI недостатком хлора и экстракция иода в органический растворитель, например ССl4 (в результате водный слой обесцвечивается, органический слой окрашивается в фиолетовый цвет).
Уравнения важнейших реакций:
10I — + 16Н + + 2МnO4 — = 5I2↓ + 2Мn 2+ + 8Н2O
I — + Аg + = АgI (желт.)↓
Задание 33.1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Демонстрационный вариант КИМ ЕГЭ по химии 2019 года
1) При указанных условиях (H2SO4, 180 ᴼC) происходит внутримолекулярная дегидратация пропанола-1 с образованием пропилена (вещество Х1): 
2) Взаимодействие пропилена с HCl приводит к образованию 2-хлорпропана (вещество Х2) (реакция гидрогалогенирования): 
3) При взаимодействии 2-хлорпропана с водным раствором NaOH происходит замещение –Cl на гидроксильную группу, образуется изопропанол (вещество Х3): 
4) Изопропанол под действием H2SO4 при нагревании (180 ᴼC) подвергается внутримолекулярной дегидратации с образованием пропилена (вещество Х1): 
5) При воздействии водного раствора KMnO4 пропилен вступает в реакцию гидроксилирования с образованием пропиленгликоля (вещество Х4): 
Задание 33.2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) Щелочной гидролиз 1,1-дибромпропана приведет к образованию альдегида - пропаналя: 
2) При взаимодействии с подкисленным раствором дихромата калия пропаналь окисляется в пропановую кислоту: 
3) В результате реакции пропановой кислоты с хлором в присуствии красного фосфора образуется 2-хлорпропановая кислота: 
4) 2-Хлорпропановая кислота взаимодействует с гидрокарбонатом натрия с образованием соответствующей натриевой соли: 
5) Взаимодействие натриевой соли 2-хлорпропановой кислоты с иодэтаном приводит к образованию соответствующего сложного эфира - этилового эфира 2-хлорпропановой кислоты: 
Задание 33.3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) Метилциклогексан в присутствии платины при нагревании вступит в реакцию дегидрирования с образованием толуола: 
2) В результате реакции с водным раствором перманганата калия толуол окисляется в бензоат калия: 
3) Сплавление бензоата калия с гидроксидом калия приведет к образованию бензола: 
4) Нитробензол получают нитрованием бензола смесью концентрированных азотной и серной кислот: 
5) Нитробензол восстанавливается водородом, выделяющимся при взаимодействии Fe и HCl, до анилина. Последний далее может взаимодействовать с HCl с образованием соответствующей соли - хлорида фениламмония: 
Суммарное уравнение реакции: 
Задание 33.4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) н-Бутан в присутствии катализатора AlCl3 изомеризуется в изобутан: 
2) Взаимодействие изобутана с бромом на свету приведет к образованию 2-бром-2-метилпропана: 
3) 2-Бром-2-метилпропан под действием спиртового раствора гидроксида калия дегидрогалогенируется с образованием изобутена (изобутилена): 
4) Реакция изобутена с подкисленным серной кислотой раствором перманганата калия приведет к окислению углеводорода с образованием ацетона и углекислого газа: 
5) Гидрирование ацетона на никеле приведет к образованию изопропилового спирта (изопропанола): 
Задание 33.5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) В результате взаимодействия бензола с хлорметаном в присутствии катализатора AlCl3 протекает реакция алкилирования с образованием толуола: 
2) Бромирование толуола в присутствии катализатора FeBr3 приводит к образованию 4-бромтолуола (п-бромтолуола) и 2-бромтолуола (о-бромтолуола): 
3) Реакция 4-бромтолуола (п-бромтолуола) с бромметаном и металлическим натрием приводит к образованию п-ксилола (реакция Вюрца-Фиттига): 
4) Окисление п-ксилола по действием подкисленного серной кислотой раствора перманганата калия приведет к образованию терефталевой кислоты: 
5) Терефталевая кислота с этиловым спиртом в присутствии катализатора H2SO4 вступит в реакцию этерификации с образованием сложного эфира - диэтилового эфира терефталевой кислоты (диэтилтерефталата): 
Задание 33.6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) Термическое разложение метана (температура около 1000 о С) приводит к образованию ацетилена: 
2) Ацетилен присоединяет воду в присутствии катионов двухвалентной ртути с образованием ацетальдегида (реакция Кучерова): 
3) Образовавшийся этаналь (ацетальдегид) взаимодействует с аммиачным раствором оксида серебра (I) (реакция серебряного зеркала), в результате окисления альдегида образуется ацетат аммония: 
4) Последующее взаимодействие с гидроксидом кальция переводит ацетат аммония в ацетат кальция: 
5) Разложение ацетата кальция при нагревании приведет к образованию ацетона: 
Задание 33.7
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) Каталитическое гидрирование дивинила (бутадиена-1,3) приводит к образованию бутена-2: 
2) Реакция бутена-2 с подкисленным серной кислотой раствором перманганата калия приведет к окислению углеводорода с образованием уксусной кислоты: 
3) Хлорирование уксусной кислоты в присутствии красного фосфора приведет к образованию хлоруксусной кислоты: 
4) Хлоруксусная кислота взаимодействует с избытком аммиака с образованием аминоуксусной кислоты (глицина):
5) Последующее взаимодействие аминоуксусной кислоты с гидроксидом магния переводит аминокислоту в соответствующую магниевую соль:
Задание 33.8
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) Тримеризация этина (ацетилена) при нагревании в присутствии активированного угля приводит к образованию бензола: 
2) В результате алкилирования бензола хлорметаном в присутствии хлорида алюминия (III) образуется толуол: 
3) Хлорирование толуола на свету приведет к образованию бензилхлорида: 
4) Бензилхлорид реагирует с водным раствором гидроксида натрия с образованием бензилового спирта: 
5) Подкисленный серной кислотой раствор дихромата калия окисляет бензиловый спирт в бензойную кислоту: 
Задание 33.9
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) В результате реакции с водным раствором перманганата калия толуол окисляется в бензоат калия: 
2) Сплавление бензоата калия с гидроксидом калия приведет к образованию бензола: 
3) В результате алкилирования бензола пропиленом в присутствии хлорида алюминия (III) и хлороводорода образуется изопропилбензол (кумол): 
4) Изопропилбензол хлорируется на свету с получением 2-хлор-2-фенилпропана: 
5) 2-Хлор-2-фенилпропан реагирует с водным раствором гидроксида натрия с образованием 2-фенилпропанола-2: 
Задание 33.10
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) Бензол гидрируется избытком водорода в присутствии платины до циклогексана: 
2) Циклогексан бромируется на свету с образованием бромциклогексана: 
3) Бромциклогексан под действием спиртового раствора гидроксида калия дегидробромируется с образованием циклогексена: 
4) Циклогексен присоединяет воду с образованием циклогексанола: 
5) Циклогексанол окиcляется под действием подкисленного серной кислотой раствора дихромата калия в циклогексанон: 
Задание 33.11
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) Метилпропионат вступает в реакцию гидролиза с образованием пропионовой кислоты и метанола: 
2) Метанол взаимодействует с хлороводородом с образованием хлорметана: 
3) Хлорметан алкилирует бензол с образованием толуола: 
4) В результате нитрования толуола смесью концентрированных азотной и серной кислот получают 4-нитротолуол (п-нитротолуол): 
5) 4-Нитротолуол восстанавливается водородом, выделяющимся при взаимодействии Fe и HCl, до 4-метиланилина (п-толуидин). Последний далее взаимодействует с HCl с образованием соответствующей соли: 
Суммарное уравнение реакции: 
Читайте также:

