Острый лимфобластный лейкоз с поломкой филадельфийской хромосомы
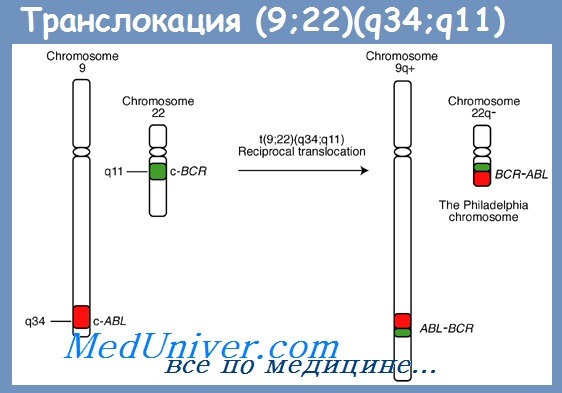
Транслокация (9;22)(q34;q11) общеизвестна как хромосомная перестройка, специфичная для хронического миелолейкоза (ХМЛ), но она характерна также и для одного из самых агрессивных субвариантов острого лимфобластного лейкоза (ОЛЛ). Характерный для хронического миелолейкоза маркер (делетированная хромосома 22) был открыт в американском городе Филадельфия и получил название филадельфийской хромосомы.
Транслокация (9;22), приводящая к формированию этого маркера, тоже называется филадельфийской (Ph), несмотря на то что была открыта позже в г. Чикаго, а лейкозы с этой транслокацией — острые и хронические — называются Ph-позитивными.
Эта аномалия наблюдается в 20—30 % случаев при остром лимфобластном лейкозе взрослых и значительно реже при остром лимфобластном лейкозе у детей (5—10 %). Ее частота экспоненциально нарастает с возрастом.
Лейкозный клон при Ph-ОЛЛ представлен потомками В-клеточных коммитированных предшественников, в то время как при хроническом миелолейкозе лейкозный клон представляет собой потомство стволовых кроветворных клеток.
Острый лимфобластный лейкоз (ОЛЛ), маркированный транслокацией (9;22) — Ph-ОЛЛ является самой агрессивной формой острого лимфобластного лейкоза.
При исследовании до начала специфической терапии Ph-ОЛЛ имеет ряд характерных особенностей, неблагоприятных в прогностическом отношении: высокий лейкоцитоз (>50 000), вариант L2 по FAB, нередко спленомегалия. У подавляющего большинства пациентов бласты имеют фенотип В-клеточных предшественников (CD10+, CD19+, CD34+).
В результате транслокации происходит слияние фрагментов двух генов — протоонкогена ABL, расположенного на хромосоме 9, и гена BCR, локализованного на хромосоме 22, в результате образуется химерный (гибридный) ген BCR-ABL.
При Ph-позитивном остром лимфобластном лейкозе (ОЛЛ) примерно в половине случаев у взрослых и у 20 % детей разрывы в гене BCR такие же, как при хроническом миелолейкозе. У остальных пациентов с острым лимфобластным лейкозом разрыв в хромосоме 22 (ген ВСЯ) расположен ближе к центромере. Образующийся химерный белок Р190 Bcr/Abl обладает более высокой протеинкиназной активностью, чем характерный для ХМЛ Р210 Bcr/Abl. Тип образующегося химерного белка не коррелирует с прогнозом: прогноз одинаково неблагоприятный, независимо от того, продуцируется белок Р190 Bcr/Abl или белок Р210 Bcr/Abl.
В отличие от хронического миелолейкоза, при котором практически все клетки костного мозга содержат Ph-транслокацию, костный мозг при Ph-позитивном остром лейкозе еще до начала лечения обычно содержит какое-то количество клеток без Ph-хромосомы (с нормальным кариотипом), а наступление ремиссии сопровождается уменьшением или полным исчезновением клона клеток с Ph-хромосомой. Эти данные используют для дифференциальной диагностики острого лимфобластного лейкоза и бластного криза хронического миелолейкоза (ХМЛ).
На рисунке показаны нормальная и аномальная клетки костного мозга при Ph-позитивном остром лимфобластном лейкозе, выявленные с помощью FISH; в аномальной клетке виден характерный сливной сигнал, соответствующий химерному гену BCR-ABL .
Прогноз при Ph-позитивном остром лимфолейкозе крайне неблагоприятен. В 1994 г. известный немецкий гематолог D. Hoelzer проанализировал данные литературы по лечению острого лимфолейкоза в разных странах (4000 взрослых пациентов). Анализ показал, что частота ремиссий при Ph-позитивном варианте существенно ниже, чем при Ph-негативном: 60 % против 85 %. Продолжительность ремиссии в группе острого лимфолейкоза с Ph-хромосомой не превышала 6 мес, т. е. она была в 2 раза короче, чем в среднем при остром лимфолейкозе. Эти результаты подтверждены в более поздних публикациях.
Эффективность лечения детей, больных острого лимфолейкоза, значительно выше, включая Ph-позитивный вариант.
Трансплантация костного мозга во время первой или второй ремиссий улучшает выживаемость при остром лимфолейкозе с Ph-хромосомой. Этот вариант острого лимфолейкоза относят в группу высокого риска независимо от других клинико-гематологических особенностей или наличия дополнительных хромосомных изменений. Выявление таких больных имеет жизненные показания, поскольку у них есть шанс длительного безрецидивного выживания только после трансплантации костного мозга, проведенной во время первой ремиссии.
Есть наблюдения, что Ph-позитивный лейкоз может иметь более благоприятный прогноз, если еще до лечения лейкоцитоз не увеличен. У таких пациентов изредка могут быть достигнуты стойкие длительные ремиссии без пересадки костного мозга, а с помощью интенсивной химиотерапии.
Очень важные результаты получены французскими гематологами, которые наблюдали 154 взрослых пациентов с Ph-позитивным остром лимфолейкозе. Трансплантацию костного мозга удалось провести 74 больным на 3-м месяце полной ремиссии, причем у 23 из них это была аутотрансплантация. Двенадцать больных пережили 3 года, из них 3 человека после аутототрансплантации. Большинство больных, переживших 3 года, живы, а шесть из них живут более 5. лет. Авторы считают, что самыми важными благоприятными прогностическими признаками при BCR-ABL-позитивном остром лимфолейкозе являются: разрыв в области m-BCR, а не в области M-BCR, и исчезновение транскрипта BCR-ABL после курса консолидации (НАМ). К сожалению, из-за возрастных ограничений пересадка костного мозга может быть осуществлена только в 30 % случаев Ph-позитивного острого лимфолейкоза.
Существенную роль в улучшении результатов лечения Ph-позитивного острого лимфолейкоза играют ингибиторы тирозинкиназ, в частности иматиниб. Разработаны новые программы, позволяющие получить гематологические ремиссии почти у всех (95 %) взрослых пациентов. За счет комбинирования разных доз иматиниба с химиопрепаратами удалось удлинить ремиссии и проводить трансплантации костного мозга у большего числа больных. В результате частота длительных ремиссий значительно повысилась, однако лечение этой формы лейкоза все еще нуждается в усовершенствовании. Огромное значение при поиске рациональной терапии придается показателям минимальной резидуальной болезни (МРБ).
Рекомендуется проводить лечение, руководствуясь показателями МРБ и добиваясь полной молекулярной ремиссии. Это существенно снижает риск рецидивов и повышает выживаемость.
Так, риск рецидивов был практически сведен к нулю у пациентов с Ph-позитивным острым лимфобластным лейкозом, у которых были получены полные молекулярные ремиссии после трансплантации костного мозга с последующей терапией иматинибом (монотерапия или в сочетании с другими препаратами) в отличие от больных, у которых молекулярные ремиссии не были достигнуты и в большинстве случаев развились ранние рецидивы.
Лейкоз (лейкемия) является злокачественным заболеванием белых кровяных телец. Заболевание возникает в костном мозге, а затем распространяется в кровь, лимфатические узлы, селезенку, печень, центральную нервную систему (ЦНС) и другие органы. Лейкоз может возникнуть как у детей, так и у взрослых.
Лейкоз является сложным заболеванием и имеет много различных типов и подтипов.
Лимфобластный лейкоз (острый лимфолейкоз) делится на два вида: В-линейный и Т-линейный, в зависимости от типа клеток – лимфоидных предшественников. По большей части, при остром лимфобластном лейкозе поражаются В-лимфоциты (примерно в 85% случаев), отвечающие за образование антител в организме.
Симптомы острого лимфобластного лейкоза
Синдром интоксикации – слабость, лихорадка, недомогание, потеря веса. Лихорадка может быть связана и с наличием бактериальной, вирусной, грибковой или протозойной (реже) инфекцией.
Гиперпластический синдром - увеличение всех групп периферических лимфоузлов. Инфильтрация печени и селезенки приводит к их увеличению, что может проявляться болями в животе. Могут появиться боль и ломота в костях из-за лейкемической инфильтрации надкостницы и суставной капсулы и опухолевого увеличения объема костного мозга.
Анемический синдром – бледность, слабость, тахикардия, кровоточивость слизистых полости рта, геморрагический синдром на коже, бледность. Слабость возникает в результате анемии и интоксикации.
Дыхательные нарушения, связанные с увеличение лимфоузлов средостения, которые могут привести к дыхательной недостаточности. Этот признак характерен для Т-линейного ОЛЛ.
Могут появиться кровоизлияния в сетчатку глаза, отек зрительного нерва. При офтальмоскопии могут обнаруживаться лейкемические бляшки на глазном дне.
Из-за сильно сниженного иммунитета любое повреждение кожи является очагом инфекции.
Филадельфийская хромосома – это аномальная хромосома, редко встречающаяся у больных с острым лимфобластным лейкозом и образующаяся вследствие переноса части 9 хромосомы на 22. Такое слияние влечет за собой образование аномального протеина, играющего значительную роль в процессе превращения нормальной клетки в злокачественную. Данная хромосома встречается при нескольких типах лейкозов детей и взрослых.
Лечение острых лейкозов у взрослых
Острый лейкоз у взрослых – это не одно заболевание, а несколько, и больные с различными подтипами лейкоза неодинаково отвечают на лечение.
Выбор терапии основывается как на конкретном подтипе лейкоза, так и на определенных характеристиках болезни, которые называются прогностическими признаками. Эти признаки включают: возраст больного, количество лейкоцитов, ответ на химиотерапию и сведений о том, лечился ли ранее этот больной по поводу другой опухоли
Химиотерапия
Под химиотерапией подразумевается применение препаратов, уничтожающих опухолевые клетки. Обычно противоопухолевые препараты назначаются внутривенно или внутрь (через рот). Как только препарат поступает в кровоток, он разносится по всему организму.
Химиотерапия - основной метод лечения острых лейкозов, однако при этом повреждаются как опухолевые, так и нормальные клетки.
Трансплантация стволовых клеток (ТСК)
Трансплантация стволовых клеток позволяет врачам использовать высокие дозы противоопухолевых препаратов с целью повышения эффективности лечения. И хотя противоопухолевые препараты разрушают костный мозг больного, пересаженные стволовые клетки помогают восстановить клетки костного мозга, продуцирующие клетки крови.
Лучевая терапия (использование рентгеновских лучей высоких энергий) играет ограниченную роль при лечении больных лейкозами.
Оперативное лечение больных лейкозом, в отличие от других видов злокачественных опухолей, как правило, не используется.
Материал подготовлен на основе информации открытых источников
Филадельфийская хромосома характерна для ХМЛ или хронического миелоидного лейкоза, который является клональным новообразованием, развивающимся из кроветворных стволовых клеток.
Данная опухоль была первой, при которой обнаружили признаки характерного хромосомного маркера. Открытие в 1960 году в Филадельфии сделали американские исследователи D. A. Hungerford и P. C. Nowell, в связи в чем этот маркер назвали термином филадельфийская хромосома-Ph. И именно эта находка послужила началом клинической цитогенетики в онкологии.
Что собой представляет хромосома?
Может появляться и при других видах лейкоза. Филадельфийская хромосома является укороченной хромосомой, входящей в группу малых акроцентриков. Каждая нормальная женская клетка этой группы содержит их 2 пары– 21 и 22, клетка же мужская включает не четыре, а пять таких хромосом, потому что помимо 21 и 22 пар включается еще и Y-хромосома.
Без G-бендинга, то есть при обычном окрасе, Ph-хромосома выявляется почти у каждого пациента, страдающего ХМЛ, а именно в 95-98 процентах случаев. На хромосомах, которые окрашены дифференциально, видно, что одна из 22 пар является укороченной.
Каков процент обнаружения?
Приблизительно у 90 % пациентов ее видно в каждой анализируемой метафазе, а у остальных больных обнаруживаются и клетки с хромосомой-Ph, и клетки нормальные.
К тому же в некоторых случаях Ph-хромосому регистрируют в меньшинстве клеток костного мозга. Транслокацию (9;22) наблюдают в мегакариоцитах, миелоидных клетках, В- и Т-лимфоцитах, эритробластах. Данный факт является свидетельством того, что болезнь берет начало с предшественницы гемопоэза – некоммитарованной клетки.
Атипичные транслокации
Приблизительно в 10 % случаев можно наблюдать атипичные транслокации, когда цитологическое стандартное исследование может позволить увидеть перенос части 22 хромосомы не на 9, а на любую другую. Более того, в некоторых случаях при ХМЛ обнаруживаются сложные Ph-транслокации при участии не 2 (22 и 9 хромосом), а 3 хромосом или большего количества.

Установили, что почти при каждой Ph-транслокации участвуют 9 и 22 хромосомы, но не всегда это можно увидеть при проведении стандартного цитогенетического исследования, однако это обнаруживают во время использования ПЦР и FISH.
Многочисленные исследователи полагают, что тип Ph-транслокации (сложная, атипичная, стандартная) клинического значения не имеет.
Разрыв генов
Использование методов молекулярно-генетических поспособствовало установлению того, что разрыв в 9-й хромосоме проходит через протоонкоген (ген ABL), который раньше был идентифицирован у мышей в одном из вирусов лейкоза. В 22-й хромосоме наблюдают разрыв BCR гена. Результатом слияния фрагментов генов BCR и ABL становится образование химерного гена BCR-ABL расположенного обычно на 22-й делетированной хромосоме.
Как вызывает филадельфийская хромосома лейкоз?
Приблизительно 70 % случаев характеризуется обнаружением помимо транскрипта BCR-ABL продукта другого химерного гена, который образуется вследствие t (9;22) —ABL-BCR на der (9), но роль его для развития хронического миелолейкоза не выяснена.
Делеция
Также установили очень важный факт: приблизительно 20-25 % пациентов, у которых обнаружен хронический миелолейкоз, имеют делецию в маркерной 9q+ хромосоме. Эту аномалию нельзя обнаружить при проведении простого хромосомного анализа, но можно увидеть ее во время использования FISH с зондами, которые специально разработаны.
Размер делеции варьируется у каждого пациента: участок с делецией может содержать последовательности BCR-гена, которые перенесены с 22-й хромосомы на 9-ю, на последовательности самой 9 хромосомы или обеих.
Установили также возникновение делеции с формированием специфической t (9;22) одновременно, что частота ее в группах пациентов, которых обследовали на различных стадиях хронического миелолейкоза, одинаковая.
Пока что применение данного метода диагностики (информативного прогностического), к сожалению, в широкую клиническую практику не вошло в связи с его сложностью и требованием дорогостоящего оборудования и реактивов.
Ее роль в прогрессии ХМЛ
Делеция маркера 9q+ играет важную роль в прогрессии ХМЛ, но до конца все еще не выяснена. Когда выпадают кодирующие последовательности генов ABL или/и BCR вследствие делеции, это приводит к экспрессированию лишь одного химерного гена BCR-ABL, но экспрессии гена ABL-BCR не происходит. Вероятно, данное событие также играет важную роль в прогрессировании лейкоза. Более того, исследователи обсуждают возможность инактивации пока еще неизвестных генов-супрессоров, которые локализованы в хромосомном делетируемом районе.
Белок с мол. м. 210 тысяч кодируется химерным геном BCR-ABL, который обладает большей, нежели продукт протоонкогена нормального ABL (H145), протеинкиназной активностью. Во время лейкоза, который у мышей вызван вирусом Абельсона, онкогенную активность имеет белок, продукт gag/abl гибридного гена, который имеет высокую протеинкиназную активность. В эксперименте проводилось вырезание gag/abl гена, после чего вирус уже не мог у мышей вызывать лейкоз. То есть филадельфийская хромосома является маркером этого заболевания.
Подробнее о генах BCR и ABL
При изучении в генах BCR и ABL разрывов при ХМЛ было выявлено, что у разных пациентов разная их локализация. К примеру, в ABL гене протяженность участка, где могут быть разрывы, большая, до 200 kb, а в BCR-гене локализация разрывов происходит на небольшом участке в 8,5kb, то есть можно говорить о наличии кластера разрывов, давшего название самому BCR гену - Breakpoint cluster region.
Во многих случаях t (9;22) разрывы BCR-гена обнаруживаются на участке M-BCR, причем в химерный ген включается длинная часть BCR гена, результатом чего становится появление белка, характерного для ХМЛ P210Bcr/Abl. К тому же при t (9;22) разрывы BCR-гена локализоваться могут на участках, которые называются m-bcr и u-bcr. Bm-bcr области разрывы ведут к образованию P190Bcr/Abl химерного белка, то есть меньшего по величине, чем Р210Bcr/Abl. А локализация разрывов в u-bcr ведет к образованию белка Р230Bcr/Abl более крупного.
Эти различия молекулярного характера коррелируют не строго с клинической особенностью лейкоза. Например, Р190Bcr/Abl имеется у 2 разных видов лейкозов: Ph-позитивный лимфобластный острый лейкоз и гранулоцитарный хронический лейкоз при выраженном моноцитозе и миелопластическими чертами. Если обнаруживают Р230Bcr/Abl, то можно наблюдать картину нейтрофильного хронического миелолейкоза, то есть миелолейкоз, формула крови при котором представлена единичными метамиелоцитами и зрелыми нейтрофилами. К тому же название нейтрофильного гранулоцитарного лейкоза долгое время используют, чтобы обозначать Ph(BCR-ABL)-негативный хронический миелолейкоз (относительно доброкачественный вариант, наблюдаемый у пожилых людей и иногда у подростков).
Любой из вышеприведенных белков можно обнаружить при хроническом миелолейкозе. Также сообщается о достаточно частом сочетании 2 типов белков (Р1900Bcr/Abl и Р210Bcr/Abl) при лимфобластном остром лейкозе и хроническом типичном миелолейкозе.
Роль BCR-ABL для развития хронического миелолейкоза
Решающую роль BCR-ABL гена и его продукта, а именно Р210 белка для развития хронического миелолейкоза демонстрировали на разных системах in vitro и in vivo. Например, при трансдукции bcr/abl в гемопоэтические стволовые клетки мышей и их дальнейшей трансплантации сингенным облученным животным у вторых возникает миелопролиферативная болезнь, похожая на хронический миелолейкоз человека. Установили, что онкогенный потенциал обуславливает высокая тирозинкиназная активность химерного белка BCR-ABL. Одним из центральных в злокачественной трансформации клеток является событие дерегуляции тирозинкиназной активности.
Когда исследователи вводили летально облученным мышам клетки, которые экспрессировали р210Bcr/Abl, то одни животные заболевали лейкозом, сходным с человеческим хроническим миелолейкозом, а другие различными новообразованиями из клеток гемопоэтических: эритроидные опухоли, миеломоноцитарные лейкозы, ретикулоклеточные саркомы, пре В- и Т-клеточные лимфомы, макрофагальные опухоли. Причину различий не выяснили. Такие опыты показывают, что всю цепь событий, приводящую к развитию хронического миелолейкоза еще не установили. Но факт остается. При этом заболевании обнаруживается филадельфийская хромосома в клетках костного мозга. Лечение рассмотрим ниже.
Что еще обнаружили у больных?
Получили данные, которые свидетельствуют о существенном увеличении массы кроветворных клеток и элементов крови в организме пациентов с хроническим миелолейкозом, в основном из-за резкого увеличения срока жизни таких клеток, потому что активированным геном ABL (в BCR-ABL гене) ингибируется апоптоз – запрограммированная клеточная смерть. К тому же этим геном усиливается пролиферация миелоидных клеток.
Имеются основания полагать, что в случае хронического миелолейкоза изменяется функция спец. клеточных белков, то есть интергинов, последствием чего становится нарушение адгезии к стромальным элементам молодых миелоидных клеток, а также происходит избегание стволовых лейкемических клеток негативных регуляторных влияний. Можно сделать вывод. Наличие филадельфийской хромосомы патогномонично для хронического миелолейкоза.
Выводы

Наиболее общей формулировкой молекулярного патогенеза является следующая: химерным геном BCR-ABL кодируется белок, у которого постоянно активирована тирозинкиназная активность, что приводит к активации большого количества сигнальных путей, а также выраженным изменениям апоптоза, адгезии и клеточного цикла. Считается, что эти события достаточны для определения злокачественной клеточной трансформации и поддерживания опухолевого фенотипа.
Но все равно основным маркером является филадельфийская хромосома.
Лечение
Для подавления активности патологических лейкоцитов необходимой для сохранения жизни больных им требуется вторая линия терапии. Для этого применяют нилотиниб – вещество, которое блокирует передачу сигнала от филадельфийской хромосомы.
Ведь именно это и заставляет костный мозг продуцировать в большом количестве поврежденные лейкоциты.
Специалистами выделяется 3 ступени. Во время первой достигается гематологическая ремиссия, нормализация анализа крови и состояния пациента (размера его селезенки).
Но в клетках все же остается филадельфийская хромосома. Во вторую очередь достигается цитогенетическая ремиссия, когда эта хромосома не определяется в клетках. В-третьих, при проведении молекулярного исследования клеток крови в результате воздействия ингибиторами тироксинкиназы у костного мозга не обнаруживают патологический ген.
Трансплантация костного мозга
Обязательна ли ТКМ при филадельфийской хромосоме? Такую операцию по трансплантации проводят больным с острой формой миелоидного лейкоза. Также реально совместимого донора найти бывает непросто. Это очень серьезная и длительная операция. Но она позволяет восстановить нормальную работу костного мозга.
Острый лимфобластный лейкоз (ОЛЛ) – это злокачественное заболевание крови и костного мозга – мягкой губчатой ткани внутри костей, в которой образуются клетки крови.
Острый лимфобластный лейкоз является наиболее распространенным онкологическим заболеванием у детей, а его лечение часто бывает успешным. Острый лимфобластный лейкоз также может развиваться и у взрослых. В таком случае шансы на выздоровление гораздо ниже.
Симптомы острого лимфобластного лейкоза:
- Кровоточивость десен
- Боли в костях
- Лихорадка
- Частые инфекционные заболевания
- Частые или тяжелые носовые кровотечения
- Увеличение шейных, подмышечных, абдоминальных (расположенных в брюшной полости) и паховых лимфоузлов
- Бледность кожных покровов
- Одышка
- Выраженные слабость, утомляемость
Обратитесь к врачу, если у вас или вашего ребенка появились какие-либо настораживающие симптомы.
Многие проявления острого лимфобластного лейкоза напоминают проявления гриппа, однако при гриппе со временем наблюдается улучшение состояния. Если же состояние больного не улучшается, стоит обратиться к врачу.
Острый лимфобластный лейкоз развивается, когда в клетках костного мозга возникает мутация в ДНК, в результате чего клетки продолжают расти и делиться даже тогда, когда нормальная клетка перестает делиться и погибает. Процесс размножения клеток становится неконтролируемым. В костном мозге образуются незрелые клетки, которые развиваются в лейкемические клетки, называющиеся лимфобластами. Эти патологические клетки не способны к нормальному функционированию, они накапливаются и подавляют здоровые клетки.
Не совсем ясно, что является причиной мутации ДНК, приводящей к развитию острого лимфоцитарного лейкоза, но врачи пришли к выводу, что в большинстве случаев это заболевание не является наследственным.
Факторы, повышающие риск развития острого лимфобластного лейкоза:
- Предшествующее лечение онкологического заболевания. Дети и взрослые, которые получали химио- и лучевую терапию по поводу какого-либо онкологического заболевания, имеют более высокий риск развития острого лимфобластного лейкоза.
- Воздействие радиации. Люди, получившие высокую дозу радиоактивного излучения, например, пережившие последствия катастроф на атомных объектах, имеют повышенный риск развития лимфобластного лейкоза.
- Генетические заболевания. Некоторые генетические заболевания, такие как синдром Дауна, связаны с повышенным риском развития острого лимфобластного лейкоза.
- Наличие брата или сестры, страдающего ОЛЛ. Люди, чей брат или сестра, в том числе и близнец, страдают острым лимфобластным лейкозом, имеют более высокий риск развития этого заболевания.
Обратитесь к семейному врачу или врачу общей практики, если у вас и вашего ребенка есть симптомы, которые беспокоят вас. Если ваш врач подозревает острый лимфобластный лейкоз, он, вероятно, направит вас к доктору, который специализируется на лечении заболеваний крови и костного мозга (гематолог).
Время приема может быть кратким, а обсудить нужно очень многое, поэтому желательно подготовиться заранее. Вот некоторая информация, чтобы помочь вам подготовиться, и подскажет, чего ожидать от врача.
Что вы можете сделать
- Будьте в курсе некоторых ограничений режима. Во время приема уточните у врача, нуждаетесь ли вы еще в каких-либо ограничениях, например, в ограничении употребления каких-либо продуктов
- Запишите, какие симптомы вы испытываете, в том числе и те, что могут казаться несвязанными с причиной вашего обращения к врачу.
- Запишите основные сведения о себе, в том числе о недавно перенесенных стрессах и переменах в жизни
- Составьте список всех лекарственных препаратов, витаминов и биодобавок, которые вы принимаете
- Подумайте над тем, чтобы взять с собой на прием члена семьи или друга. Иногда может быть трудно запомнить всю ту информацию, которую вы получаете во время приема врача. Тот, кто сопровождает вас, может запомнить то, что вы забудете или пропустите.
- Запишите вопросы, которые вы хотите задать врачу
Поскольку время приема врача ограничено, желательно подготовить список вопросов к врачу заранее. Расположите вопросы в порядке убывания их важности, на тот случай, если время приема выйдет. Для острого лимфобластного лейкоза список основных вопросов может быть таким:
- Что является наиболее вероятной причиной моих симптомов?
- Какие другие причины возможны?
- В каком обследовании я нуждаюсь?
- Является ли мое состояние временными или хроническим?
- Какая тактика ведения будет оптимальной?
- Какие альтернативные подходы существуют?
- У меня есть сопутствующие заболевания. Как наилучшим образом сочетать их лечение с лечением ОЛЛ?
- Должен ли я ограничивать себя в чем-либо?
- Следует ли мне обратиться к специалисту? Сколько это будет стоить? Покроет ли моя страховка это?
- Есть ли более дешевые препараты-дженерики в качестве альтернативы тем, что вы мне назначили?
- Существуют ли какие-либо брошюры и другие печатные материалы, которые я могу взять с собой? Какие сайты вы рекомендуете?
- От чего будет зависеть, потребуется ли мне дальнейшее врачебное наблюдение?
Кроме этого, не стесняйтесь задавать врачу любые другие вопросы.
Чего ожидать от врача
Врач может задать вам ряд вопросов. Будьте готовы ответить на них – это позволит уделить больше времени интересующим вас вопросам. Ваш врач может спросить:
- Когда появились ваши симптомы?
- Симптомы беспокоят вас постоянно или время от времени?
- Насколько выражены эти симптомы?
- Ухудшает или улучшает что-либо ваше состояние и, если да, то что?
Что вы можете сделать в то же время
Избегайте занятий, которые, как вам кажется, ухудшают ваше состояние. Например, если вы или ваш ребенок чувствуете себя усталыми, старайтесь больше отдыхать. Определите, какие из повседневных занятий являются наиболее важными, и сосредоточьтесь на них.
Для диагностики острого лимфобластного лейкоза применяют следующие методы:
- Общий анализ крови. В общем анализе крови выявляется повышенное число лейкоцитов и сниженное число эритроцитов и тромбоцитов. Кроме того, в крови могут присутствовать бласты – незрелые формы клеток, которые в норме находятся в костном мозге.
- Исследование костного мозга. Для аспирации костного мозга используется игла, которая вводится в подвздошную кость. Образец костного мозга направляется в лабораторию для исследования.
Врач в лаборатории классифицирует клетки крови по их размеру, форме и другим параметрам, выявляет изменения, характерные для лейкемических клеток и устанавливает, происходят ли лейкемические клетки из Т-лимфоцитов или В-лимфоцитов. Эта информация помогает врачу составить план лечения.
- Визуализирующие исследования. Использование таких методов, как рентгенография, компьютерная томография или ультразвуковое исследование, помогают установить, есть ли поражение головного и спинного мозга и других областей организма.
- Спинномозговая пункция. Люмбальная, или спинномозговая пункция, применяется для получения образца спинномозговой жидкости – той жидкости, которая омывает головной и спинной мозг. Образец жидкости
Лечение лимфобластного лейкоза делится на следующие фазы:
- Индукция ремиссии. Это первая фаза лечения лейкоза, целью которой является уничтожение большинства лейкемических клеток в крови и костном мозге и восстановление нормальной выработки клеток крови.
- Консолидационная терапия. Также эту фазу лечения называют постремиссионной терапией. Ее целью является уничтожение всех лейкемических клеток в организме, например, в головном или спинном мозге.
- Поддерживающая терапия. Это третья фаза лечения лейкоза. Ее целью является предотвращение рецидивов. Для лечения используются низкие дозы препаратов и/или излучения. Эта фаза лечения занимает много времени, часто длится годами.
- Профилактическое лечение спинного мозга. В течение каждой фазы лечения пациенты могут получать дополнительное лечение, направленное на уничтожение лейкемических клеток в центральной нервной системе. Для этого химиотерапевтические препараты вводятся непосредственно в спинномозговую жидкость.
В зависимости конкретной клинической ситуации, каждая фаза лечения может длиться от двух до трех лет.
Лечение может включать:
- Химиотерапию. Химиотерапия препаратами, уничтожающими лейкемические клетки, обычно применяется для индукции ремиссии у детей и взрослых, а также в фазах консолидации и поддерживающей терапии.
- Таргетная терапия. Таргетные препараты воздействуют на специфические молекулярные механизмы роста и деления злокачественных клеток.
У некоторых больных с острым лимфобластным лейкозом обнаруживается аномальная хромосома, которая называется Филадельфийской хромосомой. У этих больных таргетные препараты могут быть использованы для атаки на клетки, содержащие эту хромосому.
Таргетные препараты включают иматиниб (Гливек), дазатиниб (Спрайсел), нилотиниб (Тасигна) и блинатумомаб (Блинцито). Эти препараты одобрены для применения только пациентов с Филадельфийской хромосомой и могут применяться только во время или после химиотерапии.
- Лучевая терапия. Для уничтожения лейкемических клеток используется мощное излучение, например, рентгеновское. Если онкологическое заболевание поразило центральную нервную систему, врач может рекомендовать проведение лучевой терапии.
- Трансплантация костного мозга. Трансплантация костного мозга используется на этапе консолидации у пациентов при наступлении рецидива заболевания или при его высоком риске. Эта операция позволяет заменить пораженный костный мозг здоровым, взятым у здорового донора.
Перед трансплантацией проводится химио- или лучевая терапия в высоких дозах для уничтожения собственного костного мозга, который вырабатывает лейкемические клетки. Затем костный мозг заменяют костным мозгом подходящего донора (аллогенная трансплантация).
- Клинические исследования. Клинические исследования – это эксперимент, в котором изучаются новые методы лечения и новые способы использования уже существующих. Участие в клинических исследованиях дает вам или вашему ребенку шанс испытать новейший способ лечения лейкоза, однако соотношение пользы и риска может быть сомнительным. Обсудите возможность участия в клинических исследованиях с вашим врачом.
ОЛЛ у взрослых пациентов
Пожилые люди, например, старше 60 лет, как правило, испытывают больше осложнений от лечения ОЛЛ. Кроме того, они, как правило, имеют худший прогноз течения ОЛЛ по сравнению с детьми.
Обсудите возможные варианты лечения с вашим доктором. Учитывая общее стояние вашего здоровья, а также ваши цели и предпочтения, вы можете принять решение пройти курс лечения ОЛЛ.
Некоторые люди могут отказаться от лечения онкологического заболевания и получать только симптоматическое лечение, которое помогает справляться с симптомами и позволяет прожить максимально активно и комфортно отведенное время.
Хотя лечение острого лимфоцитарного лейкоза обычно бывает успешным, это может занять много времени. Лечение обычно длится два или три года, хотя первые три-шесть месяцев лечения наиболее интенсивны.
На этапе поддерживающей терапии дети могут жить относительно нормальной жизнью и посещать школу. Взрослые могут продолжать работать. Следующие советы помогут вам справиться с заболеванием:
- Узнайте как можно больше о своем заболевании, чтобы увереннее принимать решения по вопросам лечения и ухода. Попросите врача дать как можно больше информации о вашем конкретном заболевании в письменном виде. Это облегчит вам поиск информации о заболевании. Записывайте вопросы, которые вы хотите задать врачу, перед каждым посещением. Ищите информацию о заболевании в вашей местной библиотеке и в интернете. Хорошие источники информации предоставляют Национальный институт онкологии США, Американского общества рака и лейкемии и лимфомы.
- Положитесь на помощь специалистов, которые занимаются вашим лечением. В крупных медицинских и детских онкологических центрах действуют команды, которые могут включать в себя психологов, психиатров, реабилитологов, сиделок, волонтеров, клинических психологов, учителей, диетологов, священников и социальных работников. Эти специалисты могут помочь справиться с целым рядом проблем, в том числе разъяснить ребенку суть процедуры, найти источник финансовой помощи и найти жилье для родственников больного на время лечения. Не стесняйтесь полагаться на их знания и навыки.
- Узнавайте о специальных программах для больных детей. Крупные медицинские центры и некоммерческие организации предлагают многочисленные мероприятия и услуги специально для детей, страдающих онкологическими заболеваниями, и их семей. Например, предлагается отдых в летних лагерях, группы поддержки для братьев и сестер и программы исполнения желаний. Узнайте о подобных программах в вашей области.
- Помогите семье и друзьям понять вас. Создайте бесплатную персонализированную веб-страницу на некоммерческом сайте CaringBridge. Это позволяет вам сообщать всей семье о визитах к врачу, лечении, неудачах и поводах для радости – без стресса и суматохи, связанных с необходимостью информировать большое количество людей каждый раз, когда вам нужно это сделать.
Читайте также:

