Острый лимфобластный лейкоз лабораторные показатели

- Краткие сведения о заболевании
- Изменение показателей крови при лимфоцитарном лейкозе
- Полная диагностика хронического лимфолейкоза
- Итоги
- Видео по теме
Лимфолейкоз относится к неизлечимым гемобластозам – онкогематологическим опухолевым заболеваниям – злокачественным патологиям кроветворной системы и лимфатической (лимфоидной) ткани.
Особенностью болезни является длительное отсутствие соматических симптомов на начальном этапе. Общий анализ крови при лимфолейкозе отличается специфическими изменениями и может стать основанием для предположительной диагностики и дальнейшего обследования пациента.
Краткие сведения о заболевании
Точные причины возникновения заболевания медицинская наука до конца не определяет. Основным фактором считается влияние неблагополучной наследственности, выраженное в передаче последующим поколениям поврежденных генов. Лимфолейкоз характеризуется гиперплазией (разрастанием) лимфатических тканей органов гемопоэза (образования и созревания кровяных клеток), включающих костный мозг, лимфоузлы, селезенку и др.
Прогрессирование гиперплазии связано с бесконтрольным анормальным делением незрелых дефективных лимфоцитов. Атипичные лимфоциты не обладают свойствами полноценных кровяных клеток, но при этом, форсировано размножаются, вытесняют и уничтожают здоровые клетки крови и заполняют кровеносную систему.
Основной лимфоцитарной функцией лимфоцитов является обеспечение иммунного ответа (гуморального иммунитета) на вторжение патогенов и торможение активности раковых и мутирующих клеток собственного организма. Лимфоцитоз – увеличение концентрации лимфоцитов является клиническим признаком нарушенной иммунной защиты.
Заболевание крови имеет две формы:
- острую – накопление в костном мозге и кровотоке бластов (незрелых лимфоцитов);
- хроническую – аккумуляция зрелых, но недееспособных кровяных клеток в лимфоузлах, периферической крови и костном мозге.
ОЛЛ (острый лимфолейкоз) в большинстве случаев диагностируется у детей дошкольного возраста. Хроническая форма характерна для взрослых людей возрастной категории 50+, с преобладанием у мужчин. ХЛЛ (хронический лимфоцитарный лейкоз) развивается по трем стадиям:
- исходная (начальная), или бессимптомная (поражение 1–2 области организма);
- прогрессирующая, с развитием развернутых проявлений (в процесс вовлечены 3 и более участка);
- терминальная или конечная (масштабное поражение лимфосистемы).
Заболевание считается необратимым. Остановить деструктивные процессы кровеносной системы и развернуть их в обратном направлении невозможно. Диагностика ХЛЛ включает ряд лабораторных анализов, молекулярно-биологические, иммунохимические исследования, специфическую микроскопию онкогематологических заболеваний.

Изменение показателей крови при лимфоцитарном лейкозе
Биохимический и общий клинический анализ крови при хроническом лимфолейкозе являются первичными клинико-диагностическими методами. Сложность определения необходимости дальнейшего обследования заключается в том, что врач должен отследить динамику изменений в крови, характерных для ХЛЛ, за несколько месяцев. По однократному анализу чаще всего предполагаются нарушения инфекционного характера.
Обратить внимание необходимо на следующие отклонения в общем анализе крови, типичные для онкопроцессов лимфатической системы:
- Выраженный лейкоцитоз (увеличение концентрации бесцветных клеток крови).
- Сдвиг лейкограммы (лейкоцитарной формулы). В состав лейкограммы входят: лимфоциты, моноциты, нейтрофилы (палочкоядерные и сегментоядерные), эозинофилы, базофилы.
- Присутствие пролимфоцитов (незрелых форм лимфоцитов).
- Измененное количество красных клеток крови (эритроцитов), их незрелых предшественников (ретикулоцитов) и процентного индекса эритроцитов (гематокрита).
- Значительное изменение скорости оседания красных кровяных клеток (СОЭ).
- Несоответствие нормам содержание кровяных пластинок (тромбоцитов) и их процентного соотношения к общему объему крови (тромбокрита);
- Смещение показателей железосодержащего белка крови (гемоглобина).
- Наличие остатков разрушенных лимфоцитов (теней Боткина-Гумпрехта).
Последний показатель указывает на активное разрушение рабочих клеток лейкоцитарного ряда и в нормальных результатах анализа должен полностью отсутствовать. Референсные значения ОКА и примерные показатели крови при лимфоцитарном лейкозе представлены далее в таблице.
| Параметры исследования | Нормальные значения | Единица измерения | Отклонения при возможном лимфолейкозе |
| НВ (гемоглобин) мужчины/женщины | 1З5–160 / 120–1З5 | г/л | до 80 |
| RBC (эритроциты) муж./жен. | З,9–5,5 / З,8–5,4 | 10 12 клеток/л | 2,8 |
| RET (ретикулоциты) | 0,2–1,4 | % | 1 |
| HCT гематокрит | 40–45 | % | 20–25 |
| ESR (скорость оседания эритроцитов) | 1,5–15 | мм/час | 70–75 |
| PLT (тромбоциты ) | 180,0–320,0 | 10 9 клеток/л | 30–32 |
| PCT (тромбокрит) | 0,22–0,24 | % | 0,04 |
| лейкограмма | |||
| WBC (лейкоциты) | 4–9 | 10 9 клеток/л | до 100 |
| BAS (базофилы) | 0,1–1,0 | % | 0 |
| EOS (эозинофилы) | 0,5–5,0 | % | 0 |
| NEU (нейтрофилы): палочкоядерные / сегментоядерные | 1,0–6,1 / 46,8–66,0 | % | 1 /12 |
| LYM (лимфоциты) | 19,4–37,4 | % | 45–75 |
| MON (моноциты) | 3,0–11,0 | % | 1–2 |
Общие выводы по исследованию:
- снижение гемоглобина вдвое (гипогемоглобинемия);
- уменьшение концентрации эритроцитов (эритропения) и гематокрита;
- пятикратное увеличение СОЭ;
- снижение содержание тромбоцитов (тромбоцитопения) и тромбокрита;
- десятикратное повышение уровня лейкоцитов;
- отсутствие базофилов и эозинофилов (активных фагоцитов иммунной системы);
- уменьшение уровня нейтрофилов (нейтропения);
- абсолютный лимфоцитоз (значительное повышение концентрации лимфоцитов);
- обнаруживаются тени Гумпрехта.
Фиксируется сдвиг лейкограммы влево (образование в крови незрелых клеточных форм, которые в норме не обнаруживаются за пределами костного мозга). При остром лимфоцитарном лейкозе определение бластов составляет до 37%, определение пролимфоцитов – до 60%. Из-за недостаточного количества красных кровяных телец и тромбоцитов, резко снижен цветовой показатель крови.

В исходной стадии болезни биохимия является малоинформативным исследованием. При подозрении на лимфолейкоз, биохимический анализ дает основание для дальнейших диагностических процедур на развитой стадии онкогематологической патологии.
При анализе крови на биохимию в стадии прогрессирования лимфоцитарного лейкоза, фиксируются следующие изменения:
- гипопротеинемия (снижение в плазме уровня общего белка – основного строительного материала для новых здоровых клеток организма);
- гипогаммаглобулинемии (уменьшение концентрации белковой фракции глобулинов, защищающих организм от инфекций, бактерий, вирусов и т. д.);
- увеличение содержания мочевой кислоты (при норме 142–339 ммоль/л до 500 ммоль/л) является маркером обменных нарушений;
- повышение показателей ферментов АЛТ и АСТ (аланинаминотрансферазы и аспартатаминотрансферазы) и фермента ЛДГ (лактатдегидрогеназы) как результат поражения паренхимы (ткани) печени.
- повышение значений щелочной фосфатазы (ЩФ) указывает на нарушение оттока желчи;
- рост показателей гамма глутамилтрансферазы (ГГТ) свидетельствует о нарушении синтеза аминокислот, сбое в процессах образования и выведения желчи;
- увеличение уровня билирубина (желчного пигмента) как признак дисфункции печени и других органов гепатобилиарной системы.
Параллельно с патологическими изменениями работы внутренних органов, при пальпации и по симптоматическим жалобам фиксируется гепатоспленомегалия (одновременное увеличение объемов печени и селезенки), увеличение лимфоузлов (шейных, паховых, подмышечных).
Оценка результата производится по интенсивности свечения и количеству светящихся иммунных комплексов. Микроскопия проводится с помощью специального цитофлюориметра или люминесцентного микроскопа. Способ является родственным ИФА (иммуноферментному анализу), но обладает более высокой точностью.
Диагностика позволяет установить не только наличие онкогематологического заболевания, но и его тип (лейкоз, лимфома и др.). Онкомаркером выступает гликопротеин CD52, содержащийся на поверхности зрелых лимфоцитов.
Полная диагностика хронического лимфолейкоза
Для окончательной постановки диагноза лимфоцитарный лейкоз, пациенту назначается ряд исследований:
- Общий анализ крови в развернутом варианте (в сокращенном ОКА учитываются только общее количество лейкоцитов, без градации по лейкограмме).
- Биохимическое исследование крови.
- Иммунофенотипирование лимфоцитов и лейкоцитов.
- Цитогенетическое исследование. Представляет собой микроскопию носителей генной информации – хромосом. Методика основана на дифференциальном окрашивании поврежденных или мутирующих хромосом и оценке результата посредством специального светового оборудования.
- Трепанобиопсия (пункция) костного мозга. Малоинвазивное хирургическое вмешательство в гребень подвздошной кости. Манипуляция проводится специальной иглой с мандреном и ограничителем, с обязательной местной (реже общей) анестезией. Извлеченный фрагмент костномозговой ткани отправляют на гистологическое исследование для определения природы опухоли костного мозга.
На ранних стадиях острого и хронического лимфолейкоза эффективно использование молекулярно-биологических методов исследования.

Итоги
ХЛЛ (хронический лимфолейкоз) – онкогематологичекая патология злокачественного характера, поражающая лимфоидную ткань, кровяные клетки и костный мозг. Этиология болезни досконально не изучена. Принятой версией происхождения лимфоцитарного лейкоза является передача по наследству поврежденного гена.
ХЛЛ относится к разряду неизлечимых заболеваний. При ранней диагностике прогноз на жизнь составляет 10–15 лет. В исходной стадии развития заболевание не проявляется характерными симптомами, поэтому в большинстве случаев диагностируется поздно. Острая форма заболевания характерна для детей, хроническая – для взрослых (старше 50 лет).
Существующие клинические признаки можно наблюдать при стабильном мониторинге результатов общего клинического и биохимического анализа крови (на протяжении нескольких месяцев). Основные показатели лимфолейкоза в общем развернутом анализе крови:
- лейкоцитоз;
- выраженный лимфоцитоз;
- гипогемоглобинемия;
- эритропения и уменьшение процентного числа гематокрита;
- значительное увеличение СОЭ;
- тромбоцитопения и снижение индекса тромбокрита;
- нейтропения;
- обнаружение теней Гумпрехта.
При стойких перечисленных отклонениях в показателях крови пациенту необходимо подробное обследование для подтверждения (опровержения) наличия злокачественных опухолевых процессов в системе кроветворения. Патологические изменения показателей в результатах ОКА и биохимии крови – это не диагноз, а основание для расширенного обследования на рак.
Клинический анализ крови при остром лейкозе. У большинства больных острым лейкозом (ОЛ) на момент диагностики заболевания имеется нормохромная нормоцитарная анемия, в большей степени выраженная при остром миелобластном лейкозе. При развитии геморрагических осложнений может отмечаться гипохромия вследствие дефицита железа. Количество лейкоцитов периферической крови варьирует в очень широких пределах (от 1 • 10 9 /л до 200 • 10 9 /л), но чаще остается на сублейкемическом уровне и не превышает 20-30 • 10 9 /л.
У 20% пациентов количество бластных клеток превышает 50 • 109/л, а у 10% бласты в периферической крови отсутствуют (при этом обычно отмечаются панцитопения и относительный лимфоцитоз). При уровне лейкоцитов выше 100 • 10 9 /л резко повышается риск развития лейкостатических осложнений (неврологические нарушения, острый респираторный дистресс-синдром, у мужчин, кроме того, приапизм).
Тромбоцитопения выявляется у подавляющего числа больных острым лейкозом и более выражена при остром миелобластном лейкозе (ОМЛ) (у половины больных число тромбоцитов менее 50 • 10 9 /л). В то же время у 1-2% пациентов отмечается тромбоцитоз (более 400 • 10 9 /л).
У части больных может отмечаться увеличение протромбинового и парциального тромбопластинового времени; при остром промиелоцитарном лейкозе часто наблюдается снижение уровня фибриногена и другие признаки синдрома ДВС. Следует отметить, что развитие синдрома ДВС возможно при любом варианте острого лейкоза.
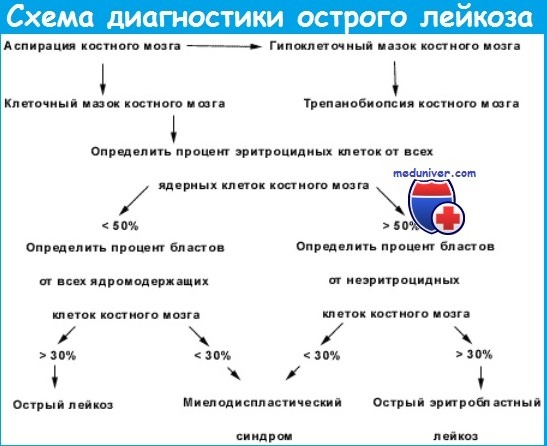
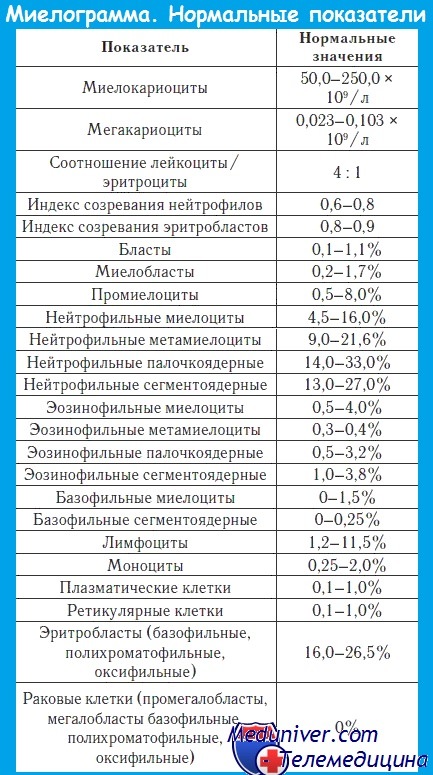
Миелограмма при остром лейкозе. Исследование аспирата костного мозга необходимо для диагностики и установления варианта острого лейкоза. Количество миелокариоцитов обычно повышено, мегакариоциты отсутствуют или их количество снижено. При подсчете миелограммы выявляется не менее 20% бластов, сужение нормальных ростков гемопоэза. Для верификации варианта острого лейкоза необходимо проведение цитохимических, иммунологических и цитогенетических исследований, результаты которых имеют прогностическое значение и позволяют планировать лечебную тактику.
Цитологическое исследование спинномозговой жидкости при остром лейкозе выполняется у всех больных острым лейкозом до начала лечения. При отсутствии патологии при остром лимфобластном лейкозе, миеломонобластных и монобластных острых лейкозов в дальнейшем проводится профилактика нейролейкоза. При развитии нейролейкоза проводят его лечение, результаты которого оцениваются на основании анализа клеточного состава спинномозговой жидкости.
Биохимические исследования при остром лейкозе. В большинстве случаев биохимические показатели находятся в пределах нормальных величин, однако при отдельных вариантах острого лейкоза (ОЛЛ, монобластный лейкоз) может отмечаться нарушение функции почек (повышение уровня креатинина) вследствие их инфильтрации опухолевыми клетками. Специфическая инфильтрация почек и/или их увеличение могут быть документированы с помощью УЗИ или компьютерной томографии. В ряде случаев (при остром лейкозе с гиперлейкоцитозом, острый лимфобластный лейкоз с органомегалией) уже в дебюте заболевания выявляется синдром лизиса опухоли.
Чаще, однако, этот синдром наблюдается при быстром лизисе клеток на фоне химиотерапии и характеризуется гипокальциемией, гиперкалиемией, повышением уровня ЛДГ и гиперурикемией с развитием почечной недостаточности.
Инструментальные исследования при остром лейкозе не имеют решающего значения при остром лейкозе, однако их результаты могут влиять на характер проводимого лечения и прогноз заболевания. Так, рентгенография органов грудной клетки позволяет выявить увеличение лимфатических узлов средостения, пневмонию; электрокардиография — нарушения ритма и/или проводимости, обусловленные специфической инфильтрацией миокарда, антрациклиновой кардиомиопатией и т. д.
Врач-гематолог, доктор медицинских наук Сергей Семочкин про острый лимфобластный лейкоз

Врач-гематолог, профессор кафедры онкологии, гематологии и лучевой терапии РНИМУ им. Н. И. Пирогова Минздрава России, доктор медицинских наук Сергей Семочкин рассказал: можно ли распознать острый лимфобластный лейкоз (ОЛЛ) на ранней стадии и поставить диагноз по анализу крови; объяснил, как лечат ОЛЛ и кому показана трансплантация костного мозга (ТКМ).
Как правило, в анализе крови есть ярко выраженные показатели: изменены ростки кроветворения, количество лейкоцитов выходит за пределы нормы - может упасть ниже нормальных значений, а может стать запредельно огромным. Мне встречались пациенты, у которых количество лейкоцитов при норме от 4 до 9 тысяч повышалось до 200 тысяч на мкл. Тромбоциты тоже в ряде случаев очень сильно снижены, но главное – изменение количества лейкоцитов. Очень важным маркером является выход опухолевых клеток в кровь, когда в крови появляются незрелые ранние клетки, которые называют бластными. Если в анализе крови выявили бластные клетки, то это, скорее всего, либо острый лейкоз, либо миелодиспластический синдром.
Анализ крови с характерными изменениями - повод для немедленного вызова скорой помощи и госпитализации пациента в профильный стационар. При лечении детей и подростков у онкогематолога, как правило, есть один-два дня ни диагностику, лечение необходимо начинать, как можно раньше. В диагностику входит повторный анализ крови, затем – верификация диагноза, для которой проводят биопсию костного мозга. У маленьких детей ее проводят под общей анестезией, у взрослых - под местной. С помощь небольшой иглы делаю прокол грудины или подвздошной кости. У детей пункцию грудины не делают. Полученный образец костного мозга, который выглядит как обычная пробирка с кровью, отправят в лабораторию, где для подтверждения диагноза проведут целый спектр исследований. Главный критерий – увеличение количества бластных клеток. Только по внешнему виду и по количеству бластных клеток определить вариант лейкоза – невозможно. Еще в 1913 году установили, что есть лимфоидный, а есть миелоидный вариант лейкоза. Для верификации применяются специальные лабораторные методы: иммунологические и химические. Существует специальный прибор – проточный цитометр, с помощью которого определяют маркеры, характеризующие данный тип клеток. Для определения подвида острого лейкоза, применяют целый спектр генетических исследований, чтобы выйти на более целевую терапию у этих пациентов.
Истинную причину возникновения лейкоза у взрослых можно выявить только в 5% случаев, в 95% совершенно непонятно, что там к чему привело. У детей все несколько интересней.
Как возникает лейкоз? В генетическом материале клетки возникает некая первичная мутация, которая сама по себе далеко не всегда приводит к лейкозу. В дальнейшем к этой мутации присоединяются другие, и когда болезнь все же возникает, в клетке накоплено уже много молекулярных событий, сочетание которых привело возникновению заболевания. Пик острого лимфобластного лейкоза приходится на детей от двух до четырех лет, потом заболеваемость падает. Следующий пик приходится на 18-29 лет, потом снова спад. После 60 лет - опять небольшой рост.
У части детей раннего возраста прослеживается некая врожденная составляющая этой проблемы. Встречаются случаи ОЛЛ у плода или новорожденного, когда ребенок рождается уже с заболеванием, либо заболевает в течение первого года жизни. Исследования пуповинной крови показали, что у новорожденных встречаются лейкемические поломки, врожденные мутации, которые могут привести к возникновению лейкоза. И мутацию эту вызывает наследственный фактор, сработавший во время внутриутробного развития. По разным данным, общее количество таких младенцев составляет от 1 до 5%. Дальше многое зависит от инфекционной обстановки, сложившейся вокруг ребенка. Многочисленные инфекции, перенесенные в детстве, способствуют формированию нормальной иммунной системы, которая нейтрализует наследственный фактор.
Если говорить про экологические проблемы, то с ними четкой связи не выявлено.
В Хиросиме и Нагасаки повышенная заболеваемость держалась около 12 лет. После Чернобыля у многих пострадала щитовидная железа, но заболеваемость лейкозами не выросла. Все зависит от типа изотопов попавших в окружающую среду. В Фукусиме тоже этого не случилось, потому что концентрация радиоактивных веществ сильно разбавилась морской водой.
Вред ультрафиолета научно доказан только в отношении меланомы. Четкой связи с ОЛЛ нет. Своим бывшим пациентам мы не разрешаем посещать солярий и не рекомендуем загорать, потому что хотя связь и не доказана, совсем исключать этот фактор тоже нельзя.
Если говорить об СВЧ-излучении, домашние микроволновые печи абсолютно безопасны.
В отличие от острого миелоидного лейкоза, показаний к аллогенной (от донора) ТКМ меньше. Ее назначают пациентам, которые не достигли ремиссии в указанные протоколом сроки или имеют неблагоприятный цитогенетический вариант заболевания. В детской практике выздоравливают более 90% детей, и примерно 15-20% являются кандидатами для аллогенной ТКМ. У взрослых процент пациентов нуждающихся в трансплантации несколько выше, за счет того, что генетических операций высокого риска становится намного больше и ответ на стандартное лечение хуже. Когда мы обсуждали хронический миелолейкоз, там фигурировала филадельфийская хромосома - транслокация (9;22). При ОЛЛ это абсолютно негативный фактор прогноза. У детей такая мутация встречается меньше чем в 5% случаев, у людей старше 50-60 лет примерно половина В-линейных ОЛЛ будет с филадельфийской хромосомой. В отличие от хронического миелолейкоза, применение ингибиторов тирозинкиназы при остром лимфобластном лейкозе не столь успешно. Вот поэтому во взрослой практике ТКМ необходимо проводить примерно 30% пациентов. Возрастной порог для аллогенной ТКМ - в районе 55 лет, это разумно.
Если мы говорим про взрослых людей, то рецидивы случаются почти в 40% случаев. Бывают ранние рецидивы, которые случаются прямо на терапии. В таком случае необходимо менять лечение, делать его более интенсивным и тяжелым. В таких случаях, как правило, показана ТКМ. Поздний рецидив может случиться и через 20 лет. К сожалению мы не можем убрать причину, которая вызывает это заболевание - оно может вернуться.
Длительная химиотерапия нарушает фертильность, поэтому лучше провести криоконсервацию спермы/яйцеклетки, а еще лучше эмбриона - это более надежный способ. У мужчин, как правило, серьезно нарушается сперматогенез, но у женщин дело обстоит несколько лучше. Вероятность забеременеть и выносить здорового ребенка высока. Если прошло не менее пяти лет в ремиссии, никаких ограничений нет.
Скорее, нет. Это не такое частое явление, как при некоторых других заболеваниях, где беременность действительно может стать провоцирующим фактором.
Лимфобластный лейкоз – редкое заболевание, поэтому вероятность того, что он случится у ребенка, рожденного от родителей после ОЛЛ, крайне мала.
Представляется, что в основе лечения онкологических заболеваний в будущем станет активация собственного иммунитета. Нам необходимо настроить иммунную систему таким образом, чтобы она распознавала и убирала раковые клетки. Сейчас мы находимся на раннем этапе развития CAR-T-терапии, но через какое-то время технологии настолько усовершенствуются, что, скорее всего, она станет одним из основных методов терапии при целом ряде онкогематологических заболеваний. Суть метода заключается в том, что у пациента собирают его собственные Т-лимфоциты и отправляют в специальную лабораторию. Эта лаборатория может быть в другом городе, стране - не важно. В лаборатории эти Т-лимфоциты перепрограммируются: в них появляется информация об опухолевых клетках, присутствующих в организме пациента. После перепрограммирования Т-лимфоциты вводят обратно пациенту, она находят раковые клетки и возникает ремиссия. Основные проблемы – создать качественный процесс распознавания и разработать стандартные протоколы лечения.
Много вопросов возникает в понимания биологии заболевания, потому как каждый конкретный случай весьма индивидуален. Мы знакомы только с грубыми поломками, но каждая отдельная поломка провоцирует различное течение болезни. Мы уже сейчас можем полностью секвенировать геном опухолевой клетки и главное научиться понимать, что в патогенезе является ключевым и как на это можно воздействовать, тогда мы ближе подойдем к полному излечению болезни. За этим будущее.
Что такое острый лимфобластный лейкоз?
Острый лимфобластный лейкоз (или острый лимфолейкоз, сокр. ОЛЛ) — это опасное для жизни заболевание, при котором клетки, в нормальных условиях развивающиеся в лимфоциты, становятся злокачественными и быстро замещают нормальные клетки в костном мозге.
- В связи с недостатком нормальных клеток крови у больных могут появляться такие симптомы, как повышение температуры, слабость и бледность.
- Как правило, в таких случаях выполняются анализы крови и исследование костного мозга.
- Проводится химиотерапия, которая часто оказывается эффективной.
Острый лимфолейкоз (ОЛЛ) встречается у больных любого возраста, но является самым распространенным типом онкологических заболеваний у детей и составляет 75% всех случаев лейкоза у детей до 15 лет. ОЛЛ наиболее часто поражает детей младшего возраста (от 2 до 5 лет). Среди людей среднего возраста это заболевание встречается немного чаще, чем у больных старше 45 лет.
При ОЛЛ очень незрелые лейкозные клетки скапливаются в костном мозге, разрушая и замещая клетки, которые производят нормальные клетки крови. Лейкозные клетки переносятся с кровотоком в печень, селезенку, лимфатические узлы, головной мозг и яички, где могут продолжать расти и делиться. При этом клетки ОЛЛ могут скапливаться в любой части организма. Они могут проникать в оболочки, покрывающие головной и спинной мозг (лейкозный менингит), и приводить к анемии, печеночной и почечной недостаточности и повреждению других органов.
Симптомы острого лимфобластного лейкоза

Ранние симптомы ОЛЛ возникают в результате неспособности костного мозга вырабатывать достаточное количество нормальных клеток крови.
- Повышение температуры и чрезмерное потоотделение могут указывать на наличие инфекции. Высокий риск инфекции связан со слишком малым количеством нормальных лейкоцитов.
- Слабость, утомляемость и бледность, свидетельствующие об анемии, могут появляться из-за недостаточного количества эритроцитов. У некоторых больных может наблюдаться затрудненное дыхание, учащенное сердцебиение и боль в груди.
- Быстро появляющиеся кровоподтеки и кровотечения, иногда в форме носовых кровотечений или кровотечений из десен, возникают из-за слишком малого количества тромбоцитов. В некоторых случаях может возникать кровоизлияние в головной мозг или внутрибрюшное кровотечение.
При проникновении лейкозных клеток в другие органы возникают соответствующие симптомы.
- Лейкозные клетки в головном мозге могут вызывать головные боли, рвоту, инсульт и нарушения зрения, равновесия, слуха и лицевых мышц.
- Лейкозные клетки в костном мозге могут приводить к болям в костях и суставах.
- Если лейкозные клетки вызывают увеличение печени и селезенки, может появляться ощущение переполнения желудка и в некоторых случаях боль.
Причины острого лимфобластного лейкоза
Основная причина ОЛЛ остается неизвестной, но существуют факторы риска, которые могут быть экологическими или вторичными по отношению к наследственным и/или приобретенным предрасполагающим условиям. Факторами риска окружающей среды являются прошлое облучение ионизирующим излучением, химическими веществами (бензол, гербициды и пестициды) и химиотерапевтическими агентами.
К наследственным предрасполагающим состояниям относятся синдром Дауна, наследственные расстройства, характеризующиеся дефектом процессов репарации ДНК и регуляции клеточного цикла (анемия Фанкони, синдром Блума и атаксия-телеангиэктазия), наследственные расстройства, характеризующиеся изменением передачи сигнала в процессах пролиферация клеток и апоптоз (синдром Костмана, синдром Швахмана–Даймонда, анемия Даймонда–Блекфена и нейрофиброматоз типа I) и синдром Ли-Фраумени.
Существуют также приобретенные предрасполагающие состояния, такие как апластическая анемия, пароксизмальная ночная гемоглобинурия и миелодиспластический синдром.
Диагностика
Первые признаки острого лимфобластного лейкоза можно обнаружить при помощи анализов крови, таких, как общий анализ крови. Общее количество лейкоцитов может быть сниженным, нормальным или повышенным, но количество эритроцитов и тромбоцитов почти всегда оказывается сниженным. Кроме того, в крови обнаруживаются очень незрелые лейкоциты (бласты).
Чтобы подтвердить диагноз и отличить ОЛЛ от других типов лейкозов, практически во всех случаях проводится исследование костного мозга. Бласты анализируют на наличие хромосомных аномалий, что помогает врачам определить точный тип лейкоза и подобрать подходящие препараты для лечения.
Анализы крови и мочи назначаются для выявления других отклонений, включая электролитные нарушения.
Также могут потребоваться визуализирующие исследования. При выявлении симптомов, позволяющих заподозрить наличие лейкозных клеток в головном мозге, проводится компьютерная томография (КТ) или магнитно-резонансная томография (МРТ). Для выявления лейкозных клеток в области вокруг легких может выполняться КТ органов грудной клетки. При увеличении внутренних органов могут проводиться КТ, МРТ или ультразвуковое исследование брюшной полости. Перед началом химиотерапии может быть выполнена эхокардиография (ультразвуковое исследование сердца), поскольку иногда химиотерапия оказывает отрицательное воздействие на сердце.
Лечение острого лимфобластного лейкоза
Лечение ОЛЛ включает:
- химиотерапию;
- другие препараты, такие как иммунотерапия и/или таргетная терапия;
- в редких случаях трансплантация стволовых клеток или лучевая терапия.
Химиотерапия является высокоэффективной и состоит из следующих фаз:
- индукция;
- лечение головного мозга;
- консолидация и интенсификация;
- поддерживающая терапия.
Индукционная химиотерапия — это первая фаза лечения. Задача индукционной терапии состоит в достижении состояния ремиссии посредством уничтожения лейкозных клеток, что восстанавливает способность нормальных клеток развиваться в костном мозге. В некоторых случаях требуется пребывание в больнице в течение нескольких дней или недель (это зависит от того, насколько быстро восстанавливается костный мозг).
Применяется одна из нескольких комбинаций лекарственных препаратов, дозы которых вводятся повторно в течение нескольких дней или недель. Выбор конкретной комбинации зависит от результатов диагностических анализов. Одна из комбинаций состоит из преднизона (кортикостероида), принимающегося внутрь, и еженедельных доз винкристина (химиотерапевтического препарата), назначаемого вместе с препаратом антрациклина (обычно даунорубицином), аспарагиназой и иногда циклофосфамидом, для внутривенного введения. У некоторых пациентов с острым лимфолейкозом могут использоваться новые препараты, такие как иммунотерапия (лечение, которое использует собственную иммунную систему человека для уничтожения опухолевых клеток) и таргетная терапия (препараты, которые атакуют внутренние биологические механизмы опухолевых клеток).
Лечение головного мозга обычно начинается во время индукции и может продолжаться на всех этапах лечения. Поскольку ОЛЛ часто распространяется и на головной мозг, эта фаза также направлена на лечение лейкоза, уже распространившегося в головной мозг, либо на профилактику распространения лейкозных клеток в головной мозг. Для воздействия на лейкозные клетки в слоях ткани, покрывающих головной и спинной мозг (мозговых оболочках), применяются лекарственные препараты, такие, как метотрексат, цитарабин, кортикостероиды или их комбинации, которые обычно вводятся прямо в спинномозговую жидкость, либо высокие дозы этих препаратов могут вводиться внутривенно. Такая химиотерапия может проводиться в сочетании с лучевой терапией головного мозга.
В фазе консолидации и интенсификации продолжается лечение заболевания костного мозга. Дополнительные химиотерапевтические препараты или те же препараты, что и во время фазы индукции, могут применяться несколько раз за период, который продолжается в течение нескольких недель. Некоторым больным с высоким риском рецидива в связи с определенными хромосомными изменениями в лейкозных клетках назначают пересадку стволовых клеток после достижения ремиссии.
Дальнейшая поддерживающая химиотерапия, которая обычно заключается в приеме меньшего количества препаратов (в некоторых случаях в меньших дозах), продолжается, как правило, в течение 2–3 лет.
Пожилые люди с ОЛЛ могут быть не способны перенести интенсивную схему лечения, используемую у молодых людей. У таких больных может быть использован более щадящий вариант лечения с применением только режимов индукционной терапии (без последующей консолидации, интенсификации или поддерживающей терапии). Иногда у некоторых пожилых людей может назначаться иммунотерапия или более щадящая форма трансплантации стволовых клеток.
Во время всех вышеуказанных фаз для лечения анемии и предотвращения кровотечений может потребоваться переливание крови и тромбоцитов, а для лечения инфекций — прием противомикробных препаратов. Чтобы помочь избавить организм от вредных веществ (таких как мочевая кислота), которые образуются при разрушении лейкозных клеток, могут проводиться внутривенные вливания жидкостей и лечение препаратами аллопуринол либо расбуриказа.
Лейкозные клетки могут начать появляться снова (такое состояние называют рецидивом). Часто они образуются в крови, костном мозге, головном мозге или яичках. Раннее повторное появление таких клеток в костном мозге является особенно серьезным. Химиотерапия проводится еще раз, и, хотя многим больным помогает такое повторное лечение, существует большая вероятность повторного рецидива заболевания, особенно у детей первого года жизни и взрослых. Если лейкозные клетки повторно появляются в головном мозге, химиотерапевтические препараты 1 или 2 раза в неделю вводятся в спинномозговую жидкость. Если лейкозные клетки повторно появляются в яичках, то наряду с химиотерапией проводится лучевая терапия на область яичек.
У некоторых пациентов с рецидивирующим ОЛЛ используются новые перспективные методы лечения с использованием моноклональных антител (белков, которые специфически связываются с лейкозными клетками, маркируя их для уничтожения). Еще более новая терапия, которую можно применять у некоторых пациентов с рецидивом острого лимфобластного лейкоза, называется Т-клеточная терапия с химерным антигенным рецептором (CAR-T). Эта терапия предусматривает модификацию определенного вида лимфоцитов (Т-лимфоцитов, также называемых Т-клетками) от больного лейкозом таким образом, чтобы эти новые Т-лимфоциты лучше распознавали и атаковали лейкозные клетки.
После рецидива у больных, неспособных перенести пересадку стволовых клеток, дополнительная терапия часто оказывается плохо переносимой и неэффективной и обычно приводит к серьезному ухудшению самочувствия. Тем не менее, могут случаться ремиссии. В отношении пациентов, которым не помогает лечение, должен рассматриваться вариант ухода за неизлечимо больными людьми.
Прогноз жизни
До появления лечения большинство больных с острым лимфолейкозом умирали в течение нескольких месяцев с момента постановки диагноза. Теперь ОЛЛ удается излечить примерно у 80% детей и у 30–40% взрослых. У большинства больных первый курс химиотерапии позволяет взять заболевание под контроль (полная ремиссия). Лучшие прогнозы на излечение имеются у детей в возрасте 3-9 лет. Прогнозы для детей первого года жизни и пожилых больных менее благоприятны. Количество лейкоцитов на момент установления диагноза, наличие или отсутствие распространения лейкоза в головной мозг и хромосомные аномалии в лейкозных клетках также влияют на результат лечения.
Читайте также:

