Остаточная опухоль что это такое

Французский хирург Пьер Денуа в 1943–1952 гг. разработал систему TNM для классификации злокачественных опухолей. В 1953 г. Комитет по номенклатуре опухолей и статистике, организованный Международным противораковым союзом (UICC), и Международная комиссия по стадированию рака достигли соглашения по классификации анатомической распространенности опухолей на основе системы TNM. В 1954 г. UICC создал Комитет по клинической классификации и прикладной статистике, который в 1958 г. опубликовал первые рекомендации по клинической классификации рака молочной железы и гортани.
В 1968 г. издается 1-я редакция TNM-классификации злокачественных опухолей.
Последняя (7-я) редакция правил классификации и стадирования полностью соответствует 7-й редакции руководства по стадированию рака и одобрена всеми национальными TNM-комитетами.
Классификация остается без изменений, пока не будут сделаны крупные достижения в диагностике и лечении злокачественных опухолей.
Общие правила системы TNM
Это первый лимфоузел, получающий лимфу из первичной опухоли. Если в нем имеется метастаз, то и другие лимфоузлы могут быть поражены. Если этот лимфоузел не поражен, то и наличие метастазов в других узлах маловероятно. Иногда встречается более одного сигнального лимфоузла.
Отдельные опухолевые клетки
Отдельные опухолевые клетки (ITC) представляют собой единичные опухолевые клетки или маленькие кластеры клеток не более 0,2 мм в наибольшем измерении, которые обычно выявляются при световой микроскопии (окраске гематоксилин-эозином) либо иммуногистохимически. ITC обычно не демонстрируют метастатической активности (пролиферацию или реакцию стромы) или инвазии стенок сосудистого либо лимфатического синуса. Случаи с ITC в лимфатических узлах или отдаленных органах и тканях должны классифицироваться как N0 или M0 соответственно.
Это же применимо и к случаям, когда наличие опухолевых клеток или их компонентов подтверждается неморфологическими исследованиями — такими, как проточная морфометрия или анализ ДНК.
Случаи с ITC должны анализироваться отдельно…
Классификация остаточных опухолей (R).
Группировка по стадиям
Оценка общего состояния онкобольного
Общее состояние онкобольного рекомендовано оценивать по индексу шкале Карновского (100–0%) или шкале ECOG (0–4 балла) (см. табл. 2, 3).
Опухоли головы и шеи
Общие принципы лечения
Лечение зависит от факторов, связанных с характеристикой опухоли, и общего состояния пациента. Основными целями терапии являются излечение от опухоли, сохранение или восстановление функций органов полости рта, уменьшение осложнений лечения. Для успешного исхода требуется, как правило, мультидисциплинарный подход. Химиотерапевтическое и лучевое лечение должны быть хорошо организованными и контролироваться химиотерапевтами и радиологами, имеющими знания об особенностях лечения и осложнений у таких больных.
Способность пациента перенести оптимальную программу лечения является важным фактором принятия решения о ее проведении.
Выбор стратегии в основном осуществляется между хирургическим лечением, лучевой терапией и комбинированными методами.
Хирургический метод допустим лишь при лечении опухолей I стадии, которые можно радикально удалить с хорошим функциональным исходом. В остальных случаях рак I–II стадии лечится лучевым методом и комбинированно. Пациенты с распространенным раком всегда требуют комбинированного лечения. Неотъемлемой частью лечения этих больных являются расширенные резекции с выполнением реконструктивно-восстановительных операций. Применение неоадъ-
ювантной химиотерапии при ряде локализаций или одновременной химиотерапии и лучевого лечения позволяет увеличить число органосохраняющих вмешательств и перевести часть первично нерезектабельных опухолей в резектабельное состояние.
Послеоперационная лучевая терапия проводится при высоком риске развития рецидива (наличие 2 или более регионарных метастазов, нарушение целостности капсулы лимфоузла, наличие опухолевых клеток в краях отсечения тканей)…
Рак губы и слизистой оболочки полости рта (с00–с06)
Абсолютное большинство злокачественных новообразований слизистой полости рта и губы представлено плоскоклеточным раком (95%). Характерной его особенностью является склонность к лимфогенному метастазированию в поверхностные и глубокие лимфатические узлы шеи. Самый высокий процент регионарного метастазирования (40%) отмечается при раке языка.
Кроме плоскоклеточного рака, на слизистой оболочке полости рта могут развиваться меланома, аденокарцинома, аденокистозная карцинома и др. опухоли.
(Продолжение следует).
Систему определения стадии рака используют для описания большинства видов опухолей. Эта система отражает расположение опухоли и наличие метастазов.
Стадирование опухолей ЦНС в зависимости от наличия метастазов (М-стадия)
| М - стадия | Метастазирование |
| М0 | Метастазов нет |
| М1 | Опухолевые клетки в ликворе |
| М2 | Метастазы в пределах головного мозга |
| М3 | Метастазы в спинной мозг |
| М4 | Экстраневральные метастазы (в других органах за пределами нервной системы) |
Практически очень важна классификация по степени злокачественности, так как позволяет делать прогноз и определять тактику лечения.
Прогностические факторы
Гистологический анализ опухоли. Для выбора оптимальной стратегии лечения необходимо определить характер и стадию развития опухоли. С помощью биопсии или после удаления опухоли берут небольшой участок опухолевой ткани и проводят гистологический анализ. Микроскопическое исследование помогает охарактеризовать природу опухоли (тип клеток), ее происхождение и степень злокачественности.
Чтобы определить, насколько злокачественна и агрессивна опухоль, нужно сравнить строение ее клеток с нормальными клетками, из которых эта опухоль развивается. Здоровые органы состоят из множества сгруппированных между собой высокодифференцированных клеток, имеющих характерные признаки зрелой ткани. Если новообразованная ткань выглядит похожим образом, значит опухоль имеет высокую дифференциацию клеток и низкую степень злокачественности. И наоборот: опухоль будет низкодифференцированной и высокозлокачественной при сильном отличии ее клеток от клеток здоровой ткани.
Опухоли ЦНС представляют собой гетерогенную группу новообразований, различающуюся в первую очередь по гистологическому варианту. Терапевтический подход к лечению опухолей ЦНС в большинстве случаев зависит от степени злокачественности опухоли: так опухоли низкой степени злокачественности – I степень (grade I) обычно подлежат только оперативному лечению; при промежуточной степени злокачественности II степень (grade II) выполняется оперативное удаление опухоли и лучевая терапия, а при высокой степени злокачественности (grade III-IV) лечение обязательно включает в себя удаление опухоли, лучевую терапию и химиотерапию.
Размер остаточной опухоли. Применяется следующая классификация по результатам хирургического вмешательства:
- Тотальная резекция: опухоль удалена полностью, однако может оставаться микроскопическое количество клеток;
- Субтотальная резекция: удалена практически вся опухоль, кроме труднодоступных участков;
- Частичная резекция: удалена небольшая часть опухоли;
- Биопсия: взяты отдельные участки опухоли для анализа.
Прогноз выздоровления является самым высоким при полном хирургическом удалении опухоли.
Локализация опухоли. Опухоль может развиться в любой части мозга. Прогноз будет зависеть от доступности опухоли для лечения, в том числе хирургического, и клинических проявлений.
Метастазирование. Первичная злокачественная опухоль головного или спинного мозга у взрослых редко дает метастазы. Поэтому, за редким исключением, проводить исследования легких, печени, костей и других органов не требуется. 
Онкомаркеры. В диагностике интракраниальных (внутричерепных) герминативно-клеточных опухолей (ГКО) важно определение онкомаркеров в сыворотке крови и люмбальном ликворе – α-фетопротеина (АФП) и β-хориогонического гонадотропина (β-ХГЧ). Повышение уровня АФП и ХГЧ является диагностическим и не требует гистологической верификации опухоли. Исследование уровней АФП и β-ХГЧ используется для диагностики ГКО, оценки ответа на химио- (ХТ) и лучевую (ЛТ) терапию, выявления рецидива заболевания. Однако повышение уровня АФП и β-ХГЧ не обязательно указывает на прогрессирование опухолевого процесса – их резкий подъем может наблюдаться при лизисе опухоли на фоне химиотерапии (период полужизни АФП составляет 6 дней, β-ХГЧ – 16 ч)
Ученые заняты поиском и других онкомаркеров, которые могли бы облегчить диагностику опухолей и предсказать течение заболевания.
В настоящее время исследуют изменения в гене, кодирующем синтез О⁶-метилгуанин-ДНК-метилтрансферазы (МГМТ). Клетки опухоли, активно синтезирующие этот фермент, мало чувствительны к действию алкилирующих противоопухолевых препаратов. Влияние с помощью методов генной инженерии на активность этого гена в опухолевых клетках и уменьшение таким образом продукции фермента делает клетки более чувствительными к повреждающему действию противоопухолевых препаратов. Развитие молекулярной диагностики и генной инженерии помогает врачам и пациентам побеждать злокачественные опухоли.
Рецидив опухоли. Таким термином обозначают возобновление роста опухоли на ее исходном месте после проведенного лечения. При рецидиве опухоли обычно повторяют диагностические тесты, чтобы заново определить ее характеристики и прогностические факторы.
Интерпретация по совокупности вышеперечисленных факторов дает наиболее вероятный прогноз выздоровления.
Дифференциация — степень сходства опухолевых клеток с клетками органа, из которого она происходит.
Хотелось бы, чтобы ничего не оставалось. Резидуальная опухоль молочной железы – это остаточная карцинома после хирургического вмешательства или курса химиотерапии: нерадикальная операция или недостаточный эффект от лекарств создают условия для сохранения злокачественного новообразования.
Перерождение
Резидуальная опухоль молочной железы
- Rx – в силу каких-либо причин нет возможности обнаружить остатки карциномы после лечения;
- R0 – отсутствие остаточной карциномы;
- R1 – наличие резидуальных раковых клеток определяется только при микроскопическом исследовании;
- R2 – остатки злокачественного новообразования можно определить макроскопически при обычных исследованиях (маммография, ультразвуковое сканирование, МРТ).
Оставшаяся часть злокачественного новообразования может стать основой для повторного роста карциномы. Даже при R1 из нескольких сохранившихся раковых клеток может сформироваться местный рецидив онкологии через годы после последнего курса лечения.
Остаточная опухоль: каковы причины?
Не надо обвинять онколога или хирурга. Резидуальная опухоль молочной железы – это следующие объективные причины:
- Поздняя стадия рака молочной железы, при которой практически невозможно выполнить радикальную операцию;
- Выживание раковых клеток в не увеличенном лимфоузле, который не был удален при операции;
- Не обнаруженные очаги предрака, дополняющие основной очаг в груди (дольковый или протоковый рак in situ, находящийся в стороне от основного злокачественного узла на 1 стадии онкологии – выполняется секторальная резекция, а через несколько лет обнаруживается резидуальная опухоль молочной железы);
- Нерадикальность операции, обусловленная желанием врача и пациентки сохранить ткани груди для будущей маммопластики (перед операцией проводится курс химиотерапии, который резко уменьшает размер новообразования, что становится причиной проведения органосохраняющего хирургического вмешательства);
- Обнаружение в крае резекции раковых клеток (хирург во время проведения операции был уверен в радикальности хирургического вмешательства, а врач-гистолог обнаружил микроскопические опухолевые очаги по краю удаленных тканей);
- Ложная надежда на эффективность неоадъювантной и/или адъювантной химиотерапии (предоперационная ХТ привела к полному лечебному патоморфозу, после которого пациентка отказалась от удаления груди, или проведение нескольких курсов терапии после нерадикально выполненной операции, которые не дают ожидаемого лечебного действия);
- Сохранение во время операции тканей молочной железы, где проводилась предоперационная биопсия.
Чаще всего, резидуальная опухоль молочной железы – это местный рецидив карциномы, выявляемый в ближайшие годы после комплексной терапии. Впрочем, вернувшееся злокачественное новообразование никуда и не уходило: умело спрятавшись, карцинома дождалась благоприятных условий и снова начала расти. Тактика лечения типична – по возможности, радикально удалить. И снова использовать курсы ХТ для борьбы с болезнью.
Современные подходы к лечению злокачественных новообразований предполагают планирование наиболее эффективного курса лечения и определение прогноза заболевания, что невозможно без объективной оценки анатомической распространенности опухолевого процесса, гистологической формы и ряда других прогностических факторов.
Для этого необходимо классифицировать по разным критериям опухолевый процесс, что позволяет оптимизировать, а также оценивать эффективность лечения каждого конкретного больного в сравнительном аспекте, независимо от того, в какой стране он лечился.
Поскольку опухолевые процессы исключительно разнообразны по морфологическим и клиническим проявлениям, то исчерпать в какой либо классификации все варианты злокачественного роста чрезвычайно трудно.
Клиническая классификация злокачественных опухолей
Как показывает клинический опыт, среди многочисленных факторов, влияющих на течение и исход заболевания, наиболее отвечающим целям и задачам классификации по стадиям представляется степень распространения новообразования к моменту установления диагноза.
Распространенность опухолевого процесса характеризуется тремя основными параметрами: размер первичной опухоли и ее переход на соседние анатомические структуры, наличие метастазов в регионарных лимфатических узлах и наличие отдаленных метастазов.
Именно суммарная характеристика этих компонентов, учитывающая особенности процесса в пределах каждого из них, положена в основу двух параллельно существующая классификация злокачественных новообразований: деления их на 4 стадии (TNM).
Принятая в республике и во многих других странах классификация по стадиям базируется на принципах, которые из-за специфики течения новообразований разных локализаций могут быть сформулированы только в самой общей форме.
В зависимости от размеров, степени прорастания в окружающие органы и ткани, метастазирования в лимфатические узлы и отдаленные органы, выделяют следующие стадии:
Относятся опухоли с малыми размерами первичного очага (обычно до 1 см, но не более 3 см в диаметре), ограниченного пределами исходной ткани при отсутствии определимых регионарных метастазов и метастазов в другие органы.
Характерны большие, чем при I стадии, размеры первичной опухоли (как правило, от 3 до 5 см в диаметре) или меньшая величина новообразования, прорастающая подлежащие ткани органа без выхода за его пределы, без регионарных или при наличии одиночных (1-2) смещаемых регионарных метастазов. Отдаленных метастазов нет.
Диаметр первичной опухоли более 5 см, или распространение ее за пределы пораженного органа, но без прорастания соседних структур, независимо от того, имеются или нет одиночные регионарные метастазы; или наличие множественных смещаемых (удалимых) регионарных метастазов даже при минимальных размерах опухоли, которая не прорастает пораженный орган.
Основными признаками являются местное распространение опухоли на соседние органы (прорастание) либо наличие отдаленных (лимфогенных или гематогенных) метастазов вне зависимости от размеров первичного новообразования и даже если в момент исследования оно не обнаруживается (так называемые оккультные формы).
Определение IV стадии при подавляющем большинстве солидных злокачественных новообразований не вызывает существенных затруднений. Наибольшие разногласия возникают в условиях клинического исследования, предполагающего использование рентгенологических, эндоскопических, цитологических, радионуклидных методов и различных видов биопсии, при дифференцировании между I-II и II-III стадиями.
Как правило, разделение на стадии построено на сравнительно незначительных отличиях в размерах первичной опухоли, довольно субъективном представлении о ее подвижности и прорастании в прилегающие структуры или оценке истинного числа метастатических очагов в регионарных лимфатических узлах.
Поэтому для некоторых злокачественных новообразований определение стадии оказывается реально возможным только после хирургического вмешательства и гистологического исследования операционного препарата — опухоли, удаленной вместе с регионарными лимфатическими узлами или без них.
Представленная в общем виде система классификации по стадиям широко используется в онкологической практике. Однако ей присущ ряд недостатков. Это, прежде всего, неизбежный субъективизм в оценке клинических признаков и зависимость от полноты обследования больного.
Кроме этого, четыре градации степени распространения опухолевого процесса не охватывают всего разнообразия проявлений последнего, поэтому в рамках одной и той же стадии наблюдаются больные с различным прогнозом.
Важной задачей клинициста является определение прогноза заболевания и планирование наиболее эффективного лечения, для чего требуется объективная оценка анатомической распространенности поражения.
С этой целью необходимо иметь классификацию, основные принципы которой были бы применены ко всем локализациям злокачественных опухолей и которую впоследствии можно было бы дополнить сведениями, полученными при патогистологическом исследовании и/или данными хирургического вмешательства.
В наибольшей степени этим условиям соответствует международная TNM-классификация.
Классификация TNM основывается на клиническом и, когда возможно, гистопатологическом определении анатомического распространения заболевания. Система TNM была разработана Денуа [Denoix Р., Франция] в период с 1943 по 1952 гг. С 1953 г. происходит постоянное совершенствование этой классификации, что находит отражение в ее периодических пересмотрах.
В настоящее время действует 6-е издание (2002) классификации TNM, одобренное и принятое Американским объединенным комитетом по онкологическим заболеваниям и Международным противораковым союзом.
Система TNM в значительной степени свободна от недостатков других классификаций и создает реальные возможности унифицирования прогностических оценок, плана лечения, регистрации его исходов, взаимной информации между центрами и специалистами.
Компоненты описания анатомического распространения поражения в классификации TNM представлены:
Т — размер и местное распространение первичной опухоли;
N — отсутствие или наличие метастазов в регионарных лимфоузлах и степень их поражения;
М — наличие или отсутствие отдаленных метастазов.
Каждый из этих трех критериев имеет соответствующую градацию в виде цифры, указывающей на степень распространенности злокачественного процесса: Т1, Т2, Т3, Т4; N1, N2, N3; М0, М1.
В сомнительных случаях, или когда невозможно более точно описать опухоль, применяются еще ряд дополнительных обозначений (Т0, ТХ, TIs; NX, N0; MX), что значительно увеличивает емкость характеристики опухолевого процесса и его объективность.
Общие правила применения классификации TNM для всех локализаций опухолей:
1. В максимально возможном числе случаев должно быть гистологическое подтверждение диагноза, если его нет, то такие случаи описываются отдельно;
2. При каждой локализации описываются две классификации:
а) клиническая классификация (TNM или cTNM), основанная на данных клинического, рентгенологического, эндоскопического, биопсии, хирургического методов исследования и ряда других дополнительных методов;
б) патологическая классификация или pTNM (постхирургическая, патогистологическая классификация), основанная на данных до начала лечения, но дополненных или измененных на основании сведений, полученных при xnpypi ичоском вмешательстве или исследовании операционного материала.
При морфологической оценке первичной опухоли необходима ее резекция и биопсия для правильной оценки степени ее распространения (рТ). Для патогистологической оценки состояния регионарных лимфатических узлов (pN) требуется их адекватное удаление, что позволяет определить отсутствие или наличие в них метастазов.
Для морфологической оценки отдаленных метастазов (рМ) необходимо их микроскопическое исследование. Клиническая классификация особенно важна для выбора и оценки методов лечения, тогда как патогистологическая позволяет получить наиболее точные данные для прогноза и оценки отдаленных результатов лечения.
3. После определения TNM и/или pTpNpM категорий, может быть выполнена группировка по стадиям. Установленная степень распространения опухолевого процесса по системе TNM или по стадиям должна оставаться в медицинской документации без изменений.
4. Если есть сомнения в правильности определения категорий Т, N, М, то надо выбирать низшую (т.е. менее распространенную).
5. В случае множественных синхронных злокачественных опухолей, возникших в одном органе, классификация строится на оценке опухоли с наивысшей категорией Т, а множественность и число опухолей указывают дополнительно: Т2(3) или Т2(5) При возникновении синхронных билатеральных опухолей парных органов каждую опухоль классифицируют отдельно.
6. Описание TNM и стадии может быть сужено или расширено для клинических или научных целей при неизменности установленных базовых категорий TNM, так, Т, N или М могут быть подразделены на подгруппы.
Общие принципы использования категорий TNM в клинической классификации:
Т — первичная опухоль:
ТХ — оценить размеры и местное распространение опухопи не представляется возможным;
Т0 — первичная опухоль не определяется;
Tis — преинвазивная карцинома (carcinoma in situ);
Т1, Т2, Т3, Т4 — отражает нарастание размера и/или местного распространения опухоли.
N — регионарные лимфатические узлы:
NX — недостаточно данных для оценки регионарных лимфатических узлов;
N0 — нет признаков метастатического поражения регионарных лимфатических узлов;
N1, N2, N3 — отражает различную степень поражения метастазами регионарных лимфоузлов.
Примечание: Прямое распространение первичной опухоли в лимфатические узлы расценивается как их метастатическое поражение. Метастазы в любых лимфоузлах, не являющихся регионарными для данной локализации, классифицируются как отдаленные.
М — отдаленные метастазы:
MX — недостаточно данных для оценки отдаленных метастазов;
М0 — нет признаков отдаленных метастазов;
М1 — имеются отдаленные метастазы.
Категорию М1 можно дополнять символами в зависимости от локализации отдаленных метастазов:
pN — регионарные лимфатические узлы:
pNX — состояние регионарных лимфатических узлов не может быть оценено;
pN0 — метастатического поражения регионарных лимфатических узлов не выявлено;
pN1, pN2, pN3 — гистологически подтвержденное нарастание степени поражения регионарных лимфатических узлов.
Примечание: Прямое распространение первичной опухоли в лимфатические узлы расценивается как метастатическое их поражение. Опухолевый узел больше 3 мм, обнаруженный в соединительной ткани или в лимфатических сосудах вне ткани лимфатического узла, расценивается как регионарный метастатический лимфоузел.
Опухолевый узел до 3 мм классифицируется в категории рТ как распространение опухоли. Когда размер пораженного метастазами лимфоузла является критерием для определения pN. как. например, при раке молочной железы, оценивают только пораженные лимфоузлы, а не всю группу
рМ — отдаленные метастазы:
рМХ — наличие отдаленных метастазов не может быть определено микроскопически;
рМ0 — при микроскопическом исследовании отдаленные метастазы не выявлены;
рМ1 — при микроскопическом исследовании отдаленные метастазы подтверждены.
Категория рМ1 может иметь такие же подразделения, как и категория М1.
Также при необходимости большей детализации возможно подразделение основных категорий (например, рТ1а и/или pN2a).
Гистологическая дифференцировка (G).
Используется как дополнительная информация, касающаяся первичной опухоли, и может быть отмечена следующим образом:
GX — степень дифференцировки не может быть установлена;
G1 — высокая степень дифференцировки;
G2 — средняя степень дифференцировки;
G3 — низкая степень дифференцировки;
G4 — недифференцированные опухоли
При кодировке по классификации TNM возможно применение дополнительных символов, использование которых, однако, не является обязательным.
Среди них различают следующие:
r — обозначают рецидивы опухоли (например, rT1N1aM0 или rpT1aN0M0).
а — указывает на установление TNM после аутопсии.
m — обозначает наличие множественных первичных опухолей одной локализации.
Символом L определяют инвазию лимфатических сосудов:
LX — инвазия лимфатических сосудов не может быть выявлена;
L0 — инвазии лимфатических сосудов нет;
L1 — инвазия лимфатических сосудов выявлена.
Символ V описывает инвазию венозных сосудов:
VX — инвазия венозных сосудов не может быть выявлена;
V0 — инвазии венозных сосудов нет;
V1 — микроскопически выявлена инвазия венозных сосудов;
V2 — макроскопически определяется инвазия венозных сосудов.
Примечание: Макроскопическое поражение венозной стенки без наличия опухоли в просеете сосуда классифицируют как V2.
С-фактор или уровень надежности.
Отражает достоверность классификации с учетом использованных диагностических методов.
Градации С-фактора:
С1 — данные получены при применении стандартных диагностических методов (клинические, рентгенологические, эндоскопические исследования);
С2 — данные получены при использовании специальных диагностических методик (рентгенологическое исследование в специальных проекциях, томография, компьютерная томография (КТ), ангиография, ультразвуковое исследование (УЗИ), сцинтиграфия, магнитно-резонансная томография (МРТ), эндоскопия, биопсия, цитологические исследования);
С3 — данные получены в результате пробного хирургического вмешательства, включая биопсию и цитологическое исследование;
С4 — данные получены после радикальной операции и морфологического исследования операционного материала, pTNM эквивалентна С4;
С5 — данные получены после вскрытия. Например, конкретный случай можно описать так: T2C2N1C3M0C1, т.е. клиническая классификация TNM до лечения сформулирована с разной степенью надежности (С1, С2, С3).
R-символ указывает на наличие или отсутствие остаточной (резидуальной) опухоли после лечения и является также фактором прогноза:
RX — недостаточно данных для определения остаточной опухоли;
R0 — резидуальная опухоль отсутствует;
R1 — резидуальная опухоль определяется микроскопически;
R2 — резидуальная опухоль определяется макроскопически.
Таким образом, классификация по клиническим стадиям и по системе TNM дает достаточно точное описание анатомического распространения болезни. В формулировке онкологического диагноза обязательно указывается стадия опухолевого роста и ее расшифровка по системе TNM.
Важно помнить, что установленная больному после радикального лечения степень распространенности опухолевого процесса (стадия заболевания, TNM) в последующем не изменяется независимо от исхода заболевания (выздоровление, рецидив, генерализация процесса) и является категорией пожизненной.
Основной целью Международной классификации злокачественных новообразований по распространенности процесса является разработка методики единообразного представления клинических данных. Единые критерии оценки способствуют обмену объективной информацией между медицинскими центрами и дальнейшему изучению проблемы рака.
Угляница К.Н., Луд Н.Г., Угляница Н.К.
Необходимость удаления максимально возможного объема опухоли во время первой операции по поводу диссеминированного рака яичника (РЯ) стала аксиомой для многих онкогинекологов. Известно, что значительное снижение опухолевой нагрузки дает выраженный паллиативный эффект. По данным Munnell, 5-летняя выживаемость больных после операций в максимально возможном объеме составляла 28 %, после частичной резекции — 9 %, а после биопсии — 3 %. Для 14 выживших пациенток операция в максимально возможном объеме включала гистерэктомию с двусторонней аднексэктомией и оментэктомию.
Aure и соавт. отметили существенное улучшение выживаемости пациенток с III стадией рака яичника (РЯ) после удаления всей видимой опухоли. Griffiths и соавт. получили аналогичные результаты при использовании линейного уравнения множественной регрессии выживаемости в качестве зависимой переменной для одновременного контроля множества терапевтических и биологических факторов, влияющих на исход заболевания у отдельных пациенток.
Самыми важными факторами были гистологическая степень дифференцировки и наибольший размер остаточной опухоли после первичного хирургического лечения. Операция улучшает выживаемость только в том случае, если максимальный размер остаточной опухоли составляет менее 1,6 см.
Так называемые циторедуктивные операции (debulking operation) получили значительное распространение при лечении рака яичника (РЯ). Цель хирургического вмешательства заключается в уменьшении объема новообразования для оптимальной эффективности адъювантной терапии. Все формы дополнительного лечения наиболее эффективны при минимальном объеме остаточной опухоли. Это особенно касается истинного рака яичника (РЯ) — солидных опухолей, наиболее чувствительных к химиотерапии (XT). Часто аккуратный и терпеливый хирург может удалить крупные опухолевые очаги, которые на первый взгляд казались неоперабельными.
При использовании бессосудистых зон забрюшинного пространства можно выделить воронкотазовую связку, мочеточник и изолировать сосуды, кровоснабжающие яичник. После их перевязки и пересечения ретроградное удаление больших опухолей яичников выполнить проще и безопаснее. Выделение мочеточников проводят с максимальной осторожностью, однако их повреждение бывает даже у самых опытных хирургов. Конгломераты большого сальника при раке яичника (РЯ) удаляют через бессосудистую зону поперечно-ободочной кишки после лигирования правой и левой желудочно-сальниковых артерий. Удаление больших новообразований яичников и метастатически пораженного сальника часто уменьшает общий объем опухоли на 80—99 %.
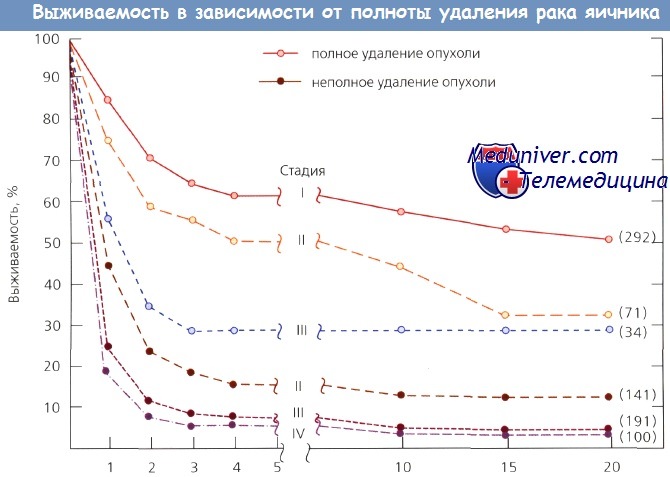
Сравнение выживаемости пациенток при полном и неполном удалении опухоли в зависимости от стадии рака яичников
Теоретическим обоснованием рассматриваемых операций (debulking procedures) служит концепция о повышении эффективности адъювантной терапии после существенного снижения числа опухолевых клеток. Кроме того, при солидных опухолях, к которым относят рак яичника (РЯ), элиминация большой популяции клеток в фазе покоя (G0) может вызывать переход оставшихся клеток в уязвимую для цитостатиков и облучения фазу пролиферации. Несколько скрупулезных ретроспективных исследований продемонстрировало увеличение выживаемости больных, у которых с помощью хирургического метода лечения удалось добиться статуса минимального опухолевого носительства. Большой опыт, накопленный в M.D. Anderson Hospital and Tumor Institute, свидетельствует о существенном повышении эффективности XT второй линии при II и III стадиях рака яичника (РЯ), если после первой операции не оставались макроскопические остаточные новообразования или диаметр единичной остаточной опухоли не превышал 1 ем.
При этом 2-летняя выживаемость пациенток со II стадией без остаточных опухолей составила 70 %, а при отдельных узлах диаметром до 1 см — 50 %.
Эти показатели хорошо согласуются с часто публикуемыми цифрами общей выживаемости при раке яичника (РЯ). GOG проводила детальный анализ результатов хирургического лечения больных с поздними стадиями заболевания для определения концепции первичной циторедуктивной операции. На первом этапе сравнили выживаемость пациенток с III стадией рака яичника (РЯ) с опухолью в брюшной полости до 1 см (1-я группа) и 1 см и более (2-я группа); больным 2-й группы опухоли уменьшили до 1 см и менее.
Если хирургическая операция — единственный важный фактор, как рассуждали исследователи, то выживаемость в обеих группах должна быть одинаковой. Однако на самом деле этого не произошло. Больные с небольшим размером опухоли 1-й группы жили дольше по сравнению с пациентками, у которых благодаря хирургической циторедукции достигнут малый размер опухоли (2-я группа). Этот феномен свидетельствует о том, что биологические свойства новообразования имеют важное прогностическое значение. На следующем этапе исследователи GOG оценили влияние наибольшего диаметра остаточной опухоли на выживаемость пациенток после субоптимальных циторедуктивных операций. Они обнаружили, что циторедукция до 2 см и менее значительно увеличивала выживаемость, но при любых остаточных опухолях диаметром более 2 см этот показатель был одинаковым. Следовательно, если остаточную опухоль нельзя уменьшить до 2 см и менее, то выживаемость не зависит от величины диаметра остаточной опухоли.
При исследовании оптимальной и субоптимальной циторедукции эксперты GOG выделили три группы: микроскопическая остаточная опухоль, диаметр остаточной опухоли менее 2 см или более 2 см. В 1-й группе 4-летняя выживаемость составила примерно 60 %, во 2-й — 35 % и в 3-й — менее 20 %. Самое удивительное — это неспособность циторедуктивной операции оказать хотя бы минимальное влияние на выживаемость, если не удалосьуменьшитьдиаметр остаточной опухоли до 2 см и менее.
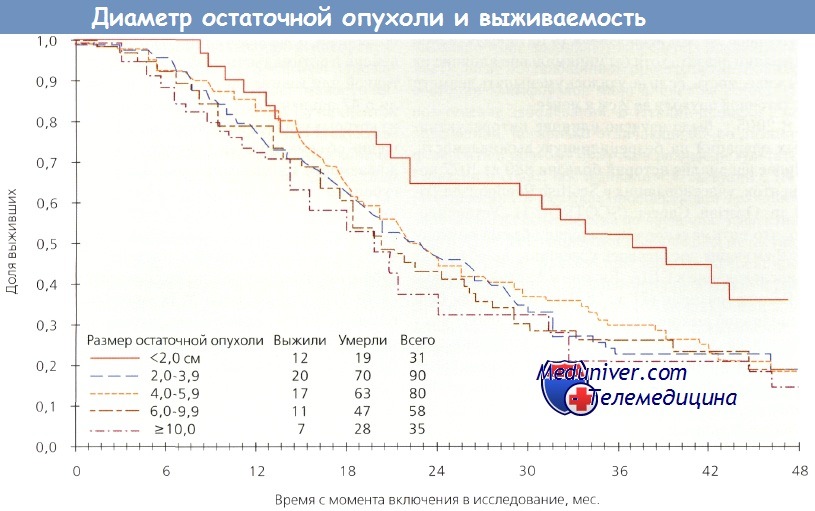
Выживаемость в зависимости от максимального диаметра остаточной опухоли
В 2005 г. было изучено влияние циторедуктивных операций на безрецидивную выживаемость. Проведен анализ историй болезни 889 из 1077 пациенток, участвовавших в Scottish Randomised Trial in Ovarian Cancer (SCOTROC-1). Установлено, что оптимальное уменьшение объема опухоли ( 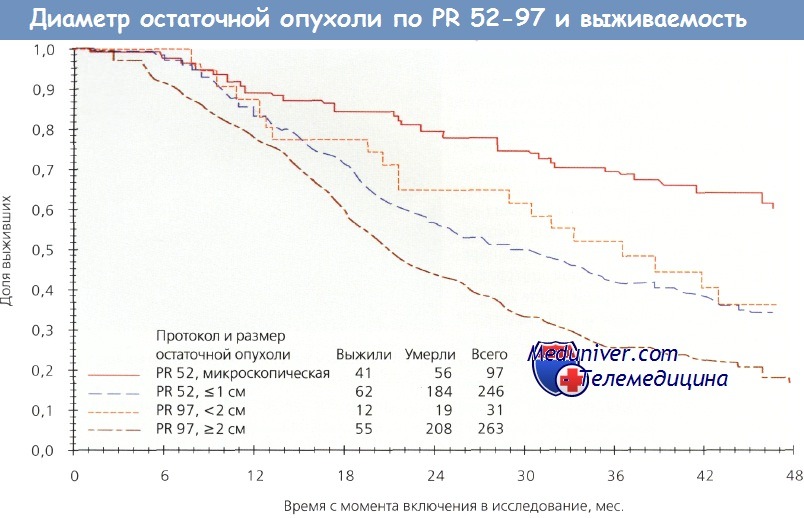
Выживаемость в зависимости от максимального диаметра остаточной опухоли, согласно 52-му и 97-му протоколам (PR) Gynecologic Oncology Group
Эксперты Southwest Oncology Group и GOG исследовали эффективность интраперитонеальной и внутривенной ХТ у пациенток с III стадией РЯ после оптимальных циторедуктивных операций и установили, что при микроскопической остаточной опухоли, остаточном поражении до 0,5 или 0,5—2,0 см медиана выживаемости составила 76, 42 и 32 мес. соответственно. Eisenkop и соавт. сообщили о 163 пациентках с IIIс и IV стадиями РЯ; полную циторедукцию можно было выполнить в 86 % случаев. Медиана выживаемости для всей группы составила 54 мес, а для больных с оптимальной циторедукцией — 62 мес.
Целесообразность выполнения лимфаденэктомии при поздних стадиях рака яичника (РЯ) продолжает оставаться предметом обсуждения. Во всех исследованиях обнаружено обширное поражение лимфоузлов при поздних стадиях заболевания (> 50 %). Вопрос заключается в том, влияет ли лимфаденэктомия на выживаемость. Burghardt один из первых высказал мнение о ее терапевтической пользе. По его данным, даже при наличии метастазов в лимфоузлах, выживаемость пациенток с поздними стадиями РЯ, которым выполнили хирургическое стадирование, а следовательно, и лимфаденэктомию, выше, чем без такого вмешательства. Некоторые авторы считают, что метастазы в лимфоузлах в отличие от интраперитонеальных не так хорошо поддаются XT, поэтому их необходимо удалять. Противники утверждают, что рецидивы значительно чаще возникают в пределах брюшной полости, но не в забрюшинном пространстве, поэтому состояние лимфоузлов мало влияет на естественное течение заболевания.
В Италии провели 2 исследования, несколько отличающихся по дизайну, и, вероятно, поэтому получили разные результаты. Parazzini и соавт. обследовали 456 женщин с III и IV стадиями РЯ в рамках проспективного рандомизированного исследования по изучению эффективности XT. У 161 пациентки обнаружены метастазы в лимфоузлах, причем при низкодифференцированных опухолях (G3) чаще, чем при высоко- и умереннодифференцированных (G1 и G2). Авторы не выявили отличий в показателях выживаемости между больными с метастатическими и интактными лимфоузлами. Следовательно, положительное влияние удаления метастатических лимфоузлов на выживаемость не установлено. Scarabelli и соавт. выполнили лимфаденэктомию 98 больным РЯ IIIс—IV стадии, у которых не было макроскопических остаточных опухолей; в группу контроля вошло 44 пациентки, которым лимфаденэктомия не проводилась. Выживаемость больных, которым выполнили лимфаденэктомию, была значительно лучше (анализ Кокса). Результаты этого исследования показали, что лимфаденэктомия обеспечивает потенциальный терапевтический эффект, но в определенной группе пациенток. Ранее обсуждались аналогичные выводы клинического испытания SCOTROC-1.
Мы обязательно выполняем стандартную тазовую и парааортальную лимфаденэктомию, но при условии оптимального уменьшения объема опухоли. Эффективность лимфаденэктомии при большом объеме остаточной опухоли, по нашему мнению, сомнительна. При поздних стадиях РЯ показано удаление всей опухоли, если это технически возможно. Для этого разработано много способов. Некоторые врачи используют хирургический УЗ-аспиратор, другие предлагают электрохирургическую резекцию с помощью электрокоагулятора с аргоновой приставкой, третьи все еще убеждены, что резекция диафрагмальной брюшины или мышцы играет важную роль в циторедукции. Влияние всех этих методов на выживаемость окончательно не определено. Следует с осторожностью относиться к успешному применению той или иной методики в руках отдельных энтузиастов и подождать весомого подтверждения в публикациях.
Растет число сторонников проведения лапароскопии вместо лапаротомии. Технически это возможно, но целесообразность удаления больших объемных образований придатков матки с помощью лапароскопа сомнительна. В публикациях описаны случаи возникновения метастазов в местах введения троакаров. Феномен рецидива рака в области послеоперационного рубца хорошо известен, однако удивительно, что даже при большой интраабдоминальной опухоли это редкость. Wang и соавт. провели обзор литературы для определения факторов риска ранних рецидивов в местах установки портов. Из всех злокачественных опухолей женских половых органов метастазы в местах введения троакаров чаще всего возникают при раке яичника (РЯ), независимо от того, имеется асцит или нет, стадии заболевания (ранней или поздней), появления после диагностических или паллиативных операций.
Такие метастазы обнаруживали и при опухолях низкой степени злокачественности. Чаще они возникают при асците и канцероматозе брюшины. Наименьший промежуток времени между лапароскопией и появлением метастаза в месте установки порта составил 8 дней. По этому поводу предложили несколько теорий: имплантация раковых клеток при травматической диссеминации во время удаления первичной опухоли, прямая имплантация инструментами, создание градиента давления при пневмоперитонеуме с последующим выходом газа (через порты), который привел опухолевые клетки во флотирующее состояние. Лапароскопия больше подходит для удаления доброкачественных образований придатков матки. При подозрении на РЯ мы предпочитаем лапаротомный доступ. Если во время лапароскопии обнаруживают РЯ, необходимо немедленно перейти на лапаротомию.
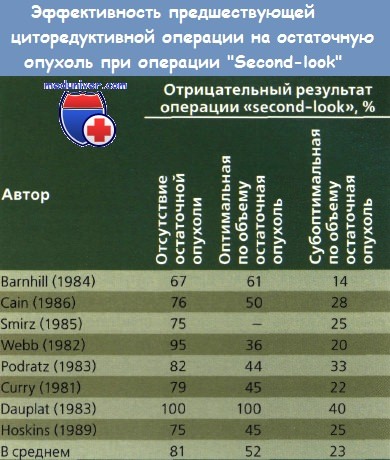
Группа EORTC сообщила о собственном опыте циторедуктивных операций при поздней стадии рака яичника (РЯ). Пациентки получили 3 курса цисплатина и циклофосфамида, и затем их разделили случайным образом на две группы: одним выполнили циторедуктивную операцию, другим — нет. Все женщины получили 6 курсов XT. Среди 278 пациенток медиана выживаемости составила 26 и 20 % (операция и без операции; р = 0,012). Многофакторный анализ показал, что циторедуктивная операция была независимым прогностическим фактором. После учета всех факторов прогноза оказалось, что хирургическое вмешательство снизило риск смерти на 33 % (р = 0,008).
В 2004 г. GOG сообщила о проведении аналогичного исследования, в которое было включено 550 больных. При неоптимальной первичной цито-редуктивной операции (остаточная опухоль более 1 см) назначали 3 цикла паклитаксела с цисплатином. После этого пациенток рандомизировали на две группы: одним продолжили XT, а другим выполнили вторую циторедуктивную операцию и продолжили XT. Промежуточная (дополнительная) между курсами XT операция не привела ни к улучшению безрецидивной выживаемости, ни к снижению относительного риска смерти. Авторы предполагают, что разница в результатах может быть обусловлена более агрессивным выполнением хирургических вмешательств у пациенток в исследовании GOG по сравнению с EORTC. Если суммировать оба исследования, можно сделать следующее заключение: пациенткам с поздними стадиями рака яичника (РЯ) показана хотя бы одна циторедуктивная операция, но с максимально возможным уменьшением объема опухоли, лучше, если се проведет онкогинеколог.
Нет сомнений, что тщательно выполненная первичная циторедуктивная операция — основной фактор, определяющий отдаленную выживаемость. Выбор времени для проведения хирургического вмешательства, целью которого служит удаление максимально возможного объема опухоли, остается предметом обсуждения. При относительных противопоказаниях (возраст, сопутствующие заболевания, плевральный или перикардиальный выпот) и распространенном злокачественном процессе в брюшной полости успешную циторедуктивную операцию осуществить невозможно, поэтому настоятельно рекомендуется рассмотреть вопрос о назначении неоадъювантной XT. Хороший клинический ответ после 2—4 циклов XT часто дает возможность выполнить эффективную циторедуктивную операцию с небольшой частотой осложнений. До начала XT нужно точно установить локализацию рака (яичник, маточная труба или брюшина), используя для этого цитологическое исследование или малоинвазивное хирургическое вмешательство. На сегодня неоадъювантная XT с последующей циторедуктивной операцией представлена в нескольких небольших ретроспективных исследованиях, включающих от 20 до 90 пациенток. Результаты указанной терапии аналогичны таковым при первичном хирургическом вмешательстве с последующей XT.
В текущем клиническом исследовании, проводимом EORTC и Национальным институтом рака (NCI) в Канаде, принимает участие более 700 больных, набор которых закончен в 2006 г. Ожидают, что это исследование даст подробную информацию о показаниях к неоадъювантной XT с последующей операцией и результатах такого комбинированного лечения.
У пациенток после обширного хирургического вмешательства увеличен риск расхождения краев раны, поэтому нужно использовать методики ушивания передней брюшной стенки через все слои. Однако в ситуациях выпячивания отечных петель кишечника из брюшной полости во избежание прорезания фасции и снижения риска несостоятельности рубца лучше наложить узловые швы с отсроченным их затягиванием.
Читайте также:

