Основные характеристики злокачественной клетки
ОПУХОЛИ
Опухоль - типовой патологический процесс, в основе которого лежит неограниченный, неконтролируемый рост клеток с преобладанием процессов пролиферации над явлениями нормальной клеточной дифференцировки.
Для опухолевой ткани характерно нарушение регуляции клеточного деления, отсутствие или недостаточное подавление клеточного деления, так как отсутствует ограничение количества деления клеток ("лимит Хейфлика"). Процесс размножения клеток идет бесконечно и прекращается только со смертью организма.
Опухоль появляется в результате мутаций в соматических клетках, что приводит к превращению нормальных клеток в опухолевые. Опухоль растет "сама из себя", т.е. увеличение ее происходит за счет клона малигнизировавших клеток. Соседние клетки в процесс не вовлекаются.
Опухоль отличается автономностью, выходит из-под контроля регулирующих систем организма.
Для опухолевой ткани характерны все виды атипизма: морфологический, биохимический, функциональный, антигенный.
Опухоли доброкачественные и злокачественные.
Доброкачественная опухоль, как правило, не покидает пределы ткани того органа, в котором она развилась, и не внедряется в соседние органы. Главный признак злокачественной опухоли - это инфильтрирующий рост, инвазия (выход за пределы исходной ткани, прорастание в окружающие ткани, разрушение их протеазами). В период бурного роста злокачественной опухоли появляются незрелые клетки, характеризующиеся тканевым и клеточным атипизмом. Клетки злокачественной опухоли могут отрываться от основного очага и распространяться по организму лимфо- и гематогенным путем, оседая в отдаленных органах и образуя там вторичные очаги опухолевого роста (метастазы). Одними из важнейших свойств злокачественных опухолей являются автономность в неограниченном их росте и опухолевая прогрессия - непрерывная эволюция опухоли в сторону все более агрессивной и неконтролируемой ткани. Злокачественные опухоли в запущенных стадиях опухолевого процесса имеют неблагоприятный прогноз. Рост злокачественной опухоли и ее метастазов вызывает деструктивные повреждения окружающих тканей, эрозивные кровотечения, воспаление, переломы костей, функциональную недостаточность пораженного органа (множественные метастазы в легкие, печень), кахексию, паранеопластические синдромы, иногда угрожающие жизни. Доброкачественные же опухоли протекают благоприятно, а их осложнения всегда связаны с локализацией. Так, доброкачественные опухоли мозга могут привести к нарушению оттока цереброспинальной жидкости и гидроцефалии, пищевода - к его непроходимости и как следствие к голоданию и кахексии. Доброкачественные опухоли могут осложниться кровотечением; такие доброкачественные новообразования, как полипы желудка, множественный полипоз толстой кишки, могут малигнизироваться. После хирургического удаления доброкачественной опухоли она прекращает свое существование. Для злокачественных опухолей часто характерно рецидивирование опухолевого процесса: 1) в виде локального появления опухоли (на месте оставшихся невидимых глазом хирурга микрометастазов) после хирургического ее удаления в различные сроки после операции; 2) в виде отдаленных метастазов (в легкие, головной мозг, печень, кости).
Этиология опухолей
Причинами превращения нормальной клетки в опухолевую являются канцерогенные факторы. Канцерогенные факторы относятся к мутагенным факторам, которые воздействуют на геном клеток и нарушают процессы регуляции клеточного деления.
Особенности действия канцерогенов: - способность прямо или косвенно влиять на геном клетки;
- способность проникать через внешние и внутренние барьеры;
- для трансформации нормальной клетки в опухолевую достаточна небольшая доза канцерогена, которая не приводит к гибели клеток; действие канцерогена необратимо; характерен эффект суммации и кумуляции.
ХИМИЧЕСКИЕ: полициклические ароматические углеводороды (ПАУ) содержатся в продуктах неполного сгорания табачного дыма, выхлопных газах, нефти, битуме, асфальте, дыме доменных печей и продуктах копчения; вызывают рак в местах аппликации;
ароматические азо- и аминосоединения (производные бензола) содержатся в красителях, применяемых в полиграфии, косметике, фотографии, для окраски тканей в промышленности; обладают органотропностью, вызывая рак печени и мочевого пузыря;
нитрозосоединения используются для получения красителей, пестицидов, могут образовываться под действием соляной кислоты из нитритов и нитратов, поступающих с пищей; органотропны, вызывают рак печени, пищевода, опухоли головного мозга и периферической нервной системы;металлы (никель, хром, мышьяк, кадмий, бериллий, кобальт, свинец, титан, цинк, железо) вызывают опухоли в местах введения.
Механизм действия химических канцерогенных веществ: 1) первый этап - циркуляция канцерогенного вещества в организме и его метаболические превращения, которые могут происходить в печени под действием микросомальных ферментов, внутри клеток ферментами ядерной оболочки. Происходят два параллельных процесса:
- метаболическая активация с образованием канцерогенных метаболитов, которые вызывают малигнизацию.
В ходе метаболических превращений все канцерогены приобретают общие свойства: становятся электрофильными соединениями, способными реагировать с нуклеофильными мишенями клеток, т.е. с биополимерами;
2) связывание метаболитов канцерогенов с биологическим субстратом клетки-мишени (компоненты мембраны, органеллы цитоплазмы, ядро). В процессе малигнизации особую роль играет взаимодействие канцерогенов с ДНК, что приводит к мутациям, или с транспортными РНК, в результате чего нарушается трансляция мРНК и последующий синтез белка.
Закреплению генетических нарушений в результате действия канцерогенов препятствует система репарации ДНК. Ферменты "вырезают" поврежденный участок цепи ДНК и на основе второй цепи ДНК, если она не повреждена, воссоздают исходную структуру по принципу комплементарности.
ФИЗИЧЕСКИЕ: ионизирующие излучения (рентгеновское, a-, b-, g-), ультрафиолетовое излучение.
Механизм действия физических канцерогенов связан с возникновением мутаций в результате прямого или опосредованного (радиолиз воды, активация перекисного окисления липидов) повреждения наследственного материала клетки на генном или хромосомном уровне.
БИОЛОГИЧЕСКИЕ: вещества, выделяемые некоторыми грибами афлатоксин, стеригматоцистин вызывают опухоли печени. Грибы паразитируют на земляных орехах, кукурузе, рисе, яйцах, сухом молоке; вирусы ДНК-содержащие: паповавирусы (доброкачественные опухоли - папилломы - кожи и слизистых),
аденовирусы (пролиферативное воспаление слизистых дыхательных
путей), герпес-вирусы (контагиозный лимфоматоз кур, карцинома почек у
лягушек, лимфома Беркита - вирус Эпштейна-Бар, рак шейки матки - вирус простого герпеса), вирусы группы оспы (доброкачественные гистиоцитомы); вирусы РНК-содержащие: ретровирусы, онкорнавирусы (имеют ферментобратную транскриптазу, с помощью которого происходит построение ДНК на основе вирусной РНК; вызывают лейкозы, саркомы, рак молочной железы).
Механизм вирусного канцерогенеза заключается в следующем: 1) вирус проникает в клетку, его генетический материал закрепляется в клетке путем физической интеграции с клеточной ДНК; 2) в составе вирусного генома есть специфические гены (онкогены), продукты которых (мРНК, онкобелки) отвечают за превращение нормальной клетки в опухолевую;
3) в результате воздействия онкобелков клетка теряет чувствительность к сигналам, регулирующим ее деление и становится опухолевой и по другим фенотипическим признакам (морфологическим, биохомическим, цитогенетическим и др.).
Стадии развития опухоли
I. Инициация. Происходит превращение нормальной клетки в опухолевую, способную постоянно делиться. Согласно Хьюгсу, процесс деления в каждой клетке регулируется системой генов: Чтобы клетка вступила в деление, необходимо наличие в геноме фактора, который предупреждает репрессию гена-репрессора 2 или гена-инициатора клеточного деления.
Трансформация может происходить двумя путями: мутационным и эпигеномным.
Мутационный канцерогенез связан с изменением структуры генов, регулирующих деление клетки. Так, если мутации подвергается ген-репрессор 1, то перестает синтезироваться белок-репрессор 1, и ген-инициатор клеточного деления растормаживается. Образуется клон клеток, в которых отсутствует ген-репрессор 1, способные к беспредельному делению.
Если происходит мутация гена-инициатора клеточного деления, то он становится недоступен тормозящему влиянию репрессора 1.
При эпигеномном канцерогенезе на систему генов, контролирующих деление, оказывают влияние факторы, не принадлежащие клеточному геному. Передающееся последующим поколениям клеток эпигеномное влияние может сформироваться под действием вируса. Предполагается, что вирусный геном заменяет функцию гена-репрессора 2, в результате чего растормаживается процесс деления клетки.
Мутационный и эпигеномный механизмы могут сочетаться.
II. Промоция. Трансформированные клетки могут долгое время находиться в неактивном состоянии. Для того, чтобы клетки начали делиться, требуется дополнительное влияние фактора, стимулирующего клетки к размножению. Как правило, канцерогенные вещества являются полными, т.е. вызывают и трансформацию, и промоцию. Однако, в случае воздействия малой дозы канцерогена активации клеток может не произойти, и канцерогенез будет протекать в два этапа. Кроме канцерогенов, в качестве промоторов могут выступать факторы, не обладающие свойствами канцерогенов: гормоны, медиаторы пролиферации (в частности, при хроническом воспалении, заживлении после травмы).
III. Прогрессия - качественные изменения свойств опухолевой ткани, приводящие к увеличению различий между ней и исходной нормальной тканью. Основным признаком прогрессии является возрастание автономности, т.е. нерегулируемости, опухолевого роста.
Опухолевой трансформации подвергается несколько клеток, из которых развивается несколько клонов. В дальнейшем в опухолевом узле клетки подвергаются отбору под действием ряда условий со стороны организма: питание, кровоснабжение, иннервация, противоопухолевый иммунитет, химиотерапия. опухоли. Однако опухолевые клетки легко изменяют свои свойства и могут ускользать из-под регуляторных систем организма. В клетках происходят спонтанные или вызванные вирусами мутации, которые закрепляются вследствие слабости репаративных процессов.
Особенности опухолевых клеток
В процессе канцерогенеза и прогрессии клетки утрачивают свою дифференцировку, возвращаясь на более низкий уровень вплоть до эмбрионального. Это явление называется анаплазией. Признаки анаплазии определяются в биохимических особенностях, физико-химических свойствах, в строении и функции.
Морфологические особенности опухолевых клеток заключаются в утрате органоспецифичности и тканеспецифичности, снижении степени дифференцировки. В клетках наблюдаются нарушенные митозы, дефекты хромосом. Встречаются многоядерные клетки.
Биохимические особенности опухоли связаны с изменением генетической регуляции клеток. Происходит дерепрессия генов, отвечающих за клеточное деление, в связи с этим увеличивается количество митотических белков, активируется синтез нуклеиновых кислот. Опухолевые клетки утрачивают специализированные функции, однако может происходить неожиданная дерепрессия синтеза веществ, несвойственных данной ткани, например, гормонов (АКТГ или гонадотропный гормон в аденокарциноме легких, тироксин в опухоли почки). Для обеспечения синтеза белков опухолевые клетки улавливают аминокислоты из крови, т.к. неспособны сами образовывать необходимые аминокислоты. Поэтому опухоль является "ловушкой азота".
Энергетическое обеспечение происходит преимущественно за счет гликолиза. Причем в опухолевых клетках гликолиз протекает при нормальном напряжении О2 (отрицательный эффект Пастера). Энергия образуется из глюкозы, которую опухоль интенсивно захватывает из крови (является "ловушкой глюкозы").
В опухолевых клетках резко ослаблено тканевое дыхание из-за того, что субстрат окисления захватывается мощной гликолитической системой.
Физико-химические особенности опухолевой ткани связаны с биохимической перестройкой. Интенсивный гликолиз приводит к накоплению молочной кислоты, в результате чего снижается pH. В опухоли повышено содержание воды и некоторых электролитов (в частности, К+). Опухолевые клетки имеют высокий отрицательный заряд, величина которого приближается к заряду лимфоцитов, что затрудняет распознавание.
Влияние опухоли на организм - развитие опухоли в определенных тканях приводят к утрате их функций (опухоли пищеварительной системы, легких, эндокринных желез и др.);
- опухоль захватывает питательные вещества и субстраты окисления из крови (аминокислоты, глюкозу), а также выделяет токсические вещества, которые нарушают обмен веществ в организме, что приводит к развитию кахексии;
- опухоли могут вызывать сдавление окружающих тканей, тем самым нарушить их функции (опухоли мозга, средостения и др.);
- гормонально активные опухоли вызывают нарушения определенных органов (гиперкатехоламинемия при феохромацитоме, гипергастринемия при опухоли поджелудочной железы, гиперкортицизм при опухолях легких и др.).
Как причина смерти населения рак занимает второе место после сердечнососудистых болезней. Существует более 100 видов рака, хотя пять из них: рак легкого, молочной железы, толстой кишки, предстательной железы и матки - составляют более 50% от всех впервые диагностируемых случаев.
В зависимости от способности к распространению опухоли делят на доброкачественные, или локальные, не обладающие способностью прорастать в соседние ткани, и злокачественные, способные к инвазии и метастазированию в другие органы.
Канцерогенез - комплексный многоступенчатый процесс, включающий изменения не менее чем в 10 генетических факторах, каждый из которых является скоростьлимитарующим. В организме носителя каждая стадия процесса представляет собой физиологический барьер, который должен быть преодолен клеткой, прогрессирующей в сторону малигнизации (злокачественная трансформация). Существование множественности барьеров указывает на то, что малигнизация - явление редкое.
В организме человека 1015 клеток. В течение жизни происходит их обновление в объеме, равном 10 объемам человеческого тела. Из этого становится понятным, что только тонкая сбалансированность процессов пролиферации, дифференцировки и апоптоза позволяет поддерживать нормальное развитие и функционирование всех органов и тканей. Пролиферация обеспечивает воспроизведение клеток, дифференцировка - приобретение ими индивидуальных черт и способности к специализированным видам деятельности, а апоптоз - разрушение старых и поврежденных клеток.
Рак представляет собой совокупность генных болезней, характеризующихся неконтролируемой клеточной пролиферацией.
В настоящее время доказано, что нарушения, ответственные за развитие опухолей, происходят на уровне ДНК. За исключением вирусиндуцированных, которые у людей достаточно редки.
Трансформация клеток в раковые является результатом структурных изменений в специфических генах, кодирующих белки, принимающие участие в регуляции роста, деления и гибели клеток.
Опухолевые клетки, как правило,
округлые или звездчатые,
они крупнее нормальных; отличаются многообразием ядерных и клеточных форм.
В них изменено ядерно-цитоплазматическое соотношение,
для них характерна полиплоидия (состояние, при котором ядро содержит три и большее число гаплоидных наборов хромосом) или анеуплоидия (число хромосом изменяется и становится не кратным гаплоидному набору).
Трансформированные клетки могут расти, не прикрепляясь к поверхности, в них снижена способность к адгезии, при этом теряет силу контактное торможение.
В опытах in vitro они растут, наползая друг на друга и образуя мультислои, в которых велико содержание митотических клеток.
В метаболизме опухолевых клеток обнаруживается ряд характерных особенностей, которые существенно отличают их от нормальных. Так, в опухолевых клетках происходит следующее:
* возрастает активность рибонуклеотидредуктазы и снижается катаболизм пиримидинов, увеличивается синтез ДНК и РНК;
* повышается скорость гликолиза, и увеличивается продукция лактата. Характерная для многих опухолей повышенная секреция лактата получила название эффекта Варбурга.
* ихзменяется соотношение изоферментного спектра. Так, в углеводном обмене - это фосфофруктокиназа, не ингибирующаяся АТР и цитратом, изофермент III гексокиназы, характеризующийся чрезвычайно высоким сродством к глюкозе, и очень активная лактатдегидрогеназа. В результате раковая клетка приобретает чрезвычайно высокое сродство к глюкозе и способность ассимилировать ее даже при очень низких коцентрациях в крови. Аналогичные сдвиги в спектре изоферментов наблюдаются и в других обменах. Это позволяет опухолевым клеткам успешно конкурировать с окружающими тканями за жизненно важные метаболиты.
* Появляются новые эмбриональные белки и антигены, такие, как ?-фетопротеин, карциноэмбриональный антиген и многие другие;
* изменяются состав и структура олигосахаридных цепей: гликопротеинов и гликосфинголипидов плазматической мембраны, а как следствие ее проницаемость и заряд.
* секретируются некоторые металлопротеазы, коллагеназы, способствующие инвазии опухоли в соседние ткани и сосуды, факторы ангиогенеза, стимулирующие развитие сосудов, которые должны снабжать раковые клетки питательными веществами.
* возрастает скорость синтеза и секреции гормонов и некоторых факторов роста (например, секреция тканью рака легкого АКТГ или, реже, инсулина и глюкагона). Опухоли приобретают способность к автономному росту за счет перехода на пара- или аутокринный механизмы регуляции клеточного роста (рис. 3.1). При аутокринном механизме опухоли синтезируют факторы роста (ФР) и рецепторы к ним (рФР) или онкобелки, являющиеся аналогами ФР или рФР. Образованные одной и той же клеткой ФР и соответствующие им рецепторы, взаимодействуя между собой, вызывают аутостамуляцию роста и деления клеток. Так, при раке легкого клетки стромы вырабатывают инсулиноподобный фактор 2, который взаимодействует с рецепторами ткани рака и стимулирует ее рост и деление;
* появляется высокоактивный фермент теломераза или альтернативные пути удлинения теломер. У животных и человека на концах линейных хромосом расположены тысячи высококонсервативных повторов гексадезоксинуклеотидов TTAGGG, называемых теломерами, которые позволяют концам хромосом прикрепляться к ядерной оболочке и предотвращают их деградацию и рекомбинации. При каждой репликации длина теломер укорачивается примерно на 100 пар оснований. Для делящихся соматических клеток укорочение теломер служит репликометром, определяющим количество делений, которое способна совершить нормальная клетка. После достижения теломерными последовательностями критического размера клетки теряют способность к делению и стареют (барьер Хейфлика). Теломераза представляет собой олигомерный фермент рибонуклеопротеин, в котором специфический участок теломеразной РНК служит матрицей для синтеза теломерной ДНК. Механизм удлинения концов эукариотической хромосомы включает следующие этапы: а) связывание G_богатой цепи теломеры с матричным участком теломеразной РНК; б) РНК-зависимый синтез теломерной ДНК из дезоксинуклеозидтрифосфатов; в) транслокацию, т.е. перемещение ДНК, удлиненной на один повтор относительно фермента, и последующее многократное повторение этих стадий (рис. 3.2). Комплементарная нить ДНК достраивается с помощью ДНК-полимеразы.
Таким образом, особенности метаболизма, существование эффективного механизма удлинения теломер и способность к автономному росту дают опухоли не только преимущества в росте и размножении, но ведут к появлению клонов иммортализованных, или бессмертных, клеток.
• Раковым клеткам присущи несколько определенных свойств
• В отличие от здоровых клеток, при росте на чашках Петри, при контакте с окружающими клетками раковые не прекращают деление
• Для поддержания роста и пролиферации для раковых клеток характерна пониженная потребность в ростовых факторах
• В отличие от здоровых, раковые клетки, растущие в культуре не нуждаются в прикреплении к физическим субстратам — эта независимость роста от фиксации с поверхностью является их характерной чертой
• В отличие от культуры здоровых клеток, у которые деление останавливается через определенное количество циклов, раковые клетки бессмертны и поэтому после образования определенного числа поколений клеток не прекращают деления
• Для раковых клеток часто характерны хромосомные аберрации, в том числе, изменение числа хромосом и их структуры
Годами исследователи описывали специфические особенности раковых клеток. Они суммированы в таблице ниже. Многие эти особенности лучше изучать, выращивая клетки в культуре (in vitro), чем исследовать ткани организма (in vivo). Большинство раковых клеток удобно выращивать в чашках Петри. В то же время многие типы здоровых клеток гораздо труднее растить in vitro.
Здоровые клетки, помещенные в чашку Петри с питательной средой, оседают на дно и делятся до тех пор, пока не заполнят все дно, после чего их рост прекращается. Этот феномен носит название контактное торможение и означает, что при контакте клеток друг с другом механизм пролиферации выключается. Поэтому нормальные клетки образуют слой, толщина которого соответствует одной клетке, т. е. монослой. Когда слой клеток полностью покрывает дно чашки Петри, он называется конфлуентным монослоем.
Раковые клетки ведут себя совершенно другим образом. На рисунке ниже показано, что, когда они растут на чашках Петри, их рост продолжается в течение долгого времени после того, как они образовали межклеточные контакты. Невозможность прекратить деление приводит к тому, что клетки начинают образовывать слои на поверхности друг у друга.
Если раковые клетки растут среди большого количества нормальных клеток на чашках Петри, то в конце концов их потомки образуют плотные скопления клеток, окруженные монослоем здоровых клеток, которые называются фокусы. Количество таких фокусов легко подсчитать даже невооруженным глазом. Таким образом, биологи легко подсчитывают число клонов трансформированных клеток, находящихся в популяции здоровых.

Потеря контактного торможения является не единственным отличительным свойством раковых клеток. Когда суспензия этих клеток смешивается с агаровом гелем и помещается в чашку Петри, они образуют сферические колонии. Напротив, здоровые клетки не способны расти в суспензии, и для того, чтобы они начали размножаться, они должны прочно прикрепиться к поверхности дна чашки Петри. Поэтому для здоровых клеток характерен прикрепленный рост, в отличие от раковых клеток, рост которых не зависит от прикрепления.
К числу клеток, легко культивируемых in vitro, относятся клетки соединительной ткани, называемые фибробластами. Когда культуру фибробластов, растущую в чашках Петри, по мере достижения конфлуентности пересаживают в другие чашки, клетки продолжают расти и делиться, но по прошествии определенного времени прекращают пролиферировать. Прекращение роста означает, что клетки каким-то образом способны ограничивать количество циклов деления и что, когда линия клеток исчерпывает отпущенное число циклов деления, рост ее останавливается.
Это происходит даже несмотря на то, что окружающие условия остаются оптимальными для пролиферации. Об этом свидетельствуют наблюдения, согласно которым, в зависимости от типа клеток и их источника (организма), пролиферация останавливается после образования 30, 40 или 50 поколений клеток.
Рисунок ниже иллюстрирует это положение. По сравнению со здоровыми клетками, раковые представляют собой полный контраст. Адаптировавшись к условиям культивации, они способны к бесконечной пролиферации и, таким образом, являются иммортализованными.
Культуры раковых клеток также обладают другими особенностями, которые отличают их от здоровых клеток. При выращивании культуры здоровых клеток они нуждаются в питательных добавках, представляющих собой больше чем просто питательные компоненты (аминокислоты, глюкоза, витамины). Питательная среда должна также содержать сыворотку, полученную из телячьей крови. Эта сыворотка содержит ростовые факторы (GF), представляющие собой белки, которые выделяются одними клетками для поддержания роста других.
Один из распространенных ростовых факторов сыворотки, тромбоцитарный фактор роста (PDGF), выходит из тромбоцитов в процессе свертывания крови, наступающего после повреждения тканей. Обычно при высвобождении PDGF на участке раневой поверхности он оказывает стимулирующее действие на рост соседних фибробластов, которые затем участвуют в регенерации ткани. Аналогичным образом, присутствие фактора в ростовой среде необходимо для стимуляции роста фибробластов на чашках Петри; без добавления PDGF клетки в течение недель остаются жизнеспособными не не делятся и не растут.
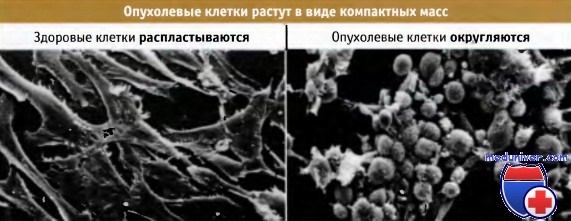
В сканирующем электронном микроскопе видно,
что здоровые клетки распластываются и образуют длинные выросты,
в то время как опухолевые клетки округляются и образуют плотные компактные массы.
Для роста различных типов эпителиальных клеток в культуре необходимы другие ростовые факторы, например такие, как эпидермальный ростовой фактор (EGF). На рисунке ниже представлены механизмы действия ростовых факторов.
Фактически все типы здоровых клеток для стимуляции своего размножения требуют присутствия в среде одного или нескольких ростовых факторов. Это наблюдение привело к важному заключению, касающемуся биологических характеристик большинства клеток: они не пролиферируют, если отсутствует индуцирующий внешний стимул, особенно относящийся к сигалам, передаваемым с помощью GF, присутствующего в окружающей среде. Этот вывод совершенно неприложим к раковым клеткам, и для них необходимы существенно меньшие концентрации GF, чем для здоровых клеток.
Раковые клетки способны сами стимулировать свою пролиферацию, рост и деление, и поэтому в основном не зависят от экзогенных ростовых сигналов.
Важно, что раковые клетки редко становятся совершенно независимыми от внешних ростовых факторов. Гораздо чаще они сохраняют зависимость от определенных клеточных факторов, которые необходимы для пролиферации соответствующего типа здоровых клеток. Так, для роста большинства типов опухолей молочной железы необходимы эстрогены, а для роста опухолей предстательной железы, андрогены. (Хотя обычно считают, что оба агента относятся к гормонам, они регулируют пролиферацию раковых клеток, функционируя как ростовые факторы.) Также для поддержания выживаемости многих типов раковых клеток человека необходим инсулиноподобный фактор роста 1(IGF-1).
В отличие от PDGF и EGF, которые стимулируют рост, некоторые внеклеточные факторы ингибируют пролиферацию клеток. К числу наиболее изученных факторов такого рода относится TGF-b, проявляющий мощное ингибирующее действие на пролиферацию различных типов эпителиальных клеток. По своему действию он напоминает GF с отрицательным эффектом (из-за способности индуцировать неприкрепленный рост некоторых клеток, он получил свое первоначальное название фактора роста опухоли). Опять-таки, в отличие от здоровых, раковые клетки по-разному реагируют на присутствие этого фактора.
Многие из них выработали способность противостоять ингибирующему эффекту TGF-b и продолжают делиться в присутствии довольно значительных концентраций этого GF с отрицательным эффектом.
Таким образом, раковые клетки проявляют неодинаковое отношение к сигнальным молекулам, присутствующим во внешнем окружении. Они относительно независимы от экзогенных сигналов, стимулирующих рост, и в то же время вырабатывают устойчивость к сигналам, его подавляющим. Такое отношение к сигнальным молекулам позволяет сделать общий вывод, касающийся биологии раковой клетки: эти клетки теряют связь с сигнальными молекулами, присутствующими в их окружении (а именно с положительно и отрицательно действующими GF).
Еще одна важная особенность раковых клеток заключается в том, что они часто характеризуются аберрантным хромосомным набором: некоторые хромосомы отсутствуют, другие присутствуют в избыточном количестве, а при объединении сегментов нормальных хромосом образуются необычные хромосомы. Такая аномалия хромосом, называемая анеуплоидией, контрастирует с нормальной картиной хромосомного набора, характерной для здоровых клеток — эуплоидией. На рисунке ниже показана микрофотография анеуплоидной опухолевой клетки, полученная после флуоресцентной гибридизации in situ.
Суммируя все вышесказанное, можно прийти к выводу, что раковым клеткам свойственно значительное количество различных аномалий. Однако перечисленными их особенностями список не исчерпывается. Необходимо учитывать, что раковые и здоровые клетки разделяют также ряд общих черт, что часто делает очень трудной задачу их избирательного уничтожения, не затрагивая при этом здоровые.
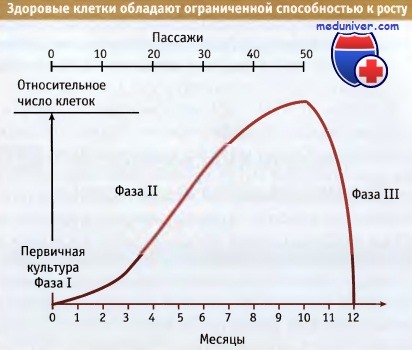
Рост популяции здоровых клеток прекращается через 30-40 удвоений.
После этого популяция вступает в т.н. фазу покоя. 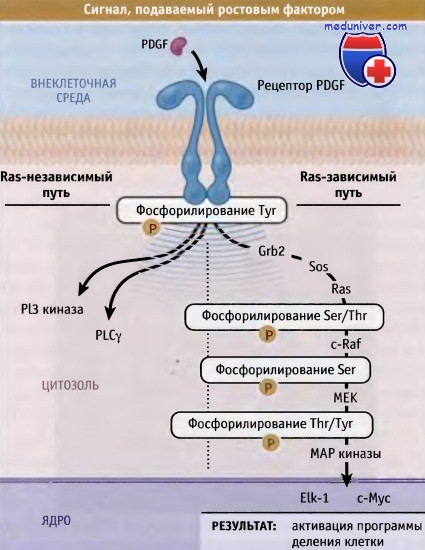
Типичная схема внутриклеточных событий при пе редаче сигнала.
Лиганд (в данном случае PDGF) связывается рецептором и активирует каскад внутриклеточных событий,
при водящий к изменению состояния клетки.
Основными сигнальны ми процессами в клетке является фосфорилирование белков, также гидролиз липидов и ГТФ. 
На этой микрофотографии показан препарат хромосом клетки одного из колоректальных раков.
Хромосомы окрашены с помощью специфических гибридизационных зондов, меченных различными флуорохромами,
которые позволяют визуализировать дефекты их структуры и количества.
Читайте также:

