Опухоли и внеклеточный матрикс
Из школьного курса биологии известно, что все живые организмы состоят из клеток. Но ткани многих многоклеточных организмов, прежде всего животных, состоят не только из клеток, но и из внеклеточного матрикса, который обеспечивает клеткам механическую поддержку, помогает сохранять определенное расположение в пространстве и влияет на многие физиологические показатели.
Внеклеточный матрикс — это сложное образование, состав и структура которого зависят от функций, выполняемых тканью или органом. У человека и животных он представляет собой волокнистую структуру, состоящую в основном из гиалуроновой кислоты и структурных белков (коллагена, фибронектина, эластина и других). Взаимодействие между клетками и внеклеточным матриксом имеет огромное значение для многих процессов в норме и при патологии.
Это взаимодействие рассматривают с использованием двух основных подходов — биохимического и физического. Первый из них предполагает определение белков, которые участвуют в формировании контактов между клетками и волокнами матрикса, а также способов передачи сигналов через эти белки. Второй подход задает вопросы, как рельеф и механические свойства матрикса влияют на клетки и как клетки могут влиять на матрикс — делать его жестче или мягче, натягивать и т. п. Ученые сравнительно недавно осознали важность физических параметров и долгое время им не уделяли должного внимания из-за того, что их сравнительно сложно измерить и стандартизовать.
Считается, что существует определенный набор механических параметров внеклеточного матрикса, оптимальных для роста клеток: жесткости, пластичности, деформации, механического напряжения и других. Клетки способны регистрировать эти параметры и реагировать на их изменения — этот процесс называется механотрансдукцией. Если жесткость субстрата и напряжение в нем недостаточны, активируются сигнальные пути, ответственные за синтез компонентов внеклеточного матрикса. Кроме того, клетка натягивает субстрат в местах контактов с ним (в так называемых фокальных контактах). Если же жесткость субстрата и напряжение в нем превышают оптимальные значения, клетка снижает передаваемую субстрату нагрузку, уменьшает секрецию компонентов матрикса и выделяет разрушающие его ферменты (например, металлопротеиназы). Передача внешних механических сил через цитоскелет на ядро приводит к активации механочувствительных каналов на поверхности ядерной мембраны, вследствие чего меняется активность внутриядерных образований: происходит сворачивание хроматина, изменяется доступ ключевых белков к сайтам регуляции и транскрипции генов.
Нарушения регуляции этого цикла может быть причиной различных патологий: фиброза (образование рубцов в различных органах), остеопороза, атеросклероза. Особенное значение механические свойства внеклеточного матрикса имеют в контексте онкологических заболеваний. Несмотря на то что отправной точкой образования опухоли является генетический сбой, развитие опухоли определяется в том числе и процессами, происходящими во внеклеточном матриксе.
Именно поэтому многие опухоли мягких тканей обнаруживают как уплотнения, это часто бывает, например, при раке груди, кожи, предстательной железы и других. Повышенная жесткость опухоли определяется одновременным действием нескольких факторов: быстрого деления клеток, разрастания и уплотнения внеклеточного матрикса, разрастания сети сосудов, в некоторых случаях увеличением давления внеклеточной жидкости. Более жесткие опухоли обычно более устойчивы к химиотерапии, а значит, этот параметр может быть прогностическими и способствовать выбору терапии. На уровне отдельных клеток опухоль не жестче, а мягче: раковые клетки обычно на 20–50% мягче, чем нормальные. Это обычно объясняют тем, что раковые клетки имеют менее развитый актиновый цитоскелет — сеть волокон, которые обеспечивают движение клеток, помогают клеткам поддерживать форму и внутриклеточный транспорт. В здоровых клетках актиновый цитоскелет формирует хорошо заметные протяженные тяжи, а в раковых он сравнительно рыхлый и слабоструктурированный. Проще говоря, раковые клетки при быстром делении не успевают сформировать развитые волокна цитоскелета и меньше нуждаются в нем, чем нормальные клетки.
Как ученые исследуют механотрансдукцию? Для исследования взаимодействия между клеткой и субстратом можно использовать двумерные или трехмерные системы. Двумерные системы используются в клеточной биологии традиционно: клетки обычно выращивают на донышках чашек Петри или планшетов. Однако в последние годы становится ясно, что в таких системах не удается воспроизвести многие биологические особенности, и исследователи переходят к культивированию клеток на гелях. Клетки помещают на поверхность или в объем мягкого геля, который обычно делают на основе коллагена. Варьируя химический состав и условия приготовления геля, можно определить влияние жесткости субстрата на клетки — проследить, как от жесткости субстрата зависят их форма, скорость миграции, скорость деления и другие параметры.

Фото: Предоставлено Дмитриемй Багровым и Анастасией Соколовой
Как клетки меняют внеклеточный матрикс, так и матрикс влияет на их поведение. Более глубокое изучение не только биохимии, но и биофизики этого взаимодействия поможет углубить наши представления о живой ткани и молекулярных механизмах развития заболеваний, а также разработать имплантаты, которые приживаются в теле человека быстрее и менее болезненно, чем ныне существующие.
Дмитрий Багров, ведущий научный сотрудник биологического факультета МГУ; Анастасия Соколова, аспирант биологического факультета МГУ
Проникновение в окружающие здоровые ткани и сопряженное с ним образование вторичных очагов опухолевого роста — два основных свойства злокачественного роста.
Рано или поздно в ходе развития большинства новообразований в первичной опухоли возникают клетки, которые проникают в смежные ткани, из них — в сосуды, по которым распространяются в отдаленные области организма и колонизируют их.
Эти отдаленные колонии — вторичные опухоли или метастазы — наиболее опасное проявление прогрессии рака и основная причина смерти онкологических больных.
Так, способность к инвазии и метастазированию заложена в эмбриональных клетках в ходе органогенеза, лежит в основе врастания нормального трофобпаста в матку, проявляется при заживлении ран и т.д.
В тоже время не всем малигнизированным клеткам первичной опухоли присуща способность к инвазии и метастазированию. Понятно, что успешное осуществление этих процессов, как и формирование первичной опухолевой массы, зависят от уже изложенных выше характерных особенностей рака.
В настоящее время установлено, что это сложный многокомпонентный генетически запрограммированный процесс. Он имеет свою информационную основу, генетическое обеспечение и базируется на типовых механизмах, в реализации которых важная роль отводится ферментам и цитокинам.
Метастазированию предшествуют размножение опухолевых клеток и инвазия их в окружающую опухоль строму. На патогенетическом уровне они тесно связаны между собой, что и оправдывает их объединение в единое свойство опухолевых клеток.
Однако, с методологических позиции целесообразно рассматривать этот механизм как два последовательных процесса:
а) инвазия опухопевых клеток во внеклеточный матрикс;
б) васкупярная диссеминация, поселение и приживление опухолевых клеток в других тканях.
Механизмы инвазии опухолевых клеток во внеклеточный матрикс
Напомним, что составные части тканей организма разделены матриксом В его состав входят базальные мембраны и стромальная соединительная ткань В ходе продвижения опухолевые клетки, взаимодействуют с внеклеточным матриксом на различных этапах метастатического каскада в виде четырех последовательных этапов: разъединение или освобождение злокачественных клеток друг от друга; прикрепление к компонентам матрикса; расщепление матрикса; миграция опухолевых клеток в межклеточном веществе.
Разъединение и обособление (диссоциация) злокачественных клеток в первичном узле опухоли является ключевым событием в обеспечении инвазии. Нормальные клетки прикреплены друг к другу или к компонентам матрикса с помощью молекул адгезии.
Межклеточную адгезию обеспечивают в основном кадгерины. среди которых наиболее изучен белок Е-кадгерин, действующий как супрессор инвазии и метастазирования.
Установлено, что разъединение и освобождение клеток из первичной опухоли возникает после утраты межклеточных связей вследствие снижения уровня молекул Е-кадгерина, как это схематически представлено на рисунке 3.20.

Рис. 3.20. Механизм нарушения межклеточных контактов. Утрата молекулы клеточной адгезии (Е-кадгерина), может запустить метастатический процесс [Kirbyк S.; цит. по Моисеенко В.М. и соавт., 2004].
Вероятно, понимание этого механизма открывает новые терапевтические подходы для предупреждения рецидивов, метастазов и разработки новых лечебных воздействий на остаточные клетки опухоли.
Прикрепление опухолевых клеток к внеклеточному матриксу
Утрата межклеточной фиксации приводит к увеличению потери фракции раковых клеток из опухоли. Дальнейший ход инвазии и метастазирования будет зависеть от возможности преодоления малигнизированными клетками внеклеточного матрикса.
Однако для этого они вначале должны прикрепиться к его компонентам (в частности, к паминину, фибронектину, коллагену), т.е. пройти этап адгезии (лат. adhaesio — прилипание).
Доказано, что фиксация опухолевых клеток к матриксу опосредована рецепторами прикрепления, среди которых кардинальную роль играют интегрины. Установлена прямая зависимость между плотностью распределения рецепторов прикрепления и способностью раковых клеток к инвазии.
Поэтому, с точки зрения противоопухолевой терапии, вероятно, возможно создание лечебных средств интегриннаправленного действия, например антител против интегринов. Подобные препараты могут быть направпены на биологические процессы не только в опухоли, но и при артериальном рестенозировании, тромбозе, остеопорозе и т.д.
Расщепление внеклеточного матрикса
После фиксации в матриксе раковые клетки должны проложить себе пути для миграции, что требует активного ферментного расщепления протеазами компонентов матрикса. Протеазы вырабатываются самими опухолевыми клетками, либо местными клетками стромы (фибробластами, макрофагами) и подразделяются на пять групп.
Центральную роль в протеолитической деградации матрикса при инвазии играют матриксные металлопротеиназы. (matrix metalloproteinases, ММР). Это семейство эндопротеаз (их известно более 20) содержит атом металла и способно разрушить большинство компонентов базальной мембраны и матрикса.
Поэтому можно считать весьма перспективным применение лекарственных препаратов, ингибирующих продукцию матриксразрушающих протеаз, для хотя бы частичного подавления инвазивного и метастатического процесса.
Миграция опухолевых клеток
Они вырабатываются самими опухолевыми и/или клетками окружения. К хемокинам относятся аутокринные факторы самопроизвольной подвижности, а также некоторые факторы роста (инсулиноподобные и др.). Ответ на органоспецифические хемокины, вероятно, может определять особые пути миграции и места экстравазации метастатических клеток.
Вероятно, поэтому карциномы желудка часто метастазируют в надпочечники, хотя закономерностями васкуляризации это совсем не диктуется.
На процесс инвазии могут влиять и другие факторы. Так, выбор направления миграции опухолевых клеток может определяться градиентом рН и давления кислорода. Клетки перемещаются из зон с высокими или низкими значениями этих показателей в область с нейтральными.
Инвазии опухолевых клеток способствует возрастающее давление внутри ткани опухоли за счет быстрого размножение клеток и развития местного отека вследствие пережатия лимфатических путей. Увеличенное давление выталкивает по пути наименьшего сопротивления опухолевые клетки за пределы опухоли в прилегающие ткани.
Кроме того, опухолевые клетки редко проникают в такие плотные ткани, как фасции, кость или толстостенные артерии и артериолы, а продвигаются вдоль линий наименьшего сопротивления, образуемых соединительнотканной стромой.
Существенную роль в инвазии играет также пролиферация окружающей опухоль соединительной ткани. Ее пролиферирующие клетки, обеспечивая механическую поддержку и питание опухоли, создают дополнительные условия направленной миграции опухолевых клеток.
Кроме того, достаточно часто наблюдается обильная околоопухолевая клеточная инфильтрация преимущественно лимфоцитами, плазматическими клетками, гистиоцитами, макрофагами, что расценивается как активная клеточная иммунная реакция. Замечено, что она исчезает с началом метастазирования.
Механизмы метастазирования (метастатического каскада). После того, как раковые клетки попали в матрикс, начинается собственно процесс метастазирования, который состоит из серии последовательных и взаимосвязанных этапов (рис. 3.21).

Рис. 3.21. Схема принципиальных этапов метастазирования злокачественных новообразований [Cotran R.S., и соавт., 1989].
Каждый из них проходит на фоне цитотоксических влияний иммунной системы, воздействия лекарств и в условиях конкуренции с локальными нормальными клеточными клонами.
Интравазальная инвазия опухолевых клеток
Что касается кровеносной системы, то интравазация чаще происходит в артериальные сосуды. Считается, что прямой интравазации неопластических клеток в вены препятствует их спадение в опухолях. Однако в вены раковые клетки могут заноситься из сосудов лимфатических.
Стенки мелких сосудов опухолей устроены по типу капилляров из одного слоя эндотелия, околососудистая соединительная ткань относительно скудная и поэтому имеется большое количество щелевых дефектов между эндотелиальными клетками, через которые подобно макрофагам и лимфоцитам, опухолевые клетки проникают в сосуды в лимфатических капиллярах базальная мембрана вообще отсутствует.
Дефектность или полная утрата базальной мембраны объясняется снижением синтеза ее компонентов или повышением активности разрушающих ее протеаз.
Циркуляция злокачественных клеток по лимфо- и/или гематогенному руслу
При попадании в сосуд клетки должны перенести процесс транспортировки, поскольку часто их гибель связана с относительно большей чувствительностью к иммунным и неиммунным защитным механизмам, включая турбуленцию кровотока и травму клеток во время циркуляции.
Так, хорошо известно, что опухолевые клетки могут взаимодействовать с факторами системы коагуляции крови через выработку тромбокиназы или индукцию агрегации тромбоцитов.
Поэтому циркулирующие в крови опухолевые клетки легче прикрепляются к сосудистой стенке капилляров, если они вовлекаются в состав микротромбоэмболов. В прежние поды выдвигались версии, что метастазирование можно подавить антикоагулянтами (стрептокиназой, аспирином, гепарином и др.). однако информация о клинической эффективности антикоагулянтов как средств, препятствующих метастазированию, крайне скудна и противоречива.
Опухолевая эмболия представляет собой внутрисосудистый этап метастазирования и характеризуется тем, что циркулирующие в сосудах опухопевые клетки весьма подвержены разрушающему воздействию иммунной системы и в частности NK-клеток.
Как раз одним из факторов, защищающих раковые клетки от иммунных воздействий, и является образование микротромбоэмболов. Это, а также секреция в микроэмболах тромбоцитами факторов роста значительно увеличивает вероятность выживания и успешной имплантации неоппастических клеток.
Прикрепление злокачественных клеток к стенке сосудов предшествует выходу их за пределы лимфососудистого русла. Процесс адгезии клеток хорошо изучен методом прижизненной видеомикроскопии. Было обнаружено, как циркулирующие раковые клетки уменьшаются в размерах, затем прижимаются к эндотелию и деформируются.
Последнее изменение долго трактовалось как признак разрушения и массивной клеточной потери, превращающей метастазирование в неэффективный процесс. Однако, по последним данным, среди деформированных клеток процент их, сохраняющих способность к выживанию и экстравазальному размножению, достигает 80.
Через несколько часов после указанной задержки раковые клетки вытягиваются вдоль эндотелия и происходит собственно адгезия. В процессе прилипания участвуют некоторые интегрины, молекулы адгезии эндотелия, межклеточные молекулы адгезии и другие вещества.
В отношении адгезивных процессов в лимфатическом русле известно еще меньше.
Полагают, что фиксация опухолевых эмбопов происходят вообще не в капиллярах, а в лимфатических сосудах и связана с особенностями их анатомического строения. Как известно, лимфатические сосуды состоят из клапанно-сократительных сегментов, именуемых лимфангионами. Элементы опухоли обычно прикрепляются в области створок полулунных клапанов лимфангионов.
Определенное значение имеет и то, что лимфатические сосуды прерываются в лимфатических узлах, где рост клеток приводит к формированию метастаза, блокаде лимфатических путей и развитию коллатералей.
Экстравазация злокачественных клеток
Если опухолевым клеткам удается выжить после циркуляции с током лимфы или крови, то затем они должны выйти из сосудов и проникнуть в окружающую их ткань в других участках организма.
При этом этапы и способы инвазии осуществляется по тем же механизмам, что и при выселении и перемещении злокачественных клеток из первичной опухоли за пределы базальных мембран: диссоциация, фиксация к матриксу, его расщепление и миграция по образованным каналам вглубь внеклеточного вещества.
Размножение опухолевых клеток в зоне экстравазальной инвазии, формирование метастатического очага
Приживление метастаза также требует стимуляции роста опухолевых клеток, преодоления ими на новом месте воздействия иммунокомпетентных клеток.
Таким образом, для того чтобы опухолевые клетки освободились из первичного узла, затем проникли в лимфатическое или кровеносное русло и начали вторичный рост в какой-либо дистантной локализации, им нужно пройти ряд ступеней метастатического каскада.
Достижение и завершение его возможно лишь при условии, что раковые клетки из первичной опухоли будут способны к выживанию, поскольку на каждой ступени каскада они подвергаются множеству различных воздействии и в принципе могут погибнуть.
В эксперименте показано, как, несмотря на то, что ежедневно из злокачественной опухоли в кровоток проникают миллионы клеток, лишь менее 0,05% их способны в итоге образовать всего несколько метастазов.
Основы такой непродуктивности в отношении потенций к метастазированию заложены в гетерогенности и генетической нестабильности фенотипа злокачественных клеток первичной опухоли. Лишь некоторые субклоны обладают той комбинацией генных продуктов, которая необходима для их выживания.
Молекулярные механизмы этого отбора сложны, отличаются в различных тканях, в них задействованы многие генетические программы. Этот аспект канцерогенеза — один из наиболее сложных, запутанных и наименее изученных. Сейчас уже известно, что белки нескольких классов вовлечены в инвазивные и/или метастатические процессы.
К таким белкам относятся молекулы межклеточной адгезии (Е-кадгерин) на эпителиальных клетках. Утрата функции кадгерина в результате мутационной инактивации его гена может запускать метастатический процесс за счет облегчения отделения от опухоли злокачественных клеток.
Значит, ген Е-кадгерина является супрессором инвазии и метастазирования эпителиальных раков, а его функциональное выключение представляет собой ключевой этап приобретения этих свойств. Второй важнейший фактор инвазивности и метастазирования — матрикслизирующие протеазы.
Изменение специфичности связывания других молекул адгезии и интегринов — также важный момент приобретения инвазивности и способности к метастазированию.
По-видимому, существуют гены, подавляющие метастазирование. Так, например, изучается ген пт23 (nonmetastatic), который в экспериментальных и клинических исследованиях способен противодействовать метастазированию рака молочной железы.
Очевидно, что индукция ангиогенеза и формирование сети кровеносных сосудов, как в первичной опухоли, так и в метастазе также является одним из главных условий метастазирования. Именно образование новых кровеносных сосудов позволяет опухолям расти, создавать пути эвакуации их клеткам из первичного очага и способствовать приживлению образовавшегося спонтанного аутотрансплантата в других органах и тканях.
Таким образом, способность к метастазированию складывается из комплекса более простых признаков: диссоциация злокачественных клеток, приобретение ими повышенной противолитической активности и локомоторного фенотипа, способность стимулировать ангиогенез, возникновение независимости от субстрата и др. Появление каждого из этих признаков увеличивает вероятность развития метастазирования.
Угляница К.Н., Луд Н.Г., Угляница Н.К.

Известно, что рак молочной железы нередко сопровождается лимфогенным диссеминированием [1]. Однако до сих пор не найдены надёжные критерии, характеризующие метастатический потенциал рака молочной железы [2; 3].
Согласно литературным данным, преимущественно изучался инфильтративный компонент стромы опухоли, а также его зависимость от молекулярного подтипа и ряда физиологических показателей. На основании этих исследований делали вывод о наличии или отсутствии лимфогенного метастазирования [4]. Между тем состояние внеклеточного матрикса считается одним из факторов, влияющих на злокачественную прогрессию опухоли молочной железы 5. Начальные изменения внеклеточного матрикса выявляются даже при протоковой карциноме in situ и заключаются в снижении содержания гликозаминогликанов, в частности декорина, и в изменении коллагена [8; 9]. Подобные изменения, называемые десмопластической реакцией, встречаются при многих карциномах, в том числе и при раке молочной железы [10]. Внеклеточный матрикс играет важную роль в прогрессировании и метастазировании опухоли, а деградация коллагена – в проявлении инвазивной способности рака молочной железы 12.
Поэтому актуальным остаётся поиск патогистологических параметров внеклеточного матрикса, которые позволяли бы с высокой долей достоверности охарактеризовать ту или иную злокачественную опухоль как метастазирующую или неметастазирующую в регионарные лимфатические узлы.
В связи с этим целью исследования явились оценка и поиск высокочувствительных и высокоспецифичных признаков, характеризующих внеклеточный матрикс инвазивной карциномы молочной железы неспецифического типа при лимфогенном метастазировании.
Материал и методы исследования
Исследование было проведено на постоперационном материале 85 пациенток с инвазивной карциномой молочной железы неспецифического типа, средний возраст 57 (от 38,0 до 77,0) лет. Метастазы в регионарные лимфатические узлы присутствовали у 29 пациенток в среднем возрасте 56 (от 42,0 до 69,0) лет, в то время как у остальных 56 в среднем возрасте 58 (от 38,0 до 77,0) лет в лимфоузлах метастазы отсутствовали. У больных с инвазивной карциномой неспецифического типа был определён молекулярный подтип опухоли. Кроме того, был исследован операционный материал 24 пациенток с фиброаденомой молочной железы (группа сравнения), средний возраст которых составил 48 (от 18,0 до 67,0) лет. Все пациентки, участвующие в исследовании, не получали предоперационного лечения.
Образцы молочной железы подвергались фиксации и заливке в парафин, после чего приготавливали срезы по известным методикам. Срезы окрашивали гематоксилином Эрлиха и эозином. Коллагеновые волокна, окрашенные пикрофуксином по Ван Гизону, имеют красный цвет, а при изменении их тинкториальных свойств приобретают оранжево-жёлтую окраску. ШИК-реакцией по Mак-Maнусу выявляли нейтральные гликопротеины, имеющие светло-фиолетовую окраску. Альциановым синим при рН 1,0 с последующей докраской ядер кармалюмом Майера выявляли сульфатированные гликозаминогликаны, окрашивающиеся в сине-зелёный цвет.
Для статистической обработки результатов использовали программный пакет SPSS v 17.0 for Windows. Полученные в ходе исследования данные представлены как медиана (Me) и интерквартильный размах (Q1; Q3).
Качество полученных результатов проверялось с помощью ROC-анализа.
Результаты исследования и их обсуждение
У большинства пациенток с инвазивной карциномой и метастазами в регионарных лимфатических узлах отмечалось выраженное разволокнение пучков коллагеновых волокон, размытость их контуров, фрагментированность. У некоторых больных имелись участки с глыбчатым распадом коллагеновых волокон. При этом наблюдались множественные обширные участки с изменением сродства коллагеновых волокон к пикрофуксину, что проявлялось изменением их тинкториальных свойств (рис. 1). В участках разрушения коллагеновых волокон наблюдалось увеличение количества нейтральных гликопротеинов (рис. 2), а также снижение содержания сульфатированных гликозаминогликанов (рис. 3).
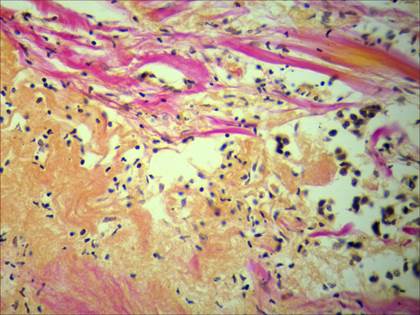
Рис. 1. Участок молочной железы с изменением тинкториальных свойств коллагеновых волокон (оранжево-жёлтое окрашивание), при наличии метастазов в регионарных лимфатических узлах. Окраска пикрофуксином по Ван Гизону. Ув. 400
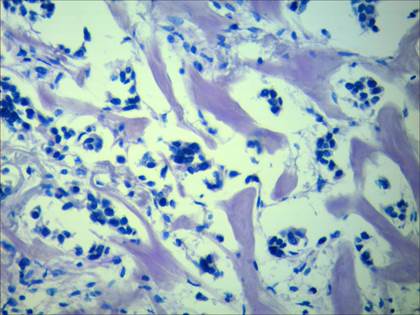
Рис. 2. Участок молочной железы с увеличением содержания нейтральных гликопротеинов (интенсивное фиолетовое окрашивание), при наличии метастазов в регионарных лимфатических узлах. ШИК-реакция по Мак-Манусу. Ув. 400
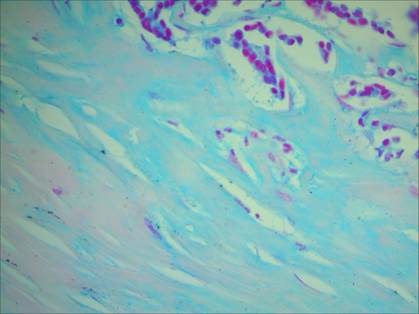
Рис. 3. Участок молочной железы со снижением содержания сульфатированных гликозаминогликанов (бледно-красное окрашивание), при наличии метастазов в регионарных лимфатических узлах. Окраска альциановым синим при рН 1,0 с последующей докраской ядер кармалюмом Майера. Ув. 400
У пациенток с инвазивной карциномой молочной железы неспецифического типа при отсутствии метастазов в регионарных лимфатических узлах в большинстве случаев было обнаружено незначительное разволокнение пучков коллагеновых волокон, без их деградации. В единичных случаях выявлялись участки с выраженным разволокнением пучков коллагеновых волокон, размытостью их контуров, фрагментированностью. Однако, в отличие от пациенток с метастазами, в подобных участках не наблюдалось изменений тинкториальных свойств коллагеновых волокон (рис. 4). У большинства пациенток в ткани молочной железы происходило незначительное повышение содержания нейтральных гликопротеинов (рис. 5) и незначительное снижение содержания сульфатированных гликозаминогликанов (рис. 6).
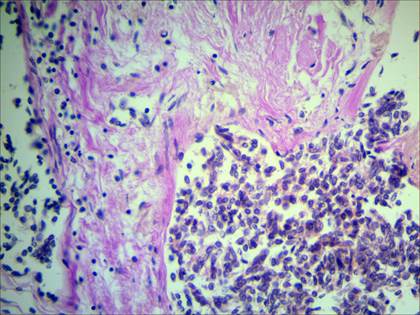
Рис. 4. Участок молочной железы с разволокнением коллагеновых волокон, но без изменений их тинкториальных свойств (красное окрашивание), при отсутствии метастазов в регионарных лимфатических узлах. Окраска пикрофуксином по Ван Гизону. Ув. 400
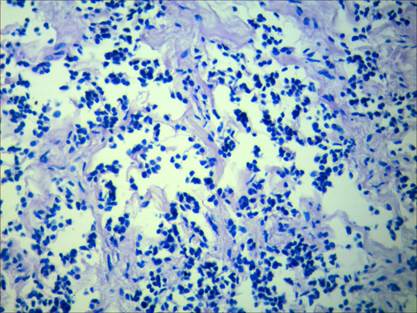
Рис. 5. Участок молочной железы с неизмененным содержанием нейтральных гликопротеинов (светло-фиолетовое окрашивание), при отсутствии метастазов в регионарных лимфатических узлах. ШИК-реакция по Мак-Манусу. Ув. 400
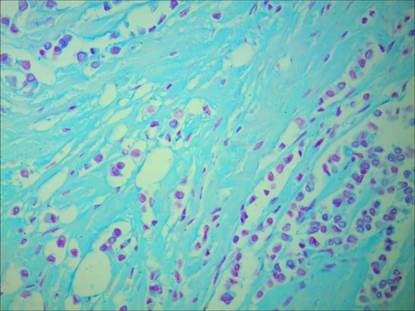
Рис. 6. Участок молочной железы с неизмененным содержанием сульфатированных гликозаминогликанов (сине-зелёное окрашивание), при отсутствии метастазов в регионарных лимфатических узлах. Окраска альциановым синим при рН 1,0 с последующей докраской ядер кармалюмом Майера. Ув. 400
У пациенток с фиброаденомой молочной железы не наблюдалось участков с деструктивными изменениями коллагеновых волокон, более того, пучки коллагеновых волокон были крупными и плотно примыкали друг к другу (рис. 7). Изменения тинкториальных свойств коллагеновых волокон отсутствовали. Вместе с тем у большинства пациенток отмечалось повышение содержания нейтральных гликопротеинов (рис. 8) и сульфатированных гликозаминогликанов (рис. 9).
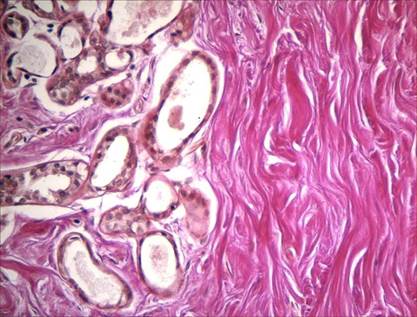
Рис. 7. Участок с крупными и плотно расположенными пучками коллагеновых волокон без изменения их тинкториальных свойств (интенсивное красное окрашивание), при фиброаденоме молочной железы. Окраска пикрофуксином по Ван Гизону. Ув. 400
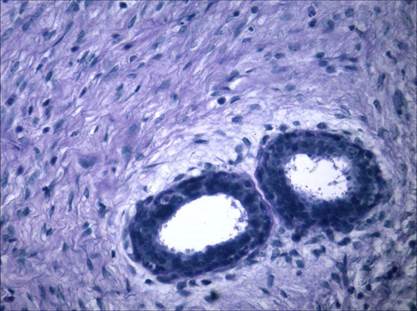
Рис. 8. Участок с увеличением содержания нейтральных гликопротеинов (интенсивное фиолетовое окрашивание) при фиброаденоме молочной железы. ШИК-реакция по Мак- Манусу. Ув. 400
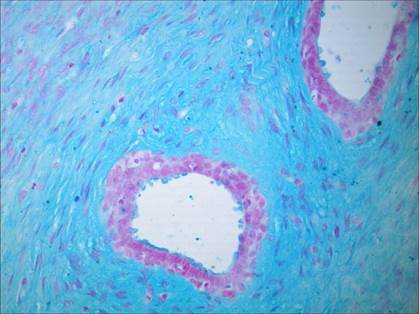
Рис. 9. Участок с увеличением содержания сульфатированных гликозаминогликанов (интенсивное сине-зелёное окрашивание) при фиброаденоме молочной железы. Окраска альциановым синим при рН 1,0 с последующей докраской ядер кармалюмом Майера. Ув. 400
Оценка признаков, характеризующих внеклеточный матрикс (ВКМ) опухоли молочной железы, выражалась в баллах, которые представлены в таблице 1.
Признаки, характеризующие внеклеточный матрикс опухоли молочной железы
А. Разволокнение пучков коллагеновых волокон и их деградация
А.1. Отсутствие признака
А.2. Незначительное разволокнение пучков коллагена, без их деградации
А.3. Умеренное разволокнение пучков коллагена, размытость их контуров, фрагментированность коллагеновых волокон менее 10%
А.4. Выраженная деградация и глыбчатый распад пучков коллагена
Б. Изменения тинкториальных свойств коллагеновых волокон
Б.1. Отсутствие признака
Б.2. Незначительные изменения тинкториальных свойств коллагена: от 1 до 3 мелких участков (S 75%) с усилением интенсивности окрашивания в большинстве полей зрения
В.4. Выраженное повышение содержания НГ: обширные участки
(S > 75%) с местами резко выраженного усиления интенсивности окрашивания в большинстве полей зрения
Г. Содержание сульфатированных гликозаминогликанов (СГ) в участках с измененными коллагеновыми волокнами
Г.1. Отсутствие изменения признака
Г.2. Незначительное снижение содержания СГ: от 1 до 3 мелких участков (S 75%
Е.3. Умеренный отёк: компоненты ВКМ занимают от 25 до 75%
Е.4. Выраженный отёк: компоненты ВКМ занимают
Читайте также:

