Опухоли головы и шеи объем облучения
Специалисты отделения опухолей головы и шеи НМИЦ онкологии имени Н.Н. Петрова подготовили ответы на самые частые вопросы пациентов, проходящих лучевую терапию. Они рассказали, с какими побочными эффектами можно столкнуться во время этого длительного и непростого лечения, как их избежать или облегчить.
Что такое лучевая терапия? В каком случае она назначается?
Лучевая терапия (радиотерапия, облучение) — современный метод лечения с помощью ионизирующего излучения. В качестве ионизирующего излучения в зависимости от видов и задач лучевой терапии могут быть использованы разные виды лучей (рентгеновские или гамма-лучи). Они вызывают сходные биологические эффекты в клетках и тканях, определяя лечебное действие облучения.

Количество полученного облучения называется дозой и измеряется в греях (Гр). Доза облучения при разных типах лучевой терапии назначается индивидуально с учётом многих факторов — особенностей как самого заболевания (вид, стадия, локализация), так и пациента.
Лучевая терапия проводится только при наличии показаний в результате взвешенного решения. При этом специалисты всегда руководствуются важной целью — оказать наилучшую помощь пациенту в лечении его заболевания. Обязательно оцениваются риски и выгоды, устанавливается соотношение пользы и вреда от облучения.
Всегда ли возникают осложнения?
Многие пациенты волнуются, ожидая тяжёлых осложнений от лучевого лечения. Следует помнить, что каждый человек — индивидуален. Нежелательные эффекты могут быть почти незаметными или временными, не все из них будут у конкретного пациента.
Но надо помнить, что как у любого метода лечения, у лучевой терапии есть побочные эффекты. Большинство из них возникает постепенно обычно к концу второй недели облучения. Они делятся на ранние лучевые реакции и поздние лучевые реакции, проявляются в органах, расположенных непосредственно в поле облучения.
Во время лечения могут проявиться тошнота, снижение аппетита, покраснения на коже, потеря концентрации внимания, выпадение волос, слабость и прочее.
Какие осложнения при проведении лучевой терапии у пациентов с опухолями головы и шеи бывают и как с ними справиться?
Проблемы с питанием и потеря веса
Для успешного прохождения лечения необходимо качественно и сбалансировано питаться. Лечение – не время диет для похудения. В этот период организм нуждается в дополнительной энергии для борьбы с болезнью. К сожалению, именно в этот момент возникают побочные эффекты, из-за которых принимать достаточное количество пищи не получается, что и ведёт к потере веса и нарушению работы всех органов и систем организма.
В далеко зашедших случаях приходится прерывать лучевую терапию. Поэтому пациенту необходимо очень внимательно отнестись к своему рациону, количеству и качеству съедаемой пищи в день.
Какие проблемы могут возникать?
Они разные, но встречаются почти у всех:
- снижение или потеря аппетита,
- нарушение вкусовых ощущений и запаха,
- сухость во рту,
- тошнота,
- нарушение глотания,
- боль в ротовой полости.
Что может помочь?
Принимайте пищу дробно. По 6-8 раз в день. Порции должны быть небольшие, а еда негорячая.
Не допускайте длительных перерывов без пищи. Всегда имейте под рукой то, чем можно перекусить.
Не ешьте бесполезной, пустой еды. Каждый кусочек должен нести пользу. Выбирайте высококалорийные продукты, богатые белком.

Переходите на мягкую или измельчённую пищу. Можно самостоятельно использовать блендер.
Не отчаивайтесь, если любимое блюдо перестало быть вкусным, ищите альтернативные варианты. Это временное явление, после лечения вкус еды постепенно вернётся.
Пейте достаточное количество жидкости.
Контролируйте свой вес: взвешивайтесь каждые два дня.
Не употребляйте алкоголь, он раздражает и дополнительно сушит слизистую рта. Алкоголь оказывает общее токсическое действие на организм.
Каждый день необходимо наблюдать за собой. Если наступает момент, когда количество потребляемой пищи и жидкости заметно уменьшилось, а вышеперечисленные советы не помогают, не надо скрывать это от лечащего врача.
В этом случае он назначит дополнительно специализированное питание и инфузионную терапию.
В некоторых ситуациях лечащий врач принимает решение установить назогастральный зонд, и тогда питание происходит через него, а ротовая полость изолируется от контакта с пищей, это даёт возможность сохранить целостность слизистых оболочек в ротовой полости, не происходит травматизация обожжённых тканей. Многие пациенты боятся и всячески избегают этой процедуры, но, по отзывам тех, кому пришлось с этим столкнуться, зонд — это спасение. Как, чем и в каком режиме питаться через зонд обучает медицинская сестра стационара, где пациент проходит лечение.
В некоторых ситуациях пациентам показано формирование гастростомы: при обширном распространении опухоли на шее, при невозможности питаться, когда пища совсем не проходит. Гастростома чаще всего устанавливается эндоскопически, что позволяет избежать травматизации и своевременно начать питание.
Трудности с дыханием
В некоторых ситуациях у пациентов возникает необходимость формирования превентивной трахеостомы. Она нужна в случае, когда пациенту трудно дышать из-за опухоли в области шеи и в ситуации, когда врач понимает, что во время лучевой терапии возникнет отёк мягких тканей, который может привести к удушью.
Одна из частых проблем — это воспалительное или язвенное поражение ротовой полости и, связанная с этим осложнением, боль.
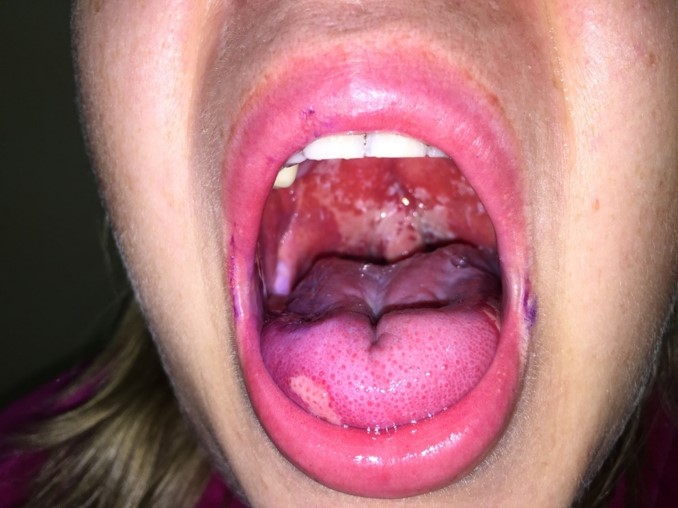
Пациент может заметить уменьшение слюноотделения, изменение вкуса, боль (она может быть острой), жжение, язвочки на слизистой полости рта, затруднение в приёме пищи и глотании.
С самого начала лечения рекомендуется соблюдать тщательную гигиену полости рта:
- использовать мягкую зубную щётку,
- чистить зубы после каждого приёма пищи,
- полоскать ротовую полость физиологическим раствором или другими растворами по назначению врача.
- Необходимо избегать приёма горячей, кислой, раздражающей, грубой пищи, а также горячих напитков.
При развитии вышеперечисленных симптомов лечащий врач назначает соответствующую терапию, в том числе противоболевую, облегчающую возникшее осложнение.
Осложнения со стороны ЖКТ
Запоры являются частой проблемой во время лечения. Причинами могут быть снижение двигательной активности, изменение рациона. Стул должен быть регулярным, ежедневным или через день. При задержке до трёх дней об этом необходимо сообщить врачу.
Диарея — это также осложнение от лечения, о ней обязательно нужно сообщить врачу. Последствия от потери жидкости в организме во время лечения могут быть невосполнимыми, а осложнения очень серьёзными.
Кожные осложнения
Кожные реакции в зоне облучения беспокоят многих пациентов. Лечащий врач назначит специальные средства для ухода за кожей.
Общие рекомендации:
- используйте мягкие, щадящие моющие средства для ежедневной гигиены;
- исключайте любое раздражение: воротнички, украшения, мочалки;
- после умывания высушивайте кожу промакивающими движениями;
- носите одежду с мягкой, свободной горловиной;
- закрывайте кожу от прямых солнечных лучей, используйте солнцезащитные средства SPF50;
- увлажняйте кожу и наносите кремы после сеанса радиотерапии.
Выпадение волос
Выпадение волос — неприятное осложнение, настигающее часть пациентов в процессе лечения.

Общие рекомендации: если выпадение сильное, то необходимо сбрить волосы полностью в парикмахерской. Волосы отрастут. Во время лечения необходимо избегать окрашивания и осветления волос. Для психологического комфорта можно использовать парики, шарфы, банданы или шапочки.
Это наиболее частые проблемы, с которыми может столкнуться пациент, а также способы их решения.
Вот ещё несколько советов, основанных на опыте сопровождения пациентов.
Сопутствующие хронические заболевания. Как их контролировать во время лучевого лечения?
Если у пациента есть хроническое заболевание: гипертония, сахарный диабет, гастрит и т.д., то следует знать, что возможно обострение или изменение его течения. Это может потребовать коррекции дозы принимаемых препаратов. Необходимо быть внимательным к своему самочувствию, аккуратно принимать назначенные лекарства.
Обо всех изменениях своего самочувствия необходимо сообщать лечащему врачу или медицинской сестре.
Что делать курильщикам?
Бесспорно — курение вредно. Необходимо постараться снизить количество выкуриваемых сигарет, а лучше совсем перестать курить.
Полезны ли физические нагрузки во время лечения?
Физические нагрузки должны быть лёгкими и неутомительными. Прогулки полезны и желательны.
Бег, поднятие тяжестей необходимо отложить на потом.
Если у пациента есть хобби: вязание, вышивка, рисование, то желательно взять всё необходимое этих занятий с собой в стационар. Если увлечения нет, то, может быть, стоит попробовать?
Общение, или где найти единомышленников?
Многие согласятся, что очень важно иметь единомышленников, с которыми можно поговорить и обсудить насущные проблемы. В ситуации заболевания единомышленник — это сосед по палате или отделению. Общение, поддержка друг друга, обмен информацией и даже взаимоконтроль помогают лучше и легче перенести лечение. Это доказано опытом.
С другой стороны, соседи по палате могут создавать и проблемы, например, храп! Не стоит пренебрегать берушами для сна. Качественный сон очень важен.

Врачи, медсёстры и другие медицинские работники — это тоже единомышленники пациента. Они рядом и готовы помочь.
Очень важно не замыкаться и не закрываться от окружающего мира.
А если нужна психологическая помощь?
Во многих стационарах есть возможность получить помощь медицинского психолога. Не стоит отказываться, если в этом есть необходимость.
Полезно задать психологу вопросы, которые беспокоят, получить на них ответы и профессиональную психологическую поддержку.
Перед выпиской важно обдумать и записать возникшие вопросы по питанию, обезболиванию, дальнейшему лечению и задать их лечащему врачу. Выписываясь из стационара, пациент должен знать, что ему делать, куда обращаться в той или иной ситуации.
И в завершение пожелание от одного из пациентов НМИЦ онкологии им. Н.Н. Петрова:
2013 год, 58 лет, диагноз рак горла IV стадия. В течение 7 месяцев 6 курсов химиотерапии, 33 сеанса лучевой терапии, не прекращая основной работы, переведя её в дистанционную форму.
2020 год, 65 лет. Работа, хобби.
Авторы:

Медсестринский состав отделения ОГШ
- Ольга Сергеевна Корнеева;
- Наталия Сергеевна Василькова;
- Елена Николаевна Степанова;
- Кабанова Лариса Валерьевна;
- Норочевская Инга Васильевна;
- Полякова Оксана Николаевна;
- Игнашова Надежда Борисовна;
- Верюжская Любовь Николаевна.
![]()

Под научной редакцией:
Раджабова З.А.
Заведующий отделением опухолей головы и шеи
НМИЦ онкологии им. Н.Н. Петрова,
врач-онколог, научный сотрудник, кандидат медицинских наук, доцент
Лучевая терапия является неотъемлемым компонентом лечения злокачественных новообразований головы и шеи. Рентгеновские лучи были открыты в 1895 г. В. К. Рентгеном и названы им Х-лучами (этот термин применяется во многих странах). Первый радиоактивный изотоп (радий) был обнаружен в 1899 году Марией Кюри, в начале 1900-х годов он был впервые использован для лечения опухолей головы и шеи. Радиоактивные изотопы используются и по сей день при брахитерапии. Рентгеновское излучение высокой мощности является основой лечения при многих онкологических заболеваниях головы и шеи.
Ранние методы лечения (ортовольтная рентгенотерапия и поверхностная терапия) в настоящее время применяются ограниченно, т. к. их использование для подкожно расположенных опухолей сопровождается значительной альтерацией кожных покровов.
Лишь с изобретением в 1960-х высокоэнергетических линейных ускорителей стало возможным использовать внешние источники излучения для лечения опухолей головы и шеи, не повреждая при этом кожу. Изобретение методов симуляции, планирование лечения с помощью КТ, изменения формы пучка излучения при помощи многолепестковых коллиматоров и модулирование мощности излучения позволили сделать методы лучевой терапии еще более точными, концентрируя пучок излучения на тканях опухоли и сокращая воздействие радиации на окружающие органы и ткани (слюнные железы, мышцы глотки, черепные нервы). Современные методы доставки радиоактивного излучения позволяют достичь миллиметровой точности, с одномоментном коррекцией интенсивности облучения каждой анатомической области.
Эти достижения сделали лучевую терапию одним из важнейших компонентов многофакторного лечения, целью которого является не только превосходный локальный контроль опухолевого роста, но и максимальное сохранение функции пораженных и окружающих органов.
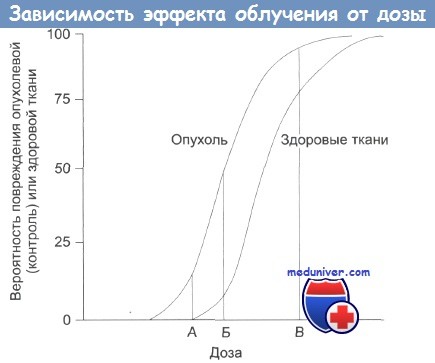
Зависимость терапевтического эффекта от дозы облучения.
А — нижняя безопасная доза;
Б — увеличение дозы: растет поражение здоровых тканей;
В — наивысшая вероятность успешного лечения, но и высокая вероятность поражения здоровых тканей, многочисленные побочные эффекты, некоторые из которых могут проявиться в отдаленном будущем
а) Биология лучевой терапии. Радиация вызывает прежде всего гибель репродуктивных клеток, таким образом опухоль лишается возможности воспроизведения. Мишенью терапии является ДНК опухоли, где формирование свободных радикалов под воздействием ионизирующего излучения обеспечивает постоянный разрыв двойной цепи. Здоровые ткани обладают большей способностью к самовосстановлению после воздействия облучения, чем клетки опухоли. Именно эта разница в репаративных свойствах нормальных и опухолевых тканей и позволяет убивать злокачественные клетки, не нарушая при этом целостность и функциональность окружающих тканей.
Как правило, для избирательной терапии используется доза в 50 Гр (грэй), для лечения остаточных микроскопических опухолей — 60 Гр, для лечения крупных новообразований — 70 Гр. Для достижения достаточного контроля опухолевого роста при стадиях Т3 и Т4 в большинстве случаев требуется использование радиосенсибилизатора. В случае плоскоклеточного рака головы и шеи время и частота использования лучевых методов лечения имеют особое значение, т.к. эти опухоли способны к отсроченной ускоренной репопуляции на фоне проводимой лучевой терапии. Феномен репопуляции во время терапии и способность раковых клеток к дифференциальной репарации часто требуют использовать различные фракционные режимы подачи ионизирующего излучения.
Существенные результаты были достигнуты простым сокращением времени лечения с традиционных семи недель до шести недель и менее. Лучшая способность нормальных тканей к репарации также используется при увеличении дозы облучения с традиционных 70 Гр до 80 Гр с гиперфракционированием и двукратным облучением в сутки. В результате в долгосрочной перспективе общая токсичность остается на том же уровне, но значительно улучшается контроль над ростом опухолевой ткани.
б) Общие методы улучшения регионарного контроля при проведении лучевой терапии. Злокачественные новообразования головы и шеи могут нарушать функции жевания, речи, глотания, вкусового восприятия, приводить к значительным косметическим дефектам. Важными задачами лечения являются ликвидация опухоли с сохранением функции органа. На ранней стадии заболевания обычно достаточно лишь одного метода лечения, в то время как запущенные случаи требуют мультидисциплинарного подхода.
Значительных успехов удалось достигнуть благодаря методам нетрадиционного фракционирования и сочетания лучевой терапии с химиотерапией. К последним достижениям относится улучшение качества визуализации опухолей, совершенствование методов доставки ионизирующего излучения, изобретение биологической (иммунной) терапии. Конечным результатом лечения всегда должно быть обеспечение оптимального качества жизни пациента с достижением максимально возможных функциональных результатов, для чего терапия должна подбираться индивидуально для каждого пациента.
в) Методы лучевой терапии и терапия пучками заряженных частиц. С целью оптимизации терапевтического эффекта было разработано несколько методов доставки ионизирующего излучения. Основой лечения остаются методы дистанционной лучевой терапии, которые основаны на том, что пучок излучения сначала генерируется при помощи специальной аппаратуры, а затем, до того, как достигнуть тела пациента, моделируется различными блоками и коллиматорами. При брахитерапии источник излучения устанавливается напрямую на опухолевую ткань с целью усиления эффекта от дистанционной лучевой терапии. В результате данного метода доза облучения опухолевых клеток увеличивается, а нормальных — снижается.

1. Дистанционная лучевая терапия. Двухмерная лучевая терапия. При проведении традиционной двухмерной лучевой терапии поля облучения формируются на основе костных ориентиров с достаточно широкими краями (до 2 см), рентгеновское излучение подается до противоположных латеральных полей и нижнего поля на передней поверхности шеи. Объем облучаемых тканей включает в себя первичную опухоль с краями здоровых тканей и лимфоузлы верхних отделов шеи (при поражении ротоглотки захватывается область выше черпаловидных хрящей, при поражении гортани и гортаноглотки — ниже перстневидного хряща).
Лучевая терапия проделала огромный путь от ортовольтных и радиевых источников, прямоугольных пучков излучения и простых обзорных снимков в качестве ориентиров до современных высокоэнергетических линейных ускорителей с динамической многолепестковой коллимацией, использования КТ для планирования и проведения лечения и современных методов иммобилизации. Развитие систем планирования лечения позволило точно таргетировать доставку ионизирующего излучения, не повреждая таким образом структуры, ответственные за глотание, слух, слюноотделение и жевание, не вызывая тошноты.
Лучевая терапия с модулированной интенсивностью (ЛТМИ). Обеспечение равномерности облучения и снижение общей токсичности при лечении сложных опухолей головы и шеи неправильной формы стало возможным с внедрением трехмерной лучевой терапии и лучевой терапии с модулированной интенсивностью (intensity-modulated radiation therapy, IMRT, ЛТМИ). ЛТМИ вызвала огромный интерес у специалистов из-за того, что она позволяет добиваться конформности дозы облучения и не вызывать повреждения окружающих тканей. С помощью модуляторов интенсивности и методов обратного (инверсного) планирования лучевой терапии каждое поле ионизирующего излучения разделяется на множество более мелких пучков.
Затем за счет объединения нескольких пучков формируется кумулятивная доза, которая затем распределяется в зависимости от размера и формы опухоли и степени резистентности окружающих тканей. Также при помощи ЛТМИ можно дифференцировать дозу облучения, подаваемую на первичный очаг опухоли, пораженные лимфатические узлы и лимфоузлы с высоким риском поражения.
Использование ЛТМИ идеально при злокачественных новообразованиях рото- и носоглотки, поскольку здесь опухоль находится очень близко от чувствительных к радиации здоровых тканей (околоушных слюнных желез, лимфоузлов глотки и заглоточного пространства, располагающихся вблизи от позвоночного столба). У 87-89% пациентов удается добиться сходного или лучшего местно-регионарного контроля по сравнению с традиционными методами (по данным серии случаев отдельных медицинских учреждений). ЛТМИ в дозе 70 Гр или фракциями по 33-35 Гр хорошо переносится больными, даже в сочетании с химиотерапией.
На настоящий момент главным преимуществом ЛТМИ по сравнению с другими методами лечения является снижение частоты развития ксеростомии. Согласно данным Eisbruch и соав., добиться сохранения стимулированной секреции слюнных желез можно при облучении одной околоушной железы при ЛТМИ в дозе 26 Гр и меньше, а полное восстановление секреции обычно происходит в течение двух лет после терапии. Данный фактор очень важен, поскольку одной из главных жалоб, серьезно снижающих качество жизни пациентов после лучевой терапии по поводу злокачественных новообразований головы и шеи, является сухость во рту.
Также при помощи ЛТМИ можно избежать поражения улитки, рвотного центра, констрикторов глотки, жевательной мускулатуры, сонных артерий, малых слюнных желез полости рта, поднижнечелюстной слюнной железы, гортани и крыловидных мышц.
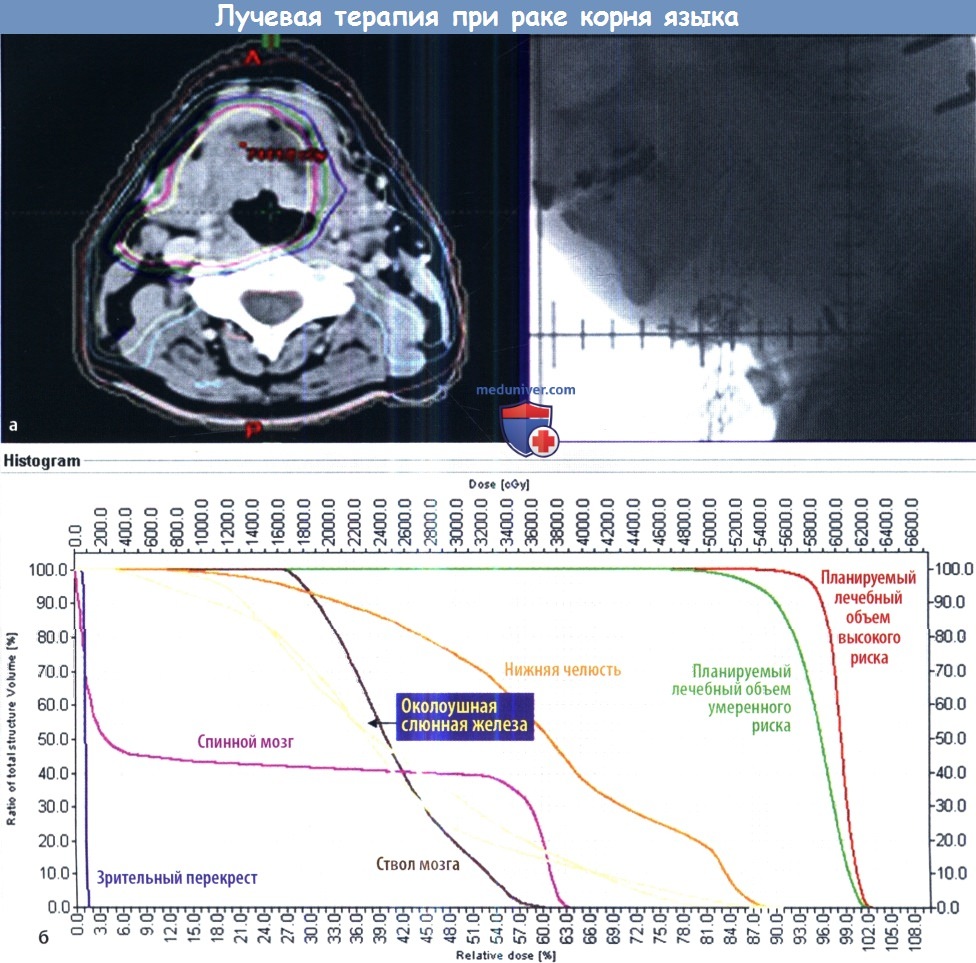
(а) Мужчина 62 лет болен раком корня языка стадии T2N2bM0. Проводилась наружная дистанционная лучевая терапия в сочетании с химиотерапией, брахитерапия и лимфодиссекция.
Облучение очага и первичных лимфоузлов проводилось в пониженной дозе в 5940 сГр, после чего проводился сеанс брахитерапии в дозе 20 Гр.
(б) Гистограмма доза-объем, демонстрирующая распределение дозы облучения в курсе лучевой терапии с модулированной интенсивностью.
2. Брахитерапия. Брахитерапия, т.е. внедрение радиоактивного источника непосредственно в опухоль, обеспечивает оптимальное распределение дозы за счет повышения направленной на опухоль части с ослаблением по закону обратных квадратов воздействия на нормальные ткани. Также уменьшить повреждения нормальных тканей удается за счет того, что использование брахитерапии позволяет снизить общую дозу лучевой терапии, что особенно важно при сочетании с химиотерапией.
3. Стереотаксическая радиотерапия. При помощи стереотаксической радиотерапии можно добиться точной доставки лучевого излучения к ткани опухоли за счет использования жестких механизмов фиксации и применения скрещивающихся пучков. Основное преимущество использования стереотаксической радиации заключается в том, что ионизирующее облучение подается либо однократно (стереотаксическая радиохирургия), либо гипофракционированно (стереотаксическая радиотерапия), а воздействие на ткани опухоли происходит с точностью вплоть до десятых долей миллиметра, что позволяет дозированно воздействовать на опухоли малого размера.
Потенциальное преимущество радиотерапии по сравнению с радиохирургией заключается в том, что фракционная подача радиации в несколько сеансов дает нормальным тканям время на восстановление, увеличивая шансы на сохранение их функции. Это крайне важно при лечении опухолей, расположенных вблизи от зрительных нервов, головного и спинного мозга. В обоих методах лечения используется стереотаксическая рама, которая нужна для точной локализации опухоли в трех плоскостях. Стереотаксическая радиация может подаваться двумя методами: (1) гамма-нож, в котором излучение генерируется 201 независимыми источниками кобальта, расположенными в специальном защитном кожухе; (2) линейный ускоритель, в котором конверсия происходит за счет действия особого коллимирующего устройства. Наиболее эффективны стереотаксические методы лечения при опухолях менее 4-5 см в диаметре, которые хорошо визуализируются на КТ, МРТ или ангиографии.
Чаще всего они используются либо после курса наружной дистанционной лучевой терапии, либо в качестве терапии отчаяния. Особенно эффективны стереотаксические методы лечения при опухолях основания черепа и околоносовых пазух, а также при некоторых доброкачественных новообразованиях (параганглиомы, менингиомы, аденомы гипофиза, сосудистые мальформации, акустические невриномы).
4. Лучевая терапия заряженными частицами. Терапия тяжелыми частицами (протонами и нейтронами) имеет особые преимущества в отношении распределения дозы облучения. Благодаря действию протонов облучение максимально концентрируется вблизи опухоли, резко снижаясь по мере удаления от нее в соответствии с кривой Брэгга, что позволяет точный контроль дозировки. Традиционно протоны использовались в лечении хондросарком основания черепа, аденокистозного рака околоушной слюнной и слезных желез. Нейтронное излучение представляет собой излучение с высокой линейной передачей, за счет чего оно может быть эффективно при лечении радиорезистентных опухолей вне зависимости от степени оксигенации тканей. Наиболее эффективно оно используется в лечении субоптимально резецированных аденокистозных опухолей.
5. Модифицированное фракционное облучение. Методы модифицированного фракционного облучения используются с целью улучшения контроля опухолевого роста либо за счет укорочения курса лечения (для преодоления феномена репопуляции), либо за счет увеличения дозы с одномоментным гиперфракционированием (для использования повышенной репаративной активности нормальных тканей). Ускорить курс лечения можно либо за счет отложенного сочетанного повышения дозы, либо за счет использования датского протокола (шесть стандартных процедур в неделю), в то время как увеличение дозы чаще всего достигается гиперфракционированием. Согласно результатам мета-анализа, выживаемость пациентов, которым лучевая терапия проводилась с эскалацией и гиперфракционированием, была выше, чем у пациентов, которые прошли курс стандартного фракционного облучения.
Знаковым стало исследование радиологической онкологической группы (Radiation Therapy Oncology Group, RTOG 90-03), которое сравнило использующиеся в США схемы фракционного облучения при различных злокачественных новообразованиях (в первую очередь раков III—IV стадии головы и шеи, рака II стадии гор-таноглотки и корня языка). По результатам восьмилетнего наблюдения, по сравнению со стандартными схемами фракционирования использование укороченных курсов и гиперфракционирования позволило улучшить местно-регионарный контроль на 8% и увеличить выживаемость без симптомов заболевания.
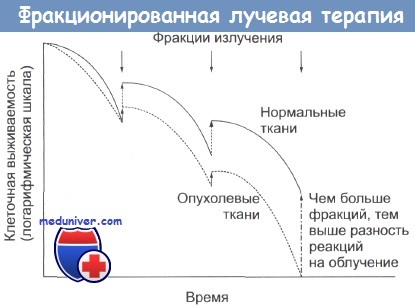
Эффект концентрации кислорода на цитотоксическое действие рентгеновских лучей.
В экспериментах in vitro использовалась культура клеток Hela.
Методики лечения злокачественных опухолей органов головы и шеи
В области головы и шеи могут возникать самые разные злокачественные новообразования, поведение которых существенным образом зависит от места возникновения. Например, характер опухоли, берущей начало в голосовых связках, значительно отличается от поведения новообразования корня языка, причем данные анатомические структуры расположены всего в нескольких сантиметрах друг от друга.
Самой распространенной злокачественной опухолью в области головы и шеи является плоскоклеточная карцинома, которая происходит из клеток, выстилающих носовую и ротовую полость и глотку изнутри. К другим, менее распространенным опухолям относятся новообразования слюнных желез, лимфомы и саркомы.
Распространение рака происходит по трем путям:
- Первый путь. Это непосредственное проникновение раковых клеток из первичного очага в рядом расположенные ткани.
- Второй путь (лимфогенный). Распространение по лимфатическим сосудам.
- Третий путь (гематогенный). Подразумевает миграцию раковых клеток по кровеносным сосудам в отдаленные ткани и органы.
В области головы и шеи самым частым способом распространения опухоли является лимфогенный.
В патологический процесс обычно вовлекаются лимфатические узлы, расположенные по ходу крупных кровеносных сосудов под грудино-ключично-сосцевидной мышцей с каждой стороны шеи. Особенно часто поражается узел в области внутренней яремной вены в углу нижней челюсти. Риск распространения опухоли по кровеносным сосудам существенно зависит от поражения лимфатических узлов шеи, а именно их количества и локализации. Если затронуты лимфатические узлы в нижних отделах шеи, то риск метастазирования увеличивается.
Лечение злокачественных опухолей органов головы и шеи
При лечении рака органов головы и шеи применяется:
- Химиотерапия.
- Радиотерапия.
- Оперативное вмешательство.
Исходными методами лечения считается лучевая терапия, хирургическая операция или их сочетание. Химиотерапия представляет собой метод дополнительного, или адъювантного, лечения. Оптимальное сочетание трех вариантов лечения при той или иной опухоли в области головы и шеи зависит от локализации новообразования и его стадии, то есть распространенности.
При опухолях на ранних стадиях развития (особенно ограниченных местом своего возникновения) назначается либо радиотерапия, либо хирургическая операция. При более распространенных опухолях возможно одновременное проведение лучевой терапии и операция. В некоторых случаях, в зависимости от клинического течения заболевания, сначала проводится хирургическое лечение, а затем - радио- и/или химиотерапия.
Если план лечения первичной опухоли включает только радиотерапию, то облучению подвергаются все органы шеи. Помимо этого, может потребоваться иссечение лимфатических узлов шеи (лимфодиссекция). Это особенно важно при распространении на них рака или невозможности полного устранения опухоли с помощью курса радиотерапии.
Другим лечением, которое может потребоваться перед или после лучевой терапии, является хирургическое удаление опухоли. В целом, если показана операция, то радиотерапия проводится при необходимости после нее. Тем не менее, в некоторых случаях сразу удалить первичную опухоль не удается в силу ее размеров или неудобного положения. В таких ситуациях сначала проводится радиотерапия, что позволяет сократить объем новообразования, а затем операция.
Недавние исследования показывают, что химиолучевое лечение, то есть одновременное проведение химио- и радиотерапии, эффективнее, чем назначение химиопрепаратов до лучевой терапии. При некоторых распространенных формах рака (стадия III или IV) в график радиотерапии также включается химиотерапия. Одновременно с лучевым лечением назначают такие препараты, как цисплатин (Платинол) и цетуксимаб (Эртубикс). Иногда используется 5-фторурацил, карбоплатин (Параплатин) и паклитаксел (Таксол). Это лишь краткий список химиопрепаратов, а лечащий врач может выбрать для лечения другое средство.
Режим химиотерапии может быть различным, включая ежедневное введение препарата в низких дозах, еженедельное введение в относительно низких дозах или использование довольно высокой дозы каждые 3-4 недели.
РАДИОТЕРАПИЯ ПРИ ОПУХОЛЯХ ОРГАНОВ ГОЛОВЫ И ШЕИ
При лечении рака головы и шеи применяется один из следующих методов радиотерапии:
- Наружная лучевая терапия. Метод доставки пучка высокоэнергетических рентгеновских лучей к опухоли. Излучение образуется вне тела пациента с помощью линейного ускорителя и направляется в область опухоли. Рентгеновское излучение уничтожает раковые клетки, а тщательное планирование лечения позволяет защитить окружающие здоровые ткани. После радиотерапии никакого излучения внутри организма пациента не остается.
- Радиотерапия с модулированной интенсивностью (РТМИ). Представляет собой современный метод высокоточной лучевой терапии с использованием компьютеризированных линейных ускорителей, что обеспечивает прицельную доставку излучения к новообразованию или какой-либо области внутри него. При этом пучок лучей полностью соответствует трехмерных параметрам опухоли, в результате чего вся доза излучения целиком фокусируется на мишени, а воздействие на здоровые клетки сводится к минимуму.
Метод проведения лучевой терапии при опухолях органов головы и шеи
Перед началом лучевой терапии пациента консультирует онколог-радиолог. В ходе консультации врач оценивает историю заболевания и проводит осмотр. Проводятся консультации и других специалистов, которые входят в состав группы лечащего персонала: хирурга, патоморфолога, радиолога и стоматолога. Вклад каждого специалиста в процесс обследования и лечения очень важен.
После обсуждения возможных вариантов лечащий врач совместно с пациентом выбирает наиболее подходящий для данного случая метод лечения. Затем врач назначает дату планирования радиотерапии, если она выбрана в качестве основного способа лечения. Составление плана лучевой терапии начинается на этапе моделирования, в ходе которого проводится серия рентгеновских снимков или КТ. Результаты обследования важны для определения типа и направления пучка лучей для воздействия на опухоль.
Формирование пучка происходит под действием специального многолепесткового коллиматора или блоков на основе свинцового сплава, которые укрепляются на линейном ускорителе. Данные приспособления обеспечивают защиту здоровых тканей от ненужного облучения. После этого врач определяет границы области воздействия излучения. Собственно радиотерапия начинается через 1-2 дня после окончания планирования.
Радиотерапия проводится 1-2 раза в день, 5 дней в неделю, в течение 5-7 недель в зависимости от графика, назначенного лечащим врачом. Первые несколько дней сеансы радиотерапии занимают от 1 до 2 часов. В последующем каждый сеанс длится всего несколько минут, а общее пребывание пациента в радиологическом отделении не превышает 30-45 минут.
Сеанс лучевой терапии не сопровождается какими-либо неприятными ощущениями, а побочные эффекты появляются только через две или более недели.
Обследование и лечение после окончания лучевой терапии при опухолях органов головы и шеи
Выделяют несколько целей последующего наблюдения и лечения:
- Лечение острых побочных эффектов радиотерапии.
- Выявление и лечение поздних побочных эффектов или осложнений лучевой терапии, если они возникают.
- Обнаружение рецидива злокачественной опухоли и проведение дополнительного лечения, например, хирургического, если радиотерапия прошла безуспешно.
- Выявление и лечение других очагов злокачественных опухолей, не связанных с первичным новообразованием.
Даже если исходное лечение прошло успешно и привело к полному излечению рака, то существует относительно невысокий риск (2-3% в год) развития новых опухолей в области головы и шеи, не связанных с первичным новообразованием. Поэтому назначается динамическое наблюдение:
- В течение первого года: каждые 4-6 недель.
- В течение второго года: каждые 2 месяца.
- В течение третьего года: каждые 3 месяца.
- В течение 4-5 года: каждые 6 месяцев.
- После этого ежегодно.
Каждый год проводится рентгенограмма органов грудной клетки и оценка функции щитовидной железы на предмет ее снижения, то есть развития гипотиреоза, который легко лечится.
В некоторых сложных случаях, когда оценка присутствия раковых клеток после лечения затруднительна, врач назначает дополнительное обследование, например, КТ, МРТ или ПЭТ с фтордезоксиглюкозой.
Побочные эффекты лучевой терапии при опухолях органов головы и шеи
Побочные эффекты радиотерапии зависят от локализации и распространенности рака органов головы и шеи. В целом, лечение не сопровождается тошнотой и рвотой, которые, однако, возможны у некоторых пациентов. Для облегчения данного состояния используются эффективные противорвотные препараты.
Побочные эффекты возникают только через две или более недели от начала радиотерапии, когда появляется боль в горле, нарушение вкусовых ощущений, сухость во рту и кожные реакции. Основным побочным эффектом, затрудняющим проведение лучевой терапии, является боль в горле. При очень сильных болях пациент не может принимать пищу и жидкости через рот, что важно для поддержания веса и водно-солевого баланса. В таких случаях врач на время вводит в желудок трубку, которая обеспечивает достаточное питание без необходимости глотать пищу. Постановка трубки в желудок проводится амбулаторно. Тем не менее, глотательные движения для пациента необходимы. В противном случае возможна атрофия глотательных мышц и развитие устойчивого нарушения глотания, что затруднит прекращение использования трубки после окончания курса радиотерапии. Поэтому за курсом радиотерапии на органы шеи внимательно следит диетолог, который помогает пациенту поддерживать адекватный водный баланс и энергообмен.
При появлении побочных эффектов некоторые больные стремятся прекратить лечение, однако этого ни в коем случае делать не стоит. Нежелательные явления представляют собой всего лишь острый ответ на радиотерапию здоровых тканей, таких как кожа или слизистые оболочки, реагирующих на излучение подобно раковым клеткам. При этом лечение, которое не вызывает острых побочных явлений, скорее всего будет неэффективным. Перерывы в терапии для облегчения побочных эффектов дают опухоли возможность для восстановления, что существенно снижает вероятность выздоровления.
При радиотерапии на органы головы и шеи практически всегда требуется дополнительный прием обезболивающих препаратов, как длительного, так и краткосрочного действия. Возможно, что потребуются и слабительные средства, поскольку обезболивающие нередко вызывают запоры. Дополнительно может быть назначен местный анестетик на область горла или ротовой полости и, при необходимости, противорвотные препараты, если пациента беспокоит тошнота.
Риски и осложнения лучевой терапии при опухолях органов головы и шеи
Четкая цель лечения каждого пациента должна быть поставлена перед началом курса радиотерапии. Первый вопрос, который предстоит решить врачу, состоит в следующем: возможно ли полное излечение от опухоли при помощи радиотерапии, или лечение предназначено только для облегчения симптомов (то есть является паллиативным)? Если излечение невозможно, то потенциальные риски, связанные с проведением лучевой терапии, ни в коем случае не должны превышать возможную пользу от лечения.
Паллиативное лечение представляет собой короткий курс радиотерапии низкими или умеренными дозами, что обеспечивает довольную высокую вероятность сокращения размеров опухоли и, в свою очередь, облечение симптомов. Побочные эффекты или осложнения при этом выражены незначительно или не возникают вовсе. Стандартный курс паллиативной лучевой терапии включает около 10 сеансов в течение двух недель.
С другой стороны, если излечение возможно, то назначается более длительный и напряженный курс радиотерапии. Шансы на полное устранение опухоли могут быть различными и, в зависимости от ситуации, должны составлять не менее 5-10%. Риски, связанные с подобным лечением, зависят от локализации и распространенности опухоли и характера рядом расположенных здоровых структур.
В целом, при любом лечении врач старается трезво оценить потенциальные риски развития основных осложнений. Если вероятность появления осложнений или побочных эффектов равна возможной пользе лечения или превышает ее, то план терапии подвергается пересмотру. С другой стороны, если вероятность полного излечения существенно превышает риски, то лечение начинается без промедлений.
Новейшие достижения в области лечения злокачественных опухолей органов головы и шеи
Новые методы лечения рака органов головы и шеи представляют собой сочетания старых подходов. Положительным примером является использование в последние годы комбинации радио- и химиотерапии или иммунотерапии при прогрессирующих опухолях.
Вероятность излечения существенно увеличивается при использовании препаратов, которые повышают чувствительность опухоли к радиотерапии. К ним относятся антиангиогенные препараты, которые атакуют питающие опухоль кровеносные сосуды, и средства, подобные эритропоэтину.
(495) 545-17-44 - клиники в Москве и за рубежом
ОФОРМИТЬ ЗАЯВКУ на ЛЕЧЕНИЕ

Протонная терапия позволяет онкологам-радиологам добиваться максимально губительного влияния излучения на опухоль, одновременно сводя к минимуму воздействие на здоровые ткани и органы и сдерживая риск развития побочных эффектов лечения.
.jpg)
Позитронно-эмиссионная томография может оказать помощь врачу-радиологу там, где рентген-исследование или МТР остаются бессильны. Определить злокачественную природу некоторых опухолей возможно только во время операции, либо, использовав ПЭТ/КТ технологию. Второй метод является преимущественным, как безболезненный и эффективный. Достоверность информации, получаемой при ПЭТ диагностике, стремится к 90 процентам, в то время как МРТ дает только 50-70 процентов точности.
Читайте также:

