Опухолевые раковые клетки превращаться в нормальные
Деление клеток опухоли
Характерной чертой злокачественной опухоли является постоянное деление ее клеток, обеспечивающее рост опухоли.
Само по себе деление клеток — это главный атрибут существования и развития жизни.
Как известно, деление клеток происходит при развитии организма, его тканей и органов как в эмбриональном, так и в постнатальном (послеэмбриональном) периодах.
Непонятно также, что заставляет в какой-то момент времени, при каких-то условиях этот ген отключиться и прекратить деление клетки. Считают, что сам организм, его нервная система каким-то образом управляет включением и отключением соответствующего гена. А чем же отличается деление раковых клеток от деления нормальных клеток?
Таким образом, для объяснения феномена постоянного деления раковых клеток ученые вынуждены к генам, регулирующим деление нормальных клеток, добавить еще и онкогены, которые регулируют деление злокачественных клеток. Но от этого не стало яснее, когда и каким образом начинается, происходит и заканчивается деление клеток как нормальных, так и раковых.
Начало формирования опухоли
Проблема формирования опухолева зачатка имеет не только теоретическое, но и практическое значение. Если опухоль развивается только из зачатка путем деления его клеток и при этом в процесс развития опухоли не вовлекаются нормальные клетки, то при лечении достаточно хирургическим путем удалить этот опухолевый зачаток или уже в определенной степени сформировавшуюся опухоль, чтобы прекратить процесс развития раковой опухоли. Если же в процесс развития опухоли вовлекаются и нормальные клетки, то хирургическое удаление опухоли может оказаться недостаточным.
Как видим, и по этой проблеме пока еще идут дискуссии, и ни одна из предложенных гипотез не доказана ни теоретически, ни экспериментально, поэтому у ученых не сложилось общего мнения по данному вопросу. А неопределенность в этом вопросе может существенно влиять на результаты лечения раковой болезни.
Изменения в геноме
Это весьма интересная и важная в теоретическом плане проблема онкологии. В нормальных клетках организма обычно поддерживается постоянство генома и числа хромосом. Так, у человека нормальным принято считать число хромосом в диплоидном наборе 2n = 46.
При развитии раковой опухоли происходят генные и хромосомные изменения. Причем эти изменения нарастают в процессе развития опухоли, т. е. с возрастом опухоли. В результате в опухоли образуются группы (клоны) клеток с различными геномами и различным числом хромосом. Опухоль превращается в новое независимое от организма хозяина существо, живущее самостоятельной паразитической жизнью.
В своей книге Г.Н. Лобко и Г.М. Порубова пишут: «Злокачественная опухоль представляет собой гетерогенную клеточную популяцию, состоящую из различных клонов. Еще в 50-х годах установлено, что число хромосом в клетке колеблется в широких пределах — от величины, значительно меньшей 2n, до величины, большей 4n. Многочисленные результаты опытов, проведенных на перевиваемых опухолях экспериментальных животных, свидетельствуют о широкой вариабельности хромосомных наборов.
Такие весьма различные и противоречивые результаты исследований изменений в геномах раковых опухолей пока не удалось объяснить с позиций современной онкологии и, по-видимому, не удастся и впредь, пока не будет выяснена истинная биологическая причина ракового заболевания.
Эволюция раковых опухолей
В процессе развития опухоли изменяется обмен веществ ее клеток, как полагают, в результате нарушения специализации клеток. При этом происходит уменьшение органелл вплоть до их полного исчезновения, что приводит к нарушению тех функций клеток, которые органеллы обеспечивают в нормальных условиях. По мере развития опухолей скорость их роста увеличивается, как считают некоторые исследователи, не в результате укорочения цикла деления клеток, а за счет увеличения массы делящихся клеток. При этом клетки опухоли все больше и больше становятся независимыми от управляющих воздействий организма.
По мере развития опухоли ее клетки постепенно теряют способность вызывать защитную реакцию иммунной системы организма. И поэтому даже при нормальной компетентности иммунной системы опухолевые клетки имеют возможность для выживания и развития. Более того, в процессе своего развития опухоль приобретает резистентность (сопротивляемость) к различным лекарственным воздействиям. Причем все описанные выше изменения в опухоли могут происходить в различные моменты развития опухоли и появляться в различной последовательности.
Так как все изменения в раковых клетках сопровождаются существенными изменениями в геноме — от отдельных мутаций и до хромосомных нарушений, — то все эти приобретенные опухолью признаки в процессе ее развития являются наследственными. Поэтому развитие раковых опухолей можно рассматривать как некий эволюционный процесс, протекающий аналогично эволюции видов одноклеточных и многоклеточных организмов, А так как деление клеток и рост раковой опухоли обычно не прекращается, то, следовательно, и эволюция злокачественных опухолей происходит постоянно.
Итак, ученые установили, что злокачественные опухоли являются своеобразными организмами, которые эволюционируют так же, как и другие организмы. Следовательно, и движущие силы эволюции должны быть теми же самыми: изменчивость и естественный отбор. Именно с таких позиций и объясняют эволюцию раковых опухолей Г.Н. Лобко и Г.М. Порубова: «Согласно концепции клональной эволюции, многие клеточные варианты, возникающие в популяции опухолевых клеток, оказываются нежизнеспособными.
Поэтому все эти предположения и догадки обычно вызывают массу вопросов, без разрешения которых наши знания о предмете исследований невозможно использовать ни в научном, ни в практическом плане. Такие сведения трудно причислить к научным знаниям.
Вот и в этом разделе об эволюции раковых опухолей имеется настоятельная необходимость высказать ряд вопросов и замечаний:
1. Каковы причины нарушения дифференцировки (специализации) клетки, вызвавшей изменения обмена веществ? А может изменения обмена веществ вызвали нарушения специализации клеток?
2. В результате чего и как клегки раковой опухоли выходят из под контроля факторов организма, регулирующих рост и размножение клеток, т. е. почему они становятся неуправляемыми? А факторы организма — что это такое?
3. Почему нормальные клетки жизнеспособны, а раковые клетки нежизнеспособны? Тем не менее они не только выживают, но развиваются, количественно растут и вытесняют, уничтожают жизнеспособные нормальные клетки.
Очень умный отбор! Все понимает!
Воздействия среды
Как известно, мутации бывают спонтанные (без видимых причин), а также индуцированные внешним воздействием на организм. В качестве таких воздействий, индуцирующих мутации, называют воздействия ионизирующих излучений, ультрафиолетовых излучений, различных химических веществ и др.
Наличие индуцированного мутагенеза доказывает влияние окружающей среды на развитие злокачественной опухоли и на передачу по наследству тех изменений в опухоли, которые появились под воздействием окружающей среды и сопровождались индуцированными мутациями. Кроме того, как полагают, в процессе развития опухоли нарушаются нормальные взаимодействия между клетками, что также способствует росту опухоли.
Но каков механизм индуцирования мутаций? Как, например, изменение химического состояния окружающей клетку среды через две мембраны клетки и ядра воздействуют непосредственно на геном и изменяют его содержание, т. е. индуцируют мутацию? Причем мутацию ни где попало, а в определенном месте и определенного гена. Действительно, связь между изменениями окружающей среды и изменениями в геноме клетки объективно существует, доказана многими экспериментаторами и в настоящее время ни у кого не вызывает сомнений.
Но конкретный механизм этой связи, закономерности индуцирования мутаций до сих пор еще неизвестны. Если, например, в физике индукция — это вполне определенное, конкретное явление, протекающее по определенному закону, описываемому конкретными математическими уравнениями, то в генетике слово индукция призвано в определенной мере сгладить наше незнание механизма воздействия окружающей среды на геном клетки.
На самом деле пока можно говорить лишь о том, что химическое (или физическое) воздействие окружающей среды на клетку вызывает те или иные мутации в ее геноме. А какие мутации конкретно и каким образом они вызываются — это нам пока неизвестно. Я подчеркиваю, воздействия не на геном, а на клетку.
И эти неизвестные механизмы и закономерности воздействия окружающей среды на клетку представляют собой весьма и весьма важную проблему как биологии, так и медицины, как с теоретической, так и с практической точек зрения. Эту проблему мы рассмотрим во второй и в третьей частях книги.
О различии в развитии
Существенный теоретический и практический интерес ученых-онкологов вызывает вопрос о различиях в закономерностях развития нормальных и злокачественных клеток. С одной стороны, как нормальные, так и злокачественные клетки являются живыми организмами и, следовательно они должны развиваться по одним и тем же закономерностям живой природы.
Итак, признано, что раковые клетки развиваются по тем же законам, что н нормальные клетки. Тем не менее раковые клетки достаточно зрелой опухоли существенно отличаются от нормальных клеток целым рядом различных признаков: непрекращающимися делениями, выходом из под контроля организма, более частыми мутациями и хромосомными перестройками и др.
Поэтому естественно возникают вопросы: почему у раковых клеток появляются эти признаки, а у нормальных клеток они не появляются? Какова биологическая причина возникновения таких признаков у раковых клеток? Эти вопросы также пока остаются без ответов.
Реверсия опухоли
Все это говорит о том, что в принципе раковые заболевания излечимы и при помощи лекарственных препаратов, если онкологи сумеют разработать необходимые для этого лекарства и, главное, методики и дозы их применения в каждом конкретном случае. А это значит, что онкологи должны научиться управлять реверсией злокачественной опухоли. Такие работы проводятся в различных направлениях.
Например, при помощи химиопрепаратов пытаются стимулировать дифференцировку злокачественных клеток, т. е. вернуть их к той специализации, которую они имели до заболевания. Считают, что дифференцировка приведет к реверсии опухоли. Исследуются и другие возможные способы управления реверсией.
Как известно, развитие злокачественной опухоли сопровождается существенными изменениями генома и хромосомными перестройками. Поэтому возникает вопрос: как эти изменения и перестройки будут влиять на дифференцировку и на реверсию раковых клеток? А можно ли без дифференцировки нормализовать опухолевые клетки?
В монослойных культурах in vitro осуществить реверсию можно и без дифференцировки, а вот в условиях in vivo, т. е. непосредственно в организме, добиться нормализации опухолевых клеток можно только при дифференцировке.
Таким образом, в принципе имеется реальная возможность целенаправленно осуществлять реверсию раковых опухолей путем определенных терапевтических воздействий. Это эффективный путь лечения раковых болезней. Однако, несмотря на уже имеющиеся примеры реверсий, эта возможность останется в области привлекательных гипотез и благих намерений до тех пор, пока не будет выяснена главная проблема онкологии — биологическая причина и механизм развития злокачественной опухоли, в том числе и реверсии, как частного случая ее развития.
Клетки с раковыми мутациями могли бы использовать своё преимущество в скорости деления и захватить всю ткань, но им мешают другие клетки с такими же амбициями.
Злокачественные опухоли возникают из-за мутаций, которые разрешают клеткам бесконтрольно делиться. Эти мутации появляются как из-за внешних факторов, вроде канцерогенных веществ, которые мы съедаем и вдыхаем, так и по естественным внутренним причинам. Наши клетки регулярно обновляются, на место старых приходят новые, а новые берутся из стволовых клеток-предшественников, которые очень долго сохраняют способность делиться. Но при делении молекулярные машины, которые удваивают ДНК, неизбежно допускают ошибки, которые остаются неисправленными и постепенно накапливаются. Некоторые исследователи полагают, что раковые мутации возникают по большей части как раз из-за неточного копирования ДНК.
Некоторые мутации появляются у нас уже в юности (как в матке, например), а с возрастом их число возрастает десятикратно. Однако далеко не всегда они приводят к чему-то плохому. Исследователи из Института Сенгера полагают, что раковые мутации остаются безопасными из-за конкуренции между клетками-мутантами.
Мутация в стволовой клетке может попасть (и часто попадает) в онкоген – то есть в ген, который, например, управляет делением клетки, но который в норме сохраняет связь с реальностью, то есть воспринимает ограничительные сигналы из внешней среды, от других клеток, от других генов той же самой клетки и т. д. Но после мутации такой ген становится уже чуть менее управляемым, и теперь стволовая клетка-предшественник начинает делиться чуть быстрее, чем обычная стволовая клетка. С одной мутации рак не начнётся, но если клетка-мутант наплодит много потомков, то повышается вероятность того, что в них к этой первой мутации добавятся ещё пара-тройка, и клетки начнут делиться по-раковому.
Но клетки существуют в ткани не сами по себе, а в окружении множества других клеток. И в них тоже могут появляться мутации, которые ускоряют их деление, делая его чуть менее контролируемым. И если одни мутанты столкнуться с другими, у которых есть те же конкурентные преимущества, они начнут друг другу мешать, и в результате никто не будет делиться быстрее и никакой опухоли не появится. В наших тканях места мало, поэтому клеткам приходится согласовывать свои интересы друг с другом.
Исследователи проверили эту гипотезу в экспериментах с мышами, у которых специально заставляли мутировать эпителиальные клетки пищевода (пищевод и кожа – два органа, в которых к среднему возрасту большинство клеток уже несут в себе те или иные мутации). У мышиных клеток очень тщательно выискивали мутации и сопоставляли эти мутации с тем, насколько успешно клетки-мутанты одного рода занимают территорию и как их успех соотносится с соседями. В статье в Nature Genetics говорится, что клоны мутантов действительно сдерживали друг друга, так что в итоге все клетки делились с нормальной скоростью. Разумеется, если в каких-то клетках появятся мутации, которые сразу дадут сильное преимущество, то сбалансировать их другим клеткам уже не получится, и, скорее всего, начнёт развиваться опухоль.
Как именно клетки-мутанты сдерживают друг друга, авторы работы пока не знают. Но если мы поймём, какие сигналы они друг другу посылают, какие молекулы задействуют, то и сами мы сможем использовать эти же сигналы, чтобы подавлять рост уже настоящих раковых клеток.
Рак – это злокачественное заболевание, которое вызывает формирование в организме атипичных клеток с неправильным набором генного ряда ДНК. Болезнь часто заканчивается смертью пациента. Больные клетки появляются из-за мутации здоровых патогенов под влиянием внешних или внутренних враждебных факторов. Неправильные геномы начинают активно делиться и не поддаются процессу апоптоза. Это приводит к формированию опухоли злокачественного характера. Раковые клетки активно изучаются учёными и врачами-практиками.
Характеристика раковых клеток
Нормальная клетка в процессе жизни проходит ряд этапов – зарождение, этап созревания, жизнь и последующая гибель под воздействием естественного механизма (апоптоза). Деление идёт по чётко установленному внутреннему порядку. Развитие клеток подчинено точно расписанному графику, изменение которого приводит к неприятным последствиям.
Раковые клетки – это геномы с нарушенным генетическим развитием, образованные из нормальных здоровых тканей. Мутации происходят под влиянием внешних факторов или внутренних патологий в организме человека. Точных причин подобных мутаций учёные до конца не выяснили. Исследование болезни продолжается до сих пор. Больные клетки не реагируют на поступающие сигналы от головного мозга, что сопровождается внешними изменениями в строении и виде патогена. До перерождения в злокачественную форму внутри клетки происходит до 60 разных мутаций. В процессе мутирования часть погибает, остальная выживает и начинает активно делиться. Так рождаются раковые патогены.
Мутации приводят к внутренним изменениям. Организм не реагирует на такие формы, что провоцирует формирование опухоли в определённом участке тела. Клетки становятся бессмертны из-за невосприимчивости к внутренним сигналам, требующим смены этапа жизни. Нормальный цикл нарушается и вызывает опасные заболевания у человека. Перерождение идёт в течение нескольких лет. Иногда злокачественное новообразование выявляется после смерти человека, но это происходит редко. Первые симптомы появляются при большой концентрации больных клеток и больших размерах уплотнения.
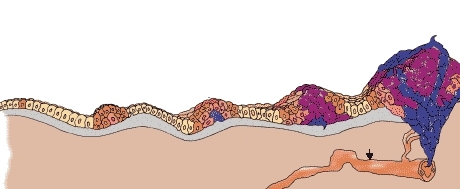
Раковые частицы образуются в лимфоузлах, на коже, на слизистой внутренних органов, в тканях головного мозга, поражают костную ткань и кровеносную и лимфатическую систему. Женский организм подвергается изменениям со стороны молочной железы, матки, придатков и яичников. В группе риска люди, у которых на теле обилие родинок.
Причины развития патологии
Причина трансформации здоровой клетки учёным неизвестна. Спровоцировать процесс перерождения может любой фактор, нарушающий естественное функционирование генома.
Врачи выделяют неблагоприятные воздействия окружающей среды и внутренних патологий, способных привести к мутации:
- болезни печени – гепатит С, В;
- наличие у человека папилломы или вируса герпеса;
- гормональный дисбаланс;
- метаболические нарушения:
- воздействие на организм канцерогенных веществ и химических соединений;
- несбалансированное питание – дефицит растительной клетчатки с избытком белка и углеводов;
- употребление большого количества алкогольных напитков;
- образование опухолей у курильщиков встречается чаще в 50-70%;
- наследственная предрасположенность;
- генетические мутации при формировании хромосомы ДНК;
- наличие патологий хронического характера;
- заболевание эндокринной системы – сахарный диабет, панкреатит;
- присутствие доброкачественных новообразований – фибром, аденомы, кисты или липомы;
- радиоактивные вещества с влиянием магнитного поля;
- нахождение под прямыми солнечными лучами продолжительное время.
В теле человека происходят сложные процессы, отвечающие за нормальное функционирование организма. Учёные описали теоретически ряд версий внутренних патологических изменений, стимулирующие образование онкологии.
Внутреннее строение и внешний вид патогена
Каждый патоген выглядит в зависимости от вида тканевого эпителия, участвующего в формировании. Рассмотреть строение можно под микроскопом. Есть раковые клетки, которые не формируют узелковые формы, к примеру, лейкозные образования в крови. Размеры, форма и состав хромосомного ряда зависит от типа ткани. Развиваются все патогены индивидуально – это позволяет отличить виды патологии. Все виды состоят из разного вида тканевого эпителия.
Аномальные клетки отличаются от здоровых по ряду внешних и внутренних свойств. Внешне злокачественная частица показывает овальную форму с наличием на поверхности большого количества светлых ворсинок.
Под микроскопом в разрезе заметно ядро с множеством генов, отвечающих за признаки и отличительные качества от нормальных частиц. Ядро имеет крупный размер, структура напоминает губку с вдавленными сегментами мембраны. Протеины находятся внутри клетки и теряют способность переносить питательные продукты, преобразующиеся в энергию.
Измененные рецепторы не способны определить проявления внешней среды, что ускоряет развитие опухоли в организме человека. Строение отличается неправильной формой и патологическим составом.
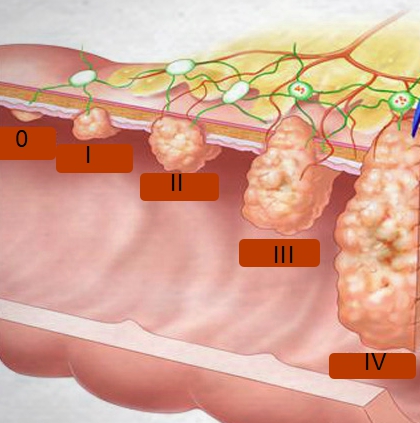
Развитие злокачественного образования
Злокачественная частица растёт поэтапно. На начальной стадии отмечается незначительное внутреннее изменение в строении ядра и внешней мембраны. Определить мутацию здесь сложно. Возможно только при помощи мощного микроскопа.
На второй стадии происходит активное деление аномальной клетки и увеличение в размерах уплотнения. Здесь опухоль может начинать выделять в кровь патологичные вещества, вызывающие соответствующие симптомы.
На третьем этапе присутствуют характерные признаки болезни. Злокачественная опухоль выделяет в кровь атипичные продукты жизнедеятельности.
Четвёртый цикл клетки называется неоперабельным, т.к. опухоль разрастается до крупных размеров, присутствуют аномальные ростки в других участках тела. В организме накапливается большая концентрация раковых веществ, что приводит к интоксикации. Раковая интоксикация – это перенасыщение организма атипичными клетками, приводящее к смерти человека.
Типы раковых генов
У всех нас в организме есть ряд генов, способных перейти в определённый вид патологии. Предрасположенность к болезни зависит от многих факторов. Человек может прожить всю жизнь, не испытав влияния подобных геномов.
Известны типы генов, вырабатывающих аномальные частицы:
- Гены-супрессоры отличаются способностью остановить развитие атипичных патогенов. Препятствующие росту больных клеток частицы уничтожают опасные ядра, что помогает контролировать болезнь. Трансформация таких частиц приводит к бесконтрольному разрастанию злокачественных элементов. При онкологии указанного типа естественное восстановление организма невозможно, требуется медицинская помощь.
- Гены репараций ДНК напоминают гены-супрессоры по механизму функциональных действий. Мутация наблюдается на стадии формирования метастазных ростков.
- Онкогены возникают на месте клеточного соединения. Перерождение одного гена приводит к трансформации всей частицы. Отличается врождённым развитием патологии.
Отличия ракового элемента от здоровой клетки
Отличить злокачественную частицу от нормальной можно по ряду присутствующих свойств – внешнему виду, внутреннему строению, функциональным особенностям.
- деление происходит постоянно, не достигая телофазы;
- жизнь короче здоровой, но быстрый рост наносит сильный вред организму;
- разрастание осуществляется при любых условиях, препятствующих росту нормального генома;
- отсутствует природная регенерация;
- внешне напоминает узелок овальной или округлой формы, возможна капсула с жидкой субстанцией.
По данным признакам врачи отличают раковые элементы и могут определить тип заболевания.
Выявление патологии
При появлении подозрительных симптомов и ухудшении в здоровье нужно провериться на присутствие злокачественного новообразования. Особенно рекомендуется регулярная проверка организма на раковые опухоли людям, у которых есть родинки на теле и светлая кожа. Диагностика включает лабораторное обследование и использование инструментальных методов исследования.
Пациенту требуется пройти некоторые процедуры:
Выявление патологии на раннем этапе формирования раковой клетки увеличивает шанс на полное выздоровление. Поэтому стоит регулярно обследоваться в поликлинике – это позволит предотвратить развитие тяжелых последствий злокачественного новообразования.
Получив результаты исследований, врач оценивает состояние больного. Есть норма показателей, характеризующая отсутствие раковых клеток. Присутствие разницы в параметрах значит, что присутствует постороннее образование злокачественного характера.
Борьба с раковым образованием
Медицина постоянно развивается и находит новые методы, останавливающие разрастание онкологического узла. На начальном этапе формирования патологии присутствует естественная борьба организма. Если победить болезнь не удаётся, требуется медицинская помощь.

Бороться с заболеванием можно разными способами – зависит от степени поражения организма и типа опухоли. Рак боится химиотерапии, где применяются сильные препараты из группы цитостатиков. Используют медикаменты, подавляющие и предотвращающие размножение атипичной клетки. Организм остро реагирует на курсы химиотерапии, поэтому лечение проходит в несколько этапов. Пациенту требуется отдых для восстановления. Дозировка против раковых образований подбирается индивидуально.
Борются с раковыми патогенами и с помощью облучения гамма-лучами. Данная терапия помогает затормозить рост новообразования. Полное уничтожение достигается редко, только при раке кожи. Здесь требуется комплексное лечение с применением нескольких способов.
Удаление возможно хирургическим путем. В этом случае применяют несколько методов – традиционный скальпель, лазерное иссечение, лапароскопия, криодеструкция, электрокоагуляция и другие. Вырезанная опухоль отправляется в лабораторию. Там проверяются ткани на определение типа патологии. Иссечение узла проводят с захватом здорового участка ткани, чтобы предотвратить образование рецидива.
Сейчас активно используется метод таргетной терапии – пациент принимает лекарственные препараты, замедляющие разрастание опухоли. Эффективность всегда индивидуальна. Влияет много внешних и внутренних факторов. Часто проходит совместно с применением рецептов нетрадиционной медицины – человек пьёт лекарственные отвары из трав, настойки, применяет мази, компрессы.
Больные во время лечения питаются по специальной диете. Врач составляет индивидуальное меню. Требуется подбор питательных продуктов, не нагружающих органы пищеварения. Повышается содержание растительной клетчатки с набором полезных микроэлементов.
Прогнозы зависят от стадии выявления патологии. Больные с онкологией на 2-3 стадии живут в среднем 5-10 лет. Влияет вид рака и физическое состояние человека. Смерть от раковой опухоли часто наступает на 4 стадии болезни – она считается неоперабельной формой болезни. Перед смертью применяются методы паллиативной терапии – пациенту создаются комфортные условия для существования. Подбирается курс лекарственных препаратов, снижающих болевые симптомы, и составляется рацион питания.
После каждого проведенного курса лечения больные сдают повторные анализы на выявление рецидива заболевания. Надо сдать мочу и кровь, а также провести ультразвуковое обследование. Результат диагностики показывает изменение состава крови и прооперированного участка. При появлении нового очага применяется повторное лечение.
Как нормальная клетка превращается в раковую (ГЕОРГИЕВ Г.П. , 1999), БИОЛОГИЯ
Открыто более сотни генов, мутации в которых могут способствовать превращению нормальной клетки в опухолевую - это онкогены и гены-супрессоры опухолей. В статье рассмотрены основные функциональные классы, к которым относятся эти гены.
КАК НОРМАЛЬНАЯ КЛЕТКА ПРЕВРАЩАЕТСЯ В РАКОВУЮ
Московский государственный университет
им. М.В. Ломоносова
Рак - это генетическая болезнь, то есть болезнь, связанная с потерей, или повреждением, или активацией, или, наконец, привнесением извне определенных генов. Как известно, ген - это отрезок ДНК, который кодирует тот или иной белок. Последовательность, состоящая из трех нуклеотидов (всего их четыре - A, G, C и Т), кодирует ту или иную аминокислоту, общее число которых равно 20. Последовательность аминокислот в молекуле белка определяет трехмерную пространственную структуру белка и его функцию. Как мы видим, между структурой ДНК (гена) и ее продукта - белка существует прямая связь.
Оказалось, что некоторые вирусы способны в определенных условиях вызывать образование опухолей. Эти вирусы были названы онкогенными вирусами. Вирусы, как правило, содержат очень мало генов - от нескольких генов до нескольких десятков, тогда как в каждой клетке человека присутствует около 100 000 генов. Далее было показано, что из всех генов вируса обычно только один нужен для превращения клетки в опухолевую, то есть для этого нужно появление в клетке лишь одного нового белка. Такие гены были названы онкогенами. У некоторых вирусов это собственные гены вируса (вирусные онкогены), у других вирусов в процессе цикла их развития происходит захват генов хозяина, например генов мыши или человека, и последние выступают в роли онкогенов. Это особенно интересная группа, поскольку в нее входят гены самой клетки, которые функционируют на определенных этапах развития и на их матрице синтезируются нормальные белки.
Возникает вопрос, почему эти нормальные гены начинают индуцировать возникновение опухолей. Есть несколько путей подобной активации онкогена. Прежде всего такая активация может происходить и в вирусе и вне вируса, просто в клетке. Один из путей активации онкогена - структурная мутация, то есть изменение структуры гена, например замена нуклеотида в ДНК, ведущая к замене аминокислоты в белковой цепи и к изменению функции белка. Другой путь - это усиление активности онкогена, то есть усиление синтеза матричных РНК на матрице ДНК и в итоге усиление синтеза белкового продукта онкогена и его накопление в клетке. Активация онкогена может быть результатом увеличения числа копий данного гена в геноме или следствием такой перестройки генома, когда рядом с потенциальным онкогеном появляется новый регуляторный элемент, обеспечивающий его более активную транскрипцию, то есть синтез матричной РНК. Есть и другие способы активации онкогена. Число известных онкогенов непрерывно растет и уже перевалило за 100.
Вскоре после открытия первых онкогенов появились сообщения о существовании генов, утрата или подавление активности которых также приводит к развитию опухолей. Иными словами, белковые продукты этих генов необходимы для того, чтобы не дать клетке превратиться в раковую. Эти гены были названы антионкогенами или генами-супрессорами опухолей (ГСО). Число известных ГСО тоже быстро растет, хотя и уступает числу открытых онкогенов. Итак, есть гены, белковые продукты которых помогают нормальной клетке превратиться в раковую, и гены, белковые продукты которых этому препятствуют. Возникает центральный вопрос, какова природа белковых продуктов онкогенов и ГСО. Оказалось, что она чрезвычайно разнообразна. Основные классы генов и их белковых продуктов, которые могут выступить в роли онкогенов или ГСО, приведены в табл. 1.
Чтобы клетка начала расти и размножаться, нужны специальные сигналы, вырабатываемые обычно другими клетками, а иногда и самой клеткой. Это обычно белковые молекулы, называемые факторами роста (рис. 1). Их производство строго регулируется, но если происходит нарушение регуляции, то факторы могут накапливаться в больших количествах. Они начинают сигнализировать клетке о необходимости расти и делиться. Поэтому некоторые гены, кодирующие факторы роста, могут выступать в роли онкогенов.
Чтобы фактор подействовал, необходим рецептор для данного фактора, расположенный на поверхности клетки-мишени. Когда фактор присоединяется к рецептору, последний активируется, что может в ряде случаев выразиться в ферментативной реакции, например фосфорилировании определенных белков. При некоторых повреждениях рецепторов факторов роста они обретают свойства "зажигаться" при отсутствии своего фактора роста. Такой рецептор будет непрерывно передавать сигнал о необходимости начинать рост, хотя фактор роста и отсутствует. Поврежденный ген, кодирующий такой измененный фактор роста, может выступать в роли онкогена.
Передача сигнала на рост не ограничивается факторами роста и их рецепторами. В передаче такого сигнала участвует много других белков - передатчиков сигнала. Это своего рода клеточное реле. Такая передача часто идет путем фосфорилирования одним белком второго, вторым третьего и т.д. Гены, кодирующие участников этих цепей, могут выступать в роли онкогенов.
Цепи передачи сигналов заканчиваются в клеточном ядре. Там происходит активация так называемых факторов транскрипции, то есть белков, связывающихся с регуляторными участками определенных генов в ДНК и активирующих транскрипцию данных генов. Иными словами, под действием факторов транскрипции на соответствующих генах происходит синтез матричных РНК, а на матрице последних - белков. Это те белки, которые нужны для роста и размножения клеток. И снова среди генов, кодирующих факторы транскрипции, оказываются онкогены. Если соответствующий ген работает с высокой активностью независимо от описанной выше регуляторной цепи, то он способствует превращению нормальной клетки в опухолевую (см. рис. 1).
Итак, многие гены, кодирующие белки передачи сигнала для роста и размножения клеток, являются потенциальными онкогенами. В отлаженной системе нормальной клетки они обеспечивают строго регулируемые рост и размножение, но при повреждении или нерегулируемой активации этих генов клетки превращаются в раковые.
Превращению нормальной клетки в опухолевую противостоят другие системы. Одна из них - это цепь передачи сигнала для подавления клеточного роста от поверхности клетки к ядру. Эти цепи состоят из компонентов, подобных описанным выше, но имеющих противоположный знак действия, то есть их действие реализуется в подавлении транскрипции генов, необходимых для роста и размножения клеток. Некоторые гены, продукты которых участвуют в таком процессе, были идентифицированы как ГСО, их инактивация индуцировала преобразование клеток в опухолевые.
Важный механизм, препятствующий превращению нормальной клетки в опухолевую, - это механизм "проверки в ходе клеточного цикла"(рис. 2). Размножаясь, клетки проходят через несколько фаз клеточного цикла. Важнейшие фазы - это деление клеток или митоз (М); фаза, предшествующая синтезу ДНК (G1); фаза репликации или синтеза ДНК (S), когда происходит удвоение генетического материала; следующая за ней фаза подготовки к делению (G2) и снова митоз (M). Кроме того, клетки могут переходить из G1 не в S, а в фазу G0 или фазу покоя, когда деление клеток отсутствует.
Оказалось, что переход из одной фазы клеточного цикла в другую - это строго регулируемый процесс. На определенных этапах клеточного цикла существуют "точки проверки", во время которых специальные белки определяют, все ли в клетке в порядке и готова ли она к переходу в следующую фазу цикла. Например, если в клетке повреждена ДНК, об этом идет сигнал и переход в следующую фазу блокируется. Или, например, в клетке синтезируются не те белки, которые должны синтезироваться на данном этапе. Опять идет сигнал о блокаде перехода в следующую фазу. Очень важной точкой проверки является точка между G1 и S, поскольку именно в фазе S происходит удвоение генетического материала ДНК и становится возможным последующее деление клетки.
Ясно, что такая система проверки требует большого количества специальных белков. Ключевая роль в разрешении на продвижение по циклу принадлежит белкам семейства циклинов. Последние связываются со специальными ферментами, фосфорилирующими белки, циклинзависимыми киназами (ЦЗК). Только находясь в комплексе с циклинами, ЦЗК начинают фосфорилировать свои белки-мишени, и это, в свою очередь, активирует гены, продукты которых нужны на следующей фазе цикла.
Многие гены, кодирующие белки - участники этой системы контроля, выступают в роли онкогенов или ГСО. Гены, кодирующие белки, помогающие клетке беспрепятственно пройти через цикл, выступают в роли онкогенов. Гены, кодирующие белки, которые блокируют прохождение клетки через точки проверки, выступают в роли ГСО. Как бы то ни было, недостаточно только запустить сигнализацию о необходимости роста и размножения клеток, надо еще сломать системы проверки.
Что же происходит с клеткой, которая остановилась в своем движении по клеточному циклу в точке проверки, например из-за того, что в ней оказалась повреждена ДНК. Первый путь - это устранение повреждений ДНК с помощью специальных ферментов. Если такая "репарация ДНК" не произойдет, то остановленная в своем продвижении по циклу клетка вступает на путь "программированной смерти", которая обозначается термином "апоптоз". Приходят в действие специальные клеточные системы, которые разрушают ее жизненно важные структуры, в том числе хромосомы, и клетка умирает. Апоптоз играет большую роль в развитии организма, ибо таким путем устраняются ненужные организму клетки. Таким же способом устраняются клетки, которые получили повреждения и резко изменили свои свойства, - различные мутантные клетки. Именно эти механизмы устраняют многие клетки, приобретшие черты раковых. Они сами себя убивают.
Как и другие перечисленные процессы, апоптоз определяется большим числом белков. Одно из центральных мест занимает ген, кодирующий белок р53, - белок с молекулярным весом около 53 000. Этот белок включает апоптоз не только если в ДНК появляются повреждения, но и во многих других случаях. Наряду с белками, включающими апоптоз, есть белки, препятствующие апоптозу, и между теми и другими существует тонкий баланс. Апоптоз выступает в роли мощного защитника от превращения нормальной клетки в раковую. Гены, способствующие апоптозу, относятся к ГСО, а гены, ему препятствующие - к онкогенам.
Поломка процесса апоптоза резко облегчает клетке превращение в раковую. В неспособных к апоптозу клетках легко будут накапливаться различные повреждения ДНК, ведущие к появлению мутаций. Среди этих мутаций будут встречаться мутации, активирующие онкогены и подавляющие ГСО. Клетки с такими мутациями приобретут преимущества в отношении роста и размножения перед своими собратьями и начнут разрастаться.
На их пути к окончательному приобретению независимости и превращению в раковые клетки стоит еще одна преграда - ограничение числа клеточных делений в нормальных клетках в связи с укорочением концов хромосом или теломеров. На концах хромосом расположены особым образом устроенные отрезки ДНК или теломеры. При каждом делении длина теломера уменьшается. Когда их длина падает до критической величины, начинаются слипание концов хромосом, дезорганизация генома и гибель клеток. Поэтому если посеять на чашках клетки человека, то они примерно через 50 делений погибают - иными словами, в культуре клеток существует предел для размножения клеток, зависящий от утраты теломеров. Нормальные клетки человека и других животных в культуре смертны. Однако у человека и других видов есть клетки, функцией которых является размножение и поддержание нужного уровня числа клеток в организме. У этих клеток потеря теломеров не происходит благодаря тому, что в них есть фермент теломераза, восстанавливающий исходные размеры теломеров. В более зрелых клетках, из которых обычно происходят опухолевые клетки, теломераза утрачивается, ген для нее сохраняется, но он молчит.
Большинство опухолевых клеток в культуре клеток не погибает, а продолжает расти в течение бесконечно длительного времени, пока им предоставляется свежая среда. Они становятся бессмертными. Одновременно эти клетки содержат активный фермент теломеразу, то есть в них ген теломеразы работает. Следовательно, ген теломеразы выступает в роли еще одного онкогена, позволяющего опухолевым клеткам благодаря его активации приобретать бессмертие. Следует отметить, что в некоторых опухолевых клетках существуют и другие механизмы приобретения бессмертия.
Это основные, хотя и не все классы онкогенов и ГСО, участвующие в превращении нормальной клетки в опухолевую. Кроме перечисленных генов и их белковых продуктов, для которых установлена функция, открыто еще много онкогенов, и особенно ГСО, для которых функция еще не установлена. Поэтому можно ожидать появления новых функциональных групп среди ГСО и онкогенов. Как бы то ни было, видно, что громадное число генов, тем или иным способом связанных с контролем роста и размножения клеток, при своих изменениях (мутациях) могут способствовать превращению нормальной клетки в опухолевую.
Важным открытием явилось установление факта, что, как правило, активации одного онкогена или, наоборот, потери функции одного ГСО недостаточно для превращения нормальной клетки в опухолевую. Это понятно в свете приведенных данных о наличии разных барьеров, стоящих на пути такого превращения. В среднем подсчитано, что в случае клеток человека число таких мутационных событий составляет в среднем 10. Только при этом нормальная клетка становится раковой. У мышей, на которых ведется большинство экспериментов по индукции опухолей, этот барьер снижен - там необходимо 3-5 мутационных событий.
Поскольку онкогенов и ГСО чрезвычайно много, то и набор мутаций в различных опухолях человека весьма разнообразен. В одних опухолях активированы или подавлены одни гены, в других - другие. Каждая опухоль, таким образом, имеет свой генетический портрет, который и определяет ее свойства. Более того, опухоль часто гетерогенна, то есть в ней есть клетки с разным набором генетических изменений.
Это создает крайне сложную и запутанную картину, когда речь заходит об анализе механизма возникновения какой-либо конкретной опухоли человека. Особенно важно, что это многоообразие и гетерогенность сильно ограничивают возможности разработки терапии опухолей на основе знания произошедших в ней генетических изменений. Ситуация несколько облегчается тем, что некоторые ГСО или онкогены оказываются измененными гораздо чаще, чем другие. Так, например, ГСО, кодирующий белок р53, поврежден примерно в 50% всех опухолей человека, а онкоген ras содержит активирующую его мутацию примерно в четверти всех опухолей человека. Некоторые другие ГСО и онкогены изменены преимущественно в опухолях той или иной локализации.
Как отмечено выше, р53 играет важную роль в направлении клеток с поврежденной ДНК по пути апоптоза. Когда ген р53 выведен из строя, клетки с поврежденной ДНК (мутантные клетки) перестают выбраковываться и в них происходит накопление новых мутаций, которые могут затрагивать ГСО и онкогены. Поэтому повреждение р53 резко ускоряет аккумуляцию других изменений и дефект р53 наблюдается в опухолях очень часто.
В заключение остановимся на роли наследственной, вирусной и экологической компонент в развитии опухолей человека. Как правило, рак развивается у людей пожилого и старого возраста. Это связано с тем, что мутации в генах возникают случайно и вероятность накопления в клетке нужного для онкогенного превращения набора мутаций весьма низка - для этого требуются многие годы. Не последнюю роль играет и ослабление с возрастом иммунных систем организма, которые препятствуют выживанию опухолевых клеток.
Однако в некоторых случаях, обычно в определенных семьях, опухоли развиваются у людей более молодого возраста. Оказалось, что в этих случаях уже исходно во всех клетках организма в одном из онкогенов или ГСО имеется мутация. Тогда на ее фоне дальнейшее накопление мутаций, необходимых для превращения нормальной клетки в раковую, происходит быстрее и опухоли развиваются с гораздо большей частотой и в более раннем возрасте. Некоторые из таких мутаций предопределяют раннее развитие опухолей практически со 100%-ной вероятностью. Например, если у человека исходно поврежден ГСО rb, играющий важную роль в процессе контроля прохождения клетки через клеточный цикл, у него всегда развиваются опухоли сетчатки (ретинобластомы). Подобные наследуемые повреждения изучают, значительная часть их известна, а другие будут выявлены в ближайшие годы. Тогда с помощью предродовой генной диагностики с последующим абортом (в случае передачи плоду поврежденного гена) наиболее вредные мутации можно будет полностью вывести из человеческой популяции.
Другой часто обсуждаемый фактор - эпидемиологический. Поскольку опухоль - генетическая болезнь, она незаразна. Но, как отмечалось выше, имеются вирусы - носители онкогенов. ДНК таких вирусов, или их генетический аппарат, может встраиваться в геном клетки, где развивается вирус и таким образом в этих клетках появится активный онкоген. Например, вирус папилломы человека, передаваемый половым путем, вносит в геном клетки хозяина ген, белковый продукт которого связывается с белком р53 и его инактивирует. Результат тот же, что и при повреждении гена р53, опухоль непосредственно не возникает, но вероятность ее появления резко возрастает. Таким образом, некоторые вирусы, привнося в клетки новые онкогены, могут повышать вероятность возникновения рака у данного индивидуума.
Что касается роли негативных факторов внешней среды, ее загрязнение различными химикатами, то здесь ситуация тоже ясная. Большинство этих загрязнений обладает мутагенной активностью, то есть в их присутствии возрастают число мутаций в клетках организма и вероятность появления того набора мутаций, который приведет к онкогенному перерождению клеток. Естественно, что полностью от мутагенов избавиться нельзя: к ним относятся и солнечная иррадиация, и космические излучения. Но при хорошем контроле за уровнем загрязнения внешней среды вероятность повышения частоты мутаций естественно снижается.
Такова в настоящее время общая картина механизма превращения нормальной клетки в опухолевую. Основные принципы понятны, участники процесса раскрыты, но конкретные механизмы развития каждой отдельной опухоли различны, и полную картину этих изменений сегодня дать невозможно, а возможно, в этом и нет необходимости. Однако проблема рака остается нерешенной и требует новых и новых усилий. Хотя полученная информация позволяет уже сейчас предупреждать развитие некоторых видов опухолей, эта информация недостаточна для развития методов эффективной терапии.
1. Lewin B. Genes for SMA: Multum in Parvo // Cell. 1995. Vol. 80(1). P. 1-5.
2. Lewin B. The Best of Molecular Biology // Mol. Cell. 1997. Vol. 1(1). P. 1.
3. Lewin B. The Mystique of Epigenetics // Cell. 1998. Vol. 93(3). P. 301-303.
Георгий Павлович Георгиев, доктор биологических наук, профессор, действительный член РАН, директор Института биологии гена РАН, лауреат Ленинской премии, Государственных премий СССР и РФ, член пяти зарубежных академий. Область научных интересов - молекулярная генетика высших организмов. Автор одной монографии и 400 научных работ.
Читайте также:

