Онкология и высокие технологии
Аннотация научной статьи по клинической медицине, автор научной работы — Ганцев Ш.Х., Рахматуллина И.Р., Меньшиков К.В., Атнабаев Р.Д., Ишмуратова Р.Ш.
Malignant tumors are one of the main reasons of mortality and invalidity of the population that induce the necessity of carrying out investigation devoted to development and inculcation of high technologies in oncology . Assessment of efficiency of new high-technology trends in medical aid developed and inculcated at Oncological Clinic of Bashkir State Medical University has been presented. They include experimental system of control and monitoring of aid rendered to oncologic patients, combined treatment using perioperative chemotherapy, nonstandard operations, radio-frequency ablation of metastases into liver, optimization of postoperative period, quality of patients' life.
Похожие темы научных работ по клинической медицине , автор научной работы — Ганцев Ш.Х., Рахматуллина И.Р., Меньшиков К.В., Атнабаев Р.Д., Ишмуратова Р.Ш.
HIGH TECHNOLOGIES IN ONCOLOGY - FROM DEVELOPMENT TO INCULCATION
Malignant tumors are one of the main reasons of mortality and invalidity of the population that induce the necessity of carrying out investigation devoted to development and inculcation of high technologies in oncology . Assessment of efficiency of new high-technology trends in medical aid developed and inculcated at Oncological Clinic of Bashkir State Medical University has been presented. They include experimental system of control and monitoring of aid rendered to oncologic patients, combined treatment using perioperative chemotherapy, nonstandard operations, radio-frequency ablation of metastases into liver, optimization of postoperative period, quality of patients' life.
Ш. Х. Ганцев, И. Р. Рахматуллина, К. В. Меньшиков, Р. Д. Атнабаев, Р. Ш. Ишмуратова, Л. Н. Изюров, А. З. Ахметов, А. Р. Адигамова, В. В. Павлова, В. А. Чистиченко, А. Г. Эйдинов
ВЫСОКИЕ ТЕХНОЛОГИИ В ОНКОЛОГИИ -ОТ РАЗРАБОТОК ДО ВНЕДРЕНИЯ
Злокачественные новообразования в настоящее время являются одной из главных медико-социальных проблем здравоохранения во всем мире, а противораковые мероприятия имеют важное государственное значение. В Российской Федерации и Республике Башкортостан отмечается тенденция к неуклонному росту заболеваемости злокачественными новообразованиями и смертности от них. Ежегодно в России выявляется почти 500 тысяч, а в Республике Башкортостан - более 10 тысяч больных злокачественными новообразованиями различных локализаций. Злокачественные новообразования в Российской Федерации являются одной из основных причин смертности населения [1].
Целью государственной политики в сфере здравоохранения, определенной как приоритетной в рамках Национальных проектов, является повышение качества и доступности медицинской помощи населению. На современном этапе развития онкологии улучшения результатов лечения больных, увеличения выживаемости и снижения онкологической смертности можно добиться, только используя высокотехнологичные виды медицинских услуг с внедрением высоких технологий. Согласно Приложению № 1 к приказу Министерства здравоохранения и социального развития Российской Федерации № 220
В клинике онкологии Башкирского государственного медицинского университета на базе Республиканского клинического онкологического диспансера МЗ РБ высокотехнологичная медицинская помощь оказывается по всем направлениям лечебно-диагностического процесса. Создана лабо-
ратория высоких технологий, целью которой является разработка и внедрение новых, высокоэффективных, а самое главное высокотехнологических методов диагностики, лечения и реабилитации в практику отделений.
Реорганизация вопросов высокотехнологический помощи начата с формирования
экспериментальной системы управления и мониторирования помощи онкологическим больным. Программа основана на базе данных, которая позволяет производить автоматический контроль за проведением различных методов лечения и осуществлять все необходимые статистические исследования.
Профили высокотехнологичной помощи, плановое количество больных и нормативы финансовых затрат по профилям
Профили высокотехнологичной медицинской помощи Плановое количество больных Нормативы финансовых затрат по профилям (тыс. руб.)
Российская академия медицинских наук Федеральное агентство по здравоохранению и социальному развитию Всего
Абдоминальная хирургия 435 1124 1559 88,7
Акушерство и гинекология 713 987 1700 90,6
Гематология 859 419 1278 43,3
Комбустиология 59 249 308 86,7
Неврология 20 437 457 80,8
Нейрохирургия 1238 1723 2961 114,3
Онкология 11661 19267 30928 79,8
Итого 28905 68702 97607 584,2
В настоящее время в рамках локальной сети для обеспечения качества лечения, в том числе и высокотехнологического, в базу данных внесены пациенты с болезнью Ходжкина, раком молочной железы и желудочно-кишечного тракта. Данные, извлеченные из регистра, показали у 396 пациентов с болезнью Ходжкина несоблюдение тайминга и режимов проводимого лечения, что снижает эффективность терапии на 35-40%.
На основании мониторинга 407 больных раком молочной железы pT1-2 N0M0 после органосберегающего лечения установлено уменьшение в 1,5 раза показателей общей и безметастатической 5-летней выживаемости пациенток с местными рециди-
вами, по сравнению с больными без рецидивов (58 и 54% против 83 и 78,3% соответственно). Найдены факторы достоверного ухудшения прогноза течения рака молочной железы при развитии местного рецидива: появление рецидива в течение 2 лет после оперативного лечения первичной опухоли, регионарные лимфогенные рецидивы, множественность поражения, возраст моложе 40 лет, гиперэкспрессия рецепторов ИБК2/пеи и отрицательный рецепторный статус к эстрогенам и прогестерону. С учетом этих факторов у больных с локорегионарными рецидивами можно выделить группы с относительно благоприятным и неблагоприятным течением заболевания, что может использоваться при выборе тактики лечения.
Регистр позволил оценить не только эффективность и своевременность лечения, но и качество жизни у 208 пациентов после проведенных стандартных, циторедуктив-ных и комбинированных методов лечения, вследствие чего были разработаны методы его улучшения.
Нами определены несколько направлений высокотехнологической помощи (ВТМП) в клинике. Так, большое внимание уделяется усовершенствованию и внедрению комбинированного лечения онкологических больных с применением периопера-ционной химиотерапии, активному выполнению нестандартных операций, радиочастотной абляции, оптимизации послеоперационного периода, качеству жизни пациентов. Высокоэффективным и перспективным направлением лечения онкологических больных, по нашему мнению, является комбинирование стандартных и нестандартных операций на органах брюшной полости с применением локорегионарной химиотерапии в сочетании с современными методами анестезии. Этот метод базируется на том, что для максимального использования возможностей химиотерапии необходимо добиться постоянного присутствия химиопрепарата в опухоли и регионарной зоне кровотока.
125 оперированных больных с раком желудка разделили на две группы: основную составили 65 чел. (35 мужчин, 30 женщин) с диагнозом рака желудка, подвергшихся хирургическим операциям с периоперацион-ной химиотерапией в условиях комбинированной эпидуральной анестезии (возраст пациентов - от 39 до 65 лет, в среднем -53,1±1,3 года). Контрольная группа состояла из 60 больных (25 женщин, 35 мужчин) ра-
ком желудка, подвергшихся хирургическим операциям с проведением периоперацион-ной химиотерапии в условиях общей анестезии (возраст больных -от 39 до 68 лет, в среднем - 56,6±1,5 года). Больные были сопоставимы по полу, возрасту, характеру основной патологии, оперативного вмешательства. Технология перио-перационной химиотерапии была следующей. В дооперационном периоде за 3-4 часа до начала операции пациенту вводилось внутривенно капельно 600-800 мг/м2 5-фторурацила (5ФУ). На интраоперацион-ном этапе при резектабельности опухоли вводилось около 800 мг/м2 5-фторурацила в портальную вену для реализации регионарной химиотерапии. С учетом продолжительности стандартных операций на желудке, толстой кишке до 3-4 часов и некоторых нестандартных операций примерно той же продолжительности, суммарно вводилось около 1200-1500 мг 5ФУ. В послеоперационном периоде части больных продолжалась регионарная инфузия химиопрепарата в портальное русло, другим инфузия проводилась в локтевую или подключичную вены до суммарной курсовой дозы 5000-7000 мг.
При внутрипортальном введении 5ФУ в контрольной и основной группах измерялось давление в портальной вене на всех этапах оперативного вмешательства. В контрольной и основной группах давление достоверно не отличалось: 123,3±5,0 мм вод.ст. - в основной группе и 121,7±3,9 мм вод.ст. - в контрольной. К этапу мобилизации в основной группе отмечается достоверное повышение портального давления -131,2±1,8 мм вод.ст.; в контрольной таковое сохранялось на прежнем уровне - 121,8±2,2 мм вод.ст. В дальнейшем в контрольной и
основной группах давление сохранялось на прежнем уровне.
Таким образом, интраоперационная инфузия 5-фторурацила не оказывает отрицательного влияния на течение анестезии и уровень портального давления на всех этапах оперативного вмешательства.
Нами также установлено, что комбинированная эпидуральная анестезия обеспечивает более глубокую нейровегетативную защиту, чем общая анестезия, при операциях по поводу рака желудка с локорегионарной химиотерапией, что значительно снижает риск сердечно-сосудистых осложнений у онкологических больных на всех этапах операций. Обеспечивается адекватное функционирование сердечно-сосудистой системы и создаются благоприятные условия для проведения локорегионарной химиотерапии.
Наш опыт периоперационной химиотерапии по описанной методике в условиях современной анестезии снижает риск развития негативных реакций, осложнений со стороны больного, повышает эффект комбинированного лечения больных. Все пациенты, вошедшие в исследование, получили полный объем (5 курсов) послеоперационной химиотерапии. Отдаленные результаты (1 год) прослежены у 100 больных. Все пациенты живы, признаков рецидива нет.
Другим, не менее важным условием обеспечения удовлетворительных результатов хирургического и комбинированного лечения онкологических больных является нормальное функционирование иммунной системы. К сожалению, в практике хирурга-онколога нередки случаи повреждений периферического органа иммунной системы -селезенки, которые почти в 100% случаев
заканчиваются спленэктомией. Однако удаление селезенки почти всегда приводит к развитию постспленэктомического синдрома, который осложняет послеоперационный период. Послеоперационные инфекционные и тромбоэмболические осложнения наиболее часто встречаются у больных после выполнения комбинированных операций при раке желудка.
За последние 10 лет в нашем центре 228 человек перенесли нестандартные операции по поводу рака желудка. Из них 100 (23%) - паллиативные операции в объеме гастроэнтеростомии, 94 (22%) - комбинированные операции, 34 (8%) - сочетан-ные хирургические вмешательства.
При анализе комбинаций оперативных вмешательств выявлено, что самой часто встречаемой операцией является спленэк-томия - 22 (23%) при гастрэктомии и 20 (21%) при резекции желудка. Вторая по частоте комбинация - спленэктомия в сочетании с резекцией поджелудочной железы - 28 (30%) операций. В группе больных, оперированных по поводу рака желудка, осложнения возникли у 8 (9%) пациентов. Из них у 2 (25%) был анастомозит, у 1 (12,5%) подпеченочный абсцесс, у 1 (12,5%) перфорация приводящей петли желудочно-кишечного анастомоза, у 1(12,5%) поддиафрагмальный абсцесс слева, у 1 (12,5%) тромбоз глубоких вен нижних конечностей и у 1 (12,5%) возникло нарушение мозгового кровообращения.
Таким образом, спленэктомия наиболее часто сопровождала операции по поводу рака желудка, что приводило к развитию постспленэктомического синдрома. Самым доступным и простым методом коррекции постспленэктомического синдрома является
аутотрансплантация селезенки. В последние 2 года нами выполнены 10 операций реплантации селезенки. Суть этих операций следующая: после выполнения спленэкто-мии производилась подготовка трансплантата. Селезенка размельчалась на несколько мелких фрагментов, которые обрабатывались раствором антисептика в течение 30 минут. Затем ткань селезенки гомогене-зировалась и вводилась в забрюшинное пространство, в брыжейку тонкой или поперечно-ободочной кишки в объеме до 100 мл. В послеоперационном периоде у 5 пациентов отмечалось повышение температуры в сроки более 7 дней. Признаков нагноения реплантированной селезенки мы не наблюдали.
Одной из актуальных в онкологии является проблема метастатического поражения печени. По локализации метастатического рака печень занимает первое место среди всех органов. Метастазы рака поджелудочной железы в печень встречаются в 50% случаев, колоректального рака — от 20
Количество РЧА в к
до 50%, рака желудка — в 35%, рака молочной железы — в 30%, рака пищевода — в 25%. По данным М.И. Давыдова (2005), комбинированное лечение больных с солитарными метастазами рака толстой кишки в печень позволяет добиться 5-летней выживаемости у 20-30 % больных. Известно, что резекция печени является единственным методом лечения при ее метастатическом поражении, однако радикально оперированы могут быть лишь порядка 20% больных. Традиционно используемая системная химиотерапия далеко не всегда вызывает существенное увеличение выживаемости пациентов.
Применение методов локального воздействия на опухоль, в частности метода радиочастотной термодеструкции очагов (абляции), как показывает мировой и наш клинический опыт, позволяет расширить возможности лечения этой сложной категории пациентов.
Приводим данные о количестве операций радиочастотной абляции (РЧА) при метастазах в печень (табл. 2).
никах России и США
РНЦХ ГВКГ РОНЦ SAGES San Antonio РКОД (г. Уфа)
Количество пациентов 31 23 61 56 92 20
Количество процедур 33 107 85 139 138 34
Среднее количество метастазов 1,06 4,7 1,4 2,5 1,5 1,7
Средний диаметр поражения, см 4,0 3,5 3,0 3,4 2,8 3,5
Средний диаметр абляции, см - 4,5 4,0 4,9 3,5 4,5
Осложнения - - 3 - 1 -
Электрохирургический радиочастотный генератор RITA, модель 1500Х разработан для выработки монополярной радиочастотной энергии и предназначен для исполь-
зования при чрескожной, эндоскопической или интраоперационной абляции. Радиочастотная термоабляция по поводу метастазов в печень с использованием электрохи-
рургического радиочастотного генератора RITA Medical Systems 1500Х выполнена 20 пациентам.
В опухоль вводилась специальная радиочастотная игла (зонд) с раскрывающимся массивом элементов-антенн. С помощью иглы создается сферическая область некроза. Опухоль разрушается нагреванием до температуры 105 °С. Выделение тепла происходит из-за смены направления движения ионов под воздействием высокочастотного (460 кГц) тока.
За 3 месяца наблюдения за больными роста обработанных метастатических узлов при УЗИ-контроле не отмечено, появление других метастатических очагов выявлено у 1 пациента, которому по этому поводу назначена системная химиотерапия.
На основании полученных результатов нами были определены показания и противопоказания к РЧА (Ш.Х.Ганцев, 2006).
Показания к РЧА
при патологии печени
1. Первичные опухоли печени.
2. Вторичные (метастатическое) поражение печени.
3. Доброкачественные новообразования печени.
Противопоказания к РЧА
1. Состояние больного по EGOG = 4, предполагаемая продолжительность жизни до 3 месяцев.
2. Канцероматоз брюшины более 30 %.
3. Вторичные поражения внутренних органов, не подлежащих туморредукции.
4. Декомпенсация сердечно-сосудистой системы, органов дыхания, печени, почек. Полиорганная недостаточность.
5. Острый период инфаркта миокарда, нарушения мозгового кровообращения.
6. Тяжелые формы инфекционных заболеваний, перитонит, сепсис.
1. Состояние больного по БООС = 3, предполагаемая продолжительность жизни до 6 месяцев.
2. Канцероматоз брюшины от 10 до
3. Подострый период инфаркта миокарда, нарушения мозгового кровообращения.
4. Мультиорганные метастатические поражения.
5. Субкомпенсация сердечно-сосудистой, дыхательной системы, печени, почек. Полиорганная недостаточность в фазе разрешения.
6. Фаза разрешения инфекционных заболеваний, перитонита, сепсиса.
7. Выраженный спаечный процесс в верхнем этаже брюшной полости.
8. Декомпенсированная портальная гипертензия.
Местные противопоказания к РЧА
1. Близость к сосудистым и желчевы-водящим структурам (особенно нижней полой вены).
2. Субтотальное и тотальное поражение печени.
3. Множественные метастазы (10 и более).
4. Размер метастаза более 8 см.
На наш взгляд, радиочастотная термоабляция является безопасным способом воздействия на метастатические очаги в печени, позволяющим при высокой результативности антиметастатического воздействия сохранять целостность печени, снижать риск осложнений без ущерба качества жизни и отдаленного прогноза.
Эффективность лечебных мероприятий в онкологии зависит от многих факторов, в том числе и от качества реабилитационных мероприятий в послеоперационном периоде, на что следует обратить особое внимание. Таким образом, высокие технологии, которые еще вчера казались недоступными, сегодня широко применяются нами с положительными результатами. Дальнейшее накопление опыта позволит более полно обобщить результаты предлагаемых методов лечения.
Sh.Kh. Gantsev, I.R. Rakhmatullina, K.V. Menshikov, R.D. Atnabaev, R.Sh. Ismuratova, L.N. Izyurov, A.Z. Akhmetov, A.R. Adigamova, V.V. Pavlova, V.A. Chistichenko, A.G. Eidinov
HIGH TECHNOLOGIES IN ONCOLOGY - FROM
DEVELOPMENT TO INCULCATION
Malignant tumors are one of the main reasons of mortality and invalidity of the population that induce the necessity of carrying out investigation devoted to development and inculcation of high technologies in oncology. Assessment of efficiency of new high-technology trends in medical aid developed and inculcated at Oncological Clinic of Bashkir State Medical University has been presented. They include experimental system of control and monitoring of aid rendered to oncologic patients, combined treatment using perioperative chemotherapy, nonstandard operations, radio-frequency ablation of metastases into liver, optimization of postoperative period, quality of patients' life.
Keywords: oncology, high technologies, cancer surgery, splenectomy, radio-frequency ablation of metastases, information systems.
Современные высокие медицинские технологии – это отражение достижений научно-технического прогресса.
Последние открытия и достижения в физике, химии, биологии и других прикладных науках находят свое применение в медицине.
Практически ежегодно появляются новые удивительные методы диагностики и лечения различных заболеваний, которые еще не так давно представлялись лишь в сюжетах фантастических фильмов и книг. Однако прежде чем занять свое место в стандартах и национальных рекомендациях, все нововведения проходят долгий путь изучения и исследований. И зачастую, одним из основных препятствий для них является скептическое отношение специалистов придерживающихся консервативных взглядов. Так некогда было с лапароскопической хирургией, и посмотрите где она сейчас? Ни одна современная операционная не представляется без эндовидеохирургической системы. А в лечении многих заболеваний лапароскопия стала золотым стандартом.
Онкология, одна из тех отраслей медицины, где наиболее остро ощущается скептицизм и недоверие ко всему новому.
Зачастую, специалисты, придерживающиеся консервативных взглядов, мотивируют свое мнение лишь недоверием и сомнениями относительно возможностей современных систем. И, тем не менее, миниинвазивные технологии все шире входят в повседневную деятельность практикующих онкологов.
Что касается современных достижений в диагностике злокачественных заболеваний, то не так давно в распоряжении урологов ГБ№40 появился самый новейший метод диагностики рака предстательной железы – Фьюжн биопсия (Fusion Biopsy).
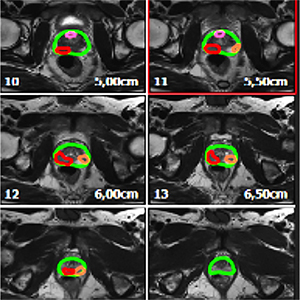
Высокая точность и достоверность метода достигается путем совмещения изображения МРТ и УЗИ предстательной железы, что позволяет производить прецизионную биопсию подозрительных в отношении рака очагов.
Во время данной биопсии берется большее количество проб - около 30, в то время как во время стандартной берется от 12 до 18.
Таким образом, трансректальная МРТ-фьюжн биопсия под УЗИ-контролем позволяет улучшить детекцию и репрезентативность клеток на рак предстательной железы.
Одно из самых современных и молодых направлений в медицине – эндоваскулярная хирургия (рентгенохирургия, интервенционная кардиология и интервенционная кардиология) - хирургические вмешательства, проводимые на кровеносных сосудах чрескожным доступом под контролем методов лучевой. Изначально эндоваскулярная техника создавалась исключительно для диагностических целей. Однако получение феноменальных результатов лечения позволило этому направлению занять обособленную нишу в современных медицинских технологиях.
Чаще всего эндоваскулярная хирургия ассоциируется с лечением заболеваний сердечно-сосудистой системы (стентирование коронарных сосудов и пр.). Однако благодаря возможностям метода ему нашлось применение и в онкологии.
Благодаря совместной работе гинекологов и специалистов по рентген-эндоваскулярным хирургическим технологиям удается достигнуть поразительных результатов лечения миом матки у пациенток детородного возраста, планирующих беременность. Первым этапом лечения интервенционными хирургами производится эмболизация маточных сосудов – под контролем рентгена производится установка эмболов (специальный губок в просвет маточных сосудов) через ультратонкий проводник в бедренной артерии.
С целью сохранения овариального резерва у нерожавших женщин репродуктивного возраста производится временная эмболизация маточных артерий, то есть эмболы, установленные в просвет маточных сосудов имеют определенный период рассасывания (до 2-х недель).
На следующий день после эмболизации выполняется хирургическое вмешательство – вагинальная консервативная миомэктомия. Миоматозные узлы удаляются вагинальным доступом, не нарушая анатомии матки и шейки матки.
Кроме того, в СПб ГБУЗ ГБ№40 специалисты по рентген-эндоваскулярной хирургии помогают онкологам в проведении так называемой внутриартериальной химиотерапии. Все также под контролем рентгена через крупный артериальный ствол (бедренная или подключичная артерия) вводят катетер в основную артерию, питающую область расположения опухолевого образования.
В результате противоопухолевое средство доставляется именно к пораженной зоне, попадая в первичное капиллярное русло. Медленный кровоток способствует хорошей абсорбции препарата патологическими клетками.
Для внутриартериальной химиотерапии применяются те же препараты, что и в классической химиотерапии, но в процессе процедуры можно избежать серьезных отравлений. Этот метод очень эффективен в случае значительных образований, но стоит отметить тот факт, что каждый вид опухоли по-разному реагирует на высокодозную химиотерапию, что объясняется во многом их васкуляризацией и анатомическим положением.
С каждым годом у врачей появляется все больше возможностей в диагностике и лечении различных заболеваний. Даже в таком сложном направлении как онкология благодаря своевременной диагностике и возможностям новейших методов лечения все большее количество пациентов могут быть полностью излечены. Иногда лечение требует комбинированного подхода, участие врачей разных специальностей доступных в крупных многопрофильных стационарах, таких как Городская больница №40.
16 марта 2020 11:30

Мануэль Руис-Эчарри, онколог:
Еще один новый метод в онкологии — иммунная терапия. Разработке этого вида лекарственного лечения способствовало недавнее раскрытие механизма иммунного ответа при онкологических заболеваниях, за что в 2018 году американец Джеймс Эллисон и японец Тасуку Хондзе получили Нобелевскую премию. Иммунная терапия активизирует собственные защитные силы организма для борьбы со злокачественными клетками. Ее эффективность высока, переносится она удовлетворительно, а побочные эффекты легче, чем у химиотерапии. Иммунотерапевтические препараты стали важной частью противоопухолевого лечения меланомы, рака почки, рака печени, разных подтипов рака легкого, опухолей ЖКТ и других онкозаболеваний. При лимфоме Ходжкина иммунотерапия показывает высокую эффективность даже после трансплантации костного мозга. К сожалению, эффективно применять эту терапию ко всем видам рака невозможно, поскольку иммунная система человека может справиться не со всеми типами опухолей. Поэтому она изначально показана не всем пациентам.

Нидаль Салим, радиационный онколог:
Еще одна область радиационной онкологии — стереотаксическая радиохирургия. Роль скальпеля здесь выполняет пучок радиационных лучей, которые называют гамма- или киберножами. Существует и еще более новое оборудование — аппарат Varian EDGE, отличающийся максимально высокой точностью. Его можно сравнить с острейшим лезвием. Таких установок пока очень мало — единицы во всем мире. Одна из них установлена в EMC.
Дозы облучения при применении стереотаксиса в несколько десятков раз превышают дозы при лучевой терапии, но это позволяет практически избавиться от опухоли или единичных метастазов всего за один-три сеанса. При этом часть клеток может оказаться устойчивой даже к очень высоким дозам облучения, поэтому такая терапия тоже подходит не для всех случаев.

Фото: Saph Photography/Pexels

Алексей Кривошапкин, нейрохирург:
Почему с глиобластомой так трудно бороться? Потому что она развивается чрезвычайно быстро. Если выполняется лишь частичное удаление такой опухоли, операция может подстегнуть ее рост и даже сократить продолжительность жизни пациента. В настоящее время разработанные алгоритмы компьютерного зрения помогают врачам рассчитать риски математически. Благодаря этой возможности выяснилось, что если оставить опухоль после ее хирургического удаления объемом менее 2,5 кубических сантиметров, то больной достоверно проживет дольше. Остаток опухоли большего размера очень быстро перестраивается и превращается в еще более агрессивную опухоль.
Радикальное удаление опухоли — наилучший шанс для больного стать долгожителем среди людей с аналогичным диагнозом. Для максимально полного удаления новообразования нужны современные технологии. Это операционные микроскопы, оснащенные флуоресцентными блоками для определения границ злокачественной опухоли, методы нейронавигации и интраоперационной визуализации (магнитный резонанс, позитронно-эмиссионная томография).
Около двух лет назад специалисты нашей клиники запатентовали новый метод лечения пациентов с рецидивом глиобластомы. Сейчас его начинают применять нейрохирурги Европы и Америки. Суть заключается в том, что после хирургической резекции опухоли в образовавшейся полости размещают мягкий пластиковый баллон, который раздувают в соответствии с границами опухоли. Затем после контроля его позиции с помощью ультразвукового сканирования в баллон вводится источник электронного облучения. Медицинские физики могут быстро и точно рассчитать необходимую лечебную дозу. Этот метод называется баллонная электронная брахитерапия. Он не требует значительного операционного времени, безопасен для больного и медицинского персонала. Метод используется в общей онкологии. Усовершенствование технологии для нейроонкологии и внедрение методики в процесс лечения рецидива глиобластомы в рамках клинического исследования показали впечатляющие результаты, которые дают надежду пациентам на значительную прибавку в продолжительности и качестве жизни после операции.

Владимир Носов, хирург-онкогинеколог:
Среди последних достижений онкогинекологии стоит отметить прогресс онкогенетического тестирования. Большие надежды возлагаются на персонализированную медицину, а также на выявление конкретных молекулярных поломок и таргетную терапию.

Фото: Saph Photography/Pexels
Искра Даскалова, хирург-маммолог:
В последние десятилетия проблема рака молочной железы все реже решается объемным хирургическим вмешательством. Многие пациентки имеют возможность сохранить и грудь, и качество жизни без ухудшения прогноза заболевания. Уже давно доказано, что для пациенток с ранней стадией болезни щадящие (органосохраняющие) операции и последующая лучевая терапия ничем не уступают радикальной мастэктомии. Данные последних лет показывают, что онкологический прогноз у таких пациенток даже лучше.
В радикальном удалении молочной железы нуждаются около 30 процентов заболевших женщин, часто это связано с неблагоприятным соотношением размера груди к размеру опухоли, поскольку удалить новообразование нужно в пределах здоровых тканей. Даже когда речь идет об удалении груди, остаются возможности для последующей реконструкции с хорошими косметическими результатами.
Институт онкологии Европейского медицинского центра EMC — экспертная клиника международного уровня. Здесь пациенты могут получить весь комплекс услуг в одном здании: диагностику, таргетную терапию, иммуно- и химиотерапию, хирургию любой сложности, лучевую терапию, реабилитацию, психологическую поддержку пациента и его семьи. Лечение проводится по современным международным протоколам. Клиника оборудована по последнему слову техники: диагностическое оборудование экспертного уровня, 12 операционных блоков, хирургический робот последнего поколения da Vinci Si HD, отделение ПЭТ/ ОФЭКТ-диагностики с собственной лабораторией по производству радиофармпрепаратов, единственная в России сверхточная система для радиохирургии и лучевой терапии Varian EDGE, система для проведения интраоперационной лучевой терапии. Для каждого пациента разрабатывается индивидуальный план лечения, согласованный несколькими специалистами в области онкологии, радиологии, лучевой терапии, онкохирургии из США, Европы, Израиля и России.
Читайте также:

