Окисление фенолов активным хлором
- Главная
- Новости
- Статьи
- Экология вокруг нас
- Общая экология
- Естествознание и основы экологии
- Экология человека
- Экология младенчества
- Литература
- Материалы
- Студентам

Оптимальной температурой окисления является 400 С. При этой температуре скорость реакции окисления фенола в 2-3 раза выше, чем при 20 0С. увеличение температуры более 45 0С нецелесообразно вследствие перехода гипохлоритов в хлораты, имеющие более низкую окислительную способность.
Метод окисления диоксидом хлора
Водные растворы диоксида хлора в кислой среде довольно устойчивы. С повышением температуры и рН скорость разложения диоксида хлора увеличивается, особенно на свету. В щелочной среде диоксид хлора гидролизируется с образованием хлоритов и хлоратов. Фенол легко окисляется диоксидом хлора. В кислой и нейтральной средах основным продуктом окисления является бензохинон. Расход диоксида хлора на окисление 1 мг фенола до бензохинона составляет 1-1,2 мг. В щелочной среде при избытке диоксида хлора основные продукты окисления фенола – органические кислоты (из которых идентифицированы малеиновая и щавелевая). Для полного окисления 1 мг фенола до органических кислот при продолжительности контакта 15…20 мин необходимо 5 мг диоксида хлора [33].
Обработка сточных вод, загрязненных фенолами, диоксидом хлора может приводить к образованию хиноидных соединений или к разрыву бензольного кольца и образованию органических кислот – конечных продуктов окисления.
Метод окисления кислородом воздуха
Фенолы, растворенные в сточных водах, относительно легко окисляются кислородом воздуха. При взаимодействии с кислородом фенолы претерпевают глубокие структурные превращения: гидроксилируются, образуют хиноны, оксихиноны карбоновые, гуминовые кислоты перекисные соединения, а также продукты уплотнения. Дальнейшее окисление может привести к образованию диоксида углерода и воды. Глубина превращения фенолов зависит от параметров окисления. Многоатомные фенолы окисляются интенсивнее одноатомных. Особенно при рН=7. Например, степень разложения метилрезорциновой и диметлирезорциновой фракции при температуре сточной воды 40 0С и рН=9,5…13 составляет 30…50%, причем наблюдается образование продуктов уплотнения и конденсации фенолов, плохо растворимых в воде [34].
Пероксид водорода
Пероксид водорода являющийся одним из сильных окислителей, применяют обычно в виде 30% водного раствора. Разложение пероксида водорода - экзотермично, катализируется некоторыми металлами переменной валентности (железо, медь, марганец, кобальт, цирконий) и их солями. При окислении фенола пероксидом водорода в присутствии двухвалентного железа рН раствора снижается, при этом окислившееся - трехвалентное железо выпадает в осадок. Более 90% фенола окисляется в течение 10 мин. Для корректировки рН в воду добавляют щелочные агенты. Эффект очистки воды при использовании гидрооксида кальция выше [39]
Применение пероксида водорода не приведет к вторичному загрязнению воды продуктами разложения реагента.
Радиационная очистка
При обработке воды излучением высокой энергии (у-излучение Со 50, Сs 137) происходят окисление и полимеризация органических и неорганических веществ, в том числе биологически не разлагаемых (предельные углеводороды) и токсичных соединений, осаждение коллоидных и взвешенных частиц, дезинфекция и дезодорация. Радиационная очистка, являющаяся быстрым одностадийным процессом, дает комплексный эффект [15].
Очищенная радиационным способом вода может быть использована для организации замкнутого водооборотного снабжения. Радиационная обработка не создает остаточной радиоактивности, так как применяемые источники имеют энергию ниже порога ядерных реакций.
Обезвреживание сточных вод хлором или его соединениями – один из самых распространенных способов очистки от ядовитых цианинов, а также от таких органических и неорганических соединений, как сероводород, гидросульфит, сульфид, метилмеркаптан и др.
Сточные воды, содержащие ядовитые цианиды, образуются на машиностроительных и металлообрабатывающих заводах в гальванических цехах. Значительное количество цианидсодержащих сточных вод получается при промывке изделий после закалки их в расплавах цианидов. Обычно содержание цианидов в таких сточных водах колеблется от 20 до 100 мг/л, но бывает и выше.
Окисление ядовитых цианид-ионов CN– осуществляется путем перевода их в нетоксичные цианаты СNO–, которые затем гидролизуются с преобразованием ионов аммония и карбонатов:
СN– + 2ОН– – 2е → CNO– + НО;
CNO– + 2Н2О→ NH4+ + СО32–.
Возможен также перевод токсичных соединений в нетоксичный комплекс или в осадок (в виде нерастворимых цианидов) с последующим удалением его из сточных вод отстаиванием или фильтрованием.
При введении в воду хлор гидролизуется, образуя хлорноватистую и соляную кислоты:
В сильнокислой среде равновесие этой реакции сдвинуто влево, в воде присутствует молекулярный хлор; при значениях рН > 4 молекулярный хлор в воде практически отсутствует.
Образовавшаяся в растворе гидролиза хлора хлорноватистая кислота диссоциирует на ион гипохлорита ОСl– и ион водорода Н+.
Степень диссоциации хлорноватистой кислоты которой зависит от рН среды. При рН = 4 молекулярный хлор практически отсутствует:
Процесс хлорирования проводят в хлораторах периодического и непрерывного действия, напорных и вакуумных. Принципиальная схема очистки вод хлорированием показана на рис. 1.52. Хлорирование проводится в емкости, включенной в систему циркуляции. В инжекторе газообразный хлор захватывается сточной водой, циркулирующей в системе до тех пор, пока не будет достигнута заданная степень окисления, после чего вода выводится для использования.
При обезвреживании вод от цианидов процесс проводят в щелочной среде (рН = 9). Цианиды можно окислить до элементного азота и диоксида углерода по уравнениям
При снижении рН возможно протекание реакции прямого хлорирования цианида с образованием токсичного хлорциана.
Реакция протекает быстро (1-3 мин.) и полно. Окисление цианидов до цианатов происходит за счет атомного кислорода в момент его выделения из окислителя. Образующиеся цианаты CNO– легко гидролизуются до карбонатов:
Скорость гидролиза зависит от рН среды. При рН = 5,3 за сутки гидролизуется около 80 % цианатов. В двухступенчатом процессе цианиды окисляются до N2 и СО2. На первой ступени процесс протекает по уравнению реакции (1) окисления до получения цианатов. На второй ступени вводят дополнительное количество окислителя, и реакция протекает по уравнению
При окислении ядовитого комплекса цианида цинка происходит следующая реакция:
Для определения расходов гипохлоритов кальция или натрия, а также хлорной извести на окисление цианидсодержащих сточных вод можно воспользоваться формулой:
где X – требуемое количество реагента, кг/сутки; k – коэффициент запаса реагента, принимаемый равным 1,2-1,3; Q – количество цианидсодержащих сточных вод, м3/сутки; а – содержание активного хлора в реагенте, равной в товарной хлорной извести 30-35 %, в гипохлорите кальция 30-45 %; x1 – теоретическое количество активного хлора, необходимого для окисления цианидов, г/м3:
где n – стехиометрический коэффициент (по активному хлору); С – концентрация цианидов в сточных водах (в пересчете на цианидион), г/м3.
Для определения коэффициента и подсчитывается количество активного хлора в гипохлорите. Активный хлор определяется по количеству грамм-атомов йода, выделенных данным реагентом из йодистого калия в кислой среде. Запишем реакцию окисления простых цианидов гипохлоритом в ионно-электронном виде
Это значит, что при взаимодействии гипохлорита с КI (калий йодистый) наблюдались следующие реакции
При наличии в сточной воде аммиака, аммониевых солей или органических веществ, содержащих аминогруппы, хлор, хлорноватистая кислота и гипохлориты вступают с ними в реакцию, образуя моно - и дихлорамины, а также трихлористый азот
Обработка цианидсодержащих сточных вод диоксидом хлора СlО2 имеет ряд преимуществ:
- высокая окислительная способность СlО2 по сравнению с другими окислителями (кроме фтора и озона);
- водные растворы СlО2 устойчивы в течение длительного времени;
- при обработке сточных вод диоксидом хлора не образуется высокотоксичных продуктов прямого хлорирования (хлорциана, хлорфенола и др.) в любом диапазоне величие рН.
Окисление цианида диоксидом хлора протекает по уравнению
При начальном содержании цианидов 25 мг/л и продолжительности окисления 1 мин – эффективность составляет 95 %, а через 10 мин реакция окисления практически заканчивается.
Хлорирование применяется для дезодорации сточных вод, образующихся при варке сульфатной целлюлозы и при выпаривании тарного щелока на целлюлозно-бумажных комбинатах. Эти сточные воды содержат сероводород, сульфиды, метил-меркаптан и др.
В щелочной среде хлор окисляет сульфиды до сульфатов:
В кислой и нейтральной среде возможно образование сульфитов:
При избытке хлора окисление всегда идет до сульфатов. Метилмеркаптан окисляется хлором несколько медленнее, чем сероводородом, но значительно быстрее, чем сульфиды и дисульфиды. В зависимости от расхода хлора окисление метилмеркаптана может протекать с образованием различных продуктов:
Поскольку метилмеркаптан окисляется хлором сравнительно быстро, продолжительность контакта сточных вод выпарной станции (загрязненных в основном сероводородом и метилмеркаптаном) с хлором составляет 5 мин.
В зависимости от агрегатного состояния вводимых в воду хлора или хлорсодержащих реагентов определяется технология обработки сточных вод. Если эту воду обрабатывают газообразным хлором или диоксидом хлора, то процесс окисления осуществляется в абсорберах; если хлор или диоксид хлора находятся в растворе, то их подают в смеситель и далее в контрольный резервуар, в них обеспечивается эффективнее их смешивание и требуемая продолжительность контакта со сточной водой.
Гипохлорит (оксохлорат) натрия образуется при пропускании газообразного хлора через раствор щелочи:
Гипохлорит кальция приготовляют хлорированием гидроксида кальция при температуре 25-30 °С:
Промышленность выпускает двухосновную соль
Сильным окислителем является хлорат натрия NaClO2, который разлагается с выделением ClO2. Диоксид хлора ядовитый зеленовато-желтый газ, обладающий более интенсивным запахом, чем хлор. Для его получения проводят следующие реакции:
К недостаткам жидкофазного окисления следует отнести сложное аппаратурное оформление процесса: насосы и компрессоры высокого давления, необходимость применения дорогостоящих конструкционных материалов и высоколегированных сталей по всему тракту высокого давления, образование накипи на теплопередающих поверхностях.
Озонирование
Озонирование - широко используемый способ глубокой очистки воды от фенолов, а также от других нефтепродуктов. Озон обладает большой окислительной способностью, оказывает сильное бактерицидное действие, устраняет неприятный запах и привкус и возвращает воде естественный цвет.
Окислительные свойства озона в воде могут проявляться в реакциях прямого окисления, озонолиза, катализа, окисления радикалами и полимеризации. Прямому окислению подвергаются некоторые органические соединения. Каталитическое действие озона заключается в инициировании реакций окисления растворенным в воде кислородом.
Окисление озоном протекает по месту двойной связи бензольного кольца и параллельно окисляется гидрокисльный радикал с последующей рекомбинацией пероксирадикалов, пероксид водорода реагирует с озоном, образуя воду и кислород.
Для ускорения процесса инициирования целесообразно окисление проводить в щелочной среде. Чем выше величина показателя рН среды, тем больше степень окисляемости озоном. Оптимальное значение рН для окисления фенолов концентрацией менее 50 мг/л – равно 11.4 [30], результаты опытов приведены в таблице (2).
Результаты окисления озоном фенолов в водном растворе
(начальная концентрация фенолов в воде 100 мг/л, рН = 12).
Расход озона, мг/л
Содержание фенола, мг/л
Расход озона, мг/л
Содержание о-Крезола, мг/л
Расход озона, мг/л
Метод озонирования позволяет эффективно очищать воду от фенолов, при этом образуются альдегиды, щавелевая и дикарбоновые кислоты, гидропероксид, диоксид углерода и вода. Озон может быть применен для глубокой очистки слабо концентрированных сточных вод, содержащих биологически трудно окисляемые вещества. С помощью озонирования можно достичь очистки сточных вод до уровня 0.05 мг/л и ниже. При озонировании фенольных сточных вод содержащих другие примеси углеводородов образующихся при обессоливании - обезвоживании нефтепродуктов расход озона значительно возрастает по сравнению с расходом на озонирование чистых водных растворов, и достигает 5…10 г озона и более на 1 г фенола [21].
В работе [10] отмечается, что степень очистки нефтесодержащих сточных вод, имеющих сложный состав, с помощью озонирования может колебаться в пределах 50…75%. Причем в озонируемой воде остаются промежуточные продукты окисления углеводородов, не поддающиеся дальнейшему разрушению и являющиеся более опасными, чем исходные вещества. Время контакта очищаемой воды, содержащей не более 0.5 мг/л нефтепродуктов, с озоном в реакторе должно быть не менее 13-15 мин. При несоблюдении этого условия реакция окисления идет не до конца, т.е. не до образования С02 и Н 2О, и выделяются очень опасные кислородсодержащие органические соединения. При окислении озоном бром-фтор-хлорорганики образуются бромистая, фтористая и соляная кислоты, а в случае хлорорганики - фосген, являющийся боевым отравляющим веществом.
Процесс озонирования осуществляют в барботажных ваннах или смесителях, в которых вода смешивается с озонируемым воздухом или кислородом [13, 14]. Для производства 1 кг озона требуется 15 кВт электроэнергии. Расход электроэнергии на 1 кг окисленного фенола составляет 50-100 кВт ч, в чистом водном растворе [31].
Преимуществом данного метода очистки можно считать то, что в воду не вносятся химические реагенты.
К недостаткам процесса озонирования следует отнести: малое время жизни молекул озона; низкий коэффициент полезного действия озонаторов; высокую стоимость озона; необходимость применения коррозионно-стойких материалов для оборудования; токсичность озона (ПДК в воздухе 0.0001 мг/л); образование при окислении высокомолекулярных соединений промежуточных токсичных органических веществ; высокую чувствительность к нарушениям технологических параметров озонирования (скорости прокачки воды и составу загрязнений); недопустимость присутствия в озонируемой воде клеточной массы водорослей и микроорганизмов, поскольку высвобождаемые белковые соединения и аминокислоты в ходе дальнейшего озонирования могут образовывать высокотоксичные соединения.
Метод обработки хлором и хлорсодержащими агентами
Оптимальной температурой окисления является 40 0 С. При этой температуре скорость реакции окисления фенола в 2-3 раза выше, чем при 20 0 С. увеличение температуры более 45 0 С нецелесообразно вследствие перехода гипохлоритов в хлораты, имеющие более низкую окислительную способность.
Метод окисления диоксидом хлора
Водные растворы диоксида хлора в кислой среде довольно устойчивы. С повышением температуры и рН скорость разложения диоксида хлора увеличивается, особенно на свету. В щелочной среде диоксид хлора гидролизируется с образованием хлоритов и хлоратов. Фенол легко окисляется диоксидом хлора. В кислой и нейтральной средах основным продуктом окисления является бензохинон. Расход диоксида хлора на окисление 1 мг фенола до бензохинона составляет 1-1,2 мг. В щелочной среде при избытке диоксида хлора основные продукты окисления фенола – органические кислоты (из которых идентифицированы малеиновая и щавелевая). Для полного окисления 1 мг фенола до органических кислот при продолжительности контакта 15…20 мин необходимо 5 мг диоксида хлора [33].
Обработка сточных вод, загрязненных фенолами, диоксидом хлора может приводить к образованию хиноидных соединений или к разрыву бензольного кольца и образованию органических кислот – конечных продуктов окисления.
Метод окисления кислородом воздуха
Фенолы, растворенные в сточных водах, относительно легко окисляются кислородом воздуха. При взаимодействии с кислородом фенолы претерпевают глубокие структурные превращения: гидроксилируются, образуют хиноны, оксихиноны карбоновые, гуминовые кислоты перекисные соединения, а также продукты уплотнения. Дальнейшее окисление может привести к образованию диоксида углерода и воды. Глубина превращения фенолов зависит от параметров окисления. Многоатомные фенолы окисляются интенсивнее одноатомных. Особенно при рН=7. Например, степень разложения метилрезорциновой и диметлирезорциновой фракции при температуре сточной воды 40 0 С и рН=9,5…13 составляет 30…50%, причем наблюдается образование продуктов уплотнения и конденсации фенолов, плохо растворимых в воде [34].
Пероксид водорода
Пероксид водорода являющийся одним из сильных окислителей, применяют обычно в виде 30% водного раствора. Разложение пероксида водорода - экзотермично, катализируется некоторыми металлами переменной валентности (железо, медь, марганец, кобальт, цирконий) и их солями. При окислении фенола пероксидом водорода в присутствии двухвалентного железа рН раствора снижается, при этом окислившееся - трехвалентное железо выпадает в осадок. Более 90% фенола окисляется в течение 10 мин. Для корректировки рН в воду добавляют щелочные агенты. Эффект очистки воды при использовании гидрооксида кальция выше [39]
Применение пероксида водорода не приведет к вторичному загрязнению воды продуктами разложения реагента.
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода: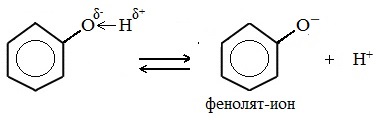
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.

1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
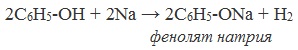
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
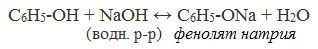
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой: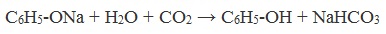
По кислотным свойствам фенол превосходит этанол в 10 6 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2 - , Br - )
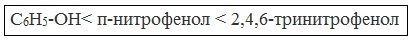
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот: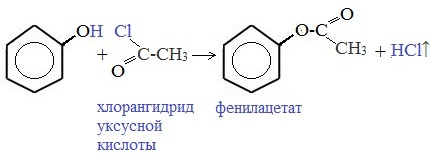
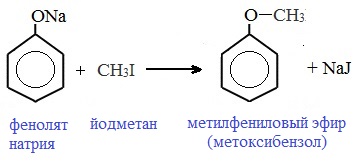
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+ М -эффект ОН-группы):
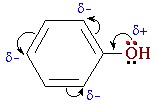
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
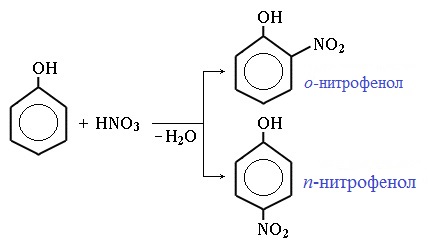
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):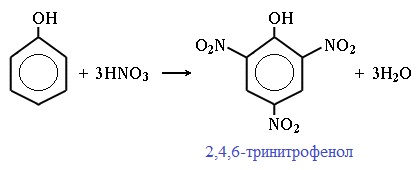
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.

2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола ( качественная реакция на фенол! ):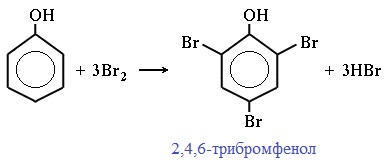
Образуется белый осадок трибромфенола.
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: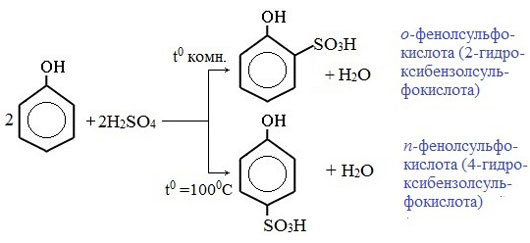
Реакции присоединения
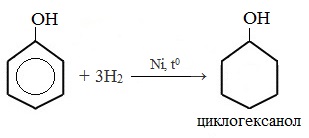
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
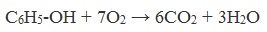
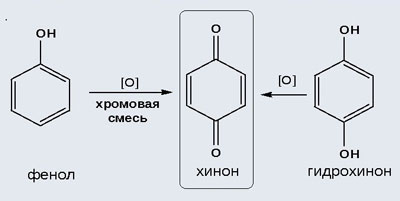
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
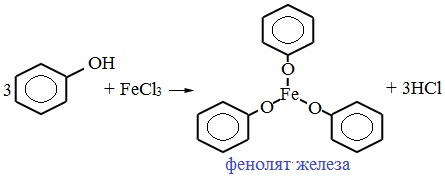
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Для очистки сточных вод используют следующие окислители: газообразный и сжиженный хлор, диоксид хлора, хлорат кальция, гипохлориты кальция и натрия, перманганат калия, бихромат калия, пероксид водорода, кислород воздуха, пероксосерные кислоты, озон, пиролюзит и др.
В процессе окисления токсичные загрязнения, содержащиеся в сточных водах, в результате химических реакций переходят в менее токсичные, которые удаляют из воды. Очистка окислителями связана с большим расходом реагентов, поэтому ее применяют только в тех случаях, когда вещества, загрязняющие сточные воды, нецелесообразно, или нельзя извлечь другими способами. Например, очистка от цианидов, растворенных соединений мышьяка и др.
Активность вещества как окислителя определяется величиной окислительного потенциала. Из всех известных в природе окислителей первое место занимает фтор, который, однако, из-за высокой агрессивности не может быть использован на практике. Для других веществ величина окислительного потенциала равна: для озона — 2,07; для хлора — 0,94; для пероксида водорода — 0,68; для перманганата калия — 0,59.
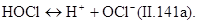 |
Далее происходит диссоциация хлорноватистой кислоты, степень которой зависит от рН среды. При рН=4 молекулярный хлор практически отсутствует:
Процесс хлорирования проводят в хлораторах периодического и непрерывного действия, напорных и вакуумных. Принципиальная схема очистки вод хлорированием показана на рис. II-59. Хлорирование проводится в емкости, включенной в систему циркуляции. В инжекторе газообразный хлор захватывается сточной водой, циркулирующей в системе до тех пор, пока не будет достигнута заданная степень окисления, после чего вода выводится для использования.
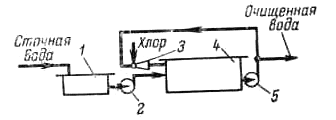
Рис. 11-59. Схема установки для очистки воды хлорированием:
1 — усреднитель; 2,5 — насосы; 3 — инжектор; 4 — емкость
При обезвреживании вод от цианидов процесс проводят в щелочной среде (рН=9). Цианиды можно окислить до элементного азота и диоксида углерода по уравнениям
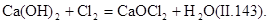 |
Гипохлорит (оксохлорат) натрия образуется при пропускании газообразного хлора через раствор щелочи:
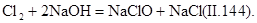 |
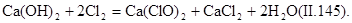 |
Гипохлорит кальция приготовляют хлорированием гидроксида кальция при температуре 25—30°С:
Промышленность выпускает двухосновную соль Са(Сl2)•2Са(ОН)2•2Н20.
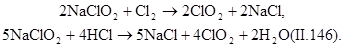 |
Сильным окислителем является хлорат натрия NaClO2, который разлагается с выделением ClO2. Диоксид хлора зеленовато-желтый ядовитый газ, обладающий более интенсивным запахом, чем хлор. Для его получения проводят следующие реакции:
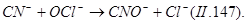 |
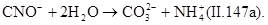 |
Окисление цианидов до цианатов происходит за счет атомного кислорода в момент его выделения из окислителя. Образовавшиеся цианаты легко гидролизуются до карбонатов:
Скорость гидролиза зависит от рН среды. При рН=5,3 за сутки гидролизуется около 80% цианатов. В двухступенчатом процессе цианиды окисляются до N2 и СО2. На первой ступени процесс протекает по реакции (II.147). На второй ступени вводят дополнительное количество окислителя и реакция протекает по уравнению
Окисление пероксидом водорода. Пероксид водорода является бесцветной жидкостью, в любых соотношениях смешивается с водой. Она может быть использована для окисления нитритов, альдегидов, фенолов, цианидов, серосодержащих отходов, активных красителей. Промышленность выпускает 85—95%-ный пероксид водорода и пергидроль, содержащий 30% Н2О2. Пероксид водорода токсичен. ПДК в воде составляет 0,1 мг/л.
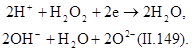 |
Пероксид водорода в кислой и щелочной средах разлагается по следующим схемам:
В кислой среде более отчетливо выражена окислительная функция, а в щелочной — восстановительная.
В кислой среде пероксид водорода переводит соли двухвалентного железа в соли трехвалентного, азотистую кислоту — в азотную, сульфиды — в сульфаты. Цианиды в цианаты окисляются в щелочной среде (рН=9—12).
В разбавленных растворах процесс окисления органических веществ протекает медленно, поэтому используют катализаторы — ионы металлов переменной валентности (Fe 2+ , Си 2+ , Mg 2+ , Co 2+ Сr 2+ , Ag + ). Например, процесс окисления пероксидом водорода с солью железа протекает весьма эффективно при: рН=3—4,5. Продуктами окисления являются муконовая и малеиновая кислоты.
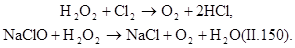 |
В процессах водообработки используют не только окислительные, но и восстановительные свойства пероксида водорода. В нейтральной и слабощелочной средах он легко взаимодействует с хлором и гипохлоритами, переводя их в хлориды:
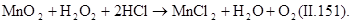 |
Эти реакции используют при дехлорировании воды. Избыток пероксида водорода можно удалять, обрабатывая его диоксидом марганца:
Перспективным является окисление загрязнений пероксосерными кислотами: пероксомоносерной Н2SO5 и пероксодисерной Н2S2O8. Например, фенол окисляется пероксомоносерной кислотой (кислота Каро) при рН=10. Этим методом возможно снизить содержание фенола до 5*10 -6 %). Скорость окисления зависит от соотношения Н2SO5/С6Н5OH и повышается с ростом температуры.
Разрушение цианидов под действием пероксосерных кислот протекает также очень быстро. При этом в случае небольших концентраций цианидов (0,01—0,05%) в сточной воде используют Н2SО5, а при высоких концентрациях — Н2S2O8. Оптимальным условиям соответствует рН=9. В нейтральной среде реакция окисления резко замедляется под действием ионов железа, которые образуют ферроцианы, не подвергающиеся окислению.
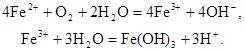 |
Окисление кислородом воздуха. Кислород воздуха используют при очистке воды от железа для окисления соединений двухвалентного железа в трехвалентное с последующим отделением от воды гидроксида железа. Реакция окисления в водном растворе протекает по схеме
Окисление проводят при аэрировании воздуха через сточную воду в башнях с хордовой насадкой. Образующийся гидроксид железа отстаивают в контактном резервуаре, а затем отфильтровывают. Использование колонн с кусковой насадкой или кольцами Рашига нецелесообразно, так как происходит зарастание насадки. Возможен процесс упрощенной аэрации. В этом случае над поверхностью фильтра разбрызгивают воду, которая в виде капель падает на поверхность фильтрующей загрузки. При контакте капель воды с воздухом происходит окисление железа.
Кислородом воздуха окисляют также сульфидные стоки целлюлозных, нефтеперерабатывающих и нефтехимических заводов. Процесс окисления гидросульфидной и сульфидной серы протекает через ряд стадий при изменении валентности серы с -2 до +6:
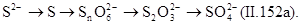 |
При этом при окислении гидросульфида и сульфида до тиосульфата рН раствора повышается, при окислении гидросульфида до сульфида и сульфата рН раствора понижается, а при окислении сульфида до сульфита и сульфата активная реакция среды не изменяется.
С повышением температуры и давления скорость реакции и глубина окисления сульфидов и гидросульфидов увеличивается. Теоретически на окисление 1 г сульфидной серы расходуется
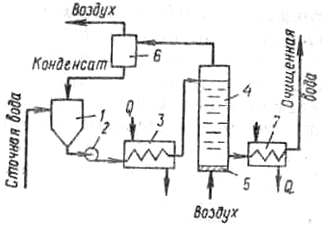
Рис. 11-60. Схема установки окисления сульфидов:
1 — приемный резервуар; 2 — насос; 3 — теплообменник; 4 — окислительная колонна; 5 — воздухораспределительное устройство; 6 — сепаратор; 7 — холодильник
1 г кислорода. Принципиальная схема установки окисления сульфидов приведена на тис. II-60.
Читайте также:

