Обтурирован опухолью это как
Обтурация – это состояние, характеризующееся полной или частичной закупоркой внутренней полости какого-либо органа или сосуда. Дефект проходимости обычно возникает из-за заболевания данного органа или компрессии, производимой извне (из-за опухолей, спаек). Обтурация может развиваться в мочеточнике, бронхах, желчных протоках, кишечнике, кровеносных сосудах. В некоторых случаях ее производят искусственно, для лечебных целей.
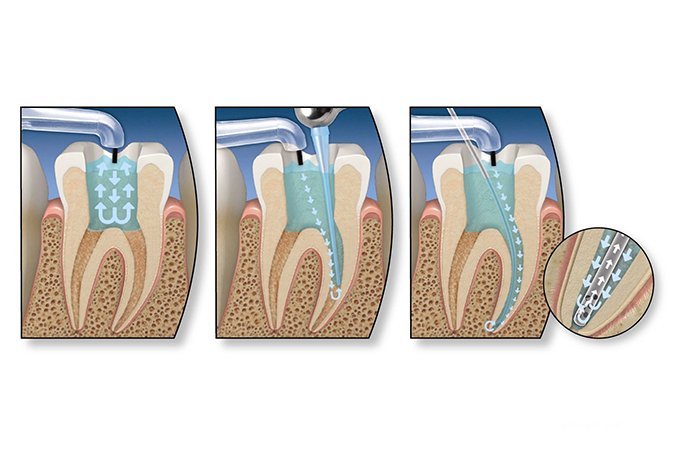
Материалы для обтурации корневых каналов
Преднамеренное закрытие полости применяется для лечения пульпита или периодонтита при пломбировании зубов. Обтурацию каналов корня зуба выполняют с использованием специальных пломбировочных материалов, к которым предъявляется целый ряд требований. Они должны:
- Обладать антибактериальными свойствами и низкой токсичностью;
- Не давать усадки;
- Иметь оптимальное время отверждения;
- Не раздражать ткани, окружающие зуб;
- Равномерно заполнять канал и при необходимости удаляться из него;
- Не растворяться при контакте с тканевой водой.
Почти всем этим требованиям соответствует применяемая большинством стоматологов при обтурации каналов корня гуттаперча, являющаяся крепким и одновременно гибким материалом, получаемым при коагуляции латекса. Так как гуттаперча не оказывает противомикробного действия, ее используют в сочетании с силером, которому также присущи пластические отвердевающие свойства.
Виды и методы обтурации корневых каналов
Существует два вида обтурации каналов корня зуба – постоянная и временная. Последняя необходима в случае воспалительного процесса, при котором невозможна постановка постоянной пломбы. Временная пломба изготавливается из нетвердеющего материала и может быть установлена на непродолжительное время, максимум на несколько месяцев, после исчезновения признаков воспаления применяют постоянную пломбу. Существует большое количество способов постоянной обтурации каналов с использованием гуттаперчевых штифтов. К наиболее распространенным из них относят следующие методики: обтурации термопластифицированной гуттаперчи, латеральной конденсации, химического размягчения гуттаперчи, термомеханической конденсации, стандартизованного пломбирования. Также некоторые клинические ситуации требуют для получения эффективных результатов комбинированных методов закрытия канала.
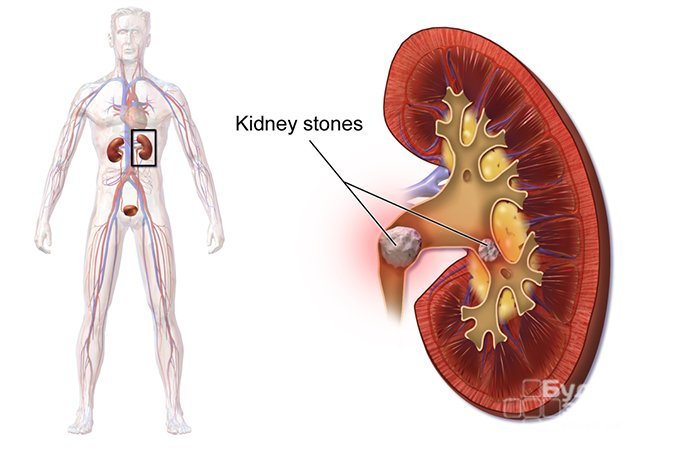
Причины обтурации мочевых путей
Сужение полости мочевых путей может наблюдаться у людей разных возрастных категорий. Но если у детей обтурация наиболее часто является врожденной, то у взрослых в большинстве случаев она возникает из-за нарушений мочевыделительной системы. Причиной обтурации мочевых путей может быть механический дефект проходимости, спровоцированный опухолью, почечными камнями, сгустками крови, инородными телами (при продолжительном пребывании катетера в мочеточнике). Также вызвать сужение просвета канала может отек, появившийся вследствие воспалительного процесса в мочевом пузыре или мочеточнике. Сама по себе обтурация не является болезнью, а лишь состоянием, свидетельствующим о возникновении патологии в организме. Вне зависимости от этиологии обтурации, она способна привести к развитию почечной недостаточности.
Симптомы обтурации мочевых путей
Обтурации наиболее часто обусловливают нарушения оттока мочи (вплоть до прекращения) по мочевыводящим путям, что является причиной острой или хронической почечной недостаточности. Также к симптомам дефекта проходимости относят болевые ощущения, интенсивность которых зависит от степени развития обтурации. При прогрессировании патологии и нарушении гомеостаза боль становится ярко выраженной, с проявлением почечных колик, и требует немедленного медицинского вмешательства. Если обтурация развивается медленно, дефекты функции почек мало проявляют себя, боль также может отсутствовать либо быть довольно слабой или умеренной и не вызывать особого беспокойства. Вместе с тем это состояние также требует оказания врачами срочной помощи, так как при хроническом нарушении оттока мочи происходят необратимые изменения в почках.
Благоприятный прогноз при обтурации мочевых путей возможен только при ее своевременном устранении и лечении заболеваний, ставших причиной ее возникновения.
Опухоли бронхов – различные в морфологическом отношении новообразования, растущие в просвет бронха (эндобронхиально) или вдоль его стенки (перибронхиально). Признаками опухоли бронха могут служить: раздражающий кашель, кровохарканье, одышка, свистящее дыхание, рецидивирующие пневмонии. При раке бронха названная симптоматика развивается на фоне общего нарушения самочувствия (слабости, похудания и пр.). В целях диагностики и верификации типа опухоли бронха проводится рентгенография и томография легких, бронхоскопия с эндоскопической биопсией и гистологическим исследованием материала. Удаление опухолей бронхов (с учетом их локализации и гистотипа) может производиться эндоскопически, путем резекции бронха или легкого.
МКБ-10
- Причины
- Классификация
- Симптомы опухолей бронхов
- Диагностика
- Лечение опухолей бронхов
- Прогноз
- Цены на лечение
Общие сведения
Опухоли бронхов – новообразования, различные по происхождению, клеточному составу, характеру роста, течению и прогнозу, исходящие из тканей бронхиального дерева. Прежде всего, все опухоли бронхов подразделяются на доброкачественные и злокачественные. Первая группа новообразований более многочисленна, хотя составляет всего 5-10% от общего числа опухолевых процессов в бронхах. Большая часть опухолей бронхов представлена различными гистологическими вариантами бронхогенного рака. Доброкачественные опухоли легких и бронхов чаще развиваются у лиц молодого возраста (30-40 лет), в одинаковой степени поражают мужчин и женщин; злокачественные новообразования в большинстве случаев выявляются у мужчин старше 50 лет.
Причины
Наиболее подвержены возникновению опухолей бронхов работники вредных производств, контактирующие с углем, асбестом, мышьяком, хромом, никелем, аэрогенными поллютантами. Отмечена связь некоторых опухолей бронхов с определенными вирусными агентами (например, ассоциация плоскоклеточных папиллом бронхов с вирусом папилломы человека). Папилломы бронхов часто сочетаются с папилломатозом гортани и трахеи.
Классификация
По типу роста опухоли легких подразделяются на центральные (произрастающие из крупных бронхов - главных, долевых, сегментарных, субсегментарных) и периферические (развиваются из мелких бронхиальных ветвей 5-го, 6-го порядка). Центральные опухоли с эндобронхиальным ростом доступны визуализации через бронхоскоп, часто обтурируют просвет бронха, вызывая при этом ателектаз сегмента или доли легкого. Периферические опухоли длительное время не вызывают клинически значимых изменений и протекают бессимптомно.
Доброкачественные опухоли могут развиваться из различных элементов бронха, на основании чего выделяют:
- опухоли из эпителия и бронхиальных желез (папилломы (плоскоклеточные, железистые, смешанные), аденомы бронхов (карциноидные, цилиндроматозные, мукоэпидермоидные, смешанные)
- опухоли из мезодермальной ткани (лейомиомы, фибромы, гемангиомы, неврогенные опухоли)
- дисэмбриологические опухоли (гамартомы, гамартохондромы)
Опухоли бронхов следует отличать от эндобронхиальных процессов неопухолевой природы. К последним в пульмонологии относятся инородные тела бронхов, воспалительная гиперплазия бронхов, бациллярный ангиоматоз легкого, амилоидные опухоли, эндометриоз и т. п.
По мере развития доброкачественных опухолей бронхов выделяют фазу бессимптомного течения, начальных клинических проявлений и развернутой клинической картины. С учетом выраженности нарушения бронхиальной проходимости различают стадию частичного стеноза бронха, клапанного стеноза бронха и полной окклюзии бронха. В некоторых случаях доброкачественные опухоли бронхов подвергаются малигнизации и приобретают злокачественное течение (например, малигнизация аденомы бронха с переходом в аденокарциному отмечается у 5–10% больных).
Симптомы опухолей бронхов
Наиболее яркая клиническая симптоматика развивается при эндобронхиальном росте опухоли, вызывающей нарушение бронхиальной проходимости. На стадии частичного бронхостеноза диаметр просвета бронха практически не изменен, пациента может беспокоить раздражающий кашель с небольшим количеством мокроты, изредка – кровохарканьем. Общее самочувствие не страдает. Рентгенологические признаки опухолевого роста отсутствуют; выявление новообразования возможно только с помощью КТ легких или бронхоскопии.
На стадии клапанного стеноза бронха опухоль уже в значительной мере перекрывает просвет воздухоносных путей. Больного беспокоит постоянный кашель с выделением слизисто-гнойной мокроты, кровохарканье, одышка, свистящее дыхание. Во время выдоха под давлением опухоль может полностью закрывать бронх, в связи с чем на этом этапе возникают признаки нарушения легочной вентиляции, воспалительные изменения. Рентгенологически обнаруживаются сегментарные инфильтраты, опухоль бронхов подтверждается эндоскопически или с помощью линейной томографии.
Полная обтурация бронха опухолью приводит к формированию ателектаза, нагноительных процессов в невентилируемом участке легочной ткани. Клиническая картина соответствует обтурационной пневмонии: лихорадка, кашель с гнойной мокротой, общая слабость, потливость. При аррозии бронхиальных сосудов могут возникать массивные легочные кровотечения.
Карциноидные аденомы бронхов могут продуцировать биологически активные вещества, поэтому при опухолях данного типа нередко развивается карциноидный синдром: бронхоспазм, головокружения, покраснение кожи, чувство жара, аллергические высыпания на коже и т. п.
Опухоли с перибронхиальным ростом, как правило, не вызывают полной обтурации бронха, поэтому симптоматика не выражена. Также малосимптомно и течение периферических опухолей. Обычно клиническая манифестация связана с аррозией сосуда (кровохарканье), сдавлением или прорастанием бронхов (кашель, одышка, повышение температуры и т. д.). При раке бронха, кроме респираторных проявлений, выражены общие нарушения: раковая интоксикация, слабость, кахексия, анемия, болевой синдром.
Диагностика
Беспричинный или длительный надсадный кашель, кровохарканье, одышка, затрудненный выдох и другие признаки неблагополучия со стороны дыхательных путей должны стать поводом для безотлагательного посещения пульмонолога. После оценки аускультативных и других физикальных данных определяется алгоритм диагностического обследования.
Как правило, первым шагом на пути выявления опухоли бронха является рентгенография легких в двух проекциях и томографическое исследование. В большинстве случаев рентгенологически определяется гиповентиляция или ателектаз части легкого; на томограммах - "ампутация" обтурированного опухолью бронха. Для оценки васкуляризации опухоли бронха целесообразно выполнение бронхиальной артериографии или ангиопульмонографии.
Наибольшей ценностью при эндобронхиальных новообразованиях обладает фибробронхоскопия с эндоскопической биопсией. Гистологический анализ биоптата позволяет окончательно определить морфологический тип опухоли. Бронхоскопия может быть информативна и при периферических опухолях – в этом случае эндоскопист фиксирует косвенные признаки опухолевого роста (сужение и деформацию контуров бронха за счет внешнего сдавления, изменение угла отхождения бронхиальных ветвей и пр.). При такой локализации также возможна трансбронхиальная биопсия опухоли. С целью оценки степени нарушения проходимости бронхов выполняется спирометрия.
В плане дифференциальной диагностики наиболее важным представляется разграничение доброкачественных и злокачественных опухолей бронхов. Определение гистотипа, локализации и степени распространенности опухоли бронха позволяет грамотно спланировать последующее лечение.
Лечение опухолей бронхов
Доброкачественные опухоли бронхов с внутрипросветным ростом могут быть удалены различными путями. Так, при одиночных полипах на узкой ножке в качестве метода выбора может рассматриваться эндоскопическое удаление полипа через бронхоскоп с коагуляцией ложа. В остальных случаях, как правило, производится торакотомия с бронхотомией и удалением опухоли, окончатая или циркулярная резекция бронха; а при наличии необратимых изменений в легком (бронхоэктазов, пневмосклероза) – различные виды резекции. Перибронхиальные и периферические доброкачественные опухоли, как правило, удаляются в процессе краевой или сегментарной резекция легкого, лобэктомии.
Совсем иной подход используется в отношении злокачественных опухолей бронхов. Исходя из требований радикальности, объем резекции увеличивается до лобэктомии и даже расширенной пневмонэктомии. Эндобронхиальное удаление (лазерная деструкция, криодеструкция, радиочастотная или аргоноплазменная коагуляция, ФДТ), как альтернатива хирургической операции, применяется лишь на стадии TisN0M0 или при функциональной неоперабельности пациента в крупных центрах торакальной хирургии, где имеется соответствующее техническое оснащение и опыт. Хирургическое лечение рака бронхов дополняется химиотерапией или лучевой терапией; в запущенных случаях эти методы служат единственно возможным способом продления жизни пациента.
Прогноз
После удаления доброкачественные опухоли бронхов могут рецидивировать, особенно в случае продолжающегося воздействия причинно значимых факторов. Эндобронхиальное удаление опухоли может осложниться рубцовым стенозом бронха. Отказ от лечения чреват возникновением жизнеугрожающего кровотечения, развитием необратимых изменений легочной ткани, озлокачествлением опухоли бронха. Прогноз злокачественных опухолей бронхов зависит от стадии онкопроцесса, радикальности проведенного лечения, гистологической формы рака, наличия метастазов на момент установления диагноза.
Как сказано в предыдущей статье, мы впервые попытались резецировать злокачественную опухоль в бронхе более 25 лет назад.
Это был больной с нерезектабельным раком левого главного бронха, прораставшим бифуркацию трахеи и почти полностью перекрывающим правый главный бронх. Больной был госпитализирован практически в терминальном состоянии, с глубокой гипоксией, без сознания. В реанимационном отделении была выполнена бронхофиброскопия и установлена причина асфиксии. После этого тубусом жесткого бронхоскопа чисто механическим способом была срезана часть опухоли, закрывающая просвет правого главного бронха. Возникло довольно сильное кровотечение, которое удалось остановить тупферами, смоченными адреналином. Состояние больного заметно улучшилось, исчезли признаки гипоксии, и он прожил еще почти полгода.
Впоследствии были предприняты единичные и не вполне удачные попытки предварительной электрокоагуляции раковых опухолей, также сопровождавшиеся кровотечением. В 1986 г. мы получили свой первый неодимовый ИАГ-лазер и начали учиться выполнять лазерные операции на трахее и бронхах. За эти годы во время операций умерли 5 больных от кровотечения, гипоксии, сердечных и легочных осложнений. Причиной смерти 2 из них было необоснованное расширение показаний к эндоскопическим вмешательствам.
У этих больных ранее мы уже выполняли успешную реканализацию трахеи, у одного из них дважды. Повторно обращаясь в клинику в крайне тяжелом состоянии, пациенты и их родственники надеялись, что мы снова сможем им помочь, и умоляли попытаться выполнить операцию, несмотря на предупреждения о колоссальном ее риске. Состояние больных было настолько тяжелым, что мы, вспоминая эндоскопическую картину несколько месяцев назад, сочли нецелесообразным производить диагностическую бронхофиброскопию и согласились предпринять еще одну попытку восстановления просвета трахеи. Однако за прошедший период размер опухоли настолько увеличился, что выполнить реканализацию оказалось невозможным.
У одного из этих больных при попытке блокирования трахеи развилось профузное кровотечение, которое не удалось остановить, а другого больного с почти полностью обтурированными главными бронхами пришлось оставить на ИВЛ через оротрахеальную трубку; он умер через 2 ч от некорригируемой гипоксии, не приходя в сознание. У третьего больного в ближайшем послеоперационном периоде развилась острая сердечная недостаточность, обусловленная инфарктом миокарда, четвертый пациент умер от двусторонней пневмонии, смерть пятого больного была расценена как следствие массивной тромбоэмболии легочной артерии (родственники отказались от вскрытия).
У остальных больных непосредственные результаты операций были положительными. После реканализации главных (у 9) и долевых (у 5) бронхов у 14 больных удалось ликвидировать или уменьшить симптомы гипоксии и гнойной интоксикации и подготовить их к радикальной операции. При поздних стадиях рака, когда опухоль прорастала в трахею или сдавливала ее снаружи, резекция внутрипросветной порции опухоли и введение стента позволили улучшить состояние больных и продлить им жизнь хотя бы на несколько месяцев.
Приводим наблюдения
Больной Я., 66 лет, поступил в торакальное отделение Московской городской клинической больницы № 61 12 октября 1999 г. в крайне тяжелом состоянии с жалобами на выраженную одышку в покое, цианоз, кашель, кровохарканье, боли в левой половине грудной клетки. С 21 сентября по 6 октября пациент находился в терапевтическом отделении больницы с диагнозом левосторонней пневмонии. 11 октября состояние больного резко ухудшилось, усилилась одышка, появилось кровохарканье.
При трахеобронхофиброскопии в нижней части трахеи над бифуркацией выявлена больших размеров плотная экзофитно растущая опухоль, местами покрытая фибрином (рис. 1.96, а), исходящая из левого главного бронха и почти полностью обтурирующая трахею и правый главный бронх. По правой латеральной стенке трахеи в области трахеобронхиального угла и правого главного бронха сохранилась узкая щель, через которую осуществляется вентиляция правого легкого. Диагноз: опухоль левого главного бронха с переходом на бифуркацию трахеи и правый главный бронх.
Больной В., 53 лет, поступил 23 июня 2000 г. в тяжелом состоянии с жалобами на стридорозное дыхание, нарастающую одышку, непродуктивный кашель, афонию, дисфагию. Жалобы появились около 2 нед назад. С 15 июня пациент находился в онкологическом отделении Московской городской клинической больницы № 57, где был верифицирован плоскоклеточный рак средней трети пищевода, прорастающий в трахею. При ларингофиброскопии отмечено отставание правой половины гортани при фонации.
При трахеоскопии в средней трети трахеи на расстоянии около 5 см от голосовой щели на значительно выбухающей в этом месте мембранозной стенке вы-явлено2 опухолевое разрастание на широком основании. Трахея сужена на 2/з (рис. 1.97, а). Протяженность опухолевого стеноза около 4 см. Дистальные отделы трахеи визуально не изменены. Диагноз: декомпенсированныи опухолевый стеноз средней трети трахеи за счет ее сдавления и прорастания опухолью пищевода.
Приводим наблюдение
Больной К., 76 лет, поступил 3 января 2001 г. с жалобами на кровохарканье, шумное дыхание, резкую одышку в покое, дисфагию. Болен с 25 декабря 2000 г., когда появились симптомы простуды. 7—8 января состояние больного стало прогрессивно ухудшаться, нарастали одышка и свистящее, шумное дыхание.
При трахеоскопии на расстоянии около 2—2,5 см от голосовой щели обнаружена экзофитно растущая, подвижная при дыхании опухоль, практически полностью перекрывающая просвет трахеи и исходящая из ее мембранозной стенки (рис. 1.98, а). Вдоль передней и левой боковой стенок сохранилась узкая щель, через которую проходит воздух.
Диагноз: декомпенсированный опухолевый стеноз верхней трети трахеи. 5 января выполнена компьютерная томография. Правые отделы шеи асимметрично увеличены за счет объемного образования с относительно четкими контурами размером 6,8 х 6,2 см в поперечнике протяженностью от уровня щитовидного хряща до П—Ш грудного позвонка. Образование тесно прилежит к магистральным сосудам шеи, сдавливает трахею и пищевод, ротирует и смещает структуры шеи. В проекции плащевого слоя III сегмента правого легкого визуализируются 2 шаровидных образования диаметром до 7 мм. При эзофагогастродуоденоскопии верхней трети пищевода на расстоянии 20—25 см от зубного ряда определяется экзофитная опухоль размером 5,0 х 1,0 х 1,5 см с участками изъязвления. Заболевание расценено как опухоль пищевода, прорастающая в трахею и метастазирующая в правое легкое.
При гистологическом исследовании удаленных фрагментов опухоли установлен диагноз низкодифференцированного крупноклеточного рака щитовидной железы с прорастанием в трахею и пищевод.
После реканализации и стентирования трахеи состояние значительно улучшилось, и 22 января без нарушений дыхания больной переведен в Институт рентгенорадиологии для проведения лучевой терапии.
Как видно из приведенных наблюдений, в критических ситуациях могут быть применены разные способы эндоскопической реканализации трахеи и бронхов, в ряде случаев с последующим их стентированием. Это позволяет улучшить состояние неоперабельных больных, сделать возможным и менее опасным проведение лучевой и химиотерапии и продлить жизнь больных, облегчив последние месяцы их жизни.
К сожалению, мы не можем точно сказать, насколько увеличилась продолжительность жизни у большинства больных с так называемыми классическими карциномами трахеи и бронхов, так как больные умерли вне стен нашей больницы, но несколько случаев значительного увеличения продолжительности жизни и улучшения ее качества у больных с более медленными вторичными формами рака мы имели возможность наблюдать.
Приводим наблюдение
Больная Д., 88 лет, поступила 29 октября 1999 г. с жалобами на стридорозное дыхание, нарастающую одышку, кашель. Отмечалось однократное кровохарканье. При ультразвуковом исследовании диагностирован узловой зоб III степени. При пункционной биопсии верифицирован рак щитовидной железы.
При бронхоскопии 1 ноября на расстоянии около 3—4 см от голосовой щели на границе верхней и средней трети трахеи обнаружено сужение трахеи за счет экзофитно растущей опухоли диаметром около 1 см, исходящей из правой и передней стенок трахеи, и опухолевой инфильтрации ее боковых стенок (рис. 1.99, а).
Область подскладочного пространства остается немного суженной и ригидной за счет перитрахеально растущей части опухоли. В связи с высокой локализацией опухоли и сужением подскладочной области трахеи установить эндотрахеальный стент не удалось.
После экстубации отмечены неадекватное восстановление дыхания и развитие лагрингоспазма. В связи с этим больная интубирована эндотрахеальной трубкой. Через 4 ч трубка удалена, дыхание свободное. Гистологическое заключение: папиллярный рак щитовидной железы.
Больная выписана из клиники через 1 нед после реканализации трахеи в состоянии средней тяжести без признаков дыхательной недостаточности. После операции она прожила 18 мес без затруднений дыхания и умерла от инфаркта миокарда в апреле 2001 г. в возрасте 90 лет.
Еще более длительными были ремиссии у больных с аденокистозным раком трахеи, большинство из которых прожили после эндоскопических операций (и лучевой терапии) от 3 до 8 лет. С учетом того что у всех пациентов имели место нерезектабельные опухоли, эти результаты можно считать удовлетворительными.
Приводим наблюдение
Больной Ш., 46 лет, поступил в августе 1990 г. с жалобами на быструю утомляемость и одышку с появлением свистящего дыхания при физической нагрузке, кровохарканье. Считает себя больным в течение года после перенесенной двусторонней пневмонии. 29 августа выполнена диагностическая трахеобронхоскопия. Трахея, начиная с верхней трети, грубо деформирована, хрящевой рисунок практически не прослеживается, стенки утолщены и на их поверхности видны расширенные извитые сосуды, кровоточащие при контакте с эндоскопом. Просвет трахеи неровный, в нижней трети сужен до 5— 6 мм на протяжении 1,5 см, в средней трети минимальный диаметр просвета не менее 7—8 мм (рис. 1.100, а). Бифуркация незначительно расширена. Произведена биопсия стенки трахеи. Гистологически выявлена цилиндрома (вариант аденокистозного рака).
В связи с почти тотальным поражением трахеи вопрос об оперативном лечении не поднимался и было решено выполнить эндоскопическую реканализацию трахеи. 10 сентября была произведена трахеоскопия под общим обезболиванием (проф. А. А. Овчинников) и комбинированным способом (лазерная и механическая резекция) частично удалена эндобронхиальная часть опухоли. При контрольной трахеоскопии 16 ноября просвет трахеи стал несколько шире (рис. 1.100, б), что проявилось улучшением дыхания.
Состояние больного стало лучше, но уже в феврале 1991 г. вновь появились затруднения дыхания и при трахеоскопии отмечено увеличение эндобронхиальной части опухоли. Было решено провести курс лучевой терапии, но выраженное сужение трахеи в нижней трети вызывало опасения. В связи с этим 13 марта в торакальном отделении нашей клиники была выполнена частичная лазерная резекция опухолевой ткани в наиболее узком месте трахеи (рис. 1.100, в), после чего трахея была расширена тубусом бронхоскопа до диаметра 10 мм.
Умеренное кровотечение остановлено лазерной коагуляцией. На фоне восстановления практически нормального дыхания в марте — апреле проведено 3 сеанса лучевой терапии, после чего отмечено значительное уменьшение опухолевой инфильтрации стенок трахеи (рис. 1.100, г). В течение 2,5 лет больной чувствовал себя удовлетворительно, вел активный образ жизни, вернулся к работе. Однако в августе 1993 г. появилась осиплость голоса и вернулись свистящее дыхание и одышка. При трахеобронхоскопии отмечен частичный парез гортани. Движения голосовых связок нерезко ограничены, гортань полностью не раскрывается. Отчетливой асимметрии движений голосовых связок нет.
В трахее вновь отмечено существенное увеличение опухолевой инфильтрации, занимающей почти всю длину трахеи и сужающей ее просвет до 5—6 мм на протяжении не менее 6 см. При рентгенологическом исследовании выявлены увеличенные лимфатические узлы средостения и множественные мелкие метастазы в нижних долях обоих легких. Выполнена повторная реканализация трахеи комбинированным (лазерная и механическая резекция) способом. Дыхание после операции стало значительно свободнее, уменьшилась одышка. Пациент прожил еще почти 2 года. Смерть наступила в июле 1995 г. на фоне выраженной диссеминации процесса.
В приведенном наблюдении комбинированное лечение (эндохирургическое и лучевое) аденокистозного рака трахеи позволило больному, обреченному на мучительную смерть от асфиксии, прожить достаточно полноценной жизнью почти 5 лет.
Приводим наблюдение
Больная О., 27 лет, обратилась в клинику в конце ноября 1987 г. по поводу затрудненного дыхания и непродуктивного кашля в течение последних 5 лет. При диагностической бронхофиброскопии обнаружена гладкостенная красного цвета опухоль диаметром около 1 см на узком основании, исходящая из мембранозной стенки дистальной части левого главного бронха (рис. 1.101, а).
При контрольном осмотре через 4 года, в 1992 г., рецидива не обнаружено. При осмотре через 11 лет, в декабре 1998 г., просвет левого главного бронха не изменен. На мембранозной стенке левого главного бронха на расстоянии 1 см от бифуркации трахеи определяется небольшая рубцовая деформация без признаков опухолевого роста. В дистальных отделах бронхов патологии нет.
У одной больной с полной обтурацией левого главного бронха карциноидной опухолью даже частичная ее резекция привела к значительному улучшению состояния и позволила больной вернуться к нормальной жизни и профессиональной деятельности.
Больная К., 62 лет, врач-педиатр, на протяжении многих лет больна диабетом. Осенью 2001 г. перенесла левостороннюю пневмонию, которая приобрела затяжной характер. При диагностической трахеобронхоскопии выявлена опухоль, обтурирующая левый главный бронх, при гистологическом исследовании биоптата диагностирован типичный карциноид. При консультации в НИИ фтизиопульмонологии (акад. РАМН М. И. Перельман), учитывая возраст больной, наличие тяжелого диабета и осложненное течение карциноида, было рекомендовано попытаться удалить опухоль эндоскопически и больная была направлена в нашу клинику.
При бронхоскопии 14 января 2002 г. в дистальном отделе левого главного бронха обнаружена крупная темно-красная опухоль, практически полностью перекрывающая просвет бронха и закрывающая устье верхнедолевого бронха. Опухоль малоподвижна при дыхании. На поверхности опухоли видны множественные расширенные сосуды (рис. 1.102, а). Принято решение попытаться выполнить эндоскопическую резекцию опухоли.
Возникшее, несмотря на предварительную анемизацию опухоли, кровотечение средней интенсивности остановлено тупферами, смоченными 5 % раствором е-аминокапроновой кислоты. Срезанная часть опухоли извлечена. Основание опухоли протяженностью около 1 см эвапорировано неодимовым ИАГ-лазером. После удаления внутрипросветной части опухоли открылись устья верхне- и нижнедолевого бронхов. Бронхи промыты фурагином.
Послеоперационный период протекал тяжело. Больная испытывала сильную слабость и недомогание. В нижней доле левого легкого сохранялись участки ателектаза. Проведена антибиотикотерапия. При контрольной бронхоскопии через 3 нед после операции отмечено наличие части опухоли в области ее основания, не нарушающее проходимости долевых бронхов левого легкого (рис. 1.102, г). Больной было предложено выполнить второй этап операции и эвапорировать оставшуюся ткань опухоли, но она категорически отказалась. Выписана с клиническим улучшением через 1 мес после операции.
При осмотре через 3 года состояние пациентки удовлетворительное, она полностью вернулась к профессиональной деятельности. При компьютерной томографии легких, которую выполняли ежегодно, отмечается наличие неровного контура медиальной стенки левого главного бронха на уровне отхождения его верхнедолевой ветви без нарушения проходимости бронхов. При сравнении рентгенологической картины в динамике ухудшения не выявлено. От бронхоскопии больная категорически отказывается.
Срок наблюдения 6 лет мы считаем минимальным для констатации выздоровления, так как располагаем 2 наблюдениями, в которых рецидив типичного карциноида в бронхе был отмечен через 3 и 4 года после удаления. У 4 больных с рецидивом карциноида операции были выполнены повторно, а у одного даже 3 раза в течение 5 лет. После 4 операций проследить катамнез не удалось и их результатов мы, к сожалению, не знаем.
А.М. Шулутко, А.А. Овчинников, О.О. Ясногородский, И.Я. Могус
Читайте также:

