Облучение головы при мелкоклеточном раке
Лучевая терапия – это группа лечебных курсов. Лечение рака представляет собой облучение раковых новообразований и повреждённых клеточных тканей рентгеновскими лучами. Воздействие лучей уничтожает патологические клетки. Однако во время проведения терапии затрагиваются и здоровые ткани, что приводит к появлению неприятных для организма пациента последствий.
Лучевая терапия характеризуется целенаправленным влиянием электромагнитных волн на злокачественные наросты. Излучение успешно разрушает структуру молекул повреждённых тканей, из-за чего клетки погибают. Повышенная действенность терапии замечена при лечении клеток, предрасположенных к повышенному размножению. Поэтому процедура направлена на борьбу именно с раковыми опухолями. Патологические ткани разрушаются первоочередно.
Показания и противопоказания
При раке лёгких лучевая терапия проводится согласно результатам диагностических процедур. Перед проведением терапии пациент проходит УЗИ и компьютерную или магнитно-резонансную томографию.
Лечение назначается, если:
- метастазные клетки попали в лимфоузлы;
- опухоль с метастазами размножилась по лимфоузлам средостения;
- нарост давит на близрасположенные структуры;
- развился рецидив;
- раковые клетки распространились по диафрагме и грудной клетке;
- опухоль с метастазами перешла на стенки груди или в часть сердца;
- опухолевые ткани проникли в надключичные участки;
- как профилактика размножения поражённых клеток после торакотомии.
Также показаниями к лучевой терапии являются:
- противопоказание к проведению оперативного вмешательства;
- отказ пациента от операции;
- как вспомогательная процедура для предупреждения вторичного появления болезни.
Врачи отмечают такие противопоказания к лечению:
- ателектаз;
- разрыв опухоли;
- существование полостей;
- кровотечение;
- повышенная температура;
- огромные размеры и территории поражения лёгких;
- кумуляция жидкости в плевре;
- воспалительный процесс в лимфатических сосудах;
- отравление организма;
- активное развитие туберкулёза открытой формы;
- перенесенный инфаркт меньше 6 месяцев назад;
- диабет на стадии декомпенсации;
- сердечная недостаточность;
- осложнённые патологии почек и печени;
- нарушение психического здоровья, нестабильность эмоционального фона.
Виды лучевой терапии
Диагностирование мелкоклеточного рака лёгких характерно для редких случаев. Данная разновидность характерна для курильщиков со стажем, отличается агрессивным характером и регулярно метастазирует. Для лечения рака прибегают к химиотерапии. Процедура выступает в качестве самостоятельного мероприятия или проводится совместно с лучевой терапией. Лучевая терапия эффективна, если злокачественное образование не начало процесс активного распространения, и не наблюдается рецидива.
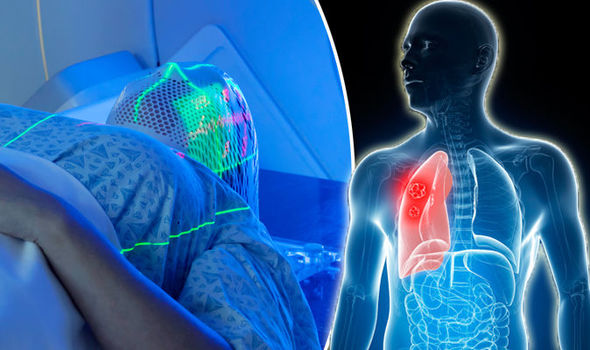
Данный тип онкологии требует использования терапии превентивно. Облучают жизненно важные органы, в частности головной мозг, пока не сформировались отдалённые метастазные клетки. Процедура осуществляется методом стереотаксической радиотерапии. Направление лучей рассчитывается через компьютерную 3D-модель.
Вылечить немелкоклеточный и плоскоклеточный рак поможет радиотерапия совместно с хирургическим вмешательством. Иногда операция заменяется радиотерапией. Начало лечения приходится на момент диагностирования опухоли лёгких. Процедура при онкологии на 3 этапе применяется после окончания хирургического лечения. Это позволяет снизить вероятность рецидивирования злокачественного нароста.
Лучевая терапия, независимо от типа рака лёгкого, выступает способом локального и целенаправленного использования. Благодаря изучению пределов терапии удалось создать новейшие методики. В основу одних легло применение агрессивных мероприятий, а другие направлены на подведение лучей напрямую к опухолевым клеткам. Для достижения наибольшего эффекта процедуры комбинируют с химиотерапией или хирургическим лечением.
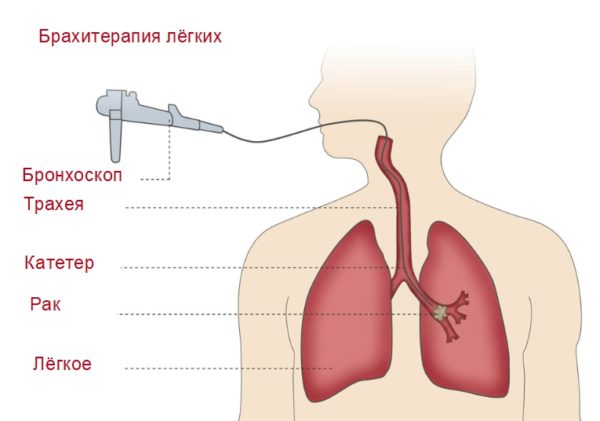
Эндобронхиальная брахитерапия назначается для нормализации путей проходимости, если новообразование подобралось близко к бронхам либо проросло в бронхиальную область. Радиотерапия при раке лёгких осуществляется под местным наркозом. В выбранный участок через фибробронхоскоп вводится зонд размером 3 мм, состоящий из полимерных материалов. На расстоянии двух крайних точек располагается аппликатор, перекрывающий опухоль на 1,5 см. Пациент находится под врачебным контролем. Также доктор прослеживает показатели артериального давления, функционирования сердца, частоту дыхания и степень поступления кислорода в кровь.
Технология лечения характеризуется повышенной действенностью. У 50% пациентов уменьшаются и проходят проявления симптомов. Положительной стороной и преимуществом схемы лечения является расположение источника излучения на близком расстоянии к поражённому участку. Высокая дозировка и влияние на здоровые ткани сокращаются. На центральную область опухоли наносится двойной удар по сравнению с периферическими тканями. Зачастую центр вырабатывает устойчивость к излучению. Показания к проведению брахитерапии:
- Расположение опухоли вблизи бронха.
- Малая величина новообразования.
- Рак, расположившийся вдали от бронхов и углубившийся в ткани лёгких. В данном случае процедура является дополнительным мероприятием к внешнему облучению.
- Улучшение путей проходимости бронхов из-за проникновения раковых клеток в бронхиальный просвет.
Методика представляет собой уничтожение опухолевых клеток при повышении дозировки облучения. При этом упор делается на клетки, способные к активному делению. Во время процедуры важно защитить здоровые ткани от попадания под облучение. Для этого создается компьютерная 3D-модель опухоли. Во время построения новообразования рассчитывается дозировка облучения и число здоровых клеток, впоследствии сэкономленных в сравнении с традиционной лучевой терапией. Также излучение не должно воздействовать на сердце.
Технология основывается на информации, полученной по мультиспиральной компьютерной и позитронно-эмиссионной томографии груди. Предварительное обследование включает в себя анализ крови, исследование мокроты, плевральную пункцию и торакоскопию. Указанные диагностические мероприятия нацелены на исключение вероятного метастазирования участков. Если конечный результат гистологического и цитологического обследования отрицательный, проводится моделирование территории облучения.
Метод раскрывает алгоритм деления раковых клеток. При применении небольших дозировок в день увеличивается суммарная дневная норма дозы, и снижается вероятность появления побочных реакций от излучения, рецидивного развития и метастазирования опухолевых клеток. При продолжительном сроке облучения выявляется отрицательное влияние на эффективность процедуры. Лечение рака проходит на протяжении 12 суток вместо 1,5 месяца. При этом суммарная дозировка достигает 54 Грей вместо 60.
Облучение осуществляется 3 раза в сутки каждые 6 часов с перерывом на сон. Единичная доза равняется 1,5 Гр. По сравнению со стандартной схемой лечения токсичность повышена. Однако превышение фиксируется только на начальных этапах после терапии.
Побочные эффекты возникают независимо от технологии применения. Отмечается высокий показатель выживаемости пациентов, подвергнувшихся указанной методике лечения, и сниженное формирование новых метастазов. Основываясь на токсичности лечения, исследователи предложили другую технологию терапии – по 2 Гр раз в сутки, 5 раз в неделю. Продолжительность курса – 5-7 недель.
Контактная представляет собой методику лечения, когда источник лучей располагается максимально близко к опухолевому очагу и находится прямо в опухоли. Для осуществления терапии применяют рентгенологическое, гамма и бета излучение. Высокая действенность схемы отмечается при некрупных наростах размером до 20 мм в диаметре. Доза рассчитывается исключительно на участок поражения. Однако терапия ухудшается при необходимости диагностировать подобный рак.
Согласно фокусной технологии лучи направляются на некотором расстоянии от поражённого места. При полостном облучении на участок вводится зонд и находится внутри на протяжении всей процедуры. Тканевый метод требует непрерывную поставку дозы. Радиохирургическая методика разрушает оставшиеся раковые клетки и очищает территории расположения опухолевых тканей после удаления. При наложенном воздействии проводится лечение аппликатором на слизистых оболочках злокачественного нароста.
Схема настраивает нужное направление потока, отодвинутого на установленное расстояние для охватывания полноценной поверхности опухоли. Ускоренные электроны и высокая энергия обеспечивают увеличенную плотность излучения. Технология допускает повышение дозы, так как благодаря установленному режиму влияния не затрагиваются здоровые клетки. Во время статистического направления пациент и аппарат попадают в стационарное состояние. Однако такая схема считается устаревшей. При подвижной схеме удаётся вращать луч согласно заданным траекториям, достигая максимальной дозировки для злокачественных тканей.
На стадии планирования врачи разрабатывают модель для расчёта дозировки, времени и путей облучения. Основываясь на изображениях, появившихся после диагностики, расписывается схема дальнейшей компьютерной обработки. Доктора разбирают методы подачи и оптимизацию поступления активного элемента. В каждой отдельной ситуации применяется разный вид излучения.
Для брахитерапии моделируют расположение катетера и время экспозиционного влияния. Планирование состоит из расчёта технологии соотношений дозировки и объёма для выявления территории поражённого участка. Параллельно врачи разрешают вопрос по сохранению и устранению максимальной площади нормальных тканей.
Возможные побочные реакции и осложнения
Максимальная эффективность терапии и применение инновационных методов лечения сопровождаются негативными побочными эффектами. Несмотря на возможность сохранения большего числа здоровых клеток, процедура вызывает неприятные симптомы. После лучевой терапии отмечают такие последствия и осложнения:
Реабилитация
После завершения курса лечения пациент проходит первый врачебный осмотр спустя 6 недель. Проходить обследования требуется раз в 3 месяца в течение двух лет. Через 2 месяца по окончанию терапии онколог проводит контрольное диагностическое исследование. Результаты компьютерной томографии отразят эффективность лечения. Полученные тесты сравнивают с прошлой картиной болезни.
Обследование позволяет врачу увидеть прохождение рубцевания клеток, что является неотъемлемой частью лучевой терапии. Анализ и диагностика способствуют своевременному обнаружению рецидива и проявления осложнений. Реабилитация требует строгого соблюдения правил и ответственного исполнения врачебных рекомендаций. В период восстановления требуется составить меню, включающее правильное и полноценное питание, а также использовать растения и травы, помогающие ослабленному организму восстановиться.
В домашних условиях пациент занимается дыхательной гимнастикой. Важно ускорить выздоровление и нормализацию привычного образа жизни. После лучевой терапии в первые 2 недели требуется:

- Выпивать достаточный объём жидкости – норма 8-10 стаканов воды.
- Отказаться от сладкого.
- Уменьшить порции, но кушать чаще. Из-за воздействия лучей пищевод и желудок ослаблены, и в них ещё наблюдается воспалительный процесс.
- Исключить из рациона молочную продукцию.
- Отказаться от острых и пряных блюд.
- Исключить сырые овощи, бобовые и цельнозерновые продукты.
- Использовать настойки из крапивы, левзеи, родиолы, сельдерея и элеутерококка.
Со временем разрешается добавлять каши из зёрен, картофель и бульоны. Продолжается травяная терапия. Также важно заняться активностью и двигательными функциями для профилактики пролежней и пневмонии. Регулярно проводится дыхательная гимнастика. Рекомендуется полностью отказаться от употребления алкогольных напитков и курения.
Эффективность лучевой терапии
Наибольшая эффективность и успех лечения рака лёгких наблюдается на начальных стадиях развития онкологических патологий. Действенность лучевой терапии основывается на:
- виде рака;
- этапе развития болезни;
- выбранном способе лечения;
- возрасте пациента;
- существующих хронических болезнях.
Брахитерапия обеспечивает повышение пятилетней выживаемости до 70%. При проведении конформационной терапии в 40% случаев у пациентов с 3 этапом опухоли отсутствует рецидив рака на протяжении 2 лет. При применении гиперфракционного способа лечения показатель выживаемости возрастает в 2 раза. Однако методика тяжело переносится людьми. Поэтому технология используется в редких случаях.
Мелкоклеточный рак легкого относится к числу радиорезистентных, и более чем в 80% случаев наблюдается полная регрессия первичной опухоли. После облучения в умеренной дозе (40-50 Гр в течение 4-5 недель) может отмечаться полная регрессия даже больших первичных опухолей с признаками лимфоаденопатии в области ворот и средостения.
Одно время радиологи проявляли интерес к схеме ежедневного двухкратного (гиперфракционированного) облучения, хотя в рандомизированных исследованиях ее преимущества не удалось продемонстрировать.
Обычно вначале опухоль реагирует на облучение, однако в пределах поля часто возникают рецидивы, и не всегда удается достигнуть контроля над ростом локального образования. Как и следует ожидать, это можно сделать при облучении в более высоких дозах, хотя при этом усиливаются токсические эффекты, особенно если наряду с облучением назначают химиотерапию.
В нескольких рандомизированных исследованиях была проверена эффективность совместного назначения химио- и лучевой терапии. Больные, получавшие курс химиотерапии, были разделены на две группы, одной из которых проводили облучение грудной клетки.
Группы были слишком малочисленны для того, чтобы показать достоверные различия между ними, однако повторный анализ данных по каждому больному показал, что 3-летняя выживаемость больных в группе, получавшей химио- и лучевую терапию, увеличилась на 5% (с 7% до 12%), что эквивалентно 60%-му относительному увеличению выживаемости. При совместном назначении химио- и лучевой терапии развиваются сильные токсические осложнения.
Тем не менее лучевая терапия широко используется в тех случаях, когда опухолевый процесс носит ограниченный характер, состояние больных удовлетворительное, и они хорошо реагируют на химиотерапию. Первые рандомизированные исследования не выявили существенных преимуществ комбинированного применения химио- и лучевой терапии. Также оставался невыясненным вопрос об оптимальном времени начала облучения.
Хотя в исследованиях из Канады утверждалось о преимуществах раннего облучения, это не подтвердилось другими данными, и при проведении метаанализа не было показано различий по продолжительности жизни больных в зависимости от времени начала облучения.
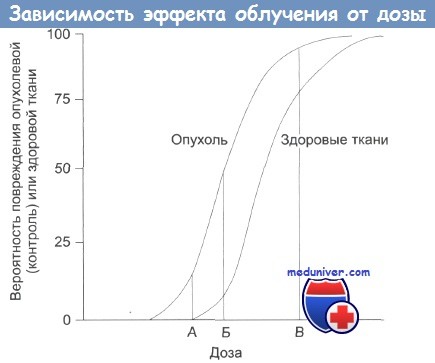
Зависимость терапевтического эффекта от дозы облучения.
А — нижняя безопасная доза;
Б — увеличение дозы: растет поражение здоровых тканей;
В — наивысшая вероятность успешного лечения, но и высокая вероятность поражения здоровых тканей, многочисленные побочные эффекты, некоторые из которых могут проявиться в отдаленном будущем
Итак, возможность назначения больным лучевой терапии необходимо предусматривать при следующих обстоятельствах:
1. При локализованной опухоли, частично или полностью чувствительной к химиотерапевтическим препаратам
2. При локальных рецидивах
3. При наличии синдрома верхней полой вены, который не снимается химиотерапевтическими препаратами.
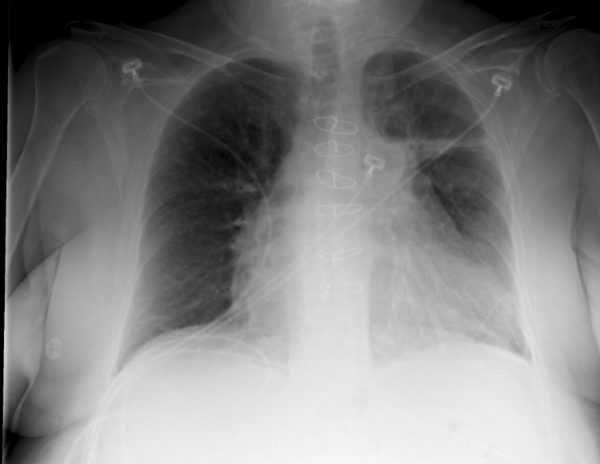
Часто лучевая терапия оказывает выраженное паллиативное действие при мелкоклеточном раке легкого, и ее назначают при болях в костях и при обнаружении метастазов в головном мозге. По данным клинического обследования, у 25% больных с мелкоклеточным раком легкого в головном мозге обнаруживаются метастазы, а по данным аутопсии они присутствуют у двух третей больных.

Во многих случаях эффективно облучение головного мозга в дозе 20 Гр, назначаемой пятью фракциями в неделю. Эта доза хорошо переносится больными, и нет необходимости назначать более продолжительные режимы. Такой же режим облучения обычно назначают при обнаружении в костях метастазов, причиняющих больным сильные боли.
При болезненных метастазах в кости, которые часто обнаруживаются при мелкоклеточном раке легкого, оценивалась эффективность назначения больным профилактического облучения головы. Метаанализ данных, полученных в двух крупномасштабных рандомизированных исследованиях, показал, что при назначении этой процедуры частота развития в мозге метастазов снижается с 40% до уровня, составляющего менее 10%.
Однако это лишь незначительно влияло на продолжительность жизни больных. Таким образом, профилактическое облучение головы ослабляет болевой синдром при метастазировании опухоли в головной мозг. В то же время после облучения головы проявляются признаки острого токсического эффекта (спутанность мыслей, чувство беспокойства, провалы в памяти) и в дальнейшем развивается неврологическая симптоматика. Правда, это наблюдается достаточно редко.
Обычно рекомендуется назначать профилактическое облучение головы больным, которые хорошо реагировали на химиотерапию. У больных, для которых химиотерапия оказалась неэффективной, назначение этой процедуры может привести к снижению продолжительности жизни.
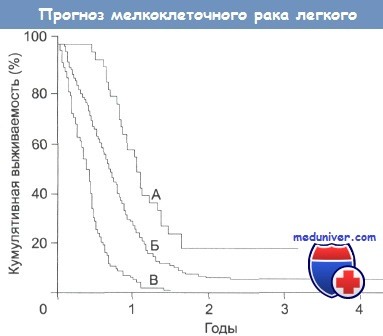
Значение прогностических факторов при мелкоклеточном раке легкого:
А — Больные характеризуются хорошим общим состоянием; результаты биохимических анализов в норме.
В — Больные с плохим общим состоянием; результаты более двух биохимических анализов отличаются от уровня нормы.
Б — Построено по данным разницы между первой и второй группой.
Мелкоклеточный рак легкого чрезвычайно радиочувствителен, поэтому лучевая терапия также играет важную роль в лечении этого заболевания.
Обзор нескольких исследований показывает, что при этом методе лечения средняя выживаемость увеличивается примерно на 1 мес, а при добавлении лучевой терапии к химиотерапии 3-летняя выживаемость возрастает на 5% (19 против 14%). Во многих исследованиях показано, что облучение грудной клетки улучшает контроль первичного опухолевого процесса и, следовательно, местных симптомов.
Однако влияние лучевой терапии на выживаемость минимизируется распространенным характером мелкоклеточного рака легкого с высокой частотой последующих метастатических рецидивов. В ходе большинства исследований сообщали о диапазоне доз от 40 Гр в 15 фракций в течение 3 нед до 50 Гр в 25 фракций в течение 5 нед.
Сроки начала облучения грудной клетки в соотношении с химиотерапией оставались предметом обсуждения. Проводили исследования, сравнивавшие раннее начало лучевой терапии (в течение первых 9 нед химиотерапии) с поздним (спустя 9 нед химиотерапии). Были изучены разные общие дозы облучения, а также различные режимы фракционирования, включая CHART.
Хотя было продемонстрировано, что последняя увеличивает выживаемость по сравнению с ежедневной схемой, обзор всех доступных исследований свидетельствует, что наиболее важным фактором выступает своевременное проведение всех намеченных курсов химиотерапии. Если этого не произошло, считают, что сроки начала лучевой терапии не важны. В исследованиях времени проведения лучевой терапии, в которых полный курс химиотерапии получили более 80% пациентов, средняя выживаемость больных была на 6 мес лучше по сравнению с исследованиями, в которых химиотерапия завершена менее чем у 80% пациентов.
Профилактическое облучение головы важно, учитывая частоту метастазов мелкоклеточного рака легкого в головной мозг и сомнения в отношении проникновения цитотоксических препаратов через гематоэнцефалический барьер. Профилактическое облучение головы направлено на эрадикацию микроскопической стадии заболевания до появления симптомов метастазов в головной мозг и, как правило, наиболее подходит лицам с ограниченной стадией опухолевого процесса, полностью ответивших на первичное лечение.
Существуют основания полагать, что профилактическое облучение головы должно быть начато вскоре после завершения химиотерапии. Исследования показывают, что профилактическое облучение головы снижает частоту развития метастазов в головной мозг, по некоторым данным, вплоть до 54%. Недавно проведенный метаанализ более чем 900 пациентов, прошедших профилактическое облучение головы после достижения полной ремиссии с помощью химиотерапии, продемонстрировал снижение относительного риска смерти на 0,84 (95% доверительный интервал 0,73-0,97), что соответствует увеличению 3-летней выживаемости на 5,4%. Более высокие дозы также снижают частоту рецидивов в головном мозге, однако не оказывают влияния на выживаемость.
Существует очень мало данных относительно влияния профилактического облучения головы на выживаемость больных с распространенной стадией мелкоклеточного рака легкого, хотя оно почти всегда снижает частоту развития метастазов в головном мозге.
Как и при немелкоклеточном раке легкого, лучевая терапия оказывает хороший паллиативный эффект, особенно при симптомах, обусловленных рецидивом заболевания. Она особенно эффективна в отношении кровохарканья, стенозирования верхних дыхательных путей, болей в костях, обструкции верхней полой вены, болезненной или обезображивающей лимфаденопатии и повреждении кожи, а в некоторых случаях — метастазов в головной мозг. В большинстве случаев наиболее эффективна и удобна 1 фракция 7-8 Гр.
Высокая скорость роста опухоли и раннее метастатическое распространение объясняют недостаточные результаты, достигнутые в прошлом для этой формы рака при использовании хирургического или лучевого метода лечения, даже при локализованной форме опухоли.
В настоящее время химиотерапия (XT) является основным системным методом лечения, а лучевая терапия (ЛТ) может добавляться к XT для улучшения локального контроля или профилактического облучения головного мозга.
Цель ЛТ состоит в том, чтобы предотвратить локальный рецидив, увеличить свободный от болезни интервал и в конечном счете улучшить выживаемость.
В мета-анализе Pignon, основанном на индивидуальных данных 2140 пациентов, 3-летняя выживаемость повысилась от 8,9 % после XT до 14,3 % после ЛТ + XT, но при этом увеличилась токсичность.
Облучение грудной клетки — партнер в лечении ограниченного мелкоклеточного рака легкого (MPЛ), но еще требует изучения ряд факторов, таких как вид лекарства, выбор времени начала лучевой терапии, схема, доза облучения и фракционирование.
Цисплатин и этопозид стали стандартной схемой химиотерапии для локализованного МРЛ, потому что они могут легко сочетаться с одновременной ЛТ. Кроме того, эти лекарства в эксперименте расширяют воздействие излучения на опухоли, но не на нормальную легочную ткань.
Однако цисплатин увеличивает реакции слизистых глотки и пищевода, и при одновременной ЛТ грудной клетки III степень эзофагита часто ограничивает возможности объединенного подхода лечения, особенно методики ускоренного облучения.
По вопросу выбора определенного времени, когда начинать лучевую терапию, были получены противоречивые данные. В Канадском национальном институте рака (NCI) пациенты получали 3 цикла XT (схема CAV чередовалась с цисплатин + этопозид) в сочетании с ЛТ (40 Гр), подводимых одновременно с первым циклом (раннее облучение, 3-я неделя) или с последним циклом XT (позднее облучение, 15-я неделя).
Период безрецидивного и общего выживания был значительно выше в группе с ранним облучением. Напротив, в другом исследовании облучение грудной клетки (50 Гр за 6 недель) было проведено с 1-м или 4-м циклом химиотерапии по схеме САР (циклофосфамид, доксорубицин, цисплатин). При раннем начале ЛТ дозы XT были уменьшены. При прослеживании 5 лет лучшие результаты были получены при проведении 4 циклов XT.
Другая проблема состоит в том, чтобы определить оптимальную схему использования 2 методов: последовательную, одновременную или чередование. Были проведены 2 рандомизированных исследования.
В анализе EORTC сравнивались альтернирующая схема (чередовались недельные курсы лучевой терапии с курсами химиотерапии по схеме циклофосфамид, доксорубицин и этопозид) и последовательный подход (облучение было поставлено в конце XT). Не было выявлено различий в ответе или выживании в 2 группах, но чередующаяся схема была более токсичной.
Суммарная доза терапии
Локальные неудачи остаются главным спорным вопросом многих испытаний. Какова должна быть суммарная доза при МРЛ?
В обзоре Choi и Carey 2,5-летняя выживаемость увеличилась с 16 % после 30 Гр до 63 % после 50 Гр. Только одно испытание изучало вопрос суммарной дозы радиации. После оценки ответа на XT больные с эффектом были рандомизированы на 2 группы: получившие 25 Гр за 10 фракций или 37,5 Гр за 15 сеансов.
Частота местных рецидивов при наблюдении 2 года уменьшилась с 80 % после 25 Гр до 69 % для более высокой дозы облучения. Радиобиологические характеристики МРЛ предполагают, что схема ускоренного гиперфракционирования (больше чем одна фракция подводится каждый день) может быть эффективна для преодоления проблемы репопуляции клеток и способности клеток к репарации.
Исследования сравнили ежедневный план облучения 1,8 Гр до суммарной дозы 45 Гр с ускоренным гиперфракционированным облучением (2 фракции по 1,5 Гр каждый день в течение 3 нед до суммарной дозы 45 Гр). В обеих группах цисплатин и этопозид вводился одновременно.
Острая токсичность была выше с 2 фракциями в день, особенно острые эзофагиты, однако имелось четкое преимущество в выживаемости. Выживаемость 2-, 3- и 5-летняя была 40,8, 26,7 и 20 % соответственно для одной фракции в день и 46,6, 31 и 28 % для 2 фракций. Облучение двумя фракциями в день вело к лучшему локо-региональному контролю, но частота локальных неудач (остаточной опухоли) осталась довольно высокой (36 %).
Последние 10 лет у больных локализованным МРЛ используется химиолучевая терапия с включением этопозида, цисплатина, винкристина, таксанов и облучения грудной клетки дозами 40-45 Гр, подводимых за 15 дней лечения. При этом особое внимание уделяется выбору объемов грудной клетки при планировании ЛТ.
До 90-х гг. XX века для определения объема облучения рака легкого использовались данные рентгеновских исследований и международные рекомендации по методикам ЛТ.
Например, у больных с локализованной формой МРЛ широко применяли методики облучения, используемые при заболевании Ходжкина. В объем облучения включали первичную опухоль, все средостение, оба корня легких. Основной способ подведения доз был статический, с двух встречных фигурных полей.
Одновременно облучали шейно-надключичные зоны с двух сторон с одного переднего поля, с узким блоком по центру в случаях профилактического лечения. После достижения суммарных очаговых доз в пределах 40 Гр уменьшали размеры полей до рентгенологически определяемых границ опухоли и продолжали лечение до 50-66 Гр. При паллиативном характере лучевой терапии ограничивались первой частью курса.
Такой подход при раке легкого, особенно при МРЛ, определялся с учетом характера рецидивов, частоты поражения лимфатических узлов, выявляемых по данным аутопсий, во время операций. Однако использование больших объемов при облучении грудной клетки способствовало появлению постлучевых изменений легких, органов средостения у большинства больных, что ухудшало их качество жизни.
С развитием и внедрением новых методов диагностики и планирования ЛТ появились рекомендации об уменьшении объема облучения до границ определяемой опухоли +1,5-2 см вокруг.
Предложено исключать противоположный корень, часть средостения и надключичные области из зоны профилактического облучения, что осуществлялось в прежних программах.
Исключение из объема облучения лимфатических узлов было обосновано следующим образом:
• только 33 % узлов нормального размера содержат клетки рака;
• современная химиотерапия может контролировать эти узлы;
• на самом деле эти узлы (корень и средостение) получают некоторые дозы, достаточные для их контроля;
• определение стадии заболевания с использованием позитронно-эмисионной томографии (ПЭТ) может уточнить активность этих узлов и определить, какие из них можно не облучать.
В настоящее время при всех формах рака легкого при планировании химиолучевой терапии мы не включаем в зону 80-90 % изодозы неизмененные лимфатические узлы средостения, определяемые при компьютерной томографии (КТ) грудной клетки (рис. 1а, б).

Рис. 1а. На КТ-слайсах контуры опухоли в легком (красный цвет), увеличенные лимфатические узлы в средостении (желтый цвет), А — ателектаз

Рис. 1б. Схема полей при облучении МРЛ, прежняя и современная (голубым цветом заштрихованы области экранировки части легкого). Внутри полей облучения красным цветом представлен контур опухоли, желтым — метастазы в средостении
При распространенных формах МРЛ основным методом лечения является XT. Лучевая терапия первичной опухоли используется при выраженном ответе на XT для закрепления эффекта в грудной клетке или с паллиативной целью для уменьшения тягостных легочных симптомов. Лучевой метод широко применяется в паллиативном лечении метастазов в головной мозг, кости, надпочечники и другие органы и ткани.
Паллиативная лучевая терапия не влияет на общую выживаемость больных МРЛ, при ее осуществлении разовые и суммарные дозы, объем облучения определяются только тяжестью симптомов, прогнозируемыми сроками жизни больного.
В.A. Горбунова, А.Ф. Маренич, 3.П. Михина, О.В. Извекова
Читайте также:

