Обходные анастомозы при раке
При раке желудка выполняют два типа паллиативных операций. При первом типе вмешательств операция, не устраняя очага поражения, направлена на улучшение питания и общего состояния больного. Такими операциями являются обходной анастомоз между желудком и тонкой кишкой - гастроэнтероанастомоз, гастро- и еюностомии. При втором типе операций удаляется первичный очаг опухоли или метастазы. К таким операциям относятся паллиативные резекции, паллиативные гастрэктомии и удаление метастазов.
Гастроэнтеростомия (наложение гастроэнтеростомоза)
Желудочно-кишечный анастомоз накладывается при иноперабельном раке выходного отдела желудка, и эта операция является наиболее частым паллиативным вмешательством. Смысл операции заключается в создании соустья между желудком и тощей кишкой. В настоящее время выполняют заднюю - позадиободочную, реже переднюю - впередиободочную гастроэнтеростомию. В первом случае через отверстие в брыжейке поперечно-ободочной кишки выводят заднюю стенку желудка и соединяют анастомозом с петлей тонкой кишки. Во втором варианте, петлю кишки проводят впереди от поперечно-ободочной кишки, прикладывают к передней стенке желудка и соединяют с ним соустьем. В 8-10 см ниже гастроэнтероанастомоза обычно накладывается межкишечный брауновский анастомоз.
Операцию применяют при неоперабельном раке проксимального отдела желудка и пищевода, сопровождающемся нарушением проходимости пиши. Предложено более ста модификаций этой операции. Наибольшее распространение получила гастростомия по Кадеру и Витцелю.
Кишечный свищ или энтеростому накладывают для обеспечения питания больного при раке желудка и создания проходимости пищеварительного тракта. Операция также производится при обширном поражении желудка с нарушением проходимости и невозможности наложить гастростому. Подобная операция является единственным средством помочь неоперабельному больному раком резецированного желудка. Чаще искусственный свищ создается в начальном отделе кишечника (еюностомия).
Однао еюностомия не пользуется популярностью среди хирургов. Это связано с тем, что введение зонда, значительно суживающего просвет кишки, вызывает застой и создает условия для вытекания кишечного содержимого.
Ко второму типу паллиативных операций относятся паллиативные резекции. Эти операции, в основном, выполняются при невозможности полного удаления метастазов в лимфатических узлах или в органах при удалимости первичной опухоли. Паллиативную резекцию желудка производят главным образом в целях увеличения эффективности последующей лучевой и химиотерапии.
Противопоказаниями к проведению паллиативной резекции являются: метастазы в брюшину, брыжейку, сальник, асцит; отдаленные метастазы в кости, головной мозг, легкие и т.д., тяжелое общее состояние больного.
Паллиативное удаление первичного очага позволяет уменьшить массу опухоли и, тем самым, снизить токсическое ее влияние на организм больного, устранить источник непроходимости и кровотечения, что позволяет больному жить некоторое время с метастазами. В основном паллиативные резекции выполняются с целью дальнейшего проведения химио- и лучевой терапии Обходные анастомозы, гастро- и еюностомы также облегчают проведение лекарственного лечения, поскольку ослабленный голодом больной не в состоянии выдержать лечение. Улучшение состояния пациента после начала питания через стому в дальнейшем позволит применить химиотерапию. Техника таких операций такая же, как и обычной резекции желудка, но без удаления лимфатических узлов или метастазов.Химиотерапию в чистом виде применяют только при неоперабельных формах рака. Попытки продлить жизнь этих больных с помощью полнили монохимиотерапии показали эффективность 5-фторурацила и фторафура. 5-Фторурацил вводят внутривенно из расчета 15 мг/кг через день в суммарной дозе на курс лечения 4—5 г. Фторафур назначают по 30 мг/кг внутривенно или внутрь, рекомендуется суточную дозу делить на 2 приема, ориентировочная суммарная доза — 20—30 г. Повторные курсы химиотерапии проводят через 4—6 нед.
Химиотерапия позволяет добиться частичной регрессии опухоли у 20—30% больных. Средняя продолжительность жизни больных, перенесших паллиативную дистальную резекцию желудка, при проведении им химиотерапии составляет 23,3±3,6 мес, а если химиотерапия не назначалась — только 12,9±2,8 мес.
Профилактическая химиотерапия может проводиться у радикально оперированных больных раком желудка. Дополнительное лечение 5-фторурацилом в дозе 15 мг/кг через день (по 3 г суммарно) назначают через 1 и 3 мес после радикальной операции. Это лечение уменьшает частоту рецидивов и метастазов.
Химиотерапия перечисленными препаратами может сопровождаться рядом побочных явлений, среди которых основное значение имеет угнетение кроветворения (особенно белого ростка и тромбоцитов) и поражение слизистых оболочек желудочно-кишечного тракта. В этих случаях ограничивается возможность длительного лечения или применения высоких доз.
Дата добавления: 2016-07-18 ; просмотров: 3553 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ





- Здоровье
- Статьи
- Медицина
- Форум
- Rating
- Full Article
- Comments

Это основное преимущество обходных анастомозов перед гастростомией при неоперабельном раке пищевода.
Обходные пищеводно-желудочные и пищеводно-кишечные анастомозы при неоперабельном раке кардии с переходом на пищевод впервые широко стали применяться в 40-х годах XX столетия проф. А. Г. Савиных при чрездиафрагмальном подходе к кардии и пищеводу. После того как несколько позднее получил распространение трансплевральный доступ к пищеводу и кардии, многие хирурги стали выполнять обходные анастомозы при неудалимых раковых опухолях кардии и нижнего отдела пищевода.
Р. Т. Панченков на основании опыта 15 обходных операций при неоперабельном раке пищевода с 2 неблагоприятными исходами пришел к следующим выводам:
1) обходная операция пищеводно-желудочного и пищеводно-кишечного анастомоза… есть операция выбора;
2) желудочно-пищеводный анастомоз или кишечно-пищеводный анастомоз — идеал паллиативных операций при раке пищевода и кардиального отдела желудка.
C. С. Юдин, подчеркивая, что он не имеет собственного опыта в наложении обходных анастомозов при неудалимом раке кардии и пищевода, очень сдержанно относился к этой операции. Он не разделял восторженного отношения Р. Т. Панченкова к обходным анастомозам.
Мы присоединяемся к мнению хирургов, считающих, что у тех больных, которым предпринимается пробная операция с надеждой на резекцию опухоли кардии и нижнего отдела пищевода, а в результате карцинома оказывается неудалимой, создание обходного анастомоза будет наилучшей паллиативной операцией.
Однако рак пищевода, о котором идет речь в данной работе, судя по статистическим данным, более чем в половине случаев локализуется в средней трети и лишь примерно в 25% в нижней трети пищевода. Кроме того, известно, что чем выше расположена опухоль, тем меньше надежды на ее удаление. Следовательно, в паллиативных операциях будут нуждаться главным образом больные с опухолью в среднегрудном и верхнегрудном отделах пищевода. Описанные выше обходные анастомозы при левостороннем торакальном подходе для больных с высокой локализацией опухоли пищевода неприменимы.

Спорим, вы не угадаете, что это? Это стент в просвете пищевода
Не каждый из тех, кто кашляет весной 2020 – болен COVID-19. Есть пациенты, кому еще хуже: они задыхаются, и им не помогут 2 недели в инфекционной больнице. У них рак. Рак легких, или молочной железы, или яичников, или, возможно, лимфома.
При многих опухолях частое осложнение – скопление жидкости в плевральной полости (вокруг легких). Ее бывает много, до нескольких литров (!) – и она сдавливает легкие, мешая им работать. Это называется гидроторакс.
Заметьте, хирург позволяет человеку жить дальше, хотя не действует на главную причину беды: злокачественную опухоль. Это один из примеров паллиативной хирургии.
Паллиативная хирургия – это такая, которая не устранит главную проблему – раковую опухоль, не вылечит человека полностью. Но паллиативная операция, вероятно, продлит ему жизнь и заметно повысит ее качество: он сохранит способность к самообслуживанию и социальную адекватность, сможет сам передвигаться, есть или ходить в туалет, перестанет мучиться от боли.
Почему бывает нельзя просто вырезать опухоль?
Хирургическое лечение в онкологии многие считают только радикальным: когда все очаги поражения можно просто иссечь. А иначе ведь – зачем и связываться с травматичными вмешательствами и вообще впустую размахивать скальпелем? Это распространенный стереотип.
Если, например, кроме опухоли в молочной железе у женщины метастазы в печени, легких и позвоночнике – придется удалять слишком много тканей из разных органов сразу, и риск умереть от такой операции у нее будет выше, чем от прогрессирования болезни.

Органы, куда чаще всего метастазирует рак молочной железы
Но это не значит, что таким людям ничем нельзя помочь! Паллиативная помощь может значительно облегчить состояние пациента и улучшить качество его жизни, а иногда и продлить ее – не прибегая к радикальному лечению.
Паллиативная медицина чаще всего использует химио- и лучевую терапию. К сожалению, это отложилось в головах у многих российских врачей слишком плотно: они не готовы применять хирургию, когда заранее понимают, что оставят опухоль или часть ее внутри пациента. Хотя в онкологических отделениях по миру до 20% всех операций – паллиативные.
И их становится больше. Показания к хирургическому лечению на любой стадии рака – даже при распространённом процессе – расширяются. Появляются новые малоинвазивные способы вмешательства – они снижают риски для пациента и после них легче восстановиться.
Паллиативная хирургия становится частью комплексного лечения. У нас этому очень помогает налаженное междисциплинарное взаимодействие. Когда хирург, онколог, химиотерапевт, врач лучевой терапии и реаниматолог собираются вместе, они не тянут одеяло на себя (как вы могли подумать), а находят оптимальную лечебную тактику, чтобы избавить пациента от мучительных симптомов максимально безопасно, и насколько возможно долго.
На сегодня успехи таковы. С помощью паллиативной операции можно:
- Уменьшить размер опухоли, чтобы появилась возможность действовать на нее химиотерапевтическими методами.
- Снизить опухолевую интоксикацию.
- Убрать тягостные симптомы.
- Остановить/предотвратить внутреннее кровотечение.
- Уменьшить боли.
- Реконструировать поврежденную часть тела и помочь реабилитации после радикальных методов лечения.
Не можем удалить – уменьшим. Циторедуктивные операции
а) продлить пациенту жизнь,
б) убрать тягостные симптомы,
в) предотвратить жизнеугрожающие состояния.
Часто опухолевые очаги нельзя удалить целиком. Например, опухоль слишком крупная – вместе с ней пришлось бы удалять жизненно важный орган или очень большой его участок. Или поражены слишком много систем организма – множественные отдаленные метастазы. Или очаги метастазирования мелкие, до микроскопического размера, зато их тысяча – как при канцероматозе брюшины.
Хотя в таких случаях часто есть возможность удалить не всю, но максимально возможную часть опухоли. Это уменьшит тяжелые симптомы, вызванные жизнедеятельностью раковых клеток. А главное – не остановит, но замедлит распространение злокачественного процесса, позволит пациенту выиграть время, даст больше шансов на то, что химио- и лучевая терапия подействуют – они работают тем эффективнее, чем меньше объем опухолевой ткани в организме.
Циторедуктивные операции становятся частью комплексного лечения. Мы уже рассказывали про HIPEC, гипертермическую внутрибрюшинную терапию, которая помогает пациентам на последних стадиях рака яичников, желудка, различных отделов кишечника, печени. Циторедуктивная операция занимает в процедуре HIPEC первое место: сначала хирург удалит все очаги, которые сможет найти, а затем брюшную полость пациента обработают горячим химиопрепаратом. После такой операции люди могут жить годы вместо месяцев, а в некоторых случаев – добиться ремиссии.
На этом видео можно посмотреть, как проходит циторедуктивная операция при канцероматозе брюшины. Осторожнее, если вы не любите заглядывать людям слишком глубоко внутрь!
Одна из наших пациенток, которой удаляли аденокарциному яичников, выполняет циторедуктивную операцию в сочетании с HIPEC уже 5-й раз подряд – и это 5 лет жизни.
Кроме рака яичников, циторедуктивные операции, как один из этапов лечения, показывают улучшение показателей по выживаемости при колоректальном раке, раке желудка, аденокарциноме аппендикса, саркомах мягких тканей – даже на тех стадиях, когда опухоль уже начала метастазировать.
Циторедуктивная операция нередко оказывается способом избежать худшего в ситуации, когда пациенту угрожают серьезные, опасные осложнения. Например, такое вмешательство помогает предотвратить перфорацию кишечника или сильное кровотечение из-за распада опухоли.
Эти меры, хотя и являются паллиативными – не дают пациенту уйти из жизни раньше времени.
Поэтому мы стараемся всегда найти максимум возможных вариантов лечения и следить за прогрессированием, даже когда невозможно выполнить радикальное вмешательство или опухоль плохо реагирует на химиотерапию.
Не можем удалить причину – режем следствия. Симптоматические операции
Симптоматические паллиативные хирургические вмешательства вообще не затрагивают опухоль, в отличие от циторедуктивных операций, но борются с опасными последствиями для пациента, которые вызывает рост злокачественного новообразования.
Например, про торакоцентез при скоплении жидкости в грудной клетке мы описали в самом начале статьи. Но не реже происходит скопление жидкости в брюшной полости – асцит. Это обычное осложнение при раке желудка, яичников, колоректальном раке и др.
При асците (скоплении жидкости в брюшной полости) объем жидкости может достигать 10 и более литров. Пациент чувствует себя очень плохо: одышка, нарушение в работе ЖКТ и внутренних органов. Чтобы облегчить это состояние, выполняют лапароцентез – прокол в стенке брюшной полости, чтобы вывести жидкость. Если жидкость скапливается быстро, устанавливают дренаж – он выводит излишки непрерывно.
Однако чаще всего симптоматические операции нужны, чтобы организм, по сути, продолжал производить с окружающей средой обмен, который всем нам так привычен и воспринимается здоровыми людьми как должное.
Для обеспечения функционирования пищеварительной системы
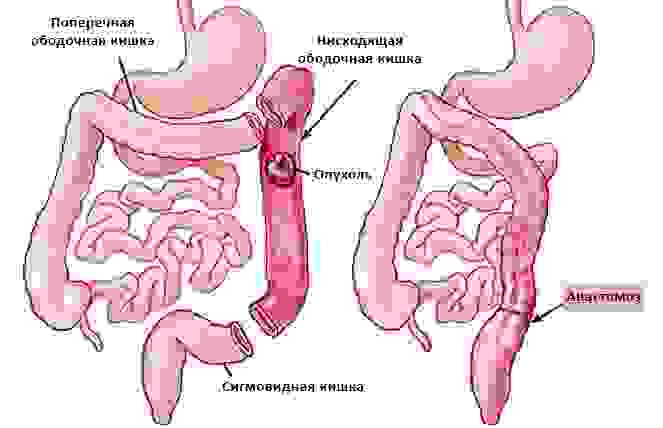
Удаление части ободочной кишки и формирование анастомоза
Однако, анастомоз наложить удается не всегда: например, пищевод или кишечник может быть слишком сильно поврежден опухолью. Существует еще ряд ситуаций, когда возникает необходимость создать прямое сообщение между полостью любого органа и окружающей средой.
На этот случай существуют стомы – отверстия, хирургическим путем сформированные на коже, к которым подшивают края нужной полости, в зависимости от локализации неоперабельной опухоли, которая закрывает просвет.
Например, гастростома – если не удается задействовать для питания пищевод: желудок подшивают к стенке брюшной полости и формируют отверстие на коже, через которое вводят полужидкую пищу.
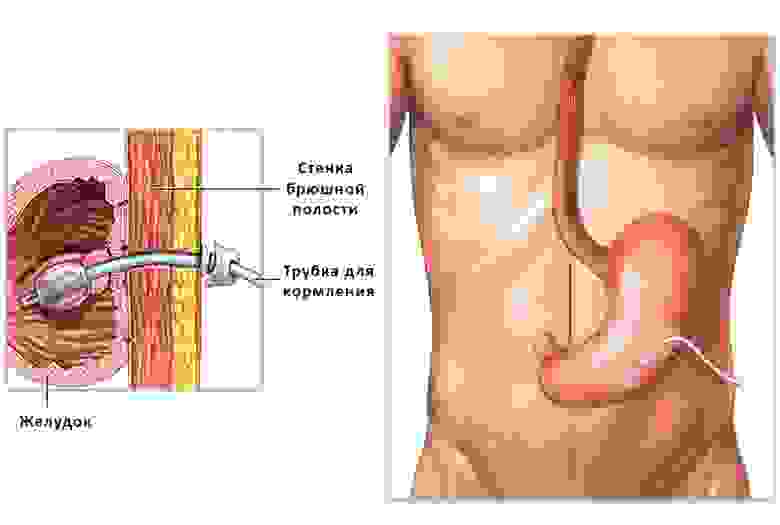
Устройство гастростомы
Колостома и илеостома. Если предыдущее отверстие было предназначено для питания пациента, то это – наоборот. При колостомии на кожу живота выводят отверстие из ободочной кишки, при илеостомии – подвздошной кишки. Через коло- или илеостому в специальный мешок-калоприемник отходят продукты жизнедеятельности.
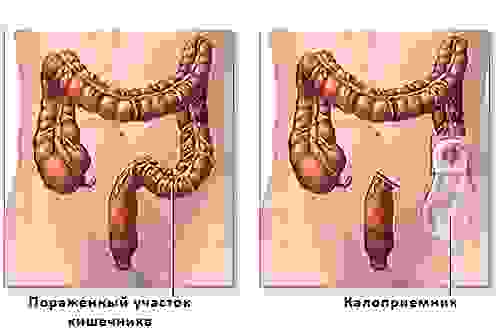
Резекция толстой кишки с выведением колостомы
Обеспечение функции дыхания
Трахеостома. При опухолях гортани, чтобы не допустить удушья, проводят трахеостомию — на кожу выводят отверстие из трахеи, через которое человек может дышать.

Трахеостома и проведение процедуры трахеостомии
Обеспечение мочевыделения
Нефростома – специальная полая трубка, которая выполняет функцию дренирования при нарушениях оттока мочи. Ее устанавливают в почечную лоханку через прокол на коже под контролем УЗИ.
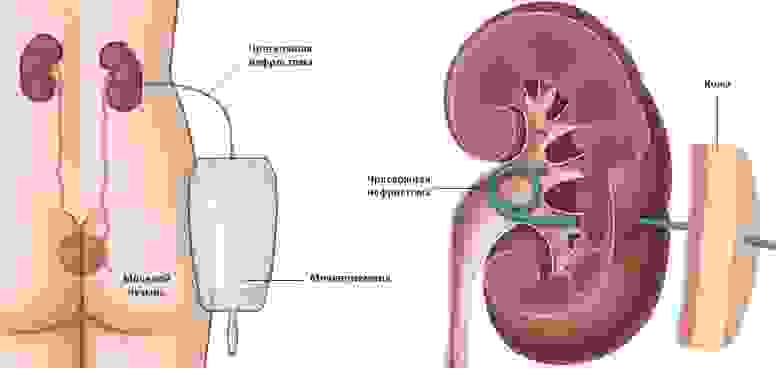
Нефростома
Когда возможно – не режем, а используем эндоскоп
Когда опухоль разрастается и вовлекает какой-либо полый орган (пищевод, желудок, желчный проток, мочеточник, и т.д.), это может приводить к сдавливанию стенок органа, сужению просвета и полной непроходимости.
Зачастую в таких случаях есть возможность установить стент — металлический или полимерный сетчатый цилиндр-расширитель, который автоматически расправляется внутри полости органа и создает каркас, чтобы поддерживать достаточный просвет и проходимость.

Билиарный стент (для желчного протока)
С помощью стентирования у нас получается сохранить физиологические функции многих органов даже на поздних стадиях опухолевого процесса.
Нормальное отведение желчи и лечение механической желтухи. Стентирование желчных протоков восстанавливает беспрепятственный отток желчи из печени в двенадцатиперстную кишку. Во-первых, пациент избавится от опасного состояния: механической желтухи. Она вызывается нарушением оттока желчи, провоцирует повышение уровня билирубина в крови и токсическое действие на ЦНС. Во-вторых, пациенту не придется ходить с выходящими наружу дренажами. В-третьих, естественный ток желчи сохранит нормальную работу кишечника. Так одна малоинвазивная операция делает очень много для сохранения качества жизни.

Стентирование желчного протока с помощью эндоскопа
Обеспечение работы пищевода и возможности самостоятельно питаться. Мы можем стентировать пищевод и желудок в случаях, когда опухоль находится в самом органе, или разрастается, придавливая его снаружи, или сужение просвета стало результатом более ранних вмешательств или иных повреждений (рубцов от химического ожога, например).

Работа стента в пищеводе, сдавленном опухолью
Судите сами: пациента привезли на реанимобиле с механической желтухой и стенозом пищевода, а выписали через 10 дней в состоянии, когда он может самостоятельно принимать пищу через рот и нормально ее переваривать.
Удалить всё и восстановить красоту. Санационные операции и реконструктивные
Когда опухоль не оперировали, и не слишком успешно лечили иными методами, она продолжает расти, а потом начинает распадаться. Эта опухолевая ткань может инфицироваться, вызывать массивные кровотечения, некрозы, оказывать токсическое действие на организм пациента, и сильно ухудшает его состояние.
Чтобы не допустить этого, нужно удалить как можно большее количество инфицированной опухолевой ткани. Такие паллиативные операции в онкологии называются санационными. Их выполняют, например, при раке молочной железы. Необходимость в таких операциях возникает у 30-40% женщин на III-IV стадиях. Также такие операции проводятся при угрозе распада и нагноения опухолей других органов: например, печени, ободочной кишки.
Часто после объемных оперативных вмешательств с полным удалением пораженного органа требуется последующая реконструкция. Например, молочной железы, частей лица или части кишечника, мочевого пузыря – для восстановления жизнедеятельности организма.
Это крайне важно и для психоэмоционального настроя пациента – чтобы он снова чувствовал себя нормальным человеком, с симметричными молочными железами и способностью ходить в туалет без дренажей и мочеприемников. От этого в большой мере зависит, будет ли человек находить радость в жизни и мотивацию для продолжения лечения.
Этой статьей мы хотим, во-первых, напомнить в нынешнее тревожное время, как счастливы те из нас, чей организм не нуждается в поддержке хирургов, чтобы есть или дышать.
А во-вторых, показать: даже в запущенных и тяжелых случаях все еще остается довольно много возможностей помочь онкологическому пациенту, продлить жизнь, убрать или облегчить мучительные симптомы. Даже если по прогнозам, жизни осталось совсем немного – есть очень большая разница в том, как ее прожить. В качестве, а не только в количестве. Паллиативная медицина – и паллиативная хирургия в частности, сегодня могут многое сделать для качества.
Ниже дан краткий обзор радикальных и паллиативных вмешательств при раке ПЖ.
В настоящее время хирургическое лечение остается единственно эффективным методом, однако опухоль можно удалить только на ранних стадиях (до 15% опухолей головки ПЖ), а операционный риск чрезвычайно высок. Радикальную операцию можно выполнить всего лишь у 1 — 5% больных, что обусловлено, в первую очередь, поздней диагностикой.
Выделяют следующие радикальные операции: гастропанкреатодуоденальная резекция, панкреатэктомия, дистальные комбинированные резекции ПЖ, расширенная субтотальная и тотальная панкреатодуоденэктомия. Радикальные операции технически очень сложны, их могут выполнить только высококвалифицированные хирурги в крупных центрах. Летальность после этих операций составляет от 27% при дистальной резекции ПЖ — до 17—39% при расширенной панкреатэктомии, пятилетняя выживаемость не превышает 8%. Последний факт обусловлен, прежде всего, тем, что у 50% больных в послеоперационном периоде возникает рецидив опухоли и в 90—95% случаев на первом году после операции развиваются отдалённые метастазы.
Существует мнение, что панкреатодуоденальную резекцию необходимо выполнять во всех случаях при подозрении на рак ПЖ даже без гистологической или цитологической верификации. Данное мнение отчасти обусловлено тем, что даже при лапаротомии и интраоперационном гистологическом исследовании частота ложноотрицательных ответов превышает 10%.
Перед операцией можно лишь предварительно судить о возможности удаления опухоли. Окончательное решение принимают после интраоперационного осмотра органов брюшной полости при исключении отдалённых метастазов и местной распространённости процесса. Наиболее часто во время операции обнаруживают такую причину нерезектабельности опухоли, как опухолевая инфильтрация забрюшинной клетчатки, включая нервные сплетения и поражение метастазами регионарных лимфатических узлов.
Панкреатодуоденальная резекция — основной тип радикальной операции при расположении опухоли в головке ПЖ. Нельзя её выполнить при прорастании опухолью нижней полой вены, аорты, верхней брыжеечной артерии и воротной вены. Для принятия окончательного решения следует отделить ДПК и головку ПЖ от подлежащих нижней полой вены и аорты, что позволяет судить и о вовлечённости верхней брыжеечной артерии; важна также оценка возможности диссекции воротной вены и верхней брыжеечной вены.
Удалённый при панкреатодуоденальной резекции анатомический препарат состоит из общего желчного протока, жёлчного пузыря, головки, шейки и секреторной части ПЖ, ДПК, проксимальной части тощей кишки, малого и части большого сальника, дистальной половины желудка. Кроме тою, иссечению подлежит паракавальная клетчатка, удаляют супрапилорические, инфрапилорические, передние и задние панкреатодуоденальные лимфатические узлы, лимфатические узлы гепатодуоденальной связки и по ходу общей печёночной артерии. Иссекают верхнюю брыжеечную вену (при изолированном опухолевом её поражении) или место се слияния с воротной веной. Такая лимфодиссекция улучшает прогноз, в то время как травматичность вмешательства увеличивается незначительно.
Простое перечисление удалённых органов свидетельствует о сложнейшей технике вмешательства. Ведь хирургу ещё предстоит выполнить серию восстановительных манипуляций — панкреатоностомию, билиодигестивный анастомоз (см. рис. 5-21), гастроеюностомию и межкишечный анастомоз. Средняя продолжительность операции составляет 6,5—7 ч.
Важны три технических приёма во время выполнения панкреатодуоденальной резекции — объём резекции паракавальной клетчатки и забрюшинной сосудистой диссекции, а также сохранение пилорического отдела желудка.
Особое внимание резекции паракавальной клетчатки уделяют потому, что именно в этой зоне чаще всего возникают рецидивы опухоли. Резекцию сосудов осуществляют при изолированном опухолевом поражении верхней брыжеечной вены или места её соединения с воротной веной. Прорастание верхней брыжеечной артерии чаще всего сопровождается обширным метастазированием в забрюшинные лимфатические узлы, что исключает возможность удаления опухоли.
Существуют мнения, что необходимо удалять узлы чревного сплетения, что позволяет существенно уменьшить выраженность болевого абдоминального синдрома в послеоперационном периоде, особенно в поздние сроки, когда заболевание прогрессирует.
Сохранение пилородуоденального сегмента при панкреатодуоденальной резекции улучшает пищеварительные функции и способствует более быстрому восстановлению массы тела больных.
Важно выявить зону первичного расположения опухоли в ПЖ, в первую очередь для исключения периампуллярных и ампулярных аденокарционом, имеющих значительно лучший прогноз.
Результаты стандартной панкреатодуоденальной резекции во многих больницах неудовлетворительные.
Послеоперационная летальность состав.ляет 12,3%, 1 год проживает 43,1% больных, средняя выживаемость больных составляет 15,5 мес, пятилетняя выживаемость не превышает 3,5—16.7%.
Неудовлетворительные отдалённые результаты, высокая послеоперационная смертность и техническая сложность панкреатодуоденальной резекции послужили основанием для отказа от радикальных вмешательств при раке ПЖ. Однако следует помнить, что репрезентативность результатов сравнительных исследований, проводимых в разных странах, может быть неодинаковой ввиду различий в диагностических критериях и подходах к стадированию рака ПЖ. В частности, в Японии применяют собственную классификацию опухолей ПЖ, отличающуюся от применяемых в США и Европе.
Выживают после гастропанкреатодуоденальной резекции лишь те больные, у которых по данным гистологического исследования послеоперационного материала по краям резекции нет опухолевых клеток. Напротив, в случаях их обнаружения больные живут приблизительно столько же, сколько больные после химиолучевого лечения.
При подтверждённом раке ПЖ выполняют ещё более объёмные операции — тотальную панкреатэктомию и расширенную панкреато-дуоденалъную резекцию. Необходимость в панкреатэктомии обусловлена важностью удаления мультифокальных очагов рака в ПЖ и более радикальным иссечением регионарных лимфоузлов (лимфатических узлов корня селезёнки, вокруг хвоста ПЖ). Несмотря на расширенный объём операции, показатели послеоперационной летальности сократились, однако отдалённые результаты от расширения объёма операции не улучшились, преимущественно за счёт развития тяжёлого сахарного диабета.
Расширенная панкреатодуоденальная резекция предусматривает удаление сегмента воротной вены и вовлечённых в опухолевый процесс артерий с реконструкцией сосудов. Кроме того, удаляют забрюшинные лимфатические узлы от чревной артерии до бифуркации подвздошных артерий. Разработчик техники этой операции Фортнер добился уровня отдалённой выживаемости 20% при послеоперационной летальности 23%.
При нерезектабельной опухоли, наличии или угрозе возникновения желтухи, гастродуоденальной непроходимости, если предполагаемая продолжительность жизни больного составляет более 6—7 мес, производят паллиативные вмешательства, в частности наложение билиодигестивного и гастроеюнального шунта (см. рис. 5-22).
При предполагаемой продолжительности жизни 1-2 мес показано эндоскопическое введение стента в жёлчные протоки. Установка эндопротеза вместо хирургического шунтирования (холедоходуоденостомии и гастроэнтеростомии) подходит больным с тяжёлыми сопутствующими заболеваниями и липам старческого возраста. Она позволяет уменьшить число осложнений и смертность. Использование новых стентов из металлической сетки даст возможность увеличить продолжительность их нахождения в протоках и снизить частоту возникновения холангита. Рецидивирование желтухи после установления стента чаще всего связано с его обтурацией вследствие сладжа жёлчи; в этом случае проводят замену стента.
Предоперационное дренирование жёлчных протоков с целью уменьшения холестаза не приводит к увеличению продолжительности жизни больных. Недавно описана методика дренирующих малоинвазивных операций с целью декомпрессии жёлчевыводяших путей с помощью ЭУС, позволяющей более точно произвести стентирование.
Пример паллиативной операции — введение спирта (50 мл) или фенола в зону чревного сплетения дая купирования болевого абдоминального синдрома. Такой подход позволяет уменьшить боли или даже купировать их на короткое время, однако у 2/3 пациентов болевой синдром рецидивирует в течение месяца. Блокаду чревного сплетения можно выполнять повторно, однако эффективность следующих процедур более низкая. Тем не менее блокада чревного сплетения более эффективна, чем применение наркотических анальгетиков в сроки до 6 нед.
Появление методики нейролизиса чревного сплетения с использованием ЭУС повысило эффективность вмешательства ввиду большой точности определения зоны введения спирта. Боль проходит у 52% пациентов, а у 30% удаётся уменьшить суточные дозы наркотических анальгетиков.
Существуют указания об эффективности торакоскопической сплапхнэктомии в лечении болевого абдоминального синдрома. Для улучшения результатов хирургического лечения его дополняют химио-и лучевой терапией. Применяют эти методы не только после операции, но и интраоперапионно (введение в воротную вену или печёночную артерию фторурацила, митомицина). Возможны различные схемы комбинации лучевой, химиотерапии и хирургического лечения, введение препаратов в ткань опухоли под контролем ЭУС.
В последние годы всё чаще применяют трансплантацию ПЖ, селективную трансплантацию островковых и ацинарных клеток, что позволяет существенно улучшить качество жизни больных после панкреатэктомии по поводу ранних стадий негенерализованного рака ПЖ.
Читайте также:

