Несеминомная герминогенная опухоль 4 стадии что это такое
Герминогенные опухоли, что это такое?
Большая часть герминогенных опухолей возникает внутри гонад. Внегонадные опухоли встречаются значительно реже, это опухоли забрюшинного пространства, переднего средостения и центральной нервной системы.
Развитие герминогенных опухолей связано с аномалиями миграции зародышевых клеток в процессе развития эмбриона.
Большая часть этих опухолей диагностируется в пределах относительно узкого возрастного интервала: 25 — 35 лет.
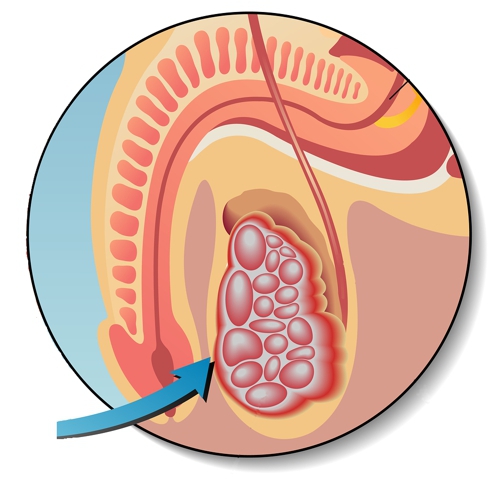
Герминогенные опухоли относятся к достаточно редким заболеваниям и составляют около 1% от всех злокачественных опухолей у мужчин. Более 90% герминогенных опухолей у мужчин представлены новообразованиями яичка, т.е. могут быть отнесены к опухолям наружной локализации, доступным осмотру и пальпации.
На момент постановки диагноза большинство пациентов имеют распространенный процесс (IIC – III ст.): до 60% больных.
Классификация Всемирной Организации Здравоохранения (ВОЗ) подразделяет герминогенные опухоли на 3 категории:
- новообразования новорождённых и раннего детского возраста. К ним относят тератомы и опухоли желточного мешка. Они могут располагаться в яичках, яичниках, забрюшинном пространстве, средостении, головном мозге.
- новообразования яичка, которые возникают между 15 и 40 годами, и подразделяются на семиномы и несеминомы.
- сперматоцитные семиномы (пациенты старше 50 лет). В отличие от опухолей 1 и 2 типов, источником новообразования являются не эмбриональные зародышевые клетки, а более зрелые – сперматогонии и сперматоциты.
Вероятность возникновения герминогенных опухолей яичек увеличивается при крипторхизме (неопущении яичка в мошонку), травмах, инфекционных заболеваниях.
В группе риска находятся пациенты с различными генетическими заболеваниями.
Виды герминогенных опухолей
В зависимости от морфологической картины, клинического течения герминогенные опухоли делятся на семиномные и несеминомные опухоли. Семиномные опухоли составляют около 40%, несеминомные – 60%. Тактика лечения и прогноз различны в двух этих группах.
Семиномы характеризуются довольно вялым течением, долгое время человек не ощущает никаких симптомов болезни. Эти опухоли хорошо поддаются лечению: они чувствительны к лучевой терапии и особенно к химиотерапии.
При запущенном процессе наблюдается, как правило, лимфогенное метастазирование в забрюшинные лимфоузлы, реже в средостенные и надключичные лимфоузлы.
К данным опухолям относят следующие морфологические подтипы:
- внутрипротоковая герминогенная неоплазия неклассифицированного типа (carcinoma in situ); семинома с клетками синцитиотрофобласта;
- сперматоцитарная семинома;
- сперматоцитарная семинома с саркомой;
- эмбриональный рак;
- опухоль желточного мешка;
- трофобластические опухоли:
- хориокарцинома;
- монофазная хориокарцинома;
- трофобластическая опухоль места крепления плаценты;
- тератома:
- дермоидная киста;
- монодермальная тератома;
- тератома с соматической малигнизацией;
- смешанные опухоли.
Микропрепарат, тератома яичника
Симптомы и первые признаки герминогенных опухолей
Опухоли яичка в ранних стадиях не сопровождаются болями или другими неприятными симптомами, в связи с чем долгое время не возникает стимулов для обращения к врачу.
Чаще всего пациенты приходят с жалобами на увеличение яичка, боль в мошонке, увеличение лимфоузлов. При распространенности процесса появляются симптомы интоксикации, например, слабость, снижение веса, отсутствие аппетита.
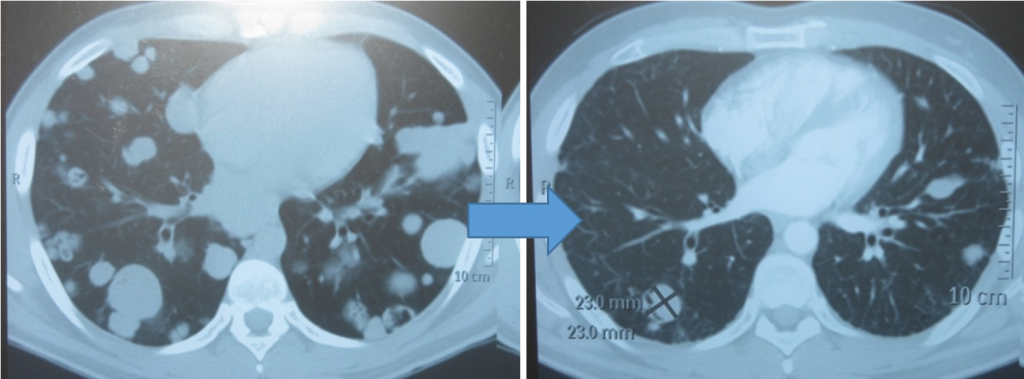
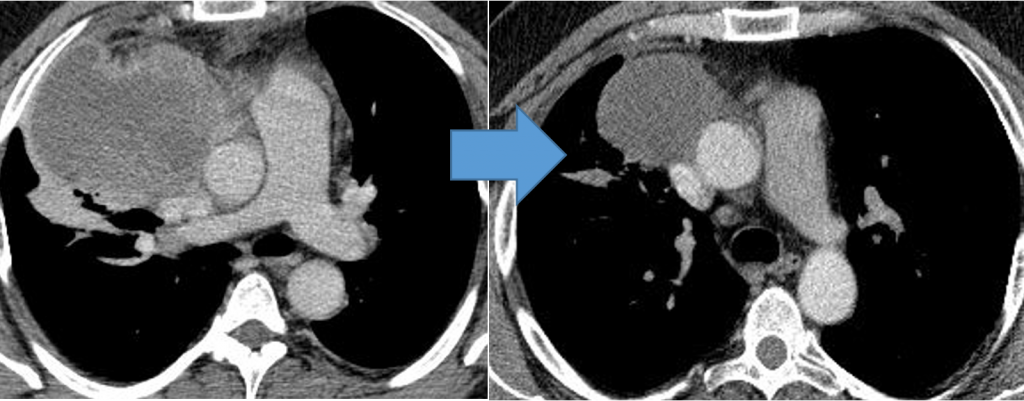
Когда опухоль располагается в средостении, особенности при ее больших размерах, пациента будут беспокоить жалобы на кашель, одышку, боли в груди, невозможность выполнять без усилия привычную физическую активность, возможна отечность шеи, синюшность кожных покровов.
Могут возникать шум в голове/ушах, ухудшение зрения, головная боль, сонливость. Это объясняется тем, что растущая опухоль давит на верхнюю полую вену.
Опухоли забрюшинного пространства обычно также не дают о себе знать длительное время. На них могут указывать такие симптомы, как нарушение стула и мочеиспускания, боли в животе, варикозное расширение вен, а также отеки.
Герминогенные опухоли центральной нервной системы (головного мозга) имеют следующие клинические проявления: головная боль, расстройство движений глазных яблок, тошнота, рвота и развитие судорог.
Диагностика герминогенных опухолей
Стандартом диагностики герминогенных опухолей является физикальный осмотр пациента, сбор анамнеза и анализ крови на биологические опухолевые маркеры. К ним относятся АФП (альфа-фетопротеин), β -ХГЧ (β единица хорионического гонадотропина человека) и ЛДГ (лактатдегидрогеназа).
В качестве уточняющих исследований проводится КТ органов брюшной полости и грудной клетки, либо УЗИ органов брюшной полости и рентгенография грудной клетки в двух проекциях.
Также выполняют МРТ головного мозга, чтобы выявить наличие метастазов в нем.
Орхофуникулэктомия — удаление яичка, выполняется с диагностической и лечебной целью.
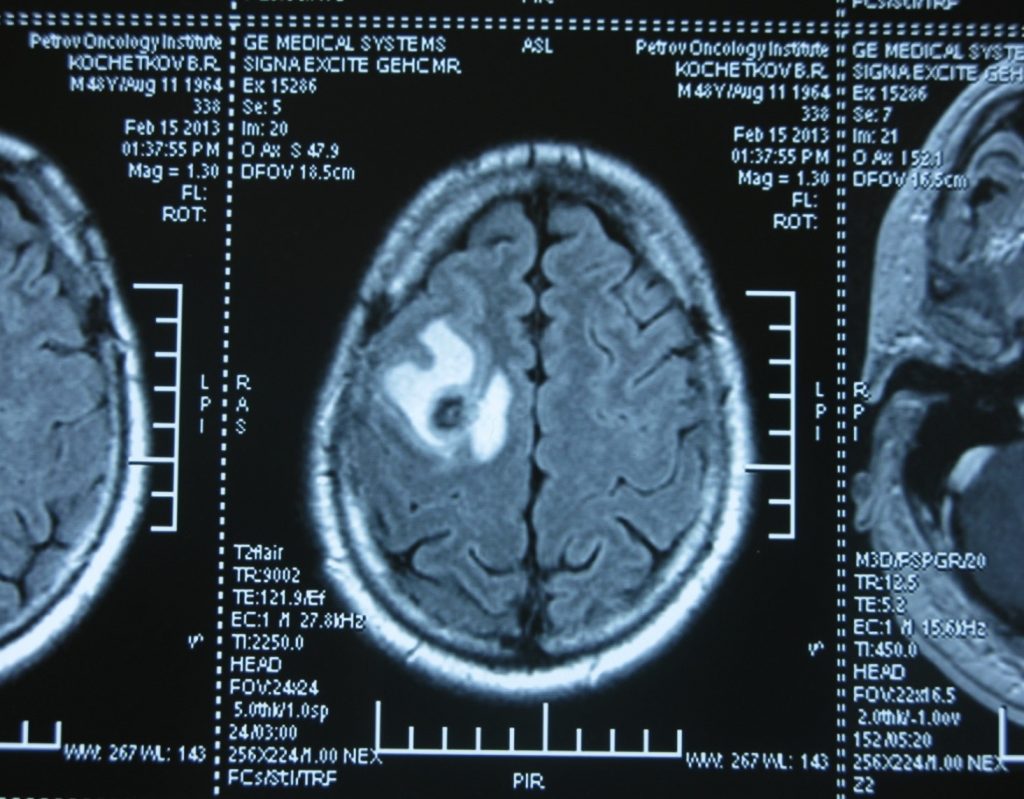
Метастаз в головной мозг при герминогенных опухолях (МРТ головного мозга)
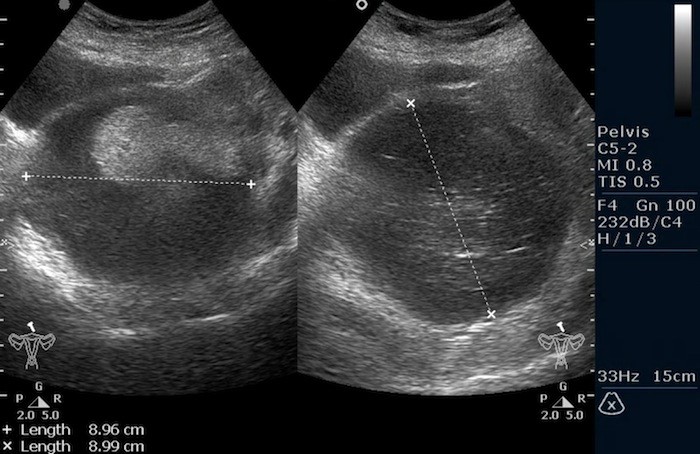
Тератома яичника (УЗИ малого таза)
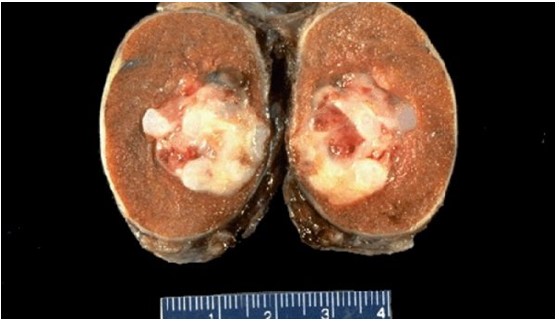
Герминогенная опухоль яичка (макропрепарат)
Стадии герминогенных опухолей
Для выработки индивидуального плана лечения учитываются классификации TNM, а также классификация метастатических герминогенных опухолей Международной объединенной группы по герминогенным опухолям (IGCCCG).
Стадирование герминогенных опухолей в соответствии с классификацией ТNМ
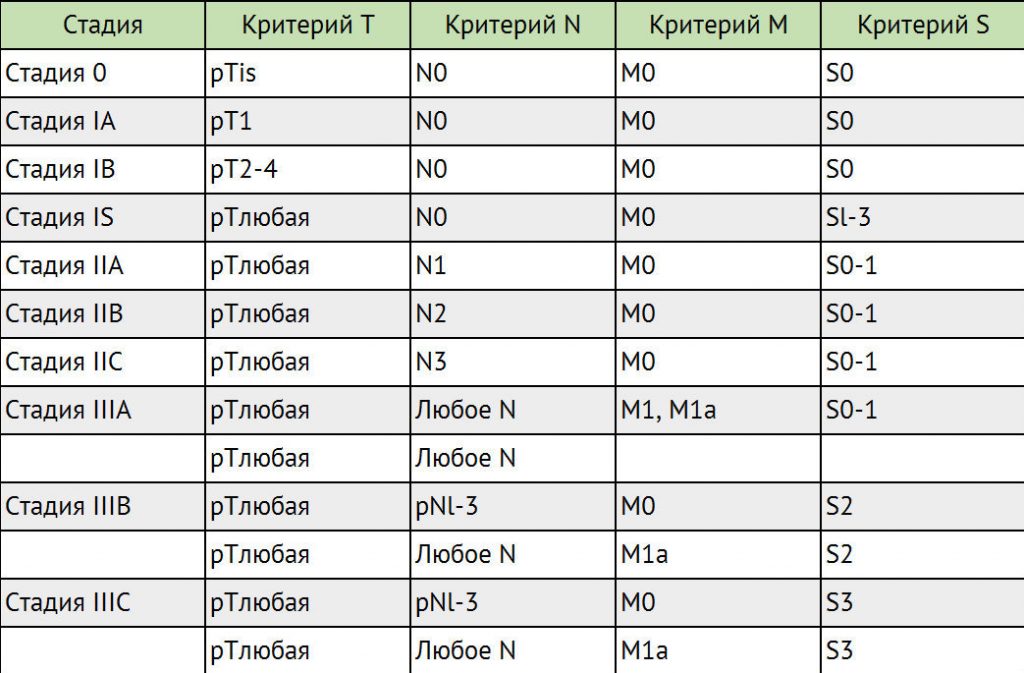
Для герминогенных опухолей IV стадия заболевания не предусмотрена.
Методы лечения герминогенных опухолей
К настоящему времени в онкологической практике накоплен большой научно-практический материал, разработаны стандарты и международные рекомендации по лечебной тактике больных герминогенными опухолями.
При герминогенных опухолях проводится, как правило, комплексное лечение, которое включает в себя хирургическое лечение, системное противоопухолевое лечение, реже лучевую терапию.
Метод лечения основывается на морфологическом типе опухоли, группе прогноза и стадии заболевания.
Большинство больных герминогеными опухолями добиваются излечения даже при распространенной форме заболевания, когда процесс не ограничен только первичной опухолью. Наиболее эффективная схема лечения – это химиотерапия с последующим удалением остаточных опухолевых очагов.
Хирургические методы:
- орхфуникулэктомия
- забрюшинная лимфаденэктомия,
- удаление легочных метастазов и пр.
Лучевая терапия назначается чаще при поражении головного мозга. Ее применение обусловлено возможностью точного локального воздействия на опухолевые массы.
Химиотерапия
Следует отметить, что при проведении системного лекарственного лечения необходимо строгое соблюдение временных рамок (начало очередного цикла проводится на 22 день).
Для оценки эффективности химиотерапии каждые 2 цикла и после ее окончания проводится компьютерная томография исходных зон поражения, перед каждым циклом мониторинг уровня опухолевых маркеров. Рост маркеров на фоне лечения или после его завершения, а также замедление их снижения свидетельствует об активности опухолевого процесса и необходимости проведения второй линии химиотерапии.
Перед проведением химиотерапии рекомендуется обдумать и решить вопрос о необходимости криоконсервации спермы.
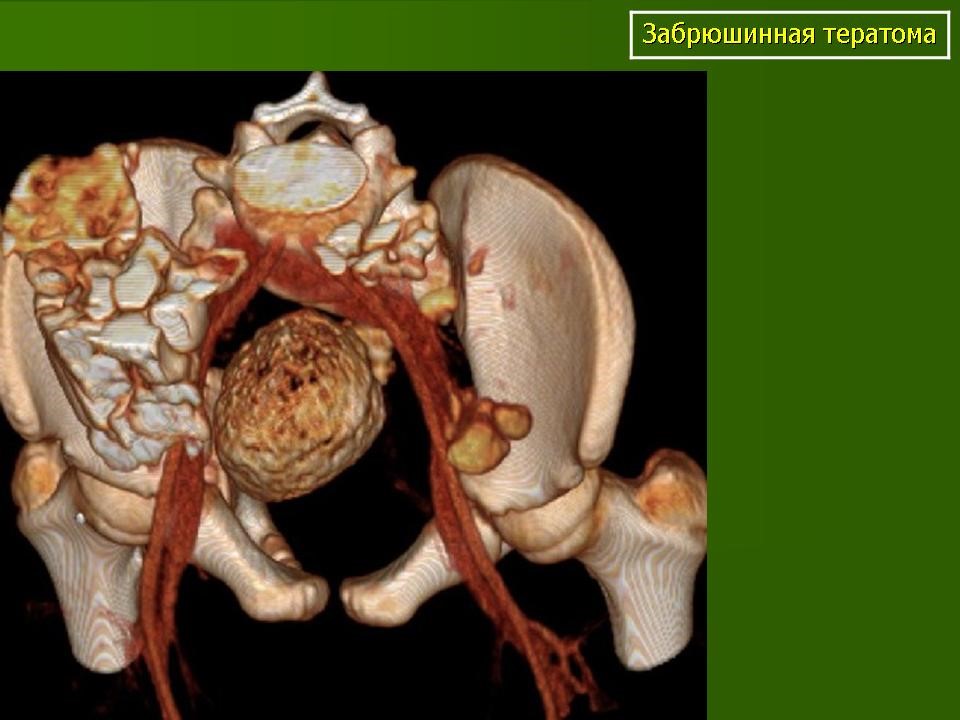
Забрюшинная тератома (3D реконструкция)
Контроль эффективности лечения и динамическое наблюдение.
Перед началом каждого цикла химиотерапии проводится контроль онкомаркеров (АФП, ЛДГ, ХГЧ).
Обязательный принцип динамического наблюдения за больными герминогенными опухолями — строгое соблюдение временных промежутков при выполнении контрольного обследования. Первый год после лечения необходимо проходить обследование каждые два месяца, а на второй год – раз в три месяца.
Следующие два года нужно обследоваться сначала каждые четыре месяца, затем каждые шесть месяцев. И далее планируется ежегодный поход к врачу.
Перечень обследований рекомендованных к выполнению в период динамического наблюдения: физикальный осмотр, кровь на маркеры (АФП, ЛДГ, ХГЧ), УЗИ пахово-подвздошных областей, брюшной полости и забрюшинного пространства, рентгенография органов грудной клетки каждые 6 месяцев.
Прогноз выживаемости
Благодаря успехам в развитии химиотерапии, герминогенные опухоли стали ярким примером курабельных солидных опухолей. Пятилетняя выживаемость больных герминогенными опухолями составляет от 60 до 90%.
Классификация метастатических герминогенных опухолей Международной объединенной группы по герминогенным опухолям (IGCCCG), основанная на прогностических факторах
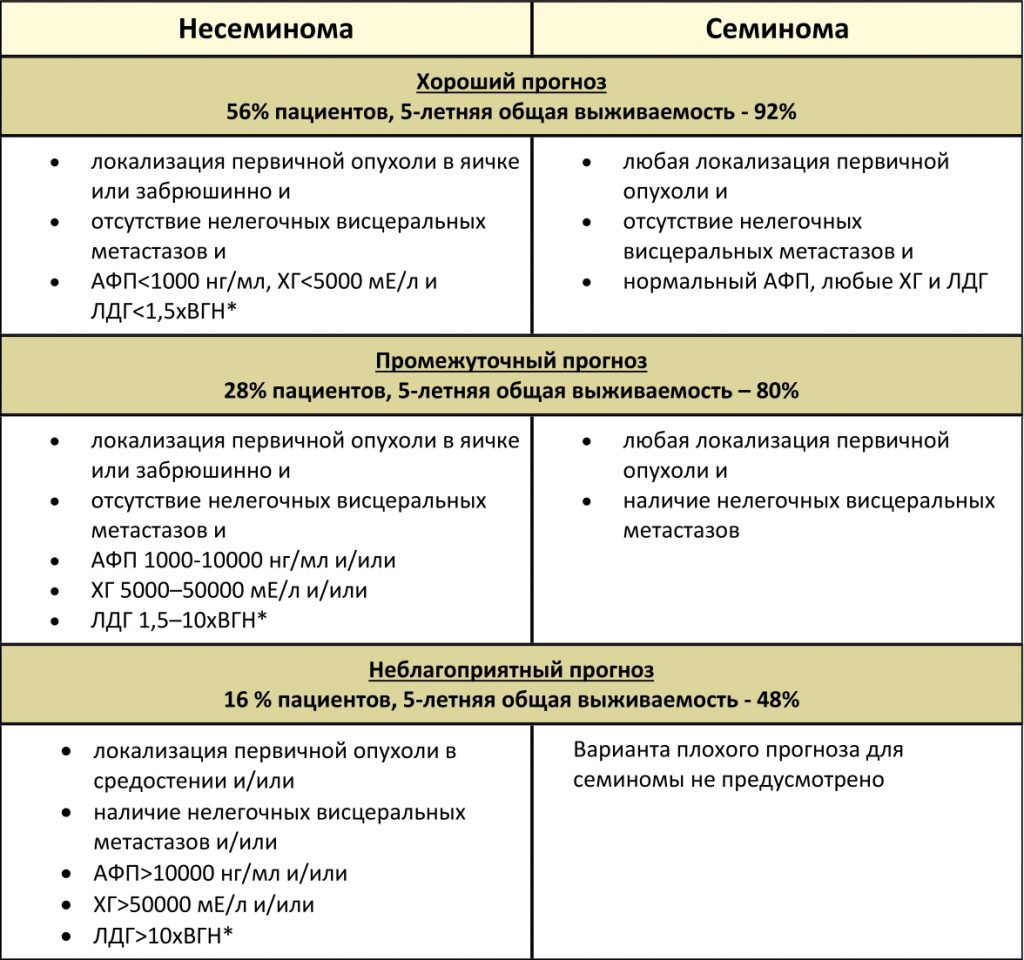
*ВГН – верхняя граница нормы.

Заболеваемость
Заболеваемость опухолями яичка в Европе удваивается каждые 20 лет. В среднем заболеваемость раком яичка в Европе составляет 6,3 на 100 тыс. чел. мужского населения, достигая наивысших показателей в странах севера Европы – 6,8 на 100 тыс. чел. При этом смертность остается крайне низкой ― 0,38/100 тыс. мужчин.
Около 60% герминогенных опухолей являются несеминомными или смешанной гистологии, 40% ― семиномы. Инвазивный рак яичка развивается из внутриканальцевой неоплазии (TIN), которая часто обнаруживается в окружающей опухоль здоровой паренхиме яичка. При выполнении биопсии контралатерального яичка у 2―5% пациентов в нем также обнаруживается TIN, что согласуется с развитием билатеральных опухолей у 2-3% больных.
Диагностика
Диагноз устанавливается на основании гистологического исследования яичка после выполнения орхофуникулэктомии или резекции яичка [IV,В].
У пациентов с клинической картиной внегонадной герминогенной опухоли диагноз устанавливается на основании биопсии или высокого уровня альфа-фетопротеина (АФП) или бета-хорионического гонадотропина (бета-ХГ).
Пациентам с обширным метастатическим поражением легких или других органов по жизненным показаниям показано немедленное начало химиотерапии. Диагноз в этих случаях может быть установлен без выполнения биопсии на основании сочетания типичной клинической картины и повышенных уровнях АФП или бета-ХГ [IV,B].
Стадирование и оценка прогноза
У всех пациентов исследуются опухолевые маркеры (АФП, бета-ХГ, ЛДГ) перед и через 7-10 дней после орхофуникулэктомии, КТ органов грудной клетки, брюшной полости, малого таза. Ультразвуковое исследование обоих яичек выполняется с использованием датчика 7,5 МГц [III,В].
Необходимо выполнение МРТ головного мозга у больных с плохим прогнозом по IGCCCG или при клинических симптомах [IV,B].
Сцинтиграфия костей скелета выполняется при наличии клинических симптомов [IV,B].
ПЭТ не дает дополнительной информации, и рутинное применение не рекомендуется [I,B].
Если пациент планирует в дальнейшем отцовство, то рекомендуется до начала химиотерапии определить уровни тестостерона, фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), выполнить спермограмму и заморозку спермы.
Если по данным КТ выявляются подозрительные на метастазы забрюшинные лимфоузлы (до 1см), то КТ следует повторить через 6 недель для принятия решения о дальнейшей тактике лечения.
В случае если у пациента по данным обследования нет метастазов, но имеются повышенные уровни опухолевых маркеров, то необходимо мониторировать их уровень до нормализации. Прекращение снижения уровня маркеров свидетельствует о диссеминации процесса.
Обязательна уже на раннем этапе консультация химиотерапевта.
Возможно выполнение биопсии здорового контралатерального яичка, особенно при его атрофии (объем 10000 нг/мл или b-ХГ >50000 МЕ/л или
*ВГН ― верхняя граница нормы
Лечение первичной опухоли
Стандартом лечения первичной опухоли является орхофуникулэктомия. Органосохранное лечение возможно только в особых случаях (единственное яичко) и в опытных центрах [II, B]. Орхофуникулэктомию необходимо выполнить до начала другой терапии. Лишь при тяжелом состоянии больного, обусловленном распространенностью заболевания, показано немедленное начало химиотерапии. Орхофуникулэктомия выполняется позже при улучшении общего состояния больного.
В случае если маркеры повышены после орхофуникулэктомии необходимо повторно определить их уровень через 7 дней для расчета их скорости снижения. Необходим последующий мониторинг их уровней каждые 7-14 дней до нормализации или прекращения падения.
Орхофуникулэктомия
Орхофуникулэктомия выполняется через паховый доступ [II,A]. Крайне важно избегать повреждения кожи мошонки (при выполнении биопсии или удалении яичка). Пораженное опухолью яичко удаляется с семенным канатиком на уровне внутреннего кольца пахового канала. В сомнительных случаях (маленькая опухоль) рекомендовано интраоперационное срочное гистологическое исследование, особенно при решении вопроса об органосохранном лечении.
Органсохранное лечение/резекция яичка
В некоторых случаях вместо орхофуникулэктомии возможно выполнение резекции яичка. Такие вмешательства должны выполняться только в опытных учреждениях. Показанием к резекции яичка могут являться: синхронные билатеральные опухоли яичка, метахронная контралатеральная опухоль яичка, опухоль единственного яичка (при условии его достаточной гормональной активности), атрофии контралатерального яичка. Следует помнить, что после резекции яичка в оставшейся ткани яичка всегда имеется внутрипротоковая карцинома, требующая проведения лучевой терапии. Если больной планирует отцовство, ее можно отложить, но на максимально короткий срок.
Диагностика и лечение внутрипротоковой карциномы (ВПК)
У больных с внегонадной герминогенной забрюшинной опухолью ВПК обнаруживается в 34%, но после проведенной химиотерапии ― лишь в 10%. При отсутствии специфического лечения у 70% больных с ВПК в течение 7 лет разовьется инвазивная опухоль яичка. Поэтому больные должны быть информированы о потенциальном риске обнаружения ВПК и им необходимо предложить биопсию контралатерального яичка. Учитывая, что длительная выживаемость этих больных близка к 100% вне зависимости от выбранного лечения, пациенту необходимо самому дать возможность принять решение, выполнять ли биопсию здорового яичка или ограничиться клиническим наблюдением. В случае если больной уже получил химиотерапию, биопсию не имеет смысла выполнять в течение первых 2 лет после ее окончания.
Существуют три основные лечебные опции ― орхофуникулэктомия, лучевая терапия и наблюдение ― которые должны быть обсуждены с каждым пациентом. Орхофуникулэктомия и лучевая терапия позволяют окончательно вылечить ВПК, но ценой потери фертильности. Так как интервал между обнаружением ВПК и развитием опухоли яичка обычно долгий, для больных, желающих авести детей, можно предложить наблюдение. При этом необходимо регулярно выполнять УЗИ яичка.
Лучевая терапия в дозе 20Гр (по 2Гр, 5 фракций в неделю) способна уничтожить все фокусы ВПК. С целью сохранения продукции тестостерона исследовалась возможность снижения суммарной дозы до 98% рецидивов будут относиться к хорошему прогнозу и будут вылечены химиотерапией. Роль нервосберегающей забрюшинной лимфаденэктомии (НЗ ЗЛАЭ) • Для тех немногих больных, нежелающих подвергаться адъювантной химиотерапии или наблюдению, можно предложить НС-ЗЛАЭ. Данный подход является наименее эффективным и наиболее травматичным. Следует помнить, что около 50% пациентов напрасно подвергнутся операции и связанным с нею побочным эффектам, в частности, с 6-8%-ным риском развития ретроградной эякуляции. Прогрессирование заболевания после НС-ЗЛАЭ наблюдается у
10% больных, в основном, за счет развития метастазов в легких.
Лечение больных с распространенными стадиями несеминомной опухоли яичка (IS, IIB/C, III стадии)
Очередной курс химиотерапии должен начинаться на 22-й день без редукций доз не зависимо от уровня нейтрофилов. Отложить его начало можно при сохраняющейся инфекции, или тромбоцитопении 10% злокачественных клеток возможно проведение консолидирующей химиотерапии (2 курса индукционной или альтернативной химиотерапии ― 2 ЕР или 2 VIP соответственно).
Мониторинг эффективности
Необходимо определять опухолевые маркеры перед каждым курсом химиотерапии. Через 4 недели после завершения последнего курса химиотерапии определяются опухолевые маркеры и КТ пораженных ранее областей для решения вопроса о необходимости хирургического лечения. ПЭТ остается экспериментальным подходом и не должны применяться вне клинических исследований.
Лечение рецидивов заболевания
Рецидивы заболевания, развившиеся в сроки свыше 3 месяцев после завершения химиотерапии, в большинстве случаев остаются платино-чувствительными, поэтому цисплатин остается основой режимов второй и третьей линий химиотерапии.
При рецидиве заболевания после первой линии химиотерапии показано проведение 4 курсов по программе PEI (VIP), VeIP (винбластин, цисплатин, ифосфамид) или TIP. Режим TIP представляется перспективным, так как паклитаксел показал активность как в монотерапии, так и в комбинации с ифосфамидом и цисплатином. Химиотерапия рецидива в стандартных дозах излечивает 15-40% пациентов в зависимости от факторов риска. Ни один из режимов не показал своего явного преимущества над другим.
Высокодозная химиотерапия не улучшает результаты лечения пациентов во II и III линиях терапии. Поэтому все пациенты с рецидивами должны включаться в текущие многоцентровые исследования и получать терапию в специализированных центрах. В качестве третьей линии химиотерапии возможно применение следующих режимов химиотерапии: паклитаксел-гемцитабин, гемцитабин- оксалиплатин или паклитаксел-гемцитабин-цисплатин, желательно в рамках клинических исследований.
В случае нормализации или значительного снижения опухолевых маркеров после химиотерапии показано хирургическое удаление резидуальной опухоли.
Поздние рецидивы (не менее 2 лет после окончания первой линии терапии)
При технической возможности пациенты с поздним рецидивом и отрицательными опухолевыми маркерами должны подвергаться оперативному лечению с целью радикального удаления зрелой тератомы или вторичной негерминогенной опухоли. Так как чувствительность поздних рецидивов к химиотерапии мала, при небольших и резектабельных очагах даже в случае повышенных маркеров показано выполнение операции.
Если же выполнение радикального вмешательства невозможно, выполняется биопсия, по результатам которой начинается химиотерапии рецидива. При ответе опухоли на химиотерапию всегда должен быть рассмотрен вопрос о повторной циторедуктивной операции.
Отсроченная токсичность
У больных имеется 3% риск развития опухоли контралатерального яичка в течение ближайших 15 лет (если больной не получал лучевую терапию на яичко или химиотерапию). У больных имеет место повышение риска развития ряда вторичных опухолей, включающих острый лейкоз, рак желудка, легкого и саркомы, особенно в ранее облученных областях. Отсроченная токсичность химиотерапии также включает в себя болезни сердечнососудистой системы, метаболический синдром (гиперхолестеринемия, артериальная гипертензия и сахарный диабет), гипогонадизм, нейротоксичность, синдром Рейно и ототоксичность.
Наблюдение за больными
Рецидивы заболевания чаще всего диагностируются на основании повышения уровня опухолевых маркеров. Поэтому оправданно уменьшение частоты выполнения КТ с 5 до 3-х в течение первых двух лет [I,B] (определенно изучено лишь при I стадии).
Все остальные рекомендации в отсутствие проспективных данных, основаны на клиническом опыте. Наблюдение в сроки свыше 5 лет важно для выявления поздней токсичности или вторичной опухоли.
Майкл Хартманн и Тобиас Поттек
Chefartz Urologische Abteilung Bundeswehrkankenhaus Hamburg, Germany
1) узлы свыше 2 см, но не более 5см;
2) свыше 5 пораженных лимфоузлов (не один из них не должен превышать 5см);
3) первичная забрюшинная внегонадная локализация опухоли.
При отсутствии других (внезабрюшинных) метастазов N1/pN1 относится к стадии IIA, а N2/pN2 — к стадии IIB. Дополнительно к этому, в классификации TNM 5-й редакции первое время также учитывался уровень a-фетопротеина (АФП), человеческого хорионического b-гонадотропина (ХГ) и лактатдегидрогеназы (ЛДГ).
На момент диагностики большинство больных несеминомными опухолями яичка относятся к I стадии. В нашем госпитале только около трети первичных пациентов имеют II стадию. Так, из 201 первичных пациентов за период с 1993 по 1998 гг. 12% относились к стадии IIA и 18% к стадии IIB (рис.1).
Зачастую небольшие забрюшинные узлы обнаруживаются только при компьютерной томографии (КТ). Большое значение здесь имеет использование перорального или внутривенного контрастирования для более четкого отграничения лимфоузлов от сосудов и кишечника. Тем не менее, при этом остается высокой частота как ложноположительных, так и ложноотрицательных результатов, достигающая 25%. Позитронно-эмиссионная КТ является более точным методом диагностики метастатических лимфоузлов. Ее эффективность в настоящее время оценивается в различных исследованиях. Однако это метод диагностики обладает высокой точностью при размерах лимфоузлов не менее 2 см (4). Определение АФП, ХГ и ЛДГ также только частично пригодно для правильного определения стадии заболевания. В классификации UICC учитывается наименьший уровень маркера после операции. Учитывая относительно длительный период полужизни АФП, снижение его до нормальных цифр при изначально высоком уровне может занять несколько недель. В связи с этим, предлагаются различные методы расчета периода полужизни маркеров, позволяющие за короткий временной интервал определить их скорость снижения (5,6).
В лечении больных II стадии несеминомных опухолей яичка возможно 2 различных подхода, дающих одинаковые шансы на излечение (7):
1. Первичная забрюшинная лимфаденэктомия (ЗЛАЭ) в сочетании или без адъювантной химиотерапии.
Во время операции полностью удаляют лимфоузлы, стараясь при этом сохранить симпатические нервы с обеих сторон (8). В последующем проводятся 2 цикла адъювантной химиотерапии (ХТ) по программе ВЕР. Без применения адъювантной ХТ возрастает частота рецидивов, однако, пациенты избегают токсичности, обусловленной ею.
2. Первичная химиотерапия в сочетании или без последующего удаления остаточной опухоли.
Проводятся 3 цикла цисплатин-содержащей ХТ, стандартом которой является ВЕР. Резидуальная опухоль размерами более 1 см после ХТ подлежит хирургическому удалению. При этом отмечается некоторое увеличение послеоперационной летальности.
Первичная ЗЛАЭ с последующей адъювантной химиотерапией.
Преимущества. Возможность точного стадирования процесса является основным преимуществом операции. Даже при использовании аппаратов КТ 4-го поколения частота ложноположительных находок колеблется от 17 до 23% (12,13,14). Большая часть этих больных не нуждается в получении дополнительной ХТ. При гистологически верифицированной I стадии частота рецидивов отмечается только в 7-12% случаев в первые 2 года с локализацией за пределами забрюшинного пространства в подавляющем большинстве случаев (15,16,17,18). При добавлении 3 курсов ХТ почти 100% этих больных излечиваются. У больных с гистологически верифицированными N1 и N2 лимфоузлами, получивших затем 2 курса адъювантной ХТ ВЕР, опасность рецидива составляет менее 3% (19,20,21). По этой причине динамическое наблюдение за ними может быть ограничено применением УЗИ и контролем маркеров.
Недостатки. Послеоперационная летальность зависит от подхода и техники операции. Baniel показал, что частота осложнений напрямую связана с опытом оперирующего хирурга. За период с 1982 по 1986 гг. у 33 (20,1%) из 164 пациентов, оперированных в госпитале Индианы, отмечались различные осложнения, тогда как за период с 1987 по 1992 гг. их число снизилось до 21 (6,6%) случая среди 314 пациентов. В большинстве случаев это были инфекционные осложнения со стороны раны и развитие послеоперационных ателектазов, что удлиняло продолжительность госпитализации, но не влияло в целом на эффект терапии у этих больных. Не было ни одного смертельного исхода, связанного с операцией (22). Потеря способности к эякуляции у больных IIA и IIB стадиями отмечается некоторыми исследователями даже при выполнении нервосохраняющих операций. Однако, хирургам еще необходимо некоторое время для освоения техники такой операции, так как результат в значительной степени зависит от их опыта.
Около 50% больных IIA и IIB стадии могут быть вылечены с помощью только одного хирургического подхода, не подвергаясь токсическому воздействию адъювантной ХТ, которое проявляется в виде возможного угнетения костномозгового кроветворения, периферической нейропатии, поражения легких и почек.
1. Illiger HJ: Therapie von Hodentumoren. Welche Stadieneinteilung sollte benutzt werden? In: Schmoll HJ, WeiЯbach L. (Hrsg.)(1988): Diagnostik und Therapie von Hodentumoren. Springer, Berlin, Heidelberg, New York, London, Paris, Tokio: 3-7
2. Cavalli F, Monfardini S, Pizzocaro G: Report on the International Workshop on Staging and Treatment of Testicular Cancer. Europ J Cancer (1980) 16: 1367-1372
3. TNM Classification of Malignant Tumours, Fifth Edition, J. Wiley & Sons, New York, 1997
4. Muller-Mattheis V; Reinhardt M; Gerharz CD; Furst G; Vosberg H; Muller-Gartner HW; Ackermann R: Positron emission tomography with [18 F]-2-fluoro-2-deoxy-D-glucose (18FDG-PET) in diagnosis of retroperitoneal lymph node metastases of testicular tumors. Urologe A (1998); 37(6):609-20
5. See WA, Cohen MB, Hoxie LD: Alpha-fetoprotein half-life as a predictor of residual testicular tumor. Cancer (1993) 71: 2048-5
6. Pottek T, Bьttner H, Hartmann M: Die Kinetik von AFP und HCG bei Hodentumoren. Berechnung und Bewertung individueller Halbwertszeiten (HWZ). Urologe [A] (1995) 34, [Suppl 1]: S 114
7. Sternberg C: Role of primary chemotherapy in stage I and low-volume stage II nonseminomatous germ-cell testis tumors. Urol Clin North Amer (1993) 20; 1: 93-109
8. Donohue JP, Foster RS, Rowland RG, Bihrle R, Jones J, Geier G: Nerve-sparing retroperitoneal lymphadenectomy with preservation of ejaculation. J Urol (1990) 144:287-292
9. Motzer RJ, Bosl GJ: Role of adjuvant chemotherapy in patients with stage II nonseminomatous germ-cell tumors. Urol Clin North Am (1993) 20: 111-116
10. Motzer RJ, Sheinfeld J, Mazumdar M,Bajorin DF, Bosl GJ, Herr H, Lyn P, Vlamis V: Etoposide and Cisplatin Adjuvant Therapy for Patients with Pathologic stage II Germ Cell Tumors. J Clin Oncol (1995) 13: 2700-2704
11. Weissbach L; Hartlapp JH: Adjuvant chemotherapy of metastatic stage II nonseminomatous testis tumor. J Urol (1991) 146: 1295-1298
12. Pizzocaro G, Nicolai N, Salvioni R, Piva L, Faustini M, Zanoni F. Comparison between clinical and pathological staging in low stage nonseminomatous germ cell testicular tumors. J Urol (1992) 148: 76-79
13. McLeod DG, Weiss RB, Stablein DM, Muggia FM, Paulson DF, Ellis JH: Staging relationships and outcome in early stage testicular cancer: a report from the testicular cancer intergroup study. J Urol (1991) 145: 1178-1183
14. Foster RS, Birhle R, Little JS, Rowland RG, Donohue JP. Stage II nonseminomatous germ cell testicular tumors: the Indiana experience and risk-benefit analysis. World J Urol (1994) 12: 143-148
15. Fossa SD, Qvist H, Stenwig AE, Lien HH, Ous S, Gierksky RE. Is postchemotherapy retroperitoneal lymph node dissection necessary in patients with malignant germ cell tumors. J Clin Oncol (1992) 10: 569-573
16. Jansen RLH, Sylvester R, Sleyfer DT, ten Bokkel WW, Kaye SB, Jones WG. Long term follow up of non-seminomatous testicular cancer patients with mature teratoma or carcinoma at postchemotherapy surgery. Eur J Cancer (1991) 27: 695-8
17. Pizzocaro G, Salvioni R, Zynoni F. Unilateral lymphadenectomy in intra-operative Stage I non-seminomatous germinal testis cancer. J Urol (1985) 134: 485-489
18. Bredael J, Vugrin D, Withmore WF. Recurrences in surgical Stage A non-seminonomatous germ cell tumors of the testis. J Urol (1983) 130: 476-8
19. Williams SD; Stablein DM; Einhorn LE; Muggia FM; Weiss RB; Donohue JP; Paulson DF; Brunner KW; Jacobs EM; Spaulding JT; DeWys WD; Crawford ED: Immediate adjuvant chemotherapy versus observation with treatment at relapse in pathological stage II testicular cancer. N Engl J Med (1987) 317; 23: 1433-8
20. Hartlapp JH; Weissbach L: Necessary extent of adjuvant chemotherapy in nonseminomatous testicular tumor stage II B. J Chemother Infect Dis Mal (1989) Suppl 1: A 10
21. Hartlapp JH; Weissbach L; Bussar-Maatz R: Adjuvant chemotherapy in nonseminomatous testicular tumor stage II. In J Androl (1987) 10: 277
22. Baniel J, Foster RS, Rowland RG, Birhle R, Donohue JP. Complications of primary retroperitoneal lymph node dissection. J Urol (1994) 152: 424-427
23. Foster RS; Donohue JP: Nerve-sparing retroperitoneal lymphadenectomy. Urol Clin North Amer (1993) 20; 1: 117-125
24. Pottek T; Hartmann M: Nervenerhaltende Operationstechniken am Beispiel der ejakulationsprotektiven nerve-sparing-RLA. In: Schreiter F (eds): Plastisch-rekonstruktive Chirurgie in der Urologie. Georg Thieme Verlag, Stuttgart New York (1999): 60-74
25. Donohue JP; Thornhill JA; Foster RS; Birhle R; Rowland RG; Einhorn LE: The role of retroperitoneal lymphadenectomy in clinical stage B testis cancer: The Indiana University experience. J Urol (1995) 153: 85-89
26. Staubitz WJ; Early KS; Magoss IV: Surgical treatment of nonseminomatous germinal testis tumors. Cancer (1973) 32: 1206-1211
27. Pizzocaro G; Monfardini S: No adjuvant chemotherapy in selected patients with pathologic stage II nonseminomatous germ cell tumors of the testis. J Urol (1984) 131: 677-680
28. Richie JP; Kantoff PW: Is adjuvant chemotherapy necessary for patients with stage B1 testicular cancer? J Clin Oncol (1991) 9: 1393-1396
29. Socinski MA; Garnick MB; Stomper PA: Stage II nonseminomatous germ cell tumors of the testis: An analysis of treatment options in patients with low-volume retroperitoneal disease. J Urol (1988) 140: 1437-1441
30. Horwich A; Norman A; Fisher C; Hendry WF; Nicholls J; Dearnaley DP: Primary cheomtherapy fьr stage II nonseminomatous germ cell tumors of the testis. J Urol (1994) 151: 72-75
31. Peckham MJ; Hendry WF: Clinical stage II nonseminomatous germ cell testicular tumours: Results of management by primary chemotherapy. Br J Urol (1985) 57: 763-768
32. Oliver RTD; Freedman LS; Parkinson MC: Medical options in the management of stages I and II testicular germ cell tumors. Urol Clin North Am (1987) 14: 721-728
33. Logothetis CJ; Swanson DA; Dexeus F: Primary chemotherapy for clinical stage II nonseminomatous germ cell tumors of the testis: A follow-up of 50 patients. J Clin Oncol (1987) 5: 906-911
34. Horwich A; Cullen HC; Stenning SP: Primary Chemotherapy after orchidectomy for stage I and II nonseminoma. Semin Oncol (1998) 25: 154-159
35. Rabbani F; Gleave ME; Coppin CM; Murray N; Sullivan LD: Teratoma in primary testis tumor reduces complete response rates in the retroperitoneum after primary chemotherapy. Cancer (1996) 78: 480-6
36. Baniel J; Foster RS; Rowland RG; Birhle R; Donohue JP: ): Complications of post-chemotherapy retroperitoneal lymph node dissection.J Urol (1995) 153: 976-980
37. Baniel J, Roth AJ, Foster RS, Donohue JP. Cost and risk benefit in the management of clinical stage II nonseminomatous testicular tumors. Cancer (1995) 75: 2897-2903
38. WeiЯbach L; Bussar-Maatz R; Flechtner H; Pichlmeier U; Hartmann M; Keller L : RPLND or primary chemotherapy in clinical stage IIA/B non-seminomatous germ cell tumours ? Results of a prospective multi-centre trial including quality of life assessment. Eur Urol (2000), in press.
Читайте также:

