Неотложная помощь при острых лейкозах
Наиболее часто встречающееся системное заболевание крови опухолевой природы с нарушением созревания кроветворных клеток на ранних стадиях развития.
Этиология и патогенез. Причина заболевания окончательно не выяснена. Лейкозогенным эффектом обладает ряд химических (бензол и др.) и физических (ионизирующая радиация) факторов. В происхождении лейкозов, несомненно, играют роль эндогенные моменты (гормональные, иммунные нарушения). Имеются факты, свидетельствующие об определенной роли вирусов в происхождении лейкозов.
Придается также значение нарушениям генетической структуры соматических клеток (изменения хромосомного аппарата). Лейкоз является бластоматозно-гиперпластическим процессом и характеризуется: а) гиперплазией кроветворной ткани; б) метаплазией — появление патологических очагов кроветворения в костном мозге и различных органах; в) клеточной анаплазией — утрата родоначальными клетками кроветворения способности к дифференцировке. Поражение сосудов, глубокая тромбоцитопения, агранулоци-тоз, иммунные нарушения и т. д. влекут за собой ряд тяжелых осложнений (геморрагии, инфаркты, язвенно-некротические изменения, присоединение инфекций и т. д.).
Клиническая картина. Начало лейкозов не имеет строго очерченной клинической картины. Изменения со стороны верхних дыхательных путей, ангина, пневмония, боли в костях и суставах, беспричинный субфебрилитет или высокая лихорадка, системная лимфаденопатия, увеличение размеров печени и селезенки — все эти явления при острых лейкозах можно встретить в качестве первых симптомов, заставивших больного обратиться к врачу. В крови — признаки анемии, тромбоцитопения, лейкопения или лейкоцитоз (реже нормальное содержание лейкоцитов), значительно увеличенная СОЭ. В лейкограмме — гра-нулоцитопения, большое количество недифференцированных клеток, лимфобластов, миелобластов. В любом случае диагноз устанавливается только на основании данных исследования костного мозга, при котором выявляется мономорфная картина властной метаплазии.
По морфологическим признакам клеток костного мозга острые лейкозы у детей классифицируются как лимфобластные и нелимфобластные (миелобластный, промиелоцитарный, миеломонобластный, эритромиелоз). В детском возрасте чаще (80 % случаев) встречается лимфобластный вариант острого лейкоза.
Диагноз. Основывается на клинико-гематоло-гической картине. Особое значение для диагностики имеет пункция костного мозга, исследование которого необходимо проводить при малейшем подозрении на острый лейкоз до назначения специфической терапии. Помимо морфологического исследования, необходимо проводить цитохимические исследования бластных клеток и имуноцитологическое их типирование.
Прогноз. Современная терапия с соблюдением всех ее принципов позволяет у 85—90 % больных добиться полной ремиссии. Среди детей с благоприятными прогностическими факторами 5-летнее безрецидивное течение заболевания отмечается у 50—80 % больных. О практическом выздоровлении от острого лимфобластного лейкоза можно говорить после 6—7-летнего безрецидивного течения заболевания.
Лечение. Состоит из следующих этапов.
1. Индукция полной ремиссии с помощью 4— 6 курсов полихимиотерапии по различным программам с ранним началом профилактики специфического поражения ЦНС (нейролейкоз) с помощью интратекаль-ного введения метотрексата или метотрексата в комбинации с цитозаром (для больных группы повышенного риска).
2. Консолидация ремиссии (закрепление). Наступление полной ремиссии обязательно должно подтверждаться контрольным исследованием костного мозга. Для уменьшения числа оставшейся популяции лейкоз-ных клеток проводится закрепляющий курс полихимиотерапии. В этот период дополнительно эндолюм-бально вводят цитостатические препараты.
3. Поддерживающее лечение последовательным (каждые 1,5—2 мес) чередованием 6-меркаптопурина и метотрексата с применением циклофосфана 1 раз в 7— 10 дней. Больным, относящимся к группе повышенного риска, в начальном периоде поддерживающего лечения проводится дистанционная гамма-терапия области головного мозга.
4. Реиндукция ремиссии: проведение 1 раз в 2— 2,5 мес курса полихимиотерапии (как в период индукции ремиссии) или 5—7- дневного курса аспараги-назы. Возможно чередование такого курсового реин-дукционного лечения. В этот период осуществляется весь комплекс гематологического обследования с продолжением химиопрофилактики нейролейкоза. При нелимфобластных лейкозах положительный эффект оказывает комбинация цитозара с рубомицином по программам 7 + 5 или 5 + 3. Эффективность терапии улучшается при использовании различных видов иммунокорригирующей терапии в период проведения поддерживающего и реиндукционного лечения.
Клиническая характеристика лейкозов
Системные злокачественные заболевания кроветворного аппарата, характеризующиеся прогрессирующей клеточной гиперплазией в органах кроветворения, разрастанием патологических элементов, развивающихся из исходных клеток ретикулярной ткани, неукротимым ростом лейкоцитов.
Это заболевание осложняется (чаще в терминальной стадии) резкой кровоточивостью сосудов, что приводит иногда к профузным желудочно-кишечным кровотечениям, которые порой настолько обильны, что являются непосредственной причиной смерти больных. В редких случаях желудочно-кишечные кровотечения наблюдаются в ранних стадиях болезни. Иногда они представляют первое клиническое проявление лейкоза.
Острые лейкозы
Заболевание встречается главным образом в молодом и юношеском возрасте. Принято считать, что оно возникает как бы внезапно, среди полного здоровья. Однако из анамнеза нередко удается установить, что за несколько недель до острого возникновения и бурного проявления болезни наблюдались такие симптомы, как острое недомогание, легкая утомляемость, бледность кожи и видимых слизистых, иногда субфебрильная температура, боли в горле, кровоточивость десен, увеличение шейных лимфоузлов.
Диагноз ставится на. основании данных исследования периферической крови (анемия, высокий лейкоцитоз) и характерной для этого заболевания клиники. В редких случаях, особенно при геморрагических формах и раннем проявлении желудочного кровотечения, диагностика представляется затруднительной.
При геморрагической форме лейкоза, когда имеется обильное кровотечение, особенно маточное или желудочно-кишечное, задача фельдшера такая же, как и при кровотечениях любой этиологии: восстановлении ОЦК внутривенным введением полиглюкина (400,0), реополиглюкина (400,0); при их отсутствии—5%-ной глюкозы 500— 1000 мл, физиологического раствора 500 мл, растворов 10%-го хлористого или глюконата натрия 10—20 мл внутривенно; раствора дицинона 250—500 мл внутривенно, при значительном снижении артериального давления — гормонов. Обязательны холод к месту кровотечения, покой больного. Госпитализация на носилках в стационар с хирургическим отделением.
Хронические лейкемии
Это наиболее часто встречающиеся формы лейкозов. Протекают в виде хронических или подострых миелолейкозов или хронических лимфолейкозов.
У больных хроническим миелолейкозом острые диффузные кровотечения из капилляров, особенно желудочно-кишечного тракта, бывают обычно лишь в терминальном периоде, в связи с чем диагностика их не представляет затруднений. Болезнь наблюдается главным образом в среднем возрасте (между 30—50 годами); в раннем юношеском возрасте, в отличие от острого лейкоза, она почти не встречается. В период выраженных клинических явлений определяются увеличенная селезенка и значительный лейкоцитоз со сдвигом влево.
При хроническом лимфолейкозе выраженная клиническая картина обычно развивается спустя много месяцев, нередко даже через несколько лет после начала заболевания и характеризуется распространенным опухолевым процессом в лимфоузлах; увеличением селезенки и резким возрастанием количества лимфоцитов в белой крови, значительной анемии. Симптомы кровотечения, особенно из сосудов желудочно-кишечного тракта у этих больных наблюдаются чаще, чем при миелолейкозе. Профузные желудочные кровотечения могут быть не только проявлением часто развивающегося геморрагического диатеза, но и следствием сдавления воротной вены увеличенными лимфатическими узлами брюшной полости, расширением пищеводных и кардиальных (у входа в желудок) вен.
Лечение кровотечений при лейкозах — весьма трудный, сложный процесс для стационара, тем более когда заболевание осложняется профузным желудочно-кишечным кровотечением. Ведь геморрагии при лейкозах связаны в основном с диффузным поражением капилляров желудка и кишечника и являются, по существу, паренхиматозными, т. е. кровоточит вся поверхность кишечника и желудка. Естественно, ни о каком оперативном вмешательстве не может быть и речи, применение обычных средств консервативной терапии часто дает малообнадеживающие результаты. Тем не менее, фельдшер на догоспитальном этапе непременно должен сделать все, что в его силах и возможностях (медикаменты, холод), и доставить больного с кровотечением в хирургический стационар, где врачами окончательно решится вопрос о дальнейшей тактике.
Лейкозы — это большая группа заболеваний, при которой происходит поражение системы кроветворения (гемопоэза). Чтобы лучше понять, что происходит с организмом при лейкозе, сначала нужно понимать, как организована система гемопоэза.
ГСК может пойти развиваться по двум направлениям:
- Миелопоэтическому, при котором образуются миелоидные клетки. Они названы так из-за того, что основную дифференцировку проходят в костном мозге (myelos — мозг, отсюда и название). В эту группу входят эритроциты, гранулоциты (нейтрофилы, базофилы и эозинофилы), моноциты и тромбоциты.
- Лимфопоэтическому, при котором образуются лимфоидные клетки. В процессе развития, они помимо костного мозга проходят дифференцировку в лимфатических узлах, селезенке и тимусе.
Итак, ГСК в процессе развития проходит несколько стадий:
В зависимости от того, на каком этапе развития происходит сбой, выделяют острые и хронические лейкозы. При острых лейкозах сбой происходит на уровне незрелых клеток — бластов. Поэтому их еще называют бластными лейкозами. Они имеют агрессивное течение, поскольку опухолевые клетки не могут выполнять свои функции, что без лечения быстро приводит к гибели больного. При хронических лейкозах сбой дифференцировки происходит уже на стадии зрелых клеток, поэтому они имеют более доброкачественное течение.
В зависимости от того, какой росток кроветворения поврежден, выделяют следующие виды острых лейкозов:
- Острый миелобластный лейкоз — опухоль из миелоидного ростка кроветворения. Более характерен для пожилых людей, но может встречаться и у молодых пациентов.
- Острый промиелоцитарный лейкоз — это особый тип миелобластного лейкоза, при котором сбой происходит на уровне незрелых гранулоцитов — промиелобластов. Раньше это была фатальная форма лейкоза, при которой пациенты погибали в течение нескольких недель после постановки диагноза. Но сейчас, при появлении трансретиноевой кислоты, лечение этой формы патологии достигло колоссальных успехов.
- Острый монобластный лейкоз — поражается моноцитарная линии кроветворения.
- Эритромиелоз — поражается красный росток кроветворения — эритроцитарный.
- Острый мегакариобластный лейкоз — очень редкая форма миелоцитарного лейкоза. При нем происходит поражение тромбоцитарного ростка.
- Острый лимфобластный лейкоз — это форма лимфопоэтичекого лейкоза. При нем поражается лимфоцитарный росток кроветворения. Заболевание в больше мере характерно для детского возраста.
Причины возникновения острого лейкоза
Лейкозы возникают из-за мутации ГСК. При этом разные мутации проявляются на разных этапах гемопоэза. Следует сказать, что одного факта наличия мутации недостаточно. Вообще генетические поломки в клетках, в том числе и гемопоэтических, возникают регулярно, но существуют механизмы, которые либо уничтожают такие клетки, либо блокируют ее дальнейшее развитие. Чтобы развился лейкоз, нужны особые обстоятельства:
- Повторные мутации в уже мутировавшей ГСК.
- Ослабление иммунной защиты, при которой мутировавшая клетка остается нераспознанной и начинает активно размножаться. Такие промахи иммунитета могут возникнуть как в период внутриутробного развития, так и в процессе жизни взрослого человека.
Таким образом, к факторам риска развития острого лейкоза относят следующие:
- Наследственная предрасположенность.
- Вторичные и первичные иммунодефициты.
- Воздействие ионизирующего излучения — рентген, лучевая терапия и др.
- Некоторые химикаты.
- Некоторые лекарственные препараты, например, цитостатики, которые применяются для лечения злокачественных новообразований.
- Вирусы. В частности, доказана этиологическая роль вируса Эпштейна-Барр.
Методы лечения острых лейкозов
Лечение острых лейкозов проводится в соответствии с утвержденными протоколами и проходит в несколько стадий. Целью лечения является достижение стойкой полной ремиссии. В среднем, полный курс лечения занимает около 2-х лет. При развитии осложнений этот срок может увеличиваться.

Для подбора оптимальной схемы терапии, необходимо знать вид острого лейкоза, его молекулярно-генетический профиль и группу риска для пациента. При стандартной группе риска, лечение проводится в соответствии со следующей схемой:
В ряде случаев при неблагоприятном прогнозе или возникновении рецидива, обычных курсов химиотерапии бывает недостаточно. В связи с этим, используются дополнительные методы лечения.
Профилактика нейролейкоза — поражение головного и спинного мозга лейкозными клетками. С этой целью в спинномозговой канал вводят цитостатики и проводят лучевую терапию на область головного мозга.
Трансплантация гемопоэтических стволовых клеток. В ряде случае пациентам требуется проведение высокодозной полихимиотерапии. Ее назначают для преодоления опухолевой резистентности, при возникновении многократных рецидивов и др. Такое лечение очень мощное и позволяет уничтожить даже устойчивые опухолевые клетки. Однако такая терапия опустошает костный мозг (фабрику кровяных клеток), и он не может в быстрые сроки полноценно восстановить кроветворение. Чтобы преодолеть это состояние, производят трансплантацию гемопоэтических стволовых клеток. Их могут взять у пациента после этапа индукции или консолидации ремиссии. В этом случает трансплантация называется аутологичной. Если стволовые клетки берутся от донора, это называется аллогенной трансплантацией. В этом случае пациент получает иммунитет другого, здорового человека. Иммунные клетки будут атаковать оставшиеся опухолевые клетки, оказывая дополнительный лечебный эффект. Недостатком аллогенной трансплантации является риск развития реакции трансплантат против хозяина, когда иммунные клетки начинают атаковать организм реципиента, приводя к развитию различных осложнений.
Последствия (ремиссия и рецидив)
Еще несколько десятилетий назад острые лейкозы приводили к смерти пациента в течение 2-3 месяцев после постановки диагноза. На сегодняшний день ситуация кардинально изменилась благодаря появлению новых препаратов для лечения.
На данный момент в клинике острых лейкозов выделяют следующие стадии:
- Первая атака — в этот период происходит активное размножение опухолевых клеток в костном мозге и выход их в кровь. Именно на данном этапе происходит постановка диагноза. Симптомы заболевания будут определяться тем, какой кроветворный росток поражен. Как правило, это упорные инфекции, анемии, общая слабость, увеличение лимфатических узлов и др.
- Период ремиссии. Если острый лейкоз ответил на химиотерапию, опухолевые клетки уничтожаются, и кроветворение восстанавливается. Количество бластов в костном мозге приходит в норму и не превышает 5% от общего количества клеток. Выделяют несколько видов ремиссии, в зависимости от того, насколько полно подавлен опухолевый клон. В настоящее время целью лечения является достижение полной ремиссии в течение 5 лет. По истечении этого срока, пациент считается полностью здоровым.
- Рецидив. У некоторых пациентов возникает рецидив, при котором опять увеличивается количество бластов. Они опять выходят в кровоток и могут образовывать внекостномозговые очаги инфильтрации. Рецидивов может быть несколько, и с каждым разом их все сложнее ввести в ремиссию. Тем не менее, у многих пациентов удается добиться полной пятилетней ремиссии, даже после нескольких рецидивов.
- Терминальная стадия. О ней говорят, когда все используемые методы лечения острых лейкозов теряют свою эффективность и сдерживать опухолевый рост уже невозможно. Происходит полное угнетение кроветворной системы организма.
Паллиативная помощь
Для терапии острого лейкоза имеется большое количество методов лечения. Это может быть химиотерапия, таргетная терапия, иммунотерапия. Все эти методы могут привести к ремиссии даже после многократных рецидивов. Поэтому как таковая, паллиативная терапия назначается редко и, как правило, у возрастных пациентов, которые не могут перенести тяжелое лечение.
В этом случае используется химиотерапия, медикаментозная терапия и лучевая терапия.
Химиотерапия при паллиативном лечении проводится не с целью достижения ремиссии, а для удержания опухолевого клона от стремительного размножения. На этом этапе могут применяться стандартные цитостатические препараты в меньших дозировках, иммунотерапия, таргетная терапия и другие методы противоопухолевого лечения.

Лучевая терапия может применяться для облегчения болевого синдрома при сильном поражении костей, а также при наличии внекостномозговых очагов.
Устранение болевого синдрома
Для помощи пациентам с болевым синдромом применяют различные обезболивающие препараты, начиная от нестероидных противовоспалительных препаратов (тот же ибупрофен) и заканчивая легкими и/или тяжелыми наркотическими средствами. Уменьшить выраженность болевого синдрома помогает и лучевая терапия.
Профилактика инфекций
На терминальных стадиях у больных серьезно нарушено кроветворение, и, как следствие, нет полноценной защиты от всех видов инфекций — бактериальной, грибковой, вирусной, что может привести к гибели пациента. Инфекционные осложнения являются одной из ведущих причин смерти при терминальных стадиях лейкозов.
Для предотвращения заражения, рекомендуется тщательно соблюдать принципы гигиены — уход за полостью рта, антисептическая обработка рук как самого больного, так и ухаживающего персонала, назначение профилактических антибактериальных и противогрибковых препаратов.
Трансфузионная поддержка
При сильном угнетении кроветворения, развивается тяжелая анемия и тромбоцитопения. Для купирования этих состояний могут применяться трансфузии эритроцитарной и тромбоцитарной массы.
Раньше тромбомассу переливали при снижении количества тромбоцитов ниже 20*109/л. Но потом появились рекомендации, согласно которым тромбоцитарные трансфузии проводят при падении уровня тромбоцитов ниже 10*109/л. При более высоких цифрах назначение тромбомассы не приводит к снижению риска развития кровотечения.
При появлении признаков геморрагического синдрома, тромбоцитарную трансфузию начинают немедленно и при необходимости увеличивают ее объем. Признаки геморрагического синдрома:
- Наличие петехиальных высыпаний, особенно в полости рта и других слизистых.
- Повышение температуры при отсутствии очагов инфекции.
- Наличие кровотечения.
- Возникновение инфекции.
Трансфузии эритроцит-содержащих сред
У терминальных больных желательно поддерживать целевой уровень гемоглобина не ниже 80 г/л. Особое внимание уделяется пациентам с тромбоцитопениями. При развитии тяжелых анемий показано переливание эритромассы до достижения целевого уровня.
В настоящее время во всем мире принят принцип — если больного нельзя вылечить, это не значит, что ему нельзя помочь!
Лейкоз — это злокачественное заболевание кроветворной системы, характеризующееся поражением костного мозга.
" data-tipmaxwidth="500"data-tiptheme="tipthemeflatdarklight"data-tipdelayclose="1000"data-tipeventout="mouseout"data-tipmouseleave="false"data-tipcontent="html" title="Онкогены">онкогены передаются вертикально от матери к плоду, приводя к образованию мутантных клеток. Их активация происходит под воздействием провоцирующих факторов: ионизирующего излучения, вирусной инфекции, химических веществ (бензол и его производные, фенолы, толуол, ксилол) с последующим развитием лейкоза.
Принята моноклональная теория патогенеза заболевания, по которой все лейкозные клетки являются потомками одной родона-чальной клетки, прекратившей свою дифференцировку и созревание на одном из ранних этапов развития.
" data-tipmaxwidth="500"data-tiptheme="tipthemeflatdarklight"data-tipdelayclose="1000"data-tipeventout="mouseout"data-tipmouseleave="false"data-tipcontent="html" title="Лейкозы">лейкозы делят на острые (97 %) и хронические (1—3 %). При остром лейкозе в периферической крови обнаруживают властные клетки. При хроническом лейкозе опухолевые клетки представлены дифференцированными элементами. У детей встречаются две формы острого лейкоза: лимфобластный и нелимфобластный (миелоидный).
Выделяют следующие варианты острого лимфобластного лейкоза:
- Т-клеточный;
- пре-Т-клеточный;
- В-клеточный;
- ре-В-клеточный;
и Т-, ни В-клеточный. Острый нелимфобластный (миелоидный) лейкоз подразделяют:
- на недифференцируемый;
- миелобластный;
- промиелоцитарный;
- миелоцитарный;
- форму лейкоза с эозинофилией;
- моноцитарный;
- эритролейкоз;
- мегакариобластный.
В течении лейкоза выделяют три стадии (влияют на выбор лечебной тактики):
Клиническая картина
В клинической картине острого лейкоза специфические проявления отсутствуют. Заболевание начинается с неспецифических жалоб на повышенную утомляемость, слабость, снижение аппетита, боли в костях и суставах, периодические повышения температуры до субфебрильных цифр. Реже встречается манифестное начало заболевания с выраженными интоксикацией? (геморрагическим, пролифера-тивным синдромами.
Основными клиническими синдромами при лейкозе являются:
Диагностика
Диагностику лейкоза проводят на основании клинической картины — наличия анемического, интоксикационного, геморрагического, гиперпластического синдромов.
" data-tipmaxwidth="500"data-tiptheme="tipthemeflatdarklight"data-tipdelayclose="1000"data-tipeventout="mouseout"data-tipmouseleave="false"data-tipcontent="html" title="Диагноз">диагноз исследованием пунктата костного мозга. На миелограмме видно большое количество (более 30 %) бластных клеток. Вариант лейкоза диагностируют при помощи цитохимического типирования.Дифференциальная диагностика.
Также лейкоз дифференцируют с другими группами заболеваний: диффузными болезнями соединительной ткани, гипо- и апла-стическими анемиями, тромбоцитопенической пурпурой.
Лечение лейкоза
Лечение лейкозов проводится в специализированных гематологических клиниках или отделениях. Основной задачей терапии является полное уничтожение всех лейкозных клеток, способных к пролиферации.
Для лечения разных форм и вариантов лейкоза используют различные схемы (протоколы) терапии, которые сочетают цитостатики, преднизолон, химиотерапию, лучевую терапию, трансплантацию костного мозга с коррекцией осложнений химио- и лучевой терапии.
Прогноз
При лейкозе прогноз зависит от формы заболевания, переносимости терапии и ее осложнений. В настоящее время при использовании современных схем лечения существует вероятность выздоровления детей от острого лимфобластного лейкоза.
Профилактика
Профилактические мероприятия направлены на выявление факторов, повышающих риск возникновения заболевания (радиация, цитостатическая терапия, иммунодефицитные состояния), наблюдение за детьми с наследственной отягощенно-стью по гемобластозам.
Диспансерное наблюдение осуществляют гематолог (специализированного стационара) и педиатр. Проводится контроль основной и поддерживающей терапии, контроль за соблюдением режима дня, профилактика ОРВИ и травм, Санация, -и; ж. Профилактико-лечебные мероприятия, проводимые для оздоровления организма.
Неотложная помощь при осложнениях полихимиотерапии у детей с острым лейкозом
В статье освещены вопросы оказания неотложной помощи при критических состояниях у детей с острым лейкозом, проведен анализ результатов их клинико-лабораторного и инструментального обследования, описан алгоритм назначения антибиотиков, коррекция гемостаза и этапы ориентированной терапия шока.
Неотложная помощь, осложнения полихимиотерапии, острый лейкоз, дети.
Оказание неотложной помощи при критических состояниях у детей остается одной из самых актуальных задач педиатрии, имеющих свои особенности в детской гематологии. Многочисленные осложнения полихимиотерапии у детей с острым лейкозом ухудшают течение заболевания, снижают эффективность лечения, нередко определяют неблагоприятный прогноз заболевания. Среди прогностически неблагоприятных осложнений особое значение имеют инфекционные осложнения — сепсис, инфекционно-токсический шок и кровотечение.
Целью данной работы является оценка тактики оказания неотложной помощи при критических состояниях у детей с острым лейкозом.
Проведен анализ результатов клинико-лабораторного и инструментального обследования 70 детей в возрасте от 1 мес. до 18 лет, находившихся на лечении в городской детской клинической больнице № 16 г. Харькова с диагнозом острого лейкоза.
У 42 больных (60 %) острым лимфобластным и миелобластным лейкозами выявлены осложнения полихимиотерапии (ПХТ) с развитием нозокомиальной инфекции. Среди осложнений цитостатической терапии регистрировали: нейтропению (42), агранулоцитоз (16), тромбоцитопению ниже критического уровня (15) с развитием тяжелого геморрагического синдрома (10) и геморрагического шока (2), постгеморрагическую анемию II–III степени (11), поражение ЖКТ в виде стоматоэзофагогастроэнтероколита (14), гепатит (4), панкреатит (2), кардиопатию (2).
Инфекционные осложнения были представлены следующим образом: пневмонии (22), в том числе с острой деструкцией легких (5), пиелонефрит (3), дисбактериоз кишечника (16), гнойный отит (3), контактный перитонит (2), менингит (2), флебит центральной вены (4) с синдромом верхней полой вены (2). Сочетание пневмонии с другими инфекционными очагами отмечалось у 17 больных, у 6 диагностирован сепсис, у 6 первичный очаг инфекции не выявлен и синдром системного воспалительного ответа объяснялся транслокацией инфекции из ЖКТ. Выявлена зависимость между исходной тяжестью состояния больного, количеством осложнений химиотерапии (XT) и инфекционных осложнений. Так, в группе больных ОЛ на этапе лечения в ОРИТ у 65 % регистрировали 3–4 осложнения, у 35 % — 5 и более.
Микробиологические исследования крови, мочи, ликвора, проведенные до начала XT, дали отрицательный результат, в кале патогенная микрофлора не высевалась, в зеве у 9 больных высеяны стрептококки (7) и стафилококки (2). При развитии осложнений (чаще на 2–3-й неделе терапии) микробиологические исследования показали значительную колонизацию. Получено 96 положительных результатов бактериологических исследований: гемокультуры (9), мочи (21), дыхательных путей (49), кала (7), ликвора (1), сосудистых катетеров (3), пиемических очагов на коже и слизистых (5), что составило в среднем 2,2 на одного больного. Частота высеваемости различных штаммов микроорганизмов в крови, моче, мокроте и других средах представлена в табл. 1.
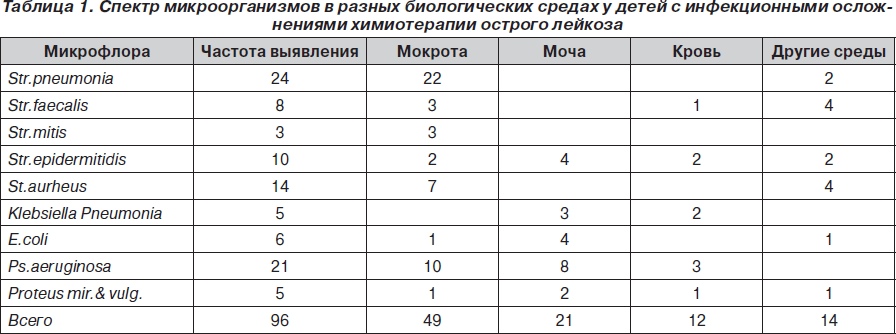
Лидирующее место в cтруктуре нозокомиальной инфекции занимает стрепто-стафилококковая флора, а среди грамотрицательной доминирует синегнойная палочка. Резистентность ко всем антибиотикам invitro выявлена у 3 штаммов стафилококка и 3 штаммов Ps.аeruginosa.
Терапия септических осложнений должна включать два обязательных компонента:
1) подавление возбудителя;
2) восстановление иммунитета.
Современный арсенал антибиотиков обеспечивает надежное подавление возбудителей, если антибиотикотерапия является ранней, а при обнаружении возбудителя — целенаправленной. Ранняя антибиотикотерапия назначается исходя из локализации первичного очага инфекции и его распространенности, алгоритм применения которой представлен на рис. 1.
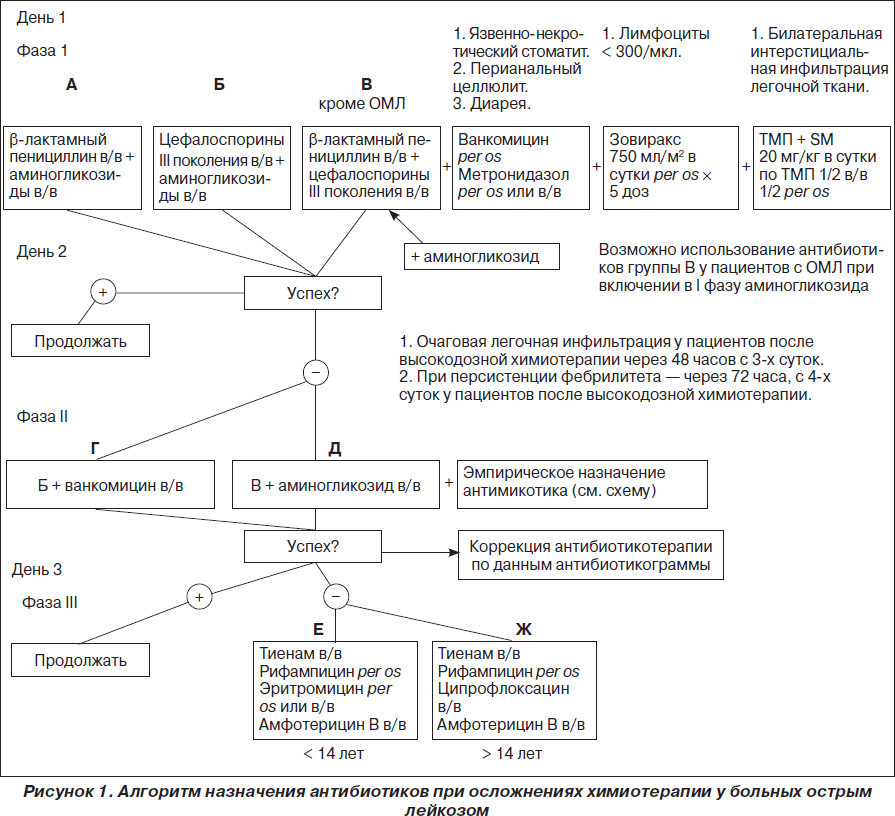
В последние годы изменился микробный пейзаж и чувствительность микроорганизмов к антибиотикам, поэтому в алгоритм назначения препаратов введены изменения. Так, во 2-й фазе при развитии инфекционно-токсического шока (ИТШ) применяют карбапенемы, фторхинолоны и антимикотики либо комбинацию цефалоспоринов IV поколения с аминогликозидами и антимикотиками. Параллельное применение высокодозного иммуноглобулина внутривенно в дозе 400 мг/кг/сут в течение 5 дней либо 1000 мг/кг/сут в течение 2 дней свидетельствует о его высокой эффективности при сепсисе и ИТШ.
При целенаправленной аптибиотикотерапии рационально использовать следующую тактику. Если предполагается стафилококковый возбудитель, следует исходить из его вероятной резистентности к метициллину. Начинать целесообразно с бета-лактамных полусинтетических пенициллинов или анзамицинов, возможно применение цефалоспоринов III поколения либо линкозаминов в сочетании с аминогликозидами или фторхинолонами. Резервом при грамположительном сепсисе должны быть цефалоспорины IV поколения, гликопептиды либо линезолид/зивокс.
Если предполагается грамотрицательный сепсис, целесообразны карбоксипенициллины, в том числе бета-лактамные, а также монобактамы. Возможно применение цефалоспоринов III поколения или фторхинолонов в сочетании с аминогликозидами. Резерв при грамотрицательном сепсисе: цефалоспорины III–IV поколений и карбапенемы.
При предположительно грибковой или ассоциированной с грибками этиологии сепсиса — амфотерицин В/фунгизон, флюконазол/дифлюкан. Препаратами выбора при лечении инвазивного аспергиллеза являются итраконазол и вариконазол.
Сроки отмены антибиотиков при успешном лечении сепсиса определяются эмпирически. Пять суток нормальной температуры при наличии признаков санации септического очага(ов) — ориентировочный срок их отмены. Излишне ранняя отмена антибиотиков может привести к рецидиву сепсиса.
Наиболее перспективным средством иммуновосстановительной терапии сепсиса оказался ронколейкин — рекомбинантный интерлейкин-2 (ИЛ-2). Дополнительным средством иммунокорригирующей терапии сепсиса являются макрофагальный колониестимулирующий и гранулоцитарно-макрофагальный колониестимулирующий факторы при наличии лейкопении.
Помимо аллоиммунизации, переливание донорских гемопрепаратов сопряжено с риском трансфузиологических реакций, передачи вирусов гепатита и иммунодефицита человека, что стимулирует развитие альтернативных подходов к предотвращению тромбоцитопении. Перспективным направлением терапии является стимуляция тромбоцитарного ростка гемопоэза. Применение рекомбинантного ИЛ-11 (опрелвекин) у больных, получавших химиотерапию, сопровождается дозозависимым увеличением количества мегакариоцитов в костном мозге и тромбоцитов в крови, а также уменьшением выраженности и длительности тромбоцитопении. Однако назначение ИЛ-11 может сопровождаться анемизацией, слабостью, отечностью и нарушением деятельности сердечно-сосудистой системы. Применение его безуспешно после пересадки костного мозга.
Терапия шока в острую фазу основана на проведении целого ряда этапов, среди которых:
— кислородотерапия при спонтанном дыхании либо ИВЛ;
— обеспечение надежного центрального венозного доступа (или доступов) и катетеризация артерий;
— введение седативных препаратов либо релаксантов при проведении ИВЛ;
— обеспечение показателя ЦВД в пределах 80–120 см вод.ст., для чего проводится активная регидратация введением коллоидных и кристаллоидных растворов; стартовый темп инфузии 40–60 мл/кг массы тела за первый час;
— если цель достигнута, среднее артериальное давление (САД) должно поддерживаться в пределах 60–90 мм вод.ст., для чего применяются вазоактивные агенты. При высоком САД применяются венозные и артериальные дилататоры (бензогексоний в разовой дозе 0,5–1 мг/кг, нитропруссид натрия либо его аналоги в виде непрерывной инфузии, подбор дозы — индивидуально по эффекту), при низком — вазопрессоры (норадреналин в дозе 0,05–0,1 мг/кг либо допамин в дозе 12 и более мкг/кг/мин);
— если цель достигнута, следует обратить внимание на поддержание сатурации венозной крови в центральной вене, которая должна быть не менее 70 %. Этот показатель достигается 2 путями: а) применением трансфузии Эр-массы, в случае если гематокрит менее 30 % либо гемоглобин менее 90– 100 г/л; б) применением инотропной поддержки с использованием добутамина (добутрекса) в дозе 5– 12 мкг/кг/мин либо допамина в дозе 5–8 мкг/кг/мин.
Далее следует продолжать терапию основного заболевания. Если цель не достигнута, проводится согревание больного, ситуация анализируется, и мероприятия повторяются, начиная с введения седативных препаратов либо релаксантов на фоне коррекции КОС и электролитного баланса.
1. Оказание неотложной помощи при критических состояниях у больных острым лейкозом остается одной из самых актуальных задач педиатрии.
2. Ранняя и целенаправленная антибиотикотерапия у данного контингента больных позволяет предупредить тяжелые инфекционные осложнения — сепсис и инфекционно-токсический шок.
3. Своевременная коррекция гемостаза с использованием современных рекомбинантных препаратов способствует снижению количества и тяжести инфекционных осложнений.
4. Ориентированная терапия шока в острую фазу является адекватным методом выведения больных из критических состояний.
3. Глумчер Ф.С. Септический шок: новые концепции патогенеза и лечения // Мистецтво лікування. — 2004. — № 8 (14). — С. 3-8.
4. Иванова Л.Ф., Дмитриева Н.В., Багирова Н.C., Дурнов Л.А. Профилактика и лечение фебрильных нейтропений у онкологических больных // Инфекции и антимикробная терапия. — 2001. — № 4. — С. 109-111.
5. Исаков Ю.Ф., Белобородова Н.В. Сепсис у детей. — Москва: Издатель Мокеев, 2001. — 369 с.
6. Одинец Ю.В. Сепсис // Врачебная практика. — 2001. — № 1. — С. 4-8.
7. Одинец Ю.В., Поддубная И.Н. Актуальные вопросы оказания неотложной помощи при заболеваниях системы крови у детей // Неотложная медпомощь: Сб. статей ХГКБСИБ, вып. 5. — Харьков: Основа, 2002. — С. 132-134.
Читайте также:

