Неоадъювантная химиотерапия метастатического колоректалтного рака
Это статья открытого доступа, распространяемая в соответствии с лицензией Creative Commons Attribution License (), которая допускает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что оригинальная работа была правильно указана.
Хирургическая резекция метастазов в печени, возникающая при колоректальном раке, считается единственным лечебным вариантом лечения. Однако многие пациенты впоследствии испытывают рецидив заболевания. Мы проспективно исследовали, снижает ли неоадъювантная химиотерапия риск рецидива после потенциально лечебной резекции печени. Особое внимание было уделено важности ответа.
50 пациентов с резектируемыми метастазами в печени получали неоадъювантный XELOX или FOLFOX4 в течение шести циклов (3 месяца). После этого была запланирована полная резекция метастазов в печени. Оценки включали частоту ответа, послеоперационную заболеваемость и выживаемость без рецидива.
Объективный ответ наблюдался у 72% всех пациентов, включая два полных ответа. Химиотерапия хорошо переносилась, и большинство нежелательных явлений было от легкой до умеренной (сорт 1/2). Потенциально лечебная резекция R0 была выполнена у всех пациентов, а послеоперационные осложнения наблюдались только у 12%. Средняя выживаемость без рецидива значительно зависела от ответа опухоли с 24,7 месяцами (95% ДИ: 4,50 до 44,97) у пациентов, отвечающих на лечение, 8,2 месяца (95% ДИ: 3,09 до 13,31) у пациентов со стабильным заболеванием и 3,0 месяца (95% CI: от 0 до 8,91) у пациентов с прогрессирующим заболеванием.
Эти данные свидетельствуют о том, что химиотерапия на основе неоадъювантной оксилалистата обеспечивает высокую частоту ответа без увеличения риска периоперационной заболеваемости. Реакция на химиотерапию может привести к длительной выживаемости без рецидива. Неоадъювантная химиотерапия может идентифицировать лучших кандидатов для потенциально лечебного подхода к лечению.
Колоректальный рак является одним из наиболее распространенных злокачественных новообразований в западном мире [1]. Печень является частым участком колоректальных метастазов, а у 15% до 25% пациентов метастазы в печени при диагнозе [2,3]. Кроме того, от 50% до 60% пациентов с локализованным заболеванием при диагнозе в конечном итоге развивают прогрессирующее или метастатическое заболевание. Медианная выживаемость пациентов с метастатическим колоректальным раком, получавших лечение только с наилучшей поддержкой, составляет примерно 6 месяцев [4]. Недавнее введение ряда новых перспективных противораковых агентов, таких как иринотекан или оксалиплатин в сочетании с 5-флюроурилом, привело к частоте отклика от 40% до 50% и средней выживаемости от 15 до 20 месяцев 6.
Несмотря на достижения в выживании с помощью химиотерапии, хирургическая резекция метастазов в печени остается единственным лечебным вариантом для пациентов с метастазами в печени и без внепеченочных заболеваний с 5-летней выживаемостью после резекции от 25% до 45% [8,9]. Однако даже после успешной резекции большинство пациентов будут испытывать рецидив заболевания [10]. Роль спящих раковых клеток, которая впоследствии превратится в метастазы, была установлена в экспериментальных моделях [11]. Целью системной химиотерапии у пациентов с резектируемыми метастазами в печени является устранение этих опухолевых клеток и, таким образом, снижение риска внутрипеченочного и внепеченочного рецидива. Большинство адъювантных исследований у пациентов с колоректальным раком после резекции печени, которые использовали внутриартериальную химиотерапию с системным лечением или без нее, не продемонстрировали преимущества выживания 12.
Неоадъювантная химиотерапия представляется многообещающей, особенно у пациентов с преимущественно резектируемыми метастазами в печени с высоким риском раннего рецидива, с использованием дублетных химиотерапевтических режимов, содержащих оксалиплатин или иринотекан [15,16]. Назначение неоадъювантной химиотерапии заключается не только в уменьшении риска рецидива и сокращения метастазов в печени, что позволяет проводить менее обширную хирургию, но и идентифицировать группу пациентов, которые могут извлечь наибольшую пользу из резекции печени, а именно ответчиков [17].
Целью нашего проспективного исследования было определить эффективность неоадъювантной химиотерапии, состоящей из оксалиплатина плюс 5-FU / LV или капецитабина у потенциально излечимых пациентов с метастатическим колоректальным раком и высоким риском рецидива опухоли. Осуществимость этого подхода к лечению не была проспективно оценена с точки зрения продления времени выживания без рецидива у пациентов, отвечающих за лечение.
Пациенты имели право на это проспективное исследование, если бы у них были гистологически подтвержденные технически резекционируемые метастазы рака толстой кишки, определенные многопрофильной группой, включая печеночных хирургов, рентгенологов и медицинских онкологов, и по крайней мере один клинический фактор риска рецидива опухоли, определенный Fong et al [8] , Метастазы в печени должны были быть двумерными, без ограничения количества и местоположения метастазов, если они были определены резекцией печеночным хирургом. Кроме того, требуемые пациенты должны обладать следующими характеристиками: в возрасте от 19 до 80 лет; Статус работоспособности Всемирной организации здравоохранения (ВОЗ) 0/1; адекватный костный мозг обеспечивает адекватную почечную и печеночную функцию.
Критериями исключения были внепеченочные заболевания, ранее проведенное паллиативное лечение, серьезное или неконтролируемое одновременное медицинское заболевание и периферическая невропатия (CTC> 1 класс). Им не разрешалось участвовать в каких-либо других клинических испытаниях за последние 30 дней. Письменное информированное согласие требовалось от всех пациентов до поступления в исследование. Исследование было одобрено Советом по институциональному обзору двух участвующих центров.
Пациенты либо получали стандартную схему FOLFOX4, состоящую из оксалиплатина 85 мг / м2 (Eloxatin®, Sanofi-Aventis, Collegeville, USA), вводимого в день 1 в виде 2-часовой инфузии IV; LV вводили в дозе 200 мг / м2 с 2-часовым внутривенным вливанием с последующим 5-ФУ 400 мг / м2 в виде болюса IV, а затем 600 мг / м2 в виде 22-часовой непрерывной инфузии IV на 1-й день и 2 или режим XELOX, состоящий из оксалиплатина 130 мг / м2, вводимого в виде 3-часовой инфузии в день 1, плюс капецитабин (Xeloda®) 2000 мг / м2 / день в день от 1 до 7 из 2-недельного цикла.
Курсы лечения повторялись каждые 2 недели в течение шести курсов, если не было ранее доказательств прогрессирующего заболевания. Последующие обследования, включая КТ сустава и живота и измерение маркера опухоли, проводились каждые 3 месяца в течение первых 2 лет, каждые 6 месяцев в течение следующих 3 лет и один раз в год после этого.
Выделение на FOLFOX4 или XELOX было основано на институциональных предпочтениях двух онкологических отделов, поскольку FOLFOX и XELOX считались одинаково первыми линиями лечения колоректального рака.
Побочные реакции оценивали в соответствии с Национальными критериями токсичности Национального рака (NCI-CTC, версия 2.0) [18]. Если у пациентов отмечалось гематологическое или гематологическое неблагоприятное событие 4-го класса, доза химиотерапевтических препаратов снижалась на 25% для всех последующих доз. Кроме того, при стойкой тяжелой нейротоксичности, несмотря на снижение дозы 25%, оксалиплатин временно снимали с поддержанием 5-FU / LV или капецитабина до восстановления. Лечение было отложено на срок до 2 недель, если абсолютное количество нейтрофилов составляло grad 1), были исключены из этого протокола.
До начала терапии все пациенты оценивали путем физического обследования, рутинной гематологии и биохимии, а также компьютерной томографии грудной клетки и брюшной полости для определения степени заболевания. После первоначальной оценки были получены полные анализы крови и анализ биохимии сыворотки по крайней мере один раз на каждом курсе лечения. Уровни карциноэмбрионального антигена (СЕА) оценивали каждые 4 недели. Субъективные симптомы, результаты физического обследования, состояние работоспособности и все побочные реакции регистрировались перед каждым циклом лечения в соответствии с критериями КТК [18]. Размер опухоли измеряли после шести циклов путем КТ или МРТ, а скорость ответа оценивали в соответствии с критериями RECIST [19].
Первичной конечной точкой была скорость ответа согласно критериям RECIST; вторичными конечными точками были скорость резективности и периоперационная заболеваемость и смертность. Пролонгацией общей и безрецидивной выживаемости у ответивших пациентов были дополнительные вторичные конечные точки.
Дизайн исследования для прогнозирования числа пациентов, необходимых для статистической достоверности (2-сторонний), основывался на предположении, что лечение с помощью XELOX или FOLFOX увеличивает время реверсии безрецидивного ответа респондентов по сравнению с пациентами, которые прогрессировали на терапию на 10 месяцев. Альфа была установлена равной 0,05, бета — 0,2, что дает мощность 80%; Расчетный размер выборки для периода приобретения 24 месяцев и последующий период продолжительностью не менее 30 месяцев составил 38 пациентов.
Метод Каплана-Мейера использовался для оценки средней выживаемости и выживаемости безрецидивной выживаемости с применением сравнения Log-Rang. Многоуровневые анализы и показатели выживаемости были построены с использованием SPSS для Windows версии 11.5.
КТ-сканирование грудной клетки и брюшной полости проводилось в конце шестого цикла химиотерапии, чтобы исключить внепеченочные заболевания. Кроме того, эхокардиограмма, ЭКГ, индоцианиновый зеленый клиренс и тест функции легких проводились обычно до операции. Была проведена интраоперационная УЗИ, чтобы подтвердить количество и размер метастазов, определить их связь с сосудистыми и желчными структурами и исключить дальнейшие внутрипеченочные метастазы. Резекция печени проводилась через 2-5 недель после последнего применения химиотерапии, и все пациенты должны были оправиться от каких-либо серьезных побочных эффектов химиотерапии. Лечебная резекция печени была обязательной, которая включала резекцию всех метастазов в печени с отрицательным пределом в одной процедуре.
В период с мая 2001 года по ноябрь 2003 года в это проспективное, нерандомизированное исследование было включено 50 пациентов с колоректальным раком и результируемыми метастазами в печени. Отдельные базовые демографические характеристики и характеристики заболевания показаны в таблице 1. Зачисленные пациенты имели средний возраст 62 года (от 36 до 77 лет); метастазы были синхронными у 35 пациентов (70%) и метахронных (диагностированных по крайней мере через 6 месяцев после первичной опухоли) у 15 пациентов (30%). Все пациенты получали неоадъювантную химиотерапию в течение 3 месяцев с 30 (60%) и 20 (40%) пациентами, получавшими XELOX и FOLFOX4, соответственно. Характеристики пациентов были одинаковыми между обеими группами.
ECOG = Восточная кооперативная онкологическая группа; CEA = карциноэмбриональный антиген
Гематологическая токсичность наблюдалась у 27 (54%) пациентов, которые включали одного (2%) пациента с нейтропенией 3-й степени и одного (2%) пациента с тромбоцитопенией 4-го уровня; все другие гематологические токсичности были от легкой до умеренной (1 или 2 степени). Не было эпизодов фебрильной нейтропении или кровотечения. Негематологические побочные эффекты отмечались у 33 (66%) пациентов (таблица 2). Наиболее распространенными негематологическими побочными эффектами от легкой до умеренной (1 или 2 степени) были тошнота (n = 17; 34%), диарея (n = 6; 12%), рвота (n = 3; 6%), усталость ( n = 4; 8%), периферическая невропатия (n = 22; 44%) и синдром руки-стопа (n = 9; 18%). Негематологические побочные эффекты 3-го класса наблюдались у 5 (10%) пациентов, включая диарею (n = 2, 4%), периферическую невропатию (n = 2, 4%) и рвоту (n = 1; 2%). Не наблюдались побочные эффекты, не связанные с гематологией 4-го уровня.
Избранные побочные эффекты
Первоначальная доза капецитабина снижалась (25%) у двух пациентов, получавших XELOX из-за диареи 3-го класса. Снижение дозы оксалиплатина на 25% было выполнено у двух пациентов, каждый из которых получал XELOX и FOLFOX4, из-за периферической невропатии 3-й степени. Снижение дозы обоих агентов было выполнено у двух пациентов из-за тромбоцитопении 4-го класса (один пациент XELOX) и рвота 3-го класса (один пациент FOLFOX4).
Опухолевая реакция оценивалась у всех 50 пациентов. Только двум пациентам не удалось пройти все шесть циклов химиотерапии (один пациент испытал прогрессирующее заболевание после трех циклов, а другой пациент прекратил после четырех циклов по личным причинам). Объективный ответ наблюдался у 36 (72%) пациентов (табл. 3). Два (4%) пациента были радиологически зарегистрированы, чтобы получить полный ответ (CR); один был патологически подтвержден, и жизнеспособные опухолевые клетки были обнаружены во время патологии у другого пациента; 34 (68%) пациентов имели радиологический подтвержденный частичный ответ (ОР). Еще 10 пациентов (20%) продемонстрировали стабильное заболевание (SD), и только четыре пациента (8%) имели прогрессирование заболевания (ПД). Снижение уровня СЕА наблюдалось у 63% пациентов, в то время как уровни не изменялись у еще 19% пациентов. Опухолевая реакция была одинаковой у пациентов, получавших XELOX или FOLFOX4 соответственно (полный / частичный ответ, 77% против 65%, стабильная болезнь 13% против 30%, прогрессирующее заболевание, 10% против 5%).
Резекция R0 проводилась у всех 50 пациентов. Односегментные резекции выполнялись у 10 (20%) пациентов, бисекектомиомы были необходимы у 13 (26%) пациентов, а 27 (54%) пациентов подверглись крупным гепатэктомии (≥ 3 сегмента). Периоперационные переливания крови были назначены 16 (32%) пациентам, но только у семи пациентов потребовалось более двух единиц упакованных эритроцитов.
Послеоперационные осложнения наблюдались только у 6 (12%) пациентов; у двух пациентов наблюдались проблемы с заживлением ран, билиома и образование абсцесса. Не было 60-дневной смертности, а средняя продолжительность госпитализации составила 9 (от 5 до 29) дней.
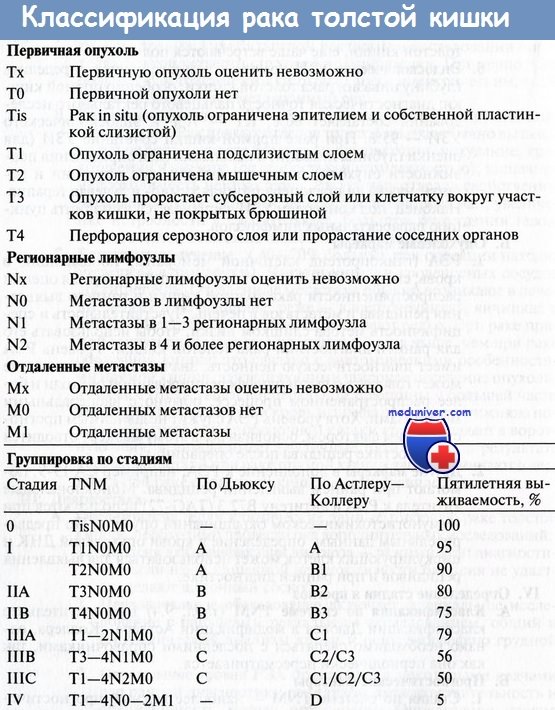
Вероятность рецидива после радикальных резекций, выполненных по поводу рака в стадии II и III без признаков резидуальной опухоли (R0 резекция), составляет 40-50% случаев.
Углубление знаний о патофизиологии опухоли, доступность различных химиопрепаратов, более совершенные схемы адъювантной и неоадъювантной химиотерапии привели к признанию ее роли, продемонстрировав преимущество комбинированного подхода над хирургическим лечением в отношении ответа опухоли и выживаемости в больших группах больных раком.
Выбор конкретного препарата, схемы, пути введения, времени и продолжительности зависит от нескольких факторов: гистопатологических особенностей, стадии, первичных и вторичных очагов опухоли, общего состояния больного, ответа на лечение, побочных эффектов и выполненной или планируемой операции.
Доказательства преимуществ постоянно изменяются и обновляются по мере получения данных новых исследований.
Показания для химиотерапии:
• Рак толстой кишки, стадия III (TxN1-2).
• Рак толстой кишки, стадия IIВ (T4N0), в частности при перфорации.
• Рак толстой кишки, стадия IIА (ТЗ) с неблагоприятными особенностями: пери-туморальной лимфоваскулярной инвазией, неадекватным количеством исследованных лимфоузлов, низкой дифференцировкой.
• Рак прямой кишки, стадия II (u/T3-4N0) и III (u/pTxN1-2).
• Рак прямой кишки, стадия Т2 после трансанального местного иссечения.
Сумма доказательств эффективности химиотерапии рака толстой кишки
1. Стадия III колоректального рака:
• Послеоперационная химиотерапия в течение 6 месяцев является достаточной (у более длительного курса преимуществ нет).
• Непрерывное введение 5-FU/LV лучше, чем болюсное.
• Необходимость в левамизоле отсутствует.
• Комбинация 5-FU/LV и оксалиплатина лучше, чем 5-FU/LV.
• Капецитабин также эффективен и даже несколько лучше, чем 5-FU/LV.
• Эффективность адъювантной химиотерапии не зависит от возраста больного.
• Роль в адъювантном режиме таких препаратов, как иринотекан, цетуксимаб или бевацизумаб не документирована, но они являются предметом текущих исследований.
2. Стадия II колоректального рака:
• Не документированы преимущества в выживаемости при адъювантной терапии у больных со II стадией заболевания при стандартном риске.
• Химиотерапия при II стадии заболевания высокого риска выглядит логически оправданной, но спорной из-за отсутствия объективной проверки достоверности => необходимость в дальнейших исследованиях.
Альтернативы химиотерапии рака толстой кишки:
• Только операция: рак толстой кишки — стадия I (pT1-2N0), стадия IIА (pT3N0); у сохранных больных со II стадией рака толстой кишки при отсутствии неблагоприятных прогностических факторов рутинное применение адъювантной химиотерапии не рекомендуется.
• Радиотерапия или радиотерапия + операция: все реже применяемые методы при опухолях ЖКТ/аноректальной области.
Схемы адъювантной химиотерапии рака толстой кишки (колоректального рака)
1. Еженедельный болюс 5-FU+ лейковорин (Розвел Парк):
Болюсное введение 5-FU + лейковорин еженедельно в течение 6 недель, 2 недели перерыв => 3 цикла каждые 8 недель.
Показания. Стандартная схема, если имеются противопоказания или непереносимость оксали-платина.
Противопоказания. Текущий сепсис, нейтропения, печеночная недостаточность, почечная недостаточность.
Токсичность и побочные эффекты. Степень III и IV: диарея (40%), стоматит (1%), нейтропения (4%).
2. Ежемесячный болюс 5-FU+ лейковорин (Мэйо):
Болюсное введение 5-FU+ лейковорин с 1 по 5 день с последующим 3-х недельным перерывом => 6 циклов каждые 4 недели.
Показания. Стандартная схема при противопоказаниях или непереносимости оксалиплатина.
Противопоказания. Текущий сепсис, нейтропения, печеночная/почечная недостаточность.
Токсичность и побочные эффекты. Более токсичная, по сравнению с другими 5-FU/LV схемами => степень III и IV: диарея (13-21%), стоматит (14-18%), нейтропения (16-55%).
3. Капецитабии (Кселода):
Капецитабин: перорально два раза в день ежедневно в течение 14 дней + перерыв 7 дней => всего 8 циклов каждые 3 недели.
Показания. Альтернативная/новая схема, если имеются противопоказания или непереносимость оксалиплатина.
Противопоказания. Текущий сепсис, нейтропения, печеночная/почечная недостаточность.
Токсичность и побочные эффекты. Переносимость лучше, чем при внутривенном введении 5-FU/LV.
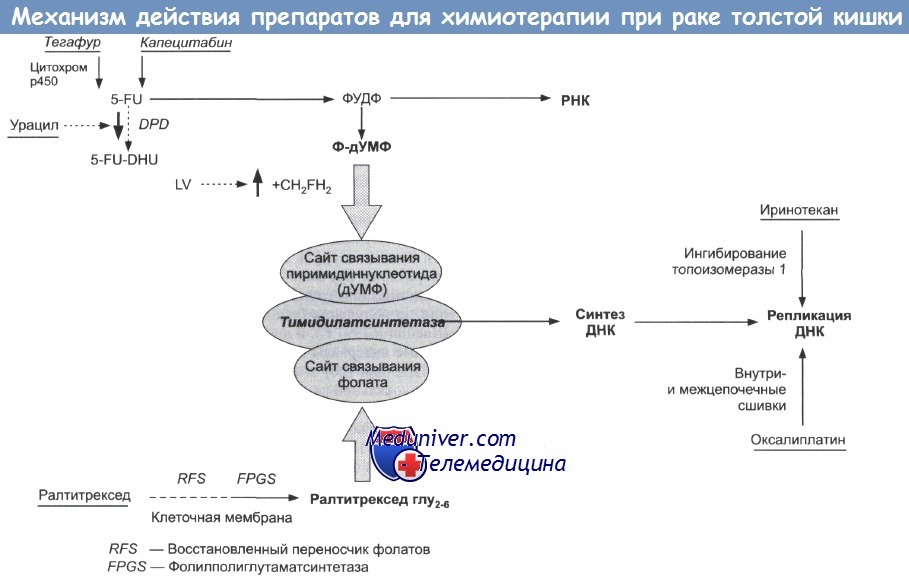
4. ФОЛиниевая кислота + Фторурацил + ОКСалиплатин (FOLFOX4):
Оксалиплатин в/в в первый день; лейковорин в/в в первый и второй дни; 5-FU в/в болюсно с последующей непрерывной инфузией в течение первого и второго дня => всего 12 циклов каждые 14 дней.
Показания. При переносимости - стандартная интенсивная схема выбора, в частности при агрессивных опухолях и у молодых больных; риск редукции дозы 18-25% по сравнению с болюсным введением 5-FU/LV (безрецидивная выживаемость - 78% и 73% соответственно).
Противопоказания. Аллергические реакции. Предшествующая нейропатия.
Токсичность и побочные эффекты. Нейтропения (>40%), фебрильная нейтропения, периферическая нейропатия (острая 3 степени - 12%, отдаленная персистирующая - 1%).
5. ФОЛиниевая кислота + Фторурацил + ОКСалиплатин (FOLFOX 6):
Оксалиплатин в/в в первый день; лейковорин в/в только в первый день; 5-FU в/в болюсно с последующей непрерывной инфузией (более высокая доза, чем при FOLFOX4) в течение первого и второго дня => всего 12 циклов каждые 14 дней.
Показания. Те же, что и при FOLFOX4, но доза оксалиплатнна выше, а назначение более удобно для больного: необходимость госпитализации только в первый день каждого цикла.
Противопоказания. Аллергические реакции. Предшествующая нейропатия.
Токсичность и побочные эффекты. Нейтропения (>40%), фебрильная нейтропения, периферическая нейропатия (острая III степени - 12%, отдаленная персистирующая - 1%).
6. КАПЕцитабин (КСЕЛода) + ОКСалиплатин (САРЕОХ, XELOX):
Оксалиплатин в/в в первый день; капецитабин нерорально два раза в день ежедневно с 1 по 14 дни + 7 дней перерыв => каждый 21 день 2 раза в день.
Показания. Альтернативная схема FOLFOX с удобным режимом приема.
Противопоказания. Текущий сепсис, нейтропения, печеночная/почечная недостаточность.
Токсичность и побочные эффекты. Сравнимый с FOLFOX или несколько лучший профиль токсичности.

Informo, ergo sum!
ПАЦИЕНТЫ МЕТАСТАТИЧЕСКИМ КОЛОРЕКТАЛЬНЫМ РАКОМ
БОЛЕЕ 30% ИЗ НИХ ПЕРЕЖИВАЮТ 5-ЛЕТНИЙ СРОК
ПОСЛЕ СОВРЕМЕННОГО КОМБИНИРОВАННОГО ЛЕЧЕНИЯ
(Конспект материалов заседания)

Интернет: www. ronc.ru //www.oncology.ru //www.elibrary.ru //www.oncodome.narod.ru
№ 3 (596)
ИНФОРМАЦИОННЫЙ БЮЛЛЕТЕНЬ МОСКОВСКОГО ОНКОЛОГИЧЕСКОГО ОБЩЕСТВА. ИЗДАЕТСЯ С 1994 г.
ОБЩЕСТВО ОСНОВАНО В 1954 г.
ЗАСЕДАНИЕ № 000
СОСТОИТСЯ В ЧЕТВЕРГ, 28 МАРТА 2013 г., в 17.00
В КОНФЕРЕНЦ-ЗАЛЕ КЛИНИКИ РОССИЙСКОГО О НКОЛОГИЧЕСКОГО НАУЧНОГО ЦЕНТРА им. Н. Н.БЛОХИНА
ПОВЕСТКА ДНЯ:
ЛЕЧЕБНАЯ СТРАТЕГИЯ
ПРИ МЕТАСТАТИЧЕСКОМ КОЛОРЕКТАЛЬНОМ РАКЕ
Президиум:
академик РАН, проф. М.Р. Личиницер, проф. Ю.И. Патютко, д. м.н. Д. Л.Cтрояковский, проф.
Доклад: СТРАТЕГИЯ ЛЕЧЕНИЯ ПРИ МЕТАСТАТИЧЕСКОМ КОЛОРЕКТАЛЬНОМ РАКЕ
Доклад: РОЛЬ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ
БОЛЬНЫХ МЕТАСТАТИЧЕСКИМ КОЛОРЕКТАЛЬНЫМ РАКОМ
Cтрояковский Д. Л.,
(Московская онкологическая больница № 62)
Дискуссия, прения:
• ЛЕЧЕНИЕ БОЛЬНЫХ КОЛОРЕКТАЛЬНЫМ РАКОМ С МЕТАСТАЗАМИ В ПЕЧЕНЬ. – , , (РОНЦ им. )
• ЛЕЧЕНИЕ БОЛЬНЫХ КОЛОРЕКТАЛЬНЫМ РАКОМ С МЕТАСТАЗАМИ В ЛЕГКИЕ. – , (РОНЦ им. )
• ЛЕЧЕНИЕ БОЛЬНЫХ МЕТАСТАТИЧЕСКИМ КОЛОРЕКТАЛЬНЫМ РАКОМ – , с соавт. (РОНЦ им. )
СОСТОЯНИЕ и ПЕРСПЕКТИВЫ
ЛЕЧЕНИЯ БОЛЬНЫХ МЕТАСТАТИЧЕСКИМ КОЛОРЕКТАЛЬНЫМ РАКОМ
Колоректальный рак – третья по частоте злокачественная опухоль (после рака легкого и желудка). В России ежегодно выявляется порядка 50.000 пациентов. Отдаленные метастазы, прежде всего – в печени, выявляются при выборе метода лечения у каждого третьего, а при наблюдении после условно радикальных операций – у каждого второго больного. В 25% случаев поражения печени длительно остаются единственным проявлением заболевания, что обосновывает показания к хирургическим вмешательствам.
В плане комбинированного лечения больных метастатическим КРР резекция печени является оптимальным объемом хирургического вмешательства. По статистике 10-25% больных метастатическим колоректальным раком могут быть оперированы при лостаточно низких показателях частоты осложнений и летальности. Химиотерапия, по данным современных рандомизированных исследований – G.Portier, et al. (2006); B.Nordlinger, et al.(2008) – улучшает отдаленные результаты лечения.
(Продолжение – см. с. 2.)
СОСТОЯНИЕ, ПЕРСПЕКТИВЫ ЛЕЧЕНИЯ БОЛЬНЫХ МЕТАСТАТИЧЕСКИМ КОЛОРЕКТАЛЬНЫМ РАКОМ
Хирургическое удаление радикально (R0) резектабельных метастазов колоректального рака в печень потенциально может привести к излечению больного. По данным литературы показатели 5-летней выживаемости соответствуют 20–45%. Пятилетняя общая и безрецидивная выживаемость составила после резекции печени 41,1-26,7%, но повышалась до 51,1-33,5% в группе больных после резекций с адъювантной химиотерапией. Получено достоверное увеличение показателей безрецидивной выживаемости при комбинированном лечении.
•Патютко лечение злокачественных опухолей печени. практическая медицина. Москва 2005.
•Laweus D., I. Taylor. Chemotherapy for colorectal cancer – an overview of current managements for surgeons. EJSO, 2005.
•Guillaume Portier, Dominique Elias et al. Multicenter Randomized Trial of Adjuvant Fluorouracil and Folinic Acid Compared
With Surgery Alone After Resection of Colorectal Liver Metastases. FFCD ACHBTH AURC 9002 Trial. J Clin Oncol, 2006.
•Nordlinger, B. Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from
colorectal cancer (EORTC Intergroup trial 40983): a randomised controlled trial / B. Nordlinger, H. Sorbye, B. Glimelius et al. //
Lancet. – 2008. - Vol.371, N 9617. – P. .
•ESMO Consensus Guidelines for management of patients with colon and rectal cancer. A personalized approach to clinical decision making.
По материалам Н. ВДобровой, , .
ТРУДЫ 
МОСКОВСКОГО ОНКОЛОГИЧЕСКОГО ОБЩЕСТВА
PROCEEDINGS OF THE MOSCOW CANCER SOCIETY (№ #596; March 28, 2013)
THE TREATMENT STRATEGY FOR METASTATIC COLORECTAL CARCINOMA
Report-1 TREATMENT’S STRATEGY FOR METASTATIC COLORECTAL CANCER. THE DATA FROM CURRENT CLINICAL PRACTICE AND RESEARCH MATERIALS OF INTERNATIONAL Dr. N. Dobrova, et al. (The N. N.Blokhin Russian Cancer Research Center).
Report-2 COMBINED TREATMENT FOR PATIENTS WITH METASTATIC COLORECTAL Prof. D. Strojakovsky et al. (Moscow City Cancer Hospital N#62)
Discussion CURRENT PROBLEMS OF TREATMENT STRATEGY FOR METASTATIC COLORECTAL CARCINOMA. •Surgery for hepatic metastases of colorectal Dr. N. Podlujny, et al. • Surgery for pulmonary metastases of colorectal Dr. A. Allaxverdiev, et al. • Тhe results of surgical and combined treatment in patients with metastatic colorectal Dr. V. Aliev, et al. (The materials for discussion are presented by the stuff of the N. N.Blokhin Russian Cancer Research Center).
Доклад: СТРАТЕГИЯ ЛЕЧЕНИЯ ПРИ МЕТАСТАТИЧЕСКОМ КОЛОРЕКТАЛЬНОМ РАКЕ
При колоректальном раке (КРР) метастазы выявляются у 20-25% больных при установлении диагноза и еще у 20-25% – после удаления первичной опухоли. Современная таргетная и химиотерапия метастатического КРР в сочетании с удалением первичной опухоли, резекцией печени и легких (как наиболее частых локализаций метастазов) позволяют добиться длительной выживаемости и улучшения качества жизни, достигнуть клинического излечения.
В научных исследованиях продолжают изучаться вопросы выбора противоопухолевой терапии, сочетания таргетных и химиопрепаратов, продолжительности и индивидуализации лечения. Сложившиеся представления формулируются следующим образом:
Принципы лечения при наличии первичной опухоли и потенциально резектабельных метастазов. Лечебная стратегия должна предусматривать возможность достижения радикализма (выполнения R0 хирургического вмешательства). Стандартом является назначение пред-и послеоперационной химиотерапии (в режиме FOLFOX; продолжительностью 3 мес до и 3 – после операции) Возможно первым этапом удаление первичной опухоли и метастазов, затем послеоперационная адъювантная терапия в режиме FOLFOX в течение 6 месяцев.
Химиотерапия при резектабельных метастазах в печень. Современным стандартом является периоперационная химиотерапия в течение 3 мес до операции и 3 – после. Такой подход доказан в исследовании EORTC 40983 для режима FOLFOX в группе больных единичными (до 4) метастазами в печень и нелеченными оксалиплатином. У больных, не ответивших в пределах предшествующих 12 месяцев на адъювантную терапию на основе оксалиплатина, необходимо использовать другой режим (например, FOLFIRI) или сразу выполнить операцию. Больным с благоприятным прогнозом, например, при солитарном (

- Какие химиопрепараты используют при колоректальном раке?
- Способы введения химиопрепаратов. Циклы и курс лечения.
- Что такое протокол химиотерапии, и для чего он нужен?
- Цены на курс химиотерапии в Европейской клинике
Чаще всего курс химиотерапии при раке толстой кишки дополняет хирургическое лечение. В зависимости от сроков проведения, различают два вида терапии:
- Неоадъювантная назначается до операции. Она помогает уменьшить размеры опухоли, благодаря чему рак легче поддается хирургическому лечению.
- Адъювантная проводится после операции. Она уничтожает оставшиеся в организме раковые клетки и помогает предотвратить рецидив.
На поздних стадиях колоректального рака химиотерапия и лучевая терапия становятся основными методами лечения. Вылечить запущенный рак уже невозможно, но активная терапия помогает существенно продлить жизнь.
Какие химиопрепараты используют при колоректальном раке?
До относительно недавнего времени, на протяжении почти полувека, единственной комбинацией препаратов с доказанной эффективностью при раке толстой кишки было сочетание 5-фторурацила с лейковорином. В настоящее время список химиопрепаратов расширился. Помимо указанной комбинации применяют следующие:
- капецитабин (Кселода);
- иринотекан (Камптозар);
- капецитабин + оксалиплатин (Элоксатин);
- лейковорин + фторурацил + оксалиплатин;
- фторурацил + оксалиплатин + иринотекан;
- трифлуридин + типирацил (комбинированный препарат Лонсурф).
Кроме того, при колоректальном раке применяют таргетные препараты. В отличие от химиопрепаратов, которые атакуют любые активно размножающиеся клетки, эти лекарственные средства нацелены на конкретную молекулу-мишень, играющую важную роль в развитии рака:
- Блокаторы VEGF (фактора роста эндотелия сосудов). Раковые клетки выделяют большое количество VEGF, для того чтобы стимулировать рост новых сосудов и обеспечить себя кислородом, питательными веществами. К группе блокаторов VEGF относятся: бевацизумаб, рамуцирумаб, регорафениб.
- Блокаторы EGFR (рецептора эпидермального фактора роста). Это молекула на поверхности клеток, которая под действием эпидермального фактора роста заставляет их размножаться. Если в раковых клетках изменен ген, отвечающий за синтез EGFR, они несут слишком много таких рецепторов и размножаются более агрессивно. К блокаторам EGFR относятся: цетуксимаб, панитумумаб.
Способы введения химиопрепаратов. Циклы и курс лечения.
В большинстве случаев химиопрепараты при колоректальном раке вводят внутривенно. Капецитабин и трифлуридин/типирацил принимают в виде таблеток. Такая химиотерапия называется системной, так как химиопрепарат распространяется по всему организму.
Колоректальный рак нередко метастазирует в печень, и в таких случаях может быть проведена местная химиотерапия. В отделении интервенционной хирургии Европейской клиники проводится химиоэмболизация печени. В сосуд, питающий опухоль, вводят микроскопические частицы — эмболы — и химиопрепарат. Эмболы перекрывают кровоток, а химиопрепарат уничтожает раковые клетки.
При системной терапии химиопрепарат атакует не только опухолевую, но и здоровые ткани. После того как получена очередная доза лекарства, организму нужно время, чтобы восстановиться. Поэтому курс химиотерапии проводят циклами. Один цикл обычно продолжается 2–3 недели. Курс лечения может включать несколько циклов.

Что такое протокол химиотерапии, и для чего он нужен?
Чаще всего для лечения рака применяют сочетания химиопрепаратов с разными механизмами действия. Но какая комбинация будет наиболее эффективна в каждом конкретном случае? Как долго должны продолжаться циклы, и сколько их нужно всего? На эти вопросы уже давно существуют ответы. Они были найдены в ходе многочисленных клинических исследований.
Эти знания отражены в специальных документах — протоколах химиотерапии. Существуют разные протоколы, врачи Европейской клиники ориентируются на рекомендации NCCN — авторитетной ассоциации, в которую входят 27 ведущих онкоцентров США.
Современные технологии позволяют изучить опухоль на молекулярно-генетическом уровне, разобраться, какие молекулярные механизмы играют ключевую роль в опухолевом росте у конкретного пациента. Это дает возможность назначать персонализированное лечение, подбирать для каждого больного оптимальную комбинацию химиопрепаратов. У врачей Европейской клиники есть доступ к данным технологиям, благодаря сотрудничеству с американской лабораторией Caris.
Мы считаем, что помочь можно при любой стадии рака, и используем для этого все современные возможности. Наши врачи применяют оригинальные европейские и американские химиопрепараты с доказанной эффективностью. Мы знаем, как помочь.
Читайте также:

