Нейроэндокринная опухоль легких карциноид
Что такое карциноид? Причины возникновения, диагностику и методы лечения разберем в статье доктора Леднев А. Н., хирурга со стажем в 4 года.

Определение болезни. Причины заболевания
Карциноид (карциноидная или нейроэндокринная опухоль) — медленно растущий тип злокачественных опухолей, происходящий из клеток нейроэндокринной системы.
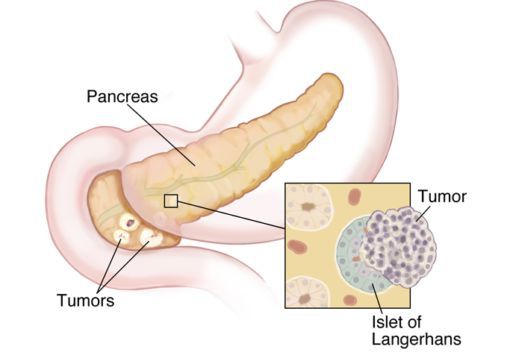
Нейроэндокринная система (НЭС) — отдел эндокринной системы, клетки которой рассеяны по всему организму и выполняют регуляторную функцию органов и систем посредством выработки гормонально-активных веществ. [1]
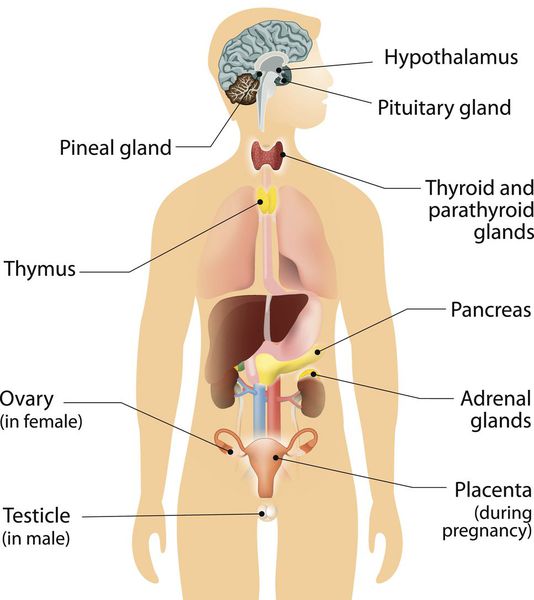
Карциноидные опухоли могут развиваться в любых органах, но чаще локализуются в органах желудочно-кишечного тракта (ЖКТ — желудок, тонкий и толстый кишечник), лёгких, тимусе, поджелудочной железе и почках.
Ввиду высокой гормональной активности клеток НЭС, при развитии опухолевого процесса (неконтролируемого деления клеток), в кровь поступает большое количество гормонально-активных веществ. В медицине эта ситуация носит название “Карциноидный синдром” и может проявляться в виде:
- приливов;
- персистирующей диареи (то есть, затяжной — более 14 дней);
- фиброзного поражения правой половины сердца;
- болей в животе;
- бронхоспазма.
Точные причины, вызывающие карциноидные опухоли, не известны. Однако есть ряд факторов, предполагающих повышенный риск развития данного заболевания:
- Пол — женщины имеют более высокую вероятность развития карциноидной опухоли, чем мужчины.
- Возраст — в большинстве случаев карциноидные опухоли диагностируются в возрасте от 40 до 50 лет.
- Наследственность — наличие множественной эндокринной неоплазии (опухоли) I типа (MEN I) у ближайших родственников увеличивает риск развития карциноидных опухолей. У пациентов с MEN I происходит развитие множественных опухолей в железах эндокринной системы.
Симптомы карциноида
Само по себе развитие карциноидной опухоли редко имеет клинические проявления. Все основные симптомы связаны с высвобождением большого количества гормонально-активных веществ в кровь, то есть с карциноидным синдромом.
Основными проявлениями карциноидного синдрома являются:
- приливы;
- диарея;
- боль в животе;
- одышка;
- поражение сердечных клапанов;
- кожная сыпь.
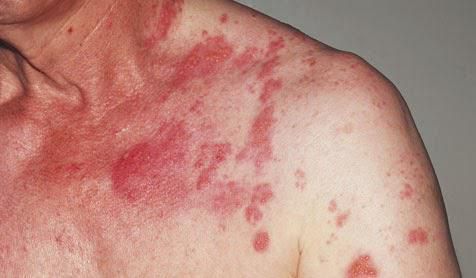
Покраснение лица и шеи — самый частый симптом данной болезни.
Начало типичного прилива внезапное. Ему характерно:
- красное окрашивание лица и верхней части туловища;
- потливость, длящаяся несколько минут.
В течение дня приступ может возникать несколько раз. Иногда он может сопровождаться обильным слезоотделением и провоцироваться приёмом алкоголя или пищи, которая содержит тирамин (шоколад, орехи, бананы). Часто данное состояние расценивается как менопаузальные приливы и остаётся без особого внимания.
Иногда встречаются и редкие симптомы карциноидного синдрома, являющиеся следствием опухолей отдельных типов клеток НЭС, чётко ассоциированные с различными органами.
В поджелудочной железе выделяют:
- гастриномы (синдром Золлингера — Эллисона);
- инсулиномы;
- випомы (синдром Вернера — Моррисона);
- глюкагономы.
Также существует ряд опухолей, которые секретируют (вырабатывают) эктопические гормоны, то есть помимо основного органа в организме, производящего определённый гормон, в организме развивается опухоль, параллельно выделяющая тот же гормон.
Наиболее часто встречается эктопическая продукция адренокортикотропного гормона (АКТГ), вследствие чего пациенты приобретают внешний вид, характерный для больных с синдромом Иценко — Кушинга. Однако на практике данные опухоли встречаются редко и имеют специфическую клиническую картину.
Патогенез карциноида
Основное звено в патогенезе всех онкологических заболеваний — бесконтрольное деление клеток. Однако при развитии опухоли в нейроэндокринной системе основное отличие заключается в том, что клетки этой ткани имеют способность вырабатывать гормонально-активные вещества.
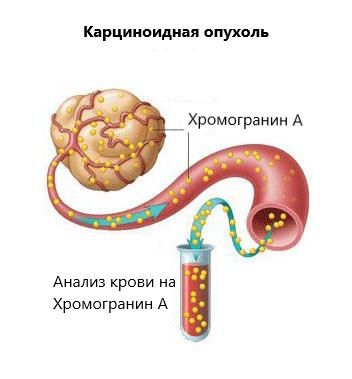
НЭС представляет собой широкую клеточную сеть, рассеянную по всему организму, которая, выделяя гормонально-активные вещества, участвует в регуляции работы органов и систем. При развитии опухоли и неконтролируемом делении данные клетки начинают продуцировать повышенное количество гормонально-активных веществ.
Основное продуцируемое вазоактивное вещество — серотонин. Однако приливы чаще происходят в результате секреции калликреина. Это фермент (ускоритель), который участвует в образовании лизил-брадикинина. Далее этот полипептид превращается в брадикинин — один из самых мощных сосудорасширяющих веществ.
Другими компонентами карциноидного синдрома являются:
- диарея (связана с повышенной продукцией серотонина, который значительно увеличивает перистальтику (сокращение полых органов), оставляя меньше времени для всасывания жидкости в кишечнике);
- фиброзное поражений сердечной мышцы (особенно правых отделов, что приводит к недостаточности клапанов сердца);
- бронхоспазм.
Патогенез поражения сердечной мышцы и бронхоспазма сложен и включает активацию рецепторов серотонина 5-НТ2В. [2]
При нахождении первичной опухоли в ЖКТ серотонин и калликреин распадаются в печени, и проявления карциноидного синдрома не возникают до тех пор, пока в печени не появляются метастазы, или же карциноидная опухоль не сопровождается печёночной недостаточностью (циррозом).
Карциноидные новообразования бронхолёгочной локализации могут провоцировать развитие карциноидного синдрома и без метастазов в печени. Данные различия связаны с особенностью кровоснабжения, при котором отток крови от органов ЖКТ происходит через печень и фильтруется в ней, а отток крови от органов грудной клетки происходит сразу в системный кровоток.
Классификация и стадии развития карциноида
Классификация карциноидов основана на оценке различных факторов.
I. По локализации
В зависимости от расположения первичной опухоли выделяют:
- карциноидные опухоли органов грудной клетки (лёгкие, бронхи, тимус) — составляют около 25% от общего количества опухолей НЭС;
- опухоли пищеварительной системы — составляют более 60% от общего количества опухолей НЭС. [3]
II. По степени дифференцировки и потенциала злокачественности [7]
Заболеваемость
Ежегодная заболеваемость типичными и атипичными карциноидными опухолями легких составляет 0,6/100 тыс. чел. в год, а стандартизованный показатель заболеваемости опухолями тимуса ― 0,01/100 тыс.чел. в год. 25% всех карциноидных опухолей локализуются в дыхательных путях. Карциноиды легких составляют 1-2% от всех опухолей легких. Карциноидные опухоли легких и тимуса могут являться составной частью сложного синдрома множественной нейроэндокринной неоплазии I типа (MEN-1).
Диагноз
Около 70% всех карциноидов локализуются в главных бронхах и 1/3 в периферических отделах легких. Чаще всего они развиваются в правом легком, преимущественно в средней доле. У 92% пациентов в клинической картине имеются кровохарканье, кашель, рецидивирующая легочная инфекция, лихорадка, дискомфорт в груди и локализованные хрипы.
У пациентов с карциноидами легких и тимуса карциноидный синдром встречается очень редко, до 2%. Серотонин является наиболее часто определяемым пептидом, вызывающим карциноидный синдром. Порой, карциноидный криз может случиться у изначально бессимптомных пациентов после бронхоскопической биопсии или хирургической манипуляции. Приблизительно у 2% пациентов с карциноидами легких и тимуса есть синдром Кушинга, обусловленный эктопической выработкой адренокортикотропного гормона (АКТГ).
Диагностические процедуры включают в себя рентгенограмму органов грудной клетки, компьютерную томографию, бронхоскопию, в отдельных случаях сцинтиграфию с использованием изотопов к рецепторам соматостатина, в то время как позитронно-эмиссионная томография (ПЭТ) с флюородеоксиглюкозой (ФДГ) часто дает ложно ― отрицательные результаты и не рекомендована к использованию.
Диагноз устанавливается на основании гистологического исследования и определения нейроэндокринных маркеров иммуногистохимическими методами. Для диагностики опухолей тимуса может потребоваться торакотомия. При легочной локализации у пациентов с центрально расположенными карциноидами во время бронхоскопического исследования выполняется биопсия. Использование ригидного бронхоскопа имеет преимущество в заборе большего объема материала, более достоверного для исследования. Для снижения риска кровотечения перед выполнением биопсии через бронхоскоп вводят раствор эпинефрина. “Brush” цитология не имеет значения для диагностики нейроэндокринных опухолей.
Гистологическая классификация нейроэндокринных опухолей легкого:
- типичный карциноид, характеризующийся высокой степенью дифференцировки и низким митотическим индексом.
- атипичный карциноид, характеризующийся более высоким митотическим индексом, меньше 10/10HPF, и отдельными участками очагового некроза.
- Крупноклеточная нейроэндокринная карцинома, которую бывает сложно отличить от атипичного карциноида; характеризуется большим митотическим индексом (>10/10HPF) и более распространенными некрозами.
- Мелкоклеточный рак легких (МКРЛ) ― самая низкодифференцированная нейроэндокринная опухоль легких, называемая также классической “овсяноклеточной карциномой”. Митотический индекс очень высокий (больше 80/10 HPF) с обширными зонами некроза. МКРЛ рассматривается в отдельной главе Клинических рекомендаций ESMO.
Как типичный, так и атипичный карциноиды легких могут экспрессировать нейроэндокринные маркеры, выявляемые иммуногистохимическими методами (хромогранин-А, синаптофизин и нейронспецифическая энолаза) и рецепторы к соматостатину. Тоже касается карциноидов тимуса, которые экспрессируют нейронспецифическую энолазу в 73%, соматостатин в 36% и АКТГ в 27% случаев. Крупноклеточная карцинома и мелкоклеточный рак легких мало экспрессируют синаптофизин и нейронспецифическая энолазу и редко экспрессируют хромогранин-А. При последних двух гистологических вариантах также обнаруживаются мутации хромосомы p53.
Нейроэндокринные опухоли тимуса могут иметь разные степени дифференцировки от типичного высоко дифференцированного карциноида до мелкоклеточного рака.
Стадирование и факторы риска
Для нейроэндокринных опухолей легких не существует какого-либо особого стадирования по системе TNM. TNM стадирование осуществляется по критериям, применимым к немелкоклеточному раку легких. Классификация по системе TNM и стадирование карциноидов тимуса следует общим правилам, применимым к опухолям тимуса, и представлена в таблице №1.
Рентгенограмма органов грудной клетки позволяет предположить диагноз, но лучшими методами для диагностики нейроэндокринных опухолей легких являются КТ и бронхоскопия с ультрасонографией и биопсией [III, B].
В связи с тем, что 80% типичных карциноидов легких экспрессируют рецепторы соматостатина, сцинтиграфия с использованием изотопов к рецепторам соматостатина может быть высоко информативной [III, B].
Для выявления первичных очагов и метастазов карциноидов тимуса рекомендуется выполнять КТ или МРТ с внутривенным контрастированием.
Сцинтиграфия с использованием изотопов к рецепторам соматостатина является дополнительным методом.
Биохимические показатели зависят от гистологического типа нейроэндокринной опухоли легких. Типичный карциноид характеризуется повышенным уровнем хромогранина-A [III, B] в плазме крови. При наличии симптомов, обусловленных гормональной активностью, может отмечаться повышение уровня АКТГ в плазме, соматолиберина, инсулиноподобного фактора роста, 5-гидроксиуксусной кислоты или метаболитов гистамина, а также уровня кортизола в моче [III, B]. Биохимический профиль карциноида тимуса обычно похож на профиль при карциноидной опухоли легких.
Типичный карциноид ― вяло текущая опухоль с низкой вероятностью возникновения рецидива. После радикального удаления метастазы возникают редко (7% случаев). 5-летняя выживаемость составляет 80%, в то время как уровень 5-летней выживаемости при атипичном карциноиде составляет 60%.
Как крупноклеточная нейроэндокринная карцинома, так и МКРЛ характеризуются плохим прогнозом с 5-летним уровнем выживаемости меньше 10 %.
Карциноиды тимуса, при большей выживаемости в отдельных случаях, имеют низкий процент излечиваемости (в среднем 10-15%); поэтому в целом имеют общий прогноз хуже, чем карциноиды легких.
Лечение
Хирургический метод является основным методом лечения всех локализованных типичных и атипичных карциноидов, как легких, так и тимуса с уровнем 5-летней выживаемости от 80 до 100%. Оперативное вмешательство не является ведущим при крупноклеточной карциноме и МКРЛ, за исключением опухолей небольшого размера, например при T1-2 N0; гистологическая верификация периферически расположенных опухолей небольшого размера позволяет их радикально удалить.
Хирургический доступ зависит от размера, локализации и типа ткани. Удаление пристеночного типичного карциноида легких можно выполнить бронхоскопическим методом (когда бронхоскопия должна выполняться под контролем КТ), который может привести к полному излечению значительного количества пациентов. Опухоли, не соответствующие критериям эндобронхиальной резекции, можно удалить методами краевой резекции легкого, сегментэктомии, лобэктомии или пневмонэктомии.
При локализованных формах [III, B] возможно дистанционное облучение очага, особенно если не планируется проведение хирургического вмешательства. Эндобронхиальное лазерное лечение, хоть и не является патогенетическим, можно использовать в определенных случаях для лечения обструкции дыхательных путей.
Метастатические и рецидивные опухоли
Стандартным методом лечения метастатических карциноидов легких и тимуса является химиотерапия в сочетании с хирургией, когда это возможно, хотя существующие режимы химиотерапии являются гораздо менее эффективными. Химиотерапия МКРЛ, являющегося чувствительным к химиопрепаратам, но не излечиваемым, обсуждена в соответствующих разделах. В случае симптомных гормонопродуцирующих низкодифференцированных опухолей [III, B] возможно применение аналогов соматостатина и альфа-интерферона.
При гормонально-неактивных опухолях целесообразность применения аналогов соматостатина находится под вопросом. При высоком уровне экспрессии рецепторов соматостатина клетками опухоли одним из возможных методов лечения является лучевая терапия [III, B].
Оптимальными режимами химиотерапии типичного и атипичного карциноидов и крупноклеточной нейроэндокринной карциномы являются комбинация 5 ФУ и альфа-интерферона; комбинации на основе стрептозооцина; химиотерапия, включающая этопозид/цисплатин или химиотерапия, включающая циклофосфамид, доксорубицин и винкристин. В целом, результаты химиотерапевтического лечения сомнительны, и данные по выживаемости следует интепретировать с осторожностью.
Метастатическое заболевание с клиническими проявлениями требует паллиативной терапии с использованием таких способов лечения как эмболизация метастазов в печени и лучевая терапия метастазов в головной мозг и кости.
После радикального хирургического лечения больные с типичным и атипичным карциноидом должны наблюдаться ежегодно в течение 10 лет [III,C] с целью выявления возможных рецидивов в зоне хирургического вмешательства.
Каждые 3-6 месяцев следует определять уровень биохимических маркеров, таких как хромогранин-А (в случае, когда они изначально были повышены); КТ или МРТ следует повторять ежегодно.
Пациенты с метастазами или рецидивом опухоли должны обследоваться во время проведения химио- и биотерапии чаще, каждые 3 месяца, с мониторингом (предпочтительно КТ) и определением уровня биологических маркеров с целью оценки результатов проведенного лечения.
Классификация TNM и стадирование злокачественных опухолей тимуса.
pТ1 Полностью инкапсулированная опухоль
pТ2 Опухоль с прорастанием капсулы, инвазией в тимус или жировую клетчатку
pТ3 Инвазия в медиастинальную плевру или перикард или инвазия в соседние органы, такие как крупные сосуды или легкие
pТ4 Опухоль с имплантацией в плевру или перикард
pN0 Отсутствие метастазов в лимфатические узлы
pN1 Метастазы в лимфатические узлы переднего средостения
pN2 Метастазы во внутригрудные лимфатические узлы, за исключением метастазов в лимфатические узлы переднего средостения
pN3 Метастазы в отдаленные лимфатические узлы
М0 Отсутствие отдаленных органных метастазов
М1 Наличие отдаленных метастазов
Группировка по стадиям
Стадия I T1, T2 N0 M0
Стадия II T1,T2 N1 M0
Стадия III T3 N0,N1 M0
Стадия IV a T4 N0,N1 M0
Стадия IV b любая T N3 M0
Стадия IV c любая T любая N M1
2) НОВООБРАЗОВАНИЯ ВНУТРИГРУДНОЙ ЛОКАЛИЗАЦИИ
(КЛИНИКА, ДИАГНОСТИКА, ЛЕЧЕНИЕ, ПРОГНОЗ)
Доклад: НЕЙРОЭНДОКРИННЫЕ ОПУХОЛИ ЛЕГКИХ.
ОПЫТ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
ТрахтенбергА.Х.. Франк Г.А. Пикин О.В. Соколов В.В. Бойко А.В. Колбанов К.И.
(МНИОИ им. П.А. Герцена)
Среди нейроэндокринных опухолей ( H ЭО) легких выделяют, согласно Международной гистологической классификации*), карциноид (типичный и атипичный). а также нейроэндокринный крупноклеточный и мелкоклеточный рак.
1. Карциноид выявляется у 3-5% оперированных по поводу новообразований легких. В отличие от рака легкого при карциноидах не выявлено четкой взаимосвязи с курением и воздействием канцерогенов (хотя отмечено, что у курящих пациентов преобладает (64-80%) атипичный тип карциноида). Благодаря высоким показателям выживаемости карциноиды рассматривались как доброкачественные новообразования.
Своеобразие гистологической структуры (наличие специфических нейросекреторных гранул в цитоплазме клеточных элементов) и функциональной активности (в 5-7% клетки опухоли могут секретировать гормонально-активные вещества – серотонин, адреналин, АКТГ и др.), наличие лимфогенного и гематогенного метастазирования, возможность рецидивирования обосновали выделение карциноидов в самостоятельную группу злокачественных эпителиальных опухолей легкого. Карциноиды подразделяют на типичные и атипичные. что обусловлено различной степенью дифференцировки клеток, их пролиферативной активностью и способностью к метастазированию. На основании морфологической структуры, электронномикроскопической характеристики, гистоиммунохимических реакций, клинического течения и прогноза в МНИОИ выделены три подтипа карциноида: высокодифференцированный (типичный), умеренно дифференцированный (атипичный), низкодифференцированнный (анаплазированный). Подобное деление более удобно с клинических позиций, т.к. клетки отличаются между собой различным потенциалом злокачественности в виде выраженности инфильтративного роста, темпа прогрессии и способности к метастазированию.
Карциноид может локализоваться и в легочной паренхиме и в бронхах, что, по аналогии с раком легкого, предопределяет выделение для этой опухоли центральной и периферической клинико-анатомических форм. По отношению к стенке бронха карциноид характеризуется экзофитным. эндофитным и смешанным типами роста. При центральной форме карциноида течение болезни бессимптомно в каждом четвертом случае, в каждом втором отмечается кровохарканье, что обусловлено выраженной васкуляризацией опухоли. Клинические проявления определяются уровнем поражения бронха, степенью нарушения легочной вентиляции. Типичный карциноид, обладая более медленным темпом роста, как правило, не приводит к резкой декомпенсации дыхания. В некоторых случаях жалобы на одышку соответствуют приступам бронхиальной астмы, что обусловливается, по всей видимости, клапанным механизмом обтурации крупного бронха.
Несмотря на секрецию опухолью гормонов и биологически активных веществ карциноидный синдром наблюдается лишь у 1-5% больных и характеризуется жалобами на приступы жара или приливов крови к голове, шее, рукам; проявлениями бронхоспазма. диареи, дерматозов; в некоторых случаях – расстройствами сознания. У 2% больных также выявляется акромегалия, синдром Иценко-Кушинга.
С 2000-х гг. как для дифференциальной диагностики карциноидов, так и для контроля эффективности лечения все чаще применяются исследования специфических опухолевых маркеров: хромогранина А. нейронспецифической енолазы, фракции гликопротеиновых гормонов и др.
Основным методом радикального лечения локализованного карциноида является хирургический. Собщается о целесообразности послеоперационной лучевой терапии при метастазах во внутригрудных лимфоузлах. особенно средостенных. Химиотерапия имеет ограниченные возможности и целесообразна только при генерализованных формах заболевания. В случаях клинической картины карциноидного синдрома назначается октреотид и его аналоги. Характер и объем оперативного вмешательства отличается от такового при раке легкого в 3 раза более редким выполнением пневмонэктомий (7-16%). Необходимость пневмонэктомии при центральном карциноиде обычно обусловлена вторичными необратимыми гнойно-воспалительными изменениями в легочной паренхиме в результате длительной обтурации главного бронха. При карциноидах, в отличие от рака легкого, линия пересечения бронха, без ущерба для радикализма, может отдаляться от видимого края опухоли всего на 5- 7 мм (при условии негативного результата интраоперационного морфологического исследования линии разреза). Основными операциями при карциноидах являются органосохранные хирургические вмешательства типа лобэктомии; несмотря на меньшую в целом частоту регионарного лимфогенного метастазирования с ледует удалять клетчатку с лимфатическими узлами средостения, соблюдая принципы онкологического радикализма.
Хирургическое лечение по поводу бронхолегочного карциноида выполнено 217 пациентам МНИОИ. Согласно принятой нами систематизации карциноидных опухолей легких, высокодифференцированный тип (типичный карциноид) диагностирован у 120, умереннодифференцированный (атипичный) – у 45 и низкодифференцированный (анаплазированный) – у 52 больных. Регионарные метастазы ( N +) выявлены в 3,0% наблюдений при типичном, в 17,5% – при атипичном и в 74,0% – при анаплазированном карциноиде. Преобладали органосохранные операции: ло б- и билобэктомии выполнены у 40,0%, лобэктомии с резекцией и пластикой бронхов – у 30,0%, сегментэктомии – у 4,0% больных. При центральном карциноиде у 14 пациентов выполнена изолированная резекция бронх а( ов ) с моно- или полибронхиальными анастомозами, т.е. сохранением непораженной паренхимы легкого.
Пятилетняя выживаемость соответствовала 81%, составив при типичном карциноиде – 100, атипичном – 90%. Отдаленные результаты при низкодифференцированном (анаплазированном) карциноиде мало-утешительны – более 5 лет жили лишь 37% пациентов (у которых не выявлялось метастазов в лимфоузлах ). В 1990-х–2000-х гг. при типичном центральном карциноиде активно применяются эндобронхоскопические операции. Помимо восстановления проходимости дыхательных путей, устранения ателектаза/ обтурационной пневмонии, данный метод лечения может считаться радикальным при высокодифференцированном карциноиде с экзофитным типом роста, при отсутствии перибронхиального компонента и увеличенных внутригрудных лимфатических узлов.
Эндобронхоскопическое лечение нами проведено 32 пациентам трахео-бронхиальными карциноидными опухолями – высокодифференцированными (21), умереннодифференцированными (9) и низкодифференцированными (2). Поражение главного бронха наблюдалось у 21 больного, долевого – у 7, трахеи – у 3, а у одного пациента имелись первично-множественные карциноидные опухоли с локализацией в трахее и бронхах. Размер удаляемой экзофитной части опухоли соответствовал 0,5- 6,0 см. Радикальное эндоскопическое лечение удалость выполнить 18 (56,2%) больным. Местный рецидив возник у одного пациента через 8 лет, ему повторно проведено эндобронхоскопическое лечение. Остальным 14 больным после эндоскопических воздействий выполнены органосохранные операции из трансторакального доступа.
Среди 178 больных морфологически верифицированным крупноклеточным раком легкого лишь у 12 (6,7%), по результатам гистоиммунохимического исследования операционного материала, диагностирован нейроэндокринный вариант; 1; 3 и 5-летняя выживаемость при этом составила 40; 10; и 0%.
Таким образом . карциноиды – наиболее благоприятно протекающие злокачественные нейроэндокринные опухоли легкого. Морфологические подтипы карциноида отличаются разным потенциалом злокачественности в виде выраженности инфильтративного роста, темпа прогрессии и способности к метастазированию. При центральной клинико-анатомичекой форме опухоли клинические проявления и рентгенологические признаки связаны с нарушением бронхиальной проходимости. Основным методом лечения признан хирургический. Большинству пациентов удается выполнить органосохранные операции. Значительному числу больных удается продлить жизнь на 5 и более лет. Крупноклеточный нейроэндокринный рак по прогнозу соответствует мелкоклеточному, в связи с этим целесообразен расширенный диагностический поиск очагов отдаленного метастазирования на дооперационном этапе. Необходимо совершенствование вариантов комбинированного лечения с применением современных лекарственных препаратов. Мелкоклеточный рак легкого, несмотря на высокую чувствительность к консервативным методам лечения, является самым прогностически неблагоприятным новообразованием. Однако, несмотря на злокачественность клинического течения, на локорегионарной стадии этих опухолей правомерна операция как компонент комбинированного лечения.
СОВРЕМЕННЫЕ ТЕНДЕНЦИИ В ДИАГНОСТИКЕ, ЛЕЧЕНИИ, ОПРЕДЕЛЕНИИ ПРОГНОЗА
НЕЙРОЭНДОКРИННЫХ ОПУХОЛЕЙ ВНУТРИГРУДНОЙ ЛОКАЛИЗАЦИИ
Давыдов М.И. Полоцкий Б.Е. Смирнова Е.А. Горбунова В.А. Унгиадзе Г.В. Мачаладзе З.О.
Кононец П.В. Орел Н.Ф. Алексеева Т.Р. Маркович А.А. Волова Н.А. ЧекиниА.К.
(РОНЦ им. Н.Н.Блохина)
В торакальном отделении РОНЦ в 1980-х – 2000-х гг. наблюдались 192 больных нейроэндокринными опухолями внутригрудной локализации. В 175 случаях новообразования локализовались в легких, в 17 – в вилочковой железе. Наблюдения нейроэндокринного крупноклеточного, а также мелкоклеточного рака в данном сообщении не рассматривались.
Нейроэндокринные опухоли легких
В 175 случаях новообразования локализовались в легких. Из них у 158 больных были диагностированы типичные, у 19 – атипичные карциноиды.
В отличие от типичного карциноида, атипичные нейроэндокринные опухоли легких характеризовались бờльшими размерами и чаще локализовались в периферических отделах легочного поля. Эти опухоли отличали злокачественное (агрессивное) течение, раннее метастазирование в медиастинальные лимфатические узлы. Симптомы заболевания, как правило, появлялись за много лет до выявления опухоли.
При этом более чем у 30% пациентов заболевание протекало бессимптомно и диагностировалось случайно при профилактической флюорографии. При центральной локализации симптомы напоминали бронхообструктивный синдром (бронхиальную астму). Нарастание обструкции бронха сопровождалось ателектазом, пневмонией, кровохарканьем. Паранеопластические синдромы встречались редко.
Карциноидный синдром (приливы, этапное изменение окраски кожных покровов, бронхоспазм, диарея, схваткообразные боли и т.д.) проявлялся приблизительно у 2% больных. Появление вышеуказанных симптомов коррелировало с развитием отдаленных метастазов (прежде всего – в печени). АКТГ-эктопированный синдром встречался приблизительно в 5% случаев. В основе эктопической продукции АКТГ – выработка опухолью АКТГ-подобных веществ ( рилизинг-гормоны. гормоны, подобные гипофизарным, СТГ, ТТГ, пролактин, гонадотропины, др.); в результате развиваются гиперплазия коры надпочечников и гиперкортицизм. Эти состояния обусловливали последующие клинические проявления заболевания. Для рутинной диагностики НЭО применялись хромогранин А и синаптофизин, 5-ОИУК.
Оценка злокачественности представляет значительные трудности для патологов, т.к. для этих опухолей не всегда пригодны критерии, обычно применяемые в онкоморфологии – митотический индекс, ядерный и клеточный полиморфизм, увеличение размеров ядрышек, инфильтративный рост и инвазия сосудов. Единственным достоверным подтверждением малигнизации является развитие метастазов.
Поиск морфологических критериев, касающихся определения экспрессии нейроэндокринных маркеров, а также индекса (скорости) пролиферации опухолевых клеток Кi -67. установление взаимосвязей между степенью злокачественности и степенью дифференцировки опухоли остаются наиболее актуальными проблемами.
Существенным фактором прогноза течения НЭО является степень злокачественности опухоли – низкая, промежуточная и высокая. Высокодифференцированные опухоли характеризуются низкой или промежуточной злокачественностью, а низкодифференцированные – высокой. Индекс пролиферации Кi -67 высокодифференцированных опухолей составляет 1-20%, а низкодифференцированных, таких как мелкоклеточный или крупноклеточный нейроэндокринный рак – 50-90%. При этом существенно отличаются по клиническому течению высокодифференцированные НЭО, которые даже при наличии метастазов прогрессируют очень медленно – от нескольких лет до десятилетий, и напротив, низкодифференцированные новообразования высокой степени злокачественности, со стремительной диссеминацией, устойчивые к лечению. Следует отметить, что индекс К i-67 может меняться в пределах одной опухоли.
Важное прогностическое значение придается определению маркеров клеточной пролиферации – агрирофиль ных белков областей ядрышковых организаторов. Этими маркерами являются нуклеофозмин и нуклеонин. Показано, что при высоком уровне их экспрессии происходит неконтролируемый клеточный рост и злокачественная трансформация.
При нейроэндокринных поражениях легких оперированы 166 (86%) пациентов. Выполнялись преимущественно органосохраняющие операции – атипичные резекции (12), ло б- и билобэктомии (132), пневмонэктомии (15); в 7 случаях операции были ограничены эксплоративной торакотомией. Радикальные операции составили 90% случаев и обязательно дополнялись систематической медиастинальной лимфодиссекцией.
При типичном карциноиде поражение лимфоузлов соответственно индексу N1 и N2 диагностировано в 3,8 и 0,0% случаев. При атипичном карциноиде указанное поражение лимфоузлов выявлено в 26,1 и 39,2% наблюдений; отсутствие метастатического поражения лимфоузлов (N0 ) отмечено в 34,8% случаев. Наличие регионарных лимфогенных метастазов в сочетании с паранеопластическим синдромом усиливало неблагоприятный прогноз. Течение заболевания и результаты хирургического лечения, прежде всего, определялись вариантом опухоли. В целом, 5-летняя выживаемость в группе типичного карциноида составила порядка 90-100%, атипичного – 43,7%.
Нейроэндокринные опухоли вилочковой железы – достаточно редкая локализация новообразований.
В дифференциальной диагностике НЭО тимуса и истиных тимом обязательно применяется окраска на NSE, а также электронная микроскопия, позволяющая выявить ультраструктурные особенности опухоли (специфическую нейросекреторную зернистость). Электронная микроскопия более информативна и имеет большее прогностическое значение, чем стандартная световая микроскопия.
Нейроэндокринные опухоли тимуса обычно выявляются при профилактическом обследовании. Продолжительность заболевания от установления диагноза до начала лечения может достигать 4-9 лет. Клиническая симптоматика неспецифична (боль в груди, отдышка, лихорадка, др.). но может сопровождаться проявлениями медиастинального компрессионного синдрома и эндокринопатией: наблюдается синдром Иценко-Кушинга (в 25-30% случаев), эктопическая продукция АДГ, гипертрофическая остеоартропатия и синдром Итона-Ламберта. Описаны эндокринные нарушения в виде карциноидного синдрома. Первыми проявлениями опухолей могут стать метастазы в шейных лимфоузлах. костях, коже.
Обобщение опыта клиники Mayo позволило выделить три варианта клинического течения нейроэндокринных опухолей тимуса: 1) с повышением уровня АКТГ и развитием синдрома Иценко- Кушинга ; 2) с проявлениями синдрома множественной эндокринной неоплазии I типа ( MEN -I ). в сочетании с гиперпаратиреоидизмом и опухолью поджелудочной железы; 3) бессимптомное течение. Первая группа характеризовалась наихудшим прогнозом, хотя в клиническом течении заболевания в остальных группах также отмечена выраженная местная распространенность и наличие лимфогенных метастазов в 73% наблюдений. Агрессивность клинического течения НЭО тимуса подтверждалась выраженной макр о- и микроинвазией в ткани средостения, а также отдаленными метастазами в 30% случаев.
Важно подчеркнуть, что при НЭО тимуса отсутствуют симптомы аутоиммунных заболеваний, таких, например, как генерализованная миастения. Нейроэндокринные опухоли тимуса характеризуются местными рецидивами (30-40%), частыми метастазами (в печень и легкие) несмотря на применения послеоперационной лучевой или химиотерапии. Особенно неблагоприятен прогноз при сочетании НЭО тимуса с новообразованиями других эндокринных желез (гипофиза, паращитовидных желез, поджелудочной железы, надпочечников).
Методом выбора в лечении нейроэндокринных опухолей тимуса является хирургический. Как и при других локализациях опухоли, прогностическую значимость представляют характеристики опухоли и ее распространенность на момент операции, а также радикальность хирургического вмешательства. Лучевая и химиотерапия самостоятельного значения не имеют и применяются либо с адъювантной целью, либо для симптоматического воздействия на неудалимую или рецидивную опухоль в случаях противопоказаний к хирургическому лечению.
Из 17 больных, наблюдавшихся в РОНЦ, оперированы 10; хирургическое лечение дополнялось лучевой терапией. В 7 случаях проводилась только лучевая и химиотерапия. Тимэктомии производились с обязательной систематической медиастинальной лимфодиссекцией.
Продолжительность жизни больных после радикальных операций составила от 1 года до 16 лет; после консервативного лечения – от 1 года до 8 лет.
Читайте также:

