Научная статья рак предстательной железы

Для лечения РПЖ чаще всего применяют хирургический метод, радио- и гормональную терапию [1]. Методом выбора при лечении больных с локализованными формами рака простаты считается радикальная простатэктомия при сохраненном соматическом статусе [2; 3]. В то же время сдержанное отношение многих урологов к радикальной простатэктомии объясняется технической сложностью операции и сравнительно высокой частотой послеоперационных осложнений, которые обусловлены, прежде всего, анатомическими особенностями железы [5]. При планировании лечения пациентов после радикальной простатэктомии необходима комплексная оценка морфологических факторов риска местного рецидива новообразования [3]. Несмотря на достигнутый за последние десятилетия значительный прогресс в хирургическом лечении больных РПЖ, в отечественной литературе отсутствует всесторонний анализ его результатов. Далеко не в полной мере разработаны прогнозирование и диагностика рецидивов РПЖ после хирургического лечения. Сведения иностранных авторов по этому поводу носят разноречивый характер, затрудняющий их использование в клинических условиях [15].
Лучевая терапия в настоящее время признается одним из ведущих консервативных специальных методов лечения РПЖ, включая местнораспространенные формы [7; 12]. В литературе последних лет утвердилось мнение о том, что лучевая терапия является хорошей альтернативой радикальной простатэктомии при ранних стадиях (Т1-Т2) рака предстательной желез. При этом в подходах к лучевому лечению у различных авторов имеются различные мнения, касающиеся техники и технологии облучения, объема лучевого воздействия и суммарных очаговых доз [5]. Введение в клиническую практику дистанционной гамма-терапии обусловило 5-летнюю выживаемость у 54% больных РПЖ в стадии Т3NхМ0. Лучевая терапия применяется также в случае невозможности простатэктомии в связи с возрастом, сопутствующими заболеваниями и другими причинами. Большинство современных исследователей считают, что куративное лучевое лечение нужно проводить при РПЖ с прорастанием в капсулу при низкой степени злокачественности опухоли, а также при общих противопоказаниях к радикальной простатэктомии [9]. Последние данные литературы свидетельствуют о серьезных достижениях лучевого метода лечения. Так, группа RTOG привела отдаленные результаты лучевого лечения в крупнейших лечебных учреждениях, занимающихся этой проблемой. Отдаленные результаты при РПЖ в стадии Т3, по данным RTOG: пролечено 2292 пациента, локальный рецидив через 5 лет отмечен у 12-26% больных, через 10 лет - у 19-31%, и через 15 лет у 25-56%. Безрецидивная выживаемость через 5 лет наблюдалась у 32-60% больных, через 10 лет - у 14-16% и через 15 лет - у 17- 40% больных [12; 22].
Данные последних лет свидетельствуют о преимуществе комбинированного гормонального и лучевого лечения у больных РПЖ. Так, в исследовании EORTC, включавшем 401 пациента с РПЖ в стадии Т3 и Т4 без отдаленных метастазов, показано улучшение результатов лечения при применении адъювантной терапии аналогами лютеинизирующего гормона - релизинг-гормона, в частности золадексом [21]. Представляют несомненный интерес результаты другого крупного рандомизированного исследования американской онкологической радиологической группы (RTOG), показавшей преимущества адъювантной терапии гозерелином в сочетании с радиотерапией по сравнению только с радиотерапией [24]. Проведенные рандомизированные исследования показали преимущество этой комбинации по сравнению с только лучевой терапией [7; 12; 20]. В настоящее время продолжается ряд исследований по сочетанию лучевой и гормональной терапии, так как существующих данных пока недостаточно для окончательных выводов об оптимальной последовательности этих двух методов, а также продолжительности гормональной терапии [9].
В последние годы определенное внимание уделяется больным с местнораспространенными формами (Т3NхМ0) заболевания. Контингент этих больных остается довольно значительным, по данным разных авторов [16], впервые выявляется в 24-68,5% случаев. К потенциальным развивающимся технологиям локальной терапии относятся: сфокусированное ультразвуковое излучение высокой интенсивности, криотерапия, брахитерапия и фотодинамическая терапия [1; 2]. Для лечения больных с ожидаемой продолжительностью жизни менее 10 лет, а также для тех, кто отказался от открытой операции из-за возможных осложнений и для пациентов с тяжелым интеркуррентным фоном, предложен ряд альтернативных методов, одним из которых является Высокоинтенсивный фокусированный ультразвук - HIFU [8]. Действие ультразвукового излучения высокой интенсивности основывается на образовании коагуляционного некроза под воздействием температуры более 60°С. Эффективность терапии составляет 69-75%, основываясь на критерии предложенном Американским обществом лечебной радиологии и онкологии и по результатам биопсий при наблюдении за больными в течение от 13 до 27 мес. после операции [26]. По данным Безрукова Е.А. [2], трехлетняя выживаемость после HIFU при локализованном РПЖ низкого и умеренного онкологического риска составила 100% - общая, 78% - безрецидивная. В мировой периодической печати появляются публикации, в которых анализируется его эффективность, обсуждаются показания к применению, несомненно, это сравнительно новый метод, требующий дальнейшего изучения и более длительного периода послеоперационного наблюдения. В настоящее время не существует абсолютно эффективного метода лечения рака простаты, местный рецидив возможен после любого из них. Однако только HIFU позволяет осуществить повторную операцию практически после каждого из них. Отрицательные результаты контрольной биопсии после 2 сеансов HIFU имели место у 84,7% больных локализованных стадий рака простаты высокого, среднего и низкого онкологического риска. Отрицательные результаты контрольной биопсии у пациентов стадии Т3а после повторного сеанса HIFU получены у 80% больных. Безрецидивное течение отмечено у 72% больных стадии Т3а [8].
Брахитерапия 125 J Rapid-Strand является современным, высокотехнологичным, эффективным, сравнительно безопасным и легко воспроизводимым методом лечения РПЖ, с низким уровнем осложнений и смертности. Однако в настоящее время не изучены отдаленные результаты лечения методом брахитерапии, не проведено качественное сравнение с другими видами лечения локализованного и местнораспространенного РПЖ, в связи с чем не определено, может ли брахитерапия рассматриваться в качестве реальной альтернативы дистанционной лучевой терапии и радикальной простатэктомии [5].
Таким образом, анализируя все выше приведенные данные, можно сделать вывод, что, несмотря на огромное количество научных публикаций по проблеме лечения РПЖ, основным вопросом остается вопрос об оценке эффективности каждого конкретного метода. С нашей точки зрения, одним из вариантов разрешения данной проблемы могло быть биопсийное исследование опухоли с оценкой ее патоморфоза. В комплексе с оценкой клинических данных данное исследование позволило бы выбрать оптимальный путь с использованием различных методов лечения с наибольшей эффективностью для больного.
Рецензенты:
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
В настоящее время в России и во многих других странах наметилась стойкая тенденция к увеличению числа больных раком простаты. Популяризация знаний об этом заболевании и современные возможности ранней диагностики позволили значительно увеличить выявляемость рака простаты на ранних стадиях, когда лечение может быть максимально эффективным.
При подробном анализе распространенности РПЖ в России выясняется, что почти у половины больных заболевание впервые выявляется на 3–4 стадии, что значительно затрудняет лечение и снижает его эффективность.
Столь широкое распространение РПЖ ставит его в ряд наиболее важных социальных проблем современности. Болезнь исключительно редко развивается раньше 40 лет и становится все более частым явлением с каждым последующим десятилетием жизни. По данным американских источников, никак себя не проявляющие очаги злокачественного перерождения предстательной железы выявляются у 15–30% мужчин старше 50 лет и у 80% мужчин старше 80 лет. Известно, что при наличии РПЖ у кровного родственника риск заболеть повышается в 2–3 раза.
Как и рак молочных желез у женщин, это заболевание на ранних стадиях практически всегда является случайной находкой или результатом специализированного скринингового обследования, поскольку длительное время не имеет никаких специфичных клинических проявлений, маскируясь за симптомами расстройства мочеиспускания, характерными для аденомы простаты, а иногда вовсе не причиняя пациенту никакого беспокойства.
Факторы окружающей среды, особенно различия в диете также играют важную роль в развитии рака простаты. Высокий уровень содержания в пище жиров животного происхождения является доказанным отрицательным фактором прогноза. В то же время было доказано, что азиатская диета, богатая соей, морепродуктами, рисом, грибами шиитаке, рыбой и зеленым чаем, оказывает некоторый защитный эффект и предотвращает развитие РПЖ.
Как было сказано выше, на начальной стадии РПЖ не имеет выраженной клинической симптоматики, что существенно затрудняет его диагностику. Признаки нарушения оттока мочи одновременно из обеих почек с развитием почечной недостаточности или появление болей в костях могут свидетельствовать о распространенности процесса.
Обнаружение простатоспецифического антигена (ПСА) в 1980-е гг. привело к революции в ранней диагностике РПЖ. ПСА – это белок, который выделяется предстательной железой и может определяться в крови в различных концентрациях. Условной границей нормы считается 4 нг/мл, но многие ведущие урологические клиники мира в последние годы склонны снижать норму этого показателя до 2,5 нг/мл, вводя дополнительные понижающие коэффициенты для более молодых мужчин. Тревожным может являться не только высокое абсолютное значение ПСА, но и высокие темпы его годового прироста (более 0,75 нг/мл). Повышение уровня ПСА – не всегда доказательство наличия рака простаты. Чувствительность этого онкомаркера составляет более 95%, а специфичность – около 75%. То есть в 25% случаев повышение уровня ПСА связано с другими причинами: наличием аденомы простаты, хроническим воспалением в предстательной железе и т. д. Так, уровень сывороточного ПСА может увеличиваться при различных манипуляциях с предстательной железой (массаж, биопсия), даже после эякуляции накануне исследования, а также при наличии инфекции.
Выбор тактики зависит от возраста больного, сопутствующих заболеваний, клинической стадии болезни, распространения опухоли и ее гистологических характеристик. Очень важно составить прогноз течения заболевания, что возможно на основании накопленного во всем мире многолетнего опыта наблюдения и лечения больных раком простаты. Хотя диагноз РПЖ на сегодняшний день ставится довольно часто, известно, что только у 25% больных непосредственной причиной смерти будет являться это заболевание.
Возраст больного – один из ключевых показателей при выборе оптимальной тактики лечения. Так, 75% больных младше 65 лет умирают от РПЖ при отсутствии надлежащего лечения. Также было установлено, что 50% пациентов с локализованным высокодифференцированным РПЖ живут более 15 лет от момента установления диагноза, даже если активного лечения не проводится.
Подход к лечению больных РПЖ должен быть сугубо индивидуальным. Максимально радикальное лечение – хирургическое (радикальная простатэктомия) подразумевает полное удаление простаты без вскрытия ее фасции единым блоком с семенными пузырьками. Если эта операция выполнена вовремя, с соблюдением всех онкологических принципов и по показаниям, то она позволяет полностью избавить больного от злокачественной опухоли и обеспечивает хороший прогноз для жизни.
Независимо от выбранной методики идея операции остается неизменной – выделение простаты без повреждения капсулы, отсечение ее от мочевого пузыря и мочеиспускательного канала и наложение соустья между пузырем и мочеиспускательным каналом. При необходимости выполняется удаление регионарных лимфатических узлов. Такая операция может быть рекомендована относительно молодым больным с ожидаемой продолжительностью жизни не менее 10–15 лет без тяжелых сопутствующих заболеваний. Несмотря на сопоставимые онкологические результаты, темпы восстановления после операции, сроки медицинской и социальной реабилитации больных во многом зависят именно от выбранной оперативной методики.
Несмотря на хорошие результаты радикальной операции, как и любое другое хирургическое вмешательство, она имеет ряд осложнений, наиболее характерными из которых являются недержание мочи и эректильная дисфункция. Частота осложнений меньше ассоциирована с методикой выполнения операции, но определенно зависит от опыта хирурга и индивидуальных особенностей пациента. Несомненно, существуют способы борьбы с подобными осложнениями, но лучше проводить профилактику их возникновения. Основополагающим ее элементом является определение показаний к операции. Второй по значимости фактор – соблюдение техники выполнения операции, имеющей много тонкостей и особенностей. Так, в зависимости от стадии процесса, локализации опухоли в простате и исходного уровня сексуальной активности у части больных операция может быть выполнена с сохранением нервов, ответственных за эректильную функцию.
Гормональная и химиотерапия в настоящее время большинством экспертов не одобрены для лечения локализованного рака простаты и должны быть резервированы для пациентов с распространенным онкологическим поражением. В таких случаях хороший результат может дать сочетанное лечение – комбинация медикаментозной и дистанционной лучевой терапии. Известно, что лучевая терапия уже десятилетия используется для лечения онкологических заболеваний. За счет поражающего радиоактивного излучения опухолевые клетки теряют свою репродуктивную активность. Радиоактивное излучение проникает глубоко в ткани. Обычно подбирается индивидуальная доза облучения – в зависимости от клинической стадии болезни. Гормональная терапия – один из стандартов нехирургического лечения распространенного РПЖ. Простата – гормоночувствительный орган, биохимические процессы в котором зависят от уровня тестостерона. Устранение его влияния на ткань простаты позволяет добиться гибели гормоночувствительных клеток, присутствующих в раковой опухоли.
Наряду с дистанционным лучевым воздействием в лечении локализованного РПЖ используется интерстициальная лучевая терапия, или брахитерапия. Источники излучения, введенные непосредственно в опухоль, обеспечивают более локальное воздействие. Опыт подобного лечения в отдельных странах насчитывает более 20 лет. Она применима у пациентов с относительно небольшими размерами простаты и невысокими значениями ПСА и обеспечивает хорошие результаты лечения.
Криотерапия представляет собой аблацию ткани путем локального воздействия очень низкой температуры и также показана пациентам с локализованным РПЖ. В 1996 г. Американская ассоциация урологов признала криоаблацию предстательной железы методом терапии локализованного РПЖ и перестала считать данную методику экспериментальной. В настоящее время криоаблация простаты представляет собой минимально инвазивный высокоэффективный способ лечения РПЖ. Посредством введения в простату 12–20 криоигл можно добиться локального снижения температуры тканей ниже 40°С. При этой температуре целостность клеток нарушается, и опухоль разрушается. В дальнейшем на этом месте происходит процесс рубцевания. Ограничения при выборе пациентов для криоаблации простаты сравнимы с таковыми при брахитерапии – большой объем простаты и выход опухоли за границы простаты. Неоспоримые преимущества криоаблации и брахитерапии – малая травматичность операции, низкий процент осложнений и меньшее количество ограничений в связи с возрастом и общим терапевтическим статусом пациента.
Высокоинтенсивный сфокусированный ультразвук, также относящийся к малотравматичным методам лечения, пока не одобрен мировой урологической общественностью ввиду малой продолжительности наблюдений и остается экспериментальным методом лечения РПЖ.
Важно помнить, что вопрос принятия решения о тактике лечения во многом зависит от выбора самого пациента и является результатом подробной беседы со специалистом, включающей тщательный анализ преимуществ и рисков того или иного метода лечения.
В этой статье мы не преследовали цель дать исчерпывающие знания о принципах диагностики и лечения рака простаты – проблемы сложной и многогранной. Мы лишь пытались создать представление о современных возможностях лечения этого грозного заболевания. Рак простаты хорошо поддается лечению и давно перестал быть приговором.
В. П. Харченко, доктор медицинских наук, профессор, член-корреспондент РАМН, А. Д. Каприн, кандидат медицинских наук, Ф. Р. Амосов
НИИ диагностики и хирургии МЗ РФ, Москва
Рак предстательной железы (РПЖ) — наиболее частое онкологическое заболевание у мужчин, оно стоит на втором месте по уровню смертности, обусловленной раком. Рак предстательной железы редко встречается в возрасте до 50 лет, но его частота, так же как и смертность от этого заболевания, неуклонно увеличивается с возрастом и достигает максимума на девятом десятке лет жизни. Хотя это в основном болезнь пожилых людей, укорочение жизни от рака простаты составляет, по существующим оценкам, девять лет.
Внедрение в клиническую практику современных методов диагностики рака предстательной железы увеличивает вероятность выявления заболевания на ранних стадиях, когда еще возможно применение радикальных методов лечения.
Диагностика этого заболевания ставит две основные задачи: выявление заболевания и определение стадии и степени распространенности процесса, что имеет решающее значение для выбора лечебной тактики.
Рак предстательной железы выявляется в 4-7% случаев у мужчин в возрасте 50 лет и старше, не имеющих урологической симптоматики и заболеваний мочеполовой системы в анамнезе. Более того, РПЖ 1-2-й стадии, как правило, клинически ничем себя не проявляет, поэтому сбор анамнеза и выявление симптоматики не являются клинически значимыми факторами в диагностике ранних стадий. На более поздних стадиях заболевания больные предъявляют жалобы на затрудненное учащенное мочеиспускание “вялой” струей, ночную поллакиурию. При наличии таких жалоб обязательно более подробное обследование для исключения онкологического заболевания предстательной железы.
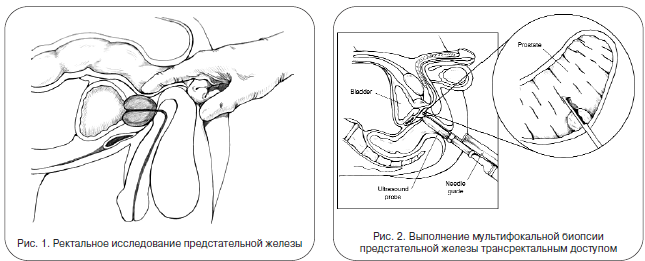
Пальцевое ректальное исследование пока является стандартом для скрининговой диагностики первичной опухоли рака предстательной железы, хотя этот метод считается недостаточно чувствительным для диагностики опухолей, не выходящих за пределы простаты. Опухоль размером 1–1,2 см, как правило, остается незамеченной. Тем не менее пальцевое ректальное исследование можно считать базовым диагностическим методом, обязательным при первичном осмотре
Пальцевое ректальное исследование (ПРИ) позволяет определить примерные размеры предстательной железы, ее конфигурацию и консистенцию. Его проводят также с целью выявления доброкачественной гиперплазии простаты, опухолей прямой кишки, хронического простатита, а также для оценки тонуса анального сфинктера. На характер тактильных ощущений может повлиять различное положение больного (на боку, коленно-локтевое и т. д.), а также степень наполненности мочевого пузыря. Специфичность пальцевого ректального исследования в отношении выявления рака простаты невелика: только у 26-34% мужчин с подозрительными результатами обнаруживается рак предстательной железы. Как правило, подозрение на рак простаты при ПРИ возникает лишь на поздних стадиях процесса. Доля ложно-отрицательных диагнозов при этом исследовании достигает 40-60%.
Диагностическими признаками РПЖ при проведении ПРИ являются увеличенный объем и асимметрия простаты, наличие затвердеваний.
Трансректальное ультразвуковое сканирование (ТРУЗ) является основным методом инструментального исследования простаты. Наиболее информативные для выявления первичной опухоли результаты удается получить при продольном трансректальном сканировании. Основной закономерностью является снижение эхогенности в пораженных опухолью участках, хотя патогномоничных ультразвуковых признаков аденокарциномы, по-видимому, не существует, а у 15-20% пациентов, у которых клиническая стадия аденокарциномы предстательной железы установлена другими методами, эхографические изменения отсутствуют. Эхографическими симптомами аденокарциномы простаты являются единичные, четко очерченные фокусы сниженной эхогенности, множественные гипоэхогенные участки с расплывчатыми границами, изо- и гиперэхогенные фокусы. При прорастании опухоли за пределы капсулы предстательной железы на эхограммах наблюдается прорыв капсулы и гиперэхогенной жировой полоски, окружающей ПЖ.
Менее эффективно сканирование в поперечной плоскости, позволяющее лишь изучить симметричность предстательной железы и семенных пузырьков. Возможности трансабдоминального сканирования ограничены из-за низкого разрешения; при этом определяются общие размеры предстательной железы, но дифференцировать ее внутренние структуры не удается.
В целом прогностичность положительного результата при использовании только ТРУЗ не превышает 40-43%, поэтому обязательным является сочетание его с другими методами.
Существует ТРУЗ с использованием цветового допплеровского картирования, позволяющего изучать сосудистую архитектонику простаты. В этом случае наиболее информативным является продольное ультразвуковое сканирование, а для изучения спектральных характеристик кровотока — поперечное сканирование. В участках злокачественного поражения наблюдается снижение индекса резистентности на 12-15% по сравнению с кровотоком неизмененной предстательной железы. Для диагностики и дифференциальной диагностики цветовое допплеровское картирование имеет вспомогательное значение.
Почти все раковые опухоли, зарождающиеся в простате, являются аденокарциномами. Во многих западноевропейских странах и Америке аденокарцинома простаты — наиболее распространенный вид рака внутренних органов у мужчин; в США в 1991 году было зарегистрировано 122 тыс. заболевших, притом что раком легких в том же году заболели 101 тыс. мужчин. Ежегодная смертность от аденокарциномы простаты составляла в 1983 и 1984 годах 22,7 случая на 100 тыс. населения при заболеваемости 75,3 случаев на 100 тыс. населения. Заболеваемость и смертность от рака простаты имеют тенденцию к увеличению во всех странах. В России с 1985 по 1995 год заболеваемость РПЖ возросла с 6 до 12 случаев на 100 тыс. мужчин
Важная цель исследований рака каждого органа — найти сывороточные маркеры, которые могут определять присутствие и степень злокачественности заболевания, обеспечивать контроль его развития во времени и подтверждать успех или неудачу лечения. Рак простаты — первое злокачественное заболевание, для которого такая биохимическая оценка стала возможной по уровню простат-специфического антигена (ПСА). При наличии рака предстательной железы в клетках опухоли не только повышается продукция ПСА, но и значительно возрастает синтез антихимотрипсина. В результате увеличивается количество связанной и снижается содержание свободной фракции ПСА при увеличении общей концентрации этого антигена.
Нормальным считается содержание общего ПСА менее 4 нг/л, повышение уровня ПСА более 10 нг/л уже является показанием для проведения детального обследования для исключения рака простаты даже при нормальных данных ПРИ. При высоких цифрах общего ПСА биопсию предстательной железы проводят в обязательном порядке. С целью более точной интерпретации повышенных значений общего ПСА необходимо исследование концентрации свободного ПСА и расчет соотношения свободного и общего ПСА. При значении этого показателя ниже 15% требуется биопсия предстательной железы. При значении более 15% необходимы наблюдение и повторное обследование больного через шесть месяцев. Показатель 15% является границей для дифференциальной диагностики рака предстательной железы и доброкачественной гиперплазии простаты.
В определенных случаях изолированный показатель общего ПСА может соответствовать различным размерам опухоли. Его значимость теряется при наличии низкодифференцированного рака простаты.
Уровень ПСА является наиболее точным маркером для скрининговой диагностики рака предстательной железы, однако его возможности ограничены при определении стадии процесса, так как уровень ПСА не зависит от объема опухоли.
Одним из наиболее надежных способов диагностики рака простаты является мультифокальная игольчатая биопсия, выполняемая либо под ультразвуковым наведением, либо под пальцевым контролем. В последние годы для получения материала из предстательной железы используется биопсийный пистолет. Рекомендуется отбирать шесть цилиндрических проб длиной 15 мм, расположенных равномерно — по три в среднесагиттальной плоскости каждой доли на равном расстоянии друг от друга. Глубина отбора и ориентировка индивидуальной пробы выбираются с таким расчетом, чтобы полностью пересечь периферическую зону простаты, толщина которой в среднесагиттальной плоскости редко превышает 10 мм, и войти в центральную зону железы. Нижний конец извлеченного столбика ткани помечают, прежде чем поместить его в формалин, что позволяет в дальнейшем идентифицировать опухоли, зарождающиеся в центральной зоне. Мультифокальная биопсия дает возможность оценить объем опухоли, определить стадию ее развития по Глиссону и локализовать ее положение, что важно для выработки правильной тактики хирургического лечения. Получаемая волюметрическая информация также выгодно отличает способ забора ткани на биопсию в виде цельных столбиков от метода аспирации.
При обнаружении в биоптате картины рака предстательной железы необходимо определение степени дифференцировки опухоли, от которой во многом зависит ее биологическое поведение и, следовательно, дальнейшая лечебная тактика. Общепринятая в России в настоящее время “Гистологическая классификация ВОЗ опухолей предстательной железы” (1980, № 22) основное внимание уделяет формально-гистологическому типу опухоли, который не является определяющим в плане установления ее биологического поведения и выбора наиболее эффективных методов лечения. В этом отношении более продуктивна система степеней гистологической дифференцировки рака предстательной железы по Глиссону (1977), используемая в национальной программе США по борьбе с раком.
Система Глиссона основана преимущественно на гистоархитектурных критериях. Процесс дедифференцировки определяется как потеря способности вновь образующихся опухолевых клеток формировать железы.
Согласно этой системе различают пять степеней дифференцировки опухоли. При изучении препаратов с наличием рака предстательной железы патолог должен выделить две основные картины: “первичную”, или преобладающую, занимающую наибольшую площадь образца, и “вторичную”, т. е. вторую по величине, а затем определить степень дифференцировки по Глиссону каждой из них. Дополнительные участки строения меньших площадей и участки, занимающие меньше 5% общей площади рака, игнорируются. Сумма степеней и определяет индекс Глиссона. В случае практически полной однородности структуры для получения индекса определяемая степень Глиссона удваивается. Чем ниже индекс Глиссона, тем эффективнее лечение и лучше прогноз для больного.
Первые три степени (степени 1, 2, 3), расцениваемые как наиболее хорошо дифференцированные, сходны по структуре с нормальной предстательной железой. Эпителиальные ткани хорошо отграничены от окружающей стромы, железы образованы одним слоем эпителиальных клеток, окружающих железистые просветы. Тем не менее выявляется менее упорядоченное ветвление желез по сравнению с доброкачественными простатическими протоками и ацинусами. Злокачественные железистые структуры имеют тенденцию к разнообразию размеров и формы желез, величины просветов.
Различия первых трех степеней незначительны. Если железы однородны, а признаки инвазии отсутствуют или выражены слабо, опухоль может быть отнесена к 1-й или 2-й степени дифференцировки. Эти степени могут быть также установлены, если клетки имеют светлую цитоплазму, которая более, чем темная, увеличивает сходство с нормальной тканью. В очень маленьких образцах отличие от нормальной ткани должно основываться не только на архитектонике, оно также должно быть подтверждено цитологическими критериями, например очень крупными ядрышками.
Важным исключением из этих правил определения хорошо дифференцированных опухолей является криброзный вариант, который также относится к 3-й степени дифференцировки по Глиссону. Отличие криброзного варианта от рака 4-й степени дифференцировки — небольшие размеры опухолевых комплексов, сопоставимые с размерами крупных протоков, округлая форма, четкие границы, хорошо выраженный стромальный компонент.
Опухоли 4-й степени дифференцировки по Глиссону характеризуются большим разнообразием гистологических проявлений и отсутствием сформированных желез, свойственных первым трем степеням.
Опухоли 5-й степени дифференцировки являются наиболее слабо дифференцированными, с едва различимыми или практически отсутствующими железистыми структурами, с крупными полями опухолевых клеток практически без каких-либо просветов. Опухолевые клетки обычно имеют скудную цитоплазму.
К 5-й степени дифференцировки обычно относят рак типа камедокарциномы. Под этим вариантом описывается интрадуктальный рак с наличием небольших криброзных участков по периферии и с тотальным некрозом клеток в центре опухолевых комплексов. Это единственный вариант рака предстательной железы, в котором отмечается некроз опухолевых клеток. Статистически доказано, что наличие подобных неинвазивных участков связано с крайне плохим прогнозом, сопоставимым с прогнозом при инвазивном раке 5-й степени дифференцировки.
Определение индекса Глиссона при обнаружении рака в биоптате предстательной железы совершенно необходимо. Однако и система Глиссона не лишена недостатков. Во-первых, по биоптату не всегда удается определить биологическое поведение опухоли для индивидуального больного: рак предстательной железы характеризуется большим разнообразием гистологических структур даже в пределах одной опухоли, а биопсийный образец имеет весьма небольшие размеры. Во-вторых, биологическое поведение опухоли может быть обусловлено потерей дифференцировки на небольших участках и не связано с доминирующими структурами.
Более точное предсказание о поведении опухоли можно сделать на основании ее объема, определяемого при радикальной простатэктомии. Объем опухоли, как правило, коррелирует со степенью ее дифференцировки и в равной степени с наличием метастазов в лимфатические узлы и отдаленных метастазов. Поэтому он является важным фактором в определении клинической стадии заболевания и в сочетании со степенью дифференцировки наиболее точно отражает биологическое поведение опухоли.
Компьютерная томография не является эффективным методом, она непригодна для дифференцирования рака предстательной железы и доброкачественной гиперплазии. Главная задача КТ состоит в оценке состояния тазовых и абдоминальных лимфатических узлов. В диагностике поражения лимфатических узлов решающее значение имеет изменение их формы и увеличение размеров более чем на 1–1,5 см.
Магниторезонансная томография (МРТ) позволяет оценить вовлечение в процесс уретры, различных отделов простаты, мочевого пузыря, клетчатки, мышцы, поднимающей наружный сфинктер прямой кишки, семенных пузырьков и лимфатических узлов. Преимущество МРТ по сравнению с КТ состоит в возможности выбора проекции: аксиальной, саггитальной и коронарной. Возможно получение объемного изображения, создаваемого посредством комбинирования коронарной и сагиттальной проекций. МРТ лучше отражает внутрипростатические изменения, чем КТ. Тем не менее распознавание ткани, пораженной доброкачественной или злокачественной опухолью, производится недостаточно надежно.
Скрининг рака простаты должен проводиться начиная с поликлинического отделения. Всем мужчинам старше 50 лет вне зависимости от наличия жалоб один раз в год необходимо выполнение пальцевого ректального исследования и определение уровня ПСА. При повышении ПСА выше 4 нг/мл показано определение соотношения свободного и общего ПСА и выполнение трансректального ультразвукового исследования.
Дальнейшее обследование пациентов предпочтительнее проводить в специализированных стационарах — урологических либо онкологических отделениях. Выполнение трансректальной мультифокальной биопсии простаты показано при повышении ПСА выше 10 нг/мл, в случае, когда соотношение свободного и общего ПСА больше 15%, при выявлении гипоэхогенных зон на трансректальном ульразвуковом сканировании и при наличии пальпируемого твердого образования в предстательной железе.
Всем больным с верифицированным диагнозом необходимо выполнение остеосцинтиграфии для выявления костных метастазов. Применение компьютерной или магниторезонансной томографии показано больным, в отношении которых планируется радикальное хирургическое или лучевое лечение для выяснения состояния тазовых лимфатических узлов.
В диагностике рака предстательной железы только один метод — биопсия — является инвазивным. При выполнении трансректальной биопсии возможно несколько осложнений: инфицирование простаты с последующим развитием острого простатита и уретроррагии. Всем больным, перенесшим биопсию простаты, необходимо назначение пероральных антибиотиков, предпочтительно группы цефалоспоринов, для профилактики воспалительных осложнений. Уретроррагия не бывает обильной и в большинстве случаев прекращается самостоятельно в течение первых суток после биопсии. Абсолютных противопоказаний к проведению диагностического поиска для выявления рака предстательной железы не существует, препятствием может служить только крайне тяжелое состояние больного.
Читайте также:

