Найдено лекарство от лейкоза
Препарат, который прописывают при болезни сетчатки, подавляет рост лейкозных клеток, не вредя нормальным стволовым клеткам крови.
Лейкемия, или лейкоз, возникает из-за испорченных стволовых клеток крови, которые перестают развиваться – из них уже не получаются зрелые эритроциты, лимфоциты, лейкоциты, вместо этого в крови накапливаются недозревшие клетки-предшественники, которые ничего другого, кроме как делиться, не умеют.
У лейкемии есть хронические и острые разновидности, и среди острых самая распространённая – это острый миелоидный лейкоз. От острого миелоидного лейкоза страдают и дети, и взрослые, причём с возрастом вероятность его только растёт.
Как и у всех онкологических болезней, лейкоз начинается с дефектов в ДНК. Проблема в том, что даже если брать одну только разновидность, тот же острый миелоидный лейкоз, то мы обнаружим у него много подвидов, в зависимости от того, какие именно гены вышли из строя. Если мы хотим избавиться от болезни, то должны либо как-то исправить эти гены, либо подействовать на другие гены, которые смогут компенсировать сломанные. По данным исследователей из Института Сенгера, есть более 400 генов, которые можно использовать как мишени для противолейкемических препаратов.
Одна из разновидностей острого миелоидного лейкоза связана с геном MLL, который управляет активностью большого количества других генов. В свою очередь, проблемы с MLL начинаются с другого гена – SRPK1. В статье в Nature Communications говорится, что если отключить SRPK1, то лейкозные клетки перестанут делиться. Однако отключать его методами генетической инженерии в повседневной клинической практике сейчас невозможно.
Но оказалось, что подействовать на SRPK1 можно уже готовым препаратом – глазными каплями, которые прописывают при неоваскуляризации сетчатки. При этом заболевании в сетчатке прорастают новые ненужные сосуды, которые время от времени кровоточат, и из-за таких кровоизлияний зрение постепенно ухудшается. Очевидно, в появлении лишних сосудов и появлении злокачественных кровяных клеток задействованы общие молекулярные механизмы.
Вещество из глазных капель тормозило рост клеток острого миелоидного лейкоза MLL-разновидности, и при этом не мешало делиться нормальным стволовым клеткам крови. От лейкоза даже удалось вылечить подопытных мышей, которым пересаживали злокачественные человеческие клетки (у самих мышей иммунитет настраивали так, чтобы он не охотился на чужеродные клетки и не мешал болезни).
Авторы работы полагают, что то же лекарство можно использовать и против других онкозаболеваний, в которые вовлечён ген SRPK1 и те гены, которые с ним работают. Правда, это не значит, что глазные капли можно прямо сейчас прописывать онкобольным – сначала нужно выполнить клинические эксперименты, которые должны подтвердить эффективность вещества у людей с лейкозами и помочь подобрать ему новую лекарственную форму.
24 Декабря 2018
Источник: Наука и жизнь (nkj.ru)

К многочисленным полезным качествам грудного молока добавилось ещё одно – как оказалось, кормление грудью, уменьшает вероятность злокачественных заболеваний крови у детей.
Лечение миелобластного лейкоза требует особого подхода, так как оно требует применения новейших медицинских методик. Недавно ученые нашли новый способ терапии этого заболеваний, который будет использоваться в ведущих зарубежных клиниках.
Некоторые тяжелые формы лейкемии развиваются, потому что белки на эпигенетическом уровне теряют свою регулирующую функцию. Теперь, в широком международном сотрудничестве, британские исследователи идентифицировали молекулы, которые могут эффективно ингибировать дисрегулированные белки. В журнале Angewandte Chemie исследователи сообщают об открытии, разработке и тестировании потенциальных лекарств против миелобластного лейкоза на клеточном уровне. Полученные данные заложили основу для новых биологических экспериментов и подходов к лечению рака в будущем.
Принцип действия нового лекарства

Чтобы регулировать экспрессию генов, клетки используют химические сигналы для маркировки ДНК и гистонов, вокруг которых обернута ДНК. Этот контроль экспрессии генов называется эпигенетикой, и было обнаружено, что нарушения эпигенетической регуляции имеют решающее значение для определенных типов развития рака. Например, острый миелоидный лейкоз – тяжелый тип рака, при котором миелоидные клетки крови быстро и ненормально растут, и накапливаются в костном мозге и крови – развиваются, когда белки, которые читают эпигенетические метки, становятся серьезно нерегулируемыми. Белки распознают модифицированные остатки лизина, аминокислоту, которая является частью хвостов гистонов, и запускают программы генной экспрессии, стимулирующие лейкемию.
Однако, нерегулируемые белки также могут быть излечимы. Препараты, связывающиеся специфически с этими белками, особенно с их лизин-связывающими белковыми доменами, могут предотвратить возникновение лейкемии на эпигенетическом уровне. Эти препараты – маленькие молекулы, имитирующие модифицированный лизин, действие которых впервые открыто Полом Бреннаном и Олегом Федоровым из Оксфордского университета, Великобритания, и их коллегами.
Природа происхождения лейкемии
Обычно клетки крови вырабатываются костным мозгом. Костный мозг – губчатый материал, расположенный в наших костях. В костном мозге есть стволовые клетки, которые созревают, образуя клетки крови. Стволовые клетки обладают способностью создавать другие клетки в человеческом организме.
Эти стволовые клетки ответственны за создание красных кровяных телец, которые помогают переносить кислород к различным частям тела; белых кровяных клеток, которые формируют иммунную систему и борются с вторгающимися микробами и тромбоцитами, которые помогают в свертывании крови и предотвращении кровотечений. Костный мозг производит зрелые формы каждого из этих типов клеток.
При лейкозе пораженный костный мозг не высвобождает взрослые и зрелые клетки и выделяет большое количество незрелых лейкоцитов, которые известны как бластные клетки. Эти бластные клетки нарушают нормальный баланс клеток в крови, что приводит к нехватке эритроцитов, вызывающих анемию, и тромбоцитов, вызывающих склонность к кровотечению. Нехватка взрослых и зрелых лейкоцитов также означает повышенный риск инфекций. При этом типе лейкоза миелоидные предшественники поражаются, растут и размножаются неконтролируемым образом.
Новый терапевтический подход к лечению лейкемии

Как доказали ученые, в результате скрининга был обнаружены молекулы с основными составляющими бензимидазола. Бензимидазолы – хорошо зарекомендовавшие себя в медицинской химии препараты, которые состоят из конденсированного бензола и азотсодержащих ароматических колец. Начиная с идентифицированного производного бензимидазола, исследователи систематически изменяли структуру, чтобы улучшить связывание и сделать молекулу более стабильной. После энергичного тестирования набора из двухсот молекул они получили мощный и стабильный молекулярный ингибитор, который очень плотно связывал два белка. В различных анализах исследователи проверили его активность в отношении дисрегулированных белков и охарактеризовали специфический режим связывания таких белков.
Авторы указали, что их открытие было первым сообщением о селективном и мощном ингибиторе эпигенетических факторов, способствующих острой миелоидной лейкемии. Этот рак быстро прогрессирует и, как правило, приводит к летальному исходу в течение нескольких недель или месяцев, если его не лечить. Альтернативы химиотерапии остаются недостаточными, и ученые отчаянно ищут новые подходы к лечению. Было также подчеркнуто, что эти подробные знания о способе связывания станут многообещающей отправной точкой для дальнейшей разработки лекарств в терапии рака.
У кого чаще возникает болезнь и как это используется при лечении?
Симптомы острого миелолейкоза, обычно возникают медленно, а затем быстро прогрессируют. Признаки болезни усиливаются по мере увеличения числа незрелых лейкоцитов в крови.
Некоторые из симптомов включают анемию или бледность кожи, усталость и усталость, одышку и повторные инфекции, и частые и необычные эпизоды кровоподтеков и кровотечений.
Острый лейкоз является редким типом рака. В России у 7600 человек ежегодно диагностируют лейкемию, и только у 2300 человек обнаруживают острый миелоидный лейкоз.
Этот рак чаще наблюдается у лиц старше 65 лет и редко встречается у лиц младше 40 лет. Средний возраст пациента с этим типом лейкоза составляет около 67 лет.
По оценкам Американского онкологического общества, для США на 2018 год зарегистрировано 47150 новых случаев лейкемии (всех видов) и 23 540 смертей от лейкемии. Из них 13780 новых случаев являются миелобластным лейкозом.
Миелобластный лейкоз чаще встречается у мужчин, чем у женщин. Пожизненный риск получения болезни для мужчины составляет около 1 к 232; для женщины риск составляет приблизительно 1 к 278 в Соединенных Штатах.
Использование модифицированных иммунных клеток самих пациентов позволило победить разновидность рака, ранее бывшую практически неизлечимой на поздних стадиях.

Специалисты из Центра изучения рака в Сиэтле (США) добились того, что 27 из 29 пациентов с запущенной лейкемией после курса иммунотерапии оказались в долговременной ремиссии. Ранее излечение таких больных на поздних стадиях заболевания практически не удавалось. Новая методика борьбы с раком использует модифицированные иммунные клетки, взятые у самого больного, что делает её значительно эффективнее всех других существующих аналогов. Соответствующее исследование опубликовано в Journal of Clinical Investigation.
При обычном течении острого лимфобластного лейкоза быстро делящиеся незрелые белые кровяные клетки окружают спинной мозг и не дают ему продуцировать здоровые кровяные клетки, без которых организм погибает. Собственные иммунные клетки человека, о бычно борющиеся с раковыми, при таком заболевании неэффективны. Дело в том, что опухолевые кл е тки исходно являются частью того же организма, отчего их поверхность покрыта в основном теми же белками, что и поверхность обычных клеток. Иммунные Т-лимфоциты, потенциально способные убить раковую клетку, п росто не могут от личить ее от нераковой и поэтому не атакуют .
Ч тобы справиться с проблемой, несколько лет назад был предложен принципиально новый способ антираковой иммунотерапи и с использованием специально "обученных" Т-лимфоцит ов. Для этого у пациента заб и ра е т ся образец этой разновидности иммунных клеток. В лаборатории его подвергают небольшой генетической модификации. В её ходе в геном встраивается участок, который отвечает за появление на поверхност и Т-лимфоцит а искусственн ого Т-лимфоцитн ого рецептор а, способн ого распознавать те белки раковой клетки, которые отличают её от здоровой. Такой участок называется химерным антигенным рецептором.

Микропрепарат костного мозга больного острой В-лимфоцитарной лейколастной лейкемией. Фото: Wikipedia
Для проверки эффективности этого метода с 2013 года в Центре изучения рака в Сиэтле (США) проводились клинические испытания, окончившееся в начале 2016 года. В них приняли участие 29 больных острым лимфобластным лейкозом на поздних стадиях. На них уже испытывались другие виды антираков о й терапии , однако они не дали никаких устойчивых результатов. Затем учёные взяли образцы Т-лимфоцит ов у всех пациентов и оснастили их искусственными рецепторами для распознавания мутировавших клеток.
Посл е этого модифицированные Т-лимфоцит ы ввели в кровоток каждого из пациентов , где они нач али размножаться делением . Модифицированные клетки с новыми распознающими рецепторами интенсивно самовоспроизводились внутри человеческого организма и быстро росли в числе . В силу многочисленности, их атаки на раковые клетки были систематическими и непрекращающимися. В итоге все мутировавшие клетки погибали за считаные недели после однократного ввода новых Т-лимфоцитов.
Из 29 пациентов на поздних стадиях острого лимфобластного лейкоза у 27 произошла устойчивая ремиссия — врачи не выявили признаков наличия раковых клеток в их спинно м мозге . Это необычный результат, поскольку такой вид рака на поздних стадиях считается практически неизлечимым. П рогноз для всех пациентов, подвергшихся новой иммунотерапии, предсказывал им считаные месяцы жизни.
Создатели новой методики иммунотерапии, полагают, что результат ы её клинического испытания станут важным шагом на пути внедрения модифицированных Т- лимфоцитов в о врачебную практику. Они отмечают, ч то такой метод является во многом более эффективным, чем радио- или химиотерапия. М одифицированные клетки иммунной системы самовоспроизводятся (их не надо вводить многократно), не имеют побочных последствий (токсических или радиационных) , свободно разносятся по всему организму и способны атаковать раковые клетки самостоятельно, без дальнейшего врачебного вмешательства. Всё это с н ижает вероятность рецидива. В перспективе новый метод может быть распространен и на другие разновидности рака, о сторожно полагают врач и .
Низкодозовое применение уже известного химиотерапевтического препарата, в обычных протоколах угнетающего иммунитет, помогло иммунным клеткам бороться с раком, а также получить ответ у больных с резистентностью к лечению.
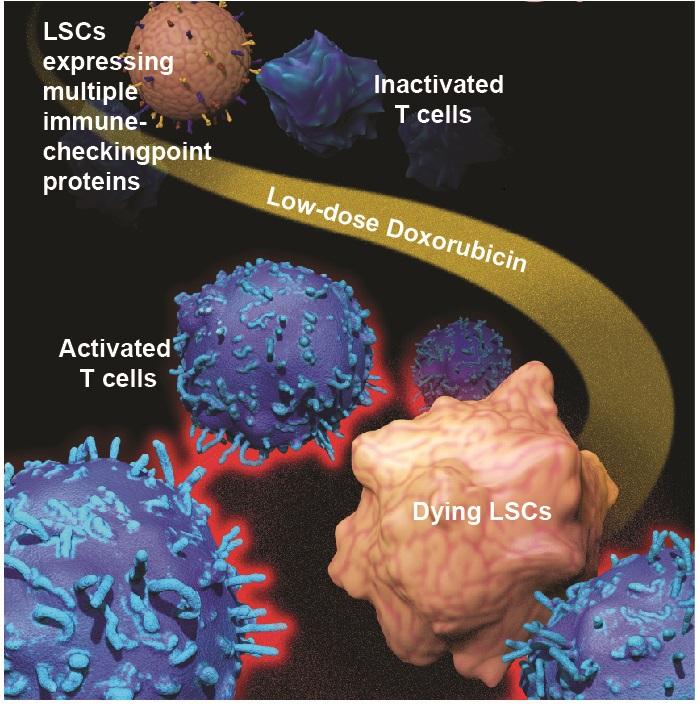
Исследователи из нескольких университетских и медицинских учреждений США в своей работе, опубликованной в издании Nature Cell Biology, сообщают о новой многообещающей стратегии преодоления лекарственной устойчивости при лейкемии и, вероятно, других злокачественных заболеваниях. Их стратегия основана на использовании целевых доз широко используемых химиотерапевтических препаратов антрациклинового ряда.
Вначале ученые обратили внимание на то, что протеинкиназа Akt может усиливать передачу сигналов Wnt посредством фосфорилирования бетакатенина. Это способствовало онкогенезу в кишечнике. Исследовав связанные пути Wnt/бетакатенин и PI3K/Akt в кроветворной системе на мышах с генетическими модификациями этих путей, ученые обнаружили, как они взаимодействуют. Оказалось, они стимулируют обновление стволовых клеток, что приводит к избыточной продукции кроветворных стволовых клеток. Постоянная активация путей вызывала у мышей развитие лейкемии как побочный эффект.
Целью ученых был поиск такого препарата, который сможет блокировать взаимодействие между Wnt/бетакатенином и PI3K/Akt и при этом не быть чрезмерно токсичным. Для этого они рассмотрели библиотеку уже существующих препаратов, чтобы определить, как их можно направить на несколько измененную задачу.
Скрининг показал, что доксорубицин наилучшим образом подавляет взаимодействие между двумя путями. Его ингибирующие свойства при низких дозах имеют преимущество по сравнению с высокодозовым применением в качестве химиотерапевтического препарата, при котором он может вызвать серьезное повреждение сердца.
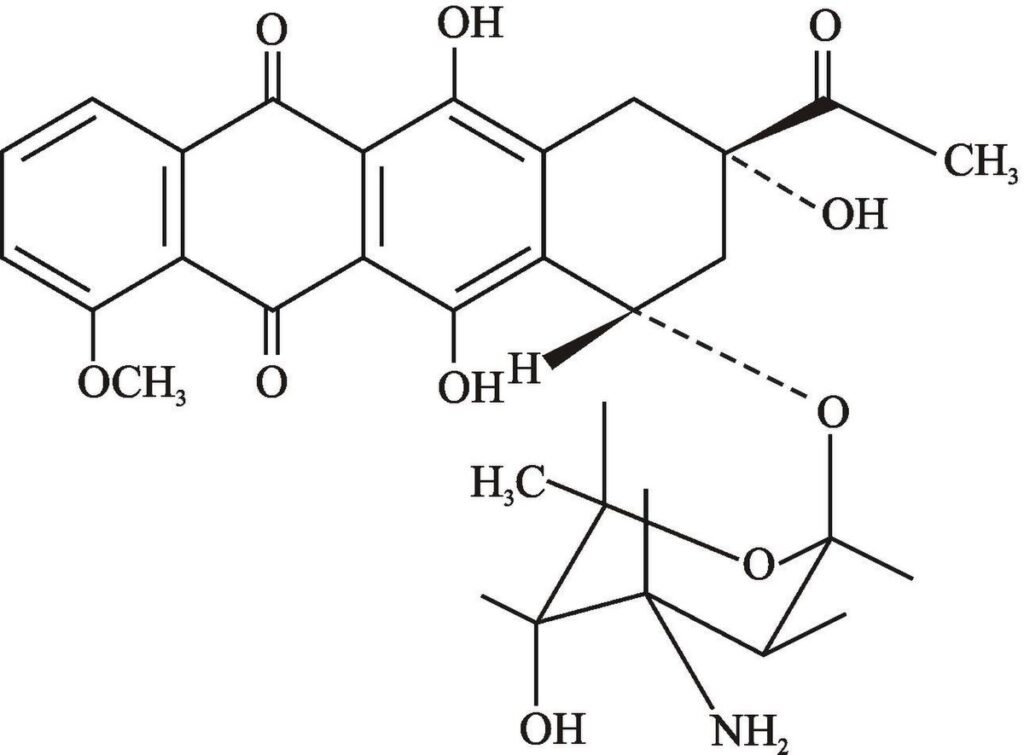
Даунорубицин (структурная формула)
В последующем клиническом тестировании на взрослых людях, устойчивых к лечению острого миелобластного лейкоза, половине больных помог низкодозовый даунорубицин (химиопрепарат того же класса, что и доксорубицин). У них был ответ на лечение и уменьшение количества стволовых клеток лейкемии, имеющих активированный Akt биомаркер бетакатенина.
Кроме прочего, ученым удалось узнать больше о механизме, который обеспечивает раковым клеткам возможность уклоняться от иммунного ответа. Они обнаружили, что стволовые клетки лейкемии экспрессируют множество белков, известных как иммунные контрольные точки, отключающие иммунный ответ, который в противном случае распознал и устранил бы стволовые клетки лейкемии. Кроме того, бетакатенин связывается с несколькими локусами гена иммунной контрольной точки. Обработка низкими дозами доксорубицина снижала экспрессию этих иммунных контрольных точек, включая PD-L1, TIM3 и CD24.
Дальнейшие исследования команды направлены на тестирование аналогичных стратегий для преодоления устойчивости к терапии таких видов рака, как рак молочной железы, толстой кишки и глиобластома.
2020. Tafasitamab - новый препарат от рака крови - на подходе

Американская фармакомпания Incyte выкупает у немецкого биотек-стартапа MorphoSys права на препарат Tafasitamab почти за $2 млрд. Это препарат на основе антител для лечения B-клеточной лимфомы, хронического лимфоцитарного лейкоза (ХЛЛ) и В-клеточной неходжкинской лимфомы. Препарат усиливает работу иммунных B-клеток, которые цепляются к раковым клеткам и привлекают макрофаги для их уничтожения. На данный момент Tafasitamab проходит последнюю стадию клинических испытаний и его эффективность сравнима с более дорогой CAR-T терапией. Incyte надеется выпустить препарат в продажу уже в этом году.
2019. В России создали нейропроцессор для диагностики рака крови

Российский научно-технический центр Модуль разработал нейросетевое устройство, которое умеет анализировать микроснимки анализа крови и выявлять атипичные клетки, которые могут быть связаны со злокачественным заболеванием кроветворной системы. Нейросеть обучалась на массиве данных лаборатории патологической анатомии одной из малазийских клиник. Разработчики говорят, что точность диагноза от нейросети составляет 98%, а анализ проводится всего за несколько секунд. В перспективе нейросеть Модуля сможет определять раковые клетки по результатам биопсии других видов рака. Сейчас устройство готовят к сертификации FDA в США.
2017. В США одобрили вторую генную терапию для лечения рака крови

Американский регулятор FDA одобрил вторую генную терапию для борьбы с раком крови: препарат Yescarta (компании Kite Pharma). Он предназначен для лечения агрессивной лимфомы у взрослых. Первым одобренным антираковым генотерапевтическим препаратом стал Kymriah (компании Novartis). В Yescarta применяется та же технология (CAR-T), что и в первой генной терапии. Она редактирует иммунные Т-клетки так что они начинают атаковать раковые клетки. Стоит Yescarta немного дешевле - 373 тыс. долларов для одного пациента. Причем есть потенциал к снижению этой стоимости, т.к. в США - более 7 тысяч пациентов в год, которым подходит эта технология. А чем больше пациентом покупают препарат, тем дешевле он становится.
2017. Антираковая генотерапия CAR-T сертифицирована в США
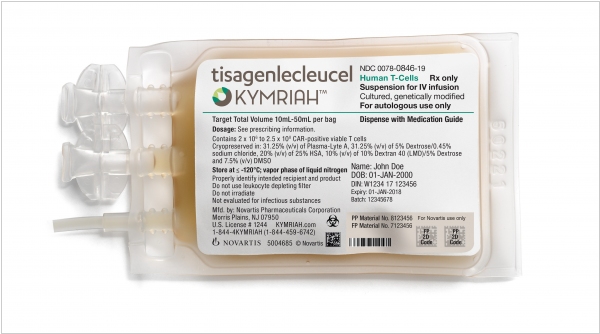
Технология CAR-T и препарат Kymriah (Кимрия) швейцарской компании Novartis, которая уже доказала свою эффективность в лечении острого лимфобластного лейкоза, была сертифицирована американским регулятором FDA (что еще раз подтверждает ее действенность). Суть технологии в том, что врачи берут образец белых кровяных телец пациента, а потом в лаборатории перепрограммируют их в убийц опухолей. Затем клетки возвращают в тело, где они быстро группируются и уничтожают раковые клетки. Конечно, стоимость такого лечения - не всем по карману - $475,000. Правда, Novartis обещает вернуть деньги, если организм пациента не отвечает на лечение.
2017. Наночастицы перепрограммируют Т-клетки прямо в организме для борьбы с лейкемией
2017. Лекарство Гливек показывает отличные результаты в лечении лейкоза
2016. Персонализированная вакцина остановила рак крови

Медицинский центр Beth Israel Deaconess, расположенный в Бостоне, провел успешные клинические испытания новой вакцины, изготавливаемой из собственных клеток пациента, которая предназначена для лечения острого миелоидного лейкоза. Вакцина использует технологию иммунотерапии, т.е. стимулирует собственные имунные Т-клетки для уничтожения опухоли. Испытания начались 4 года назад, когда 17 пациентам со средним возрастом 63 года начали вводить вакцину после сеансов химиотерапии. В результате 12 из них до сих пор показывают ремиссию. На фото - руководитель проекта - Дэвид Авиган.
2016. Технология Cellectis вылечила уже второго ребенка от лейкемии

Франко-американская компания Cellectis, похоже, заняла лидирующую позицию на многообещающем рынке иммунотерапии рака. В конце прошлого года ее технология TALEN (основанная на методе CAR-T) помогла вылечить годовалую девочку от лейкемии, а недавно они объявили о второй успешной операции, проведенной в том же лондонском госпитале. Смысл технологии в том, что ДНК иммунных клеток (Т-лимфоцитов) модифицируется в пробирке, а затем они вводятся в организм, где уничтожают поврежденные при лейкемии кровяные клетки. Есть еще три перспективных стартапа, разрабатывающих подобные технологии (Novartis, Juno Therapeutics и Kite Pharma). Но отличие технологии Cellectis в том, что она использует донорские Т-клетки, т.е. потенциально может создать универсальный и дешевый препарат, который можно быстро ввести любому пациенту.
2015. Генная инженерия и иммунотрапия спасли девочку от лейкемии
В Лондонской больнице Грейт-Ормонд-Стрит врачи использовали уникальный метод CAR-T для лечения лейкемии (рака крови) у маленькой девочки Лейлы (1 год). Химиотерапия и пересадка костного мозга ей не помогли, поэтому медики решились испробовать новый вид иммунотерапии. Они взяли иммунные клетки донора, генетически-модицифировали их так чтобы они распознавали и уничтожали раковые клетки и при этом сами не воспринимались иммунной системой, как чужеродные, и ввели их в организм девочки. Через три месяца Лейле снова пересадили костный мозг: здоровые иммунные клетки распознали генно-модифицированные клетки как чужеродные и уничтожили их. Таким образом, сейчас в организме девочки не осталось генетически модифицированных клеток. Пока о полном излечении Лейлы говорить рано, но она жива и хорошо себя чувствует. Полноценные клинические испытания этой технологии начнутся в 2016 году. Технология разработана французской биотехнологической компанией Cellectis.
2014. Создан искусственный костный мозг для выращивания стволовых клеток крови
Все клетки крови (эритроциты, лейкоциты. ) формируются из так называемых гемопоэтических стволовых клеток, которые, содержатся в костном мозге человека. И иногда человеку требуется замена этих стволовых клеток. Например, при лейкемии, когда собственные стволовые клетки превращаются в раковые. Или после лучевой терапии, когда собственные стволовые клетки погибают. В таких случаях проводят трансплантацию костного мозга, и это очень-очень дорогая операция, в основном из-за сложности поиска совместимого донора. В России с этим делом - вообще комедия. Вот было бы здорово, если б можно было взять у человека чуть-чуть стволовых клеток крови, размножить их в лаборатории, а потом ввести обратно в костный мозг. Именно над такой идеей работают ученые из нескольких ведущих научных центров Германии. И у них уже кое-что получилось. Они создали искусственную пористую структуру, имитирующую губчатое вещество кости в области кроветворного костного мозга. ***
2013. В Ханты-Мансийске проводят трансплантацию стволовых клеток при лечении рака крови
Югорский научно-исследовательский институт клеточных технологий, созданный четыре года назад, вроде-как успешно применяет свою технологию лечения рака крови с помощью стволовых клеток. На базе Сургутской ОКБ они провели уже 34 трансплантации стволовых клеток, и говорят, что все пациенты до сих пор живы. Кроветворные стволовые клетки НИИ получает от доноров (из костного мозга и пуповинной крови), проводят ДНК анализ (для определения совместимости) и хранит этот материал в своем криобанке. Затем стволовые клетки добавляют в кровь пациента каким-то уникальным методом. По словам Сергея Щукина, заместителя директора Департамента здравоохранения Югры, стоимость пересадки стволовых клеток на западе - порядка 420 тысяч долларов. А у нас по стране, хотя такие операции - редкость, но делаются они бесплатно, за счет средств бюджета.


При поражении опухолью в кровь начинают вырабатываться незрелые мутированные лейкоциты, которые постоянно делятся и полностью заполняют пространство, мешая здоровым клеткам. Также мутированные лейкоциты не выполняют свою защитную функцию.

Лейкемия лечится или нет
Первый вопрос, возникающий у людей, которые столкнулись с подозрением на рак крови, лейкемия лечится или нет.
Всем известно, что это тяжёлое и серьёзное заболевание, но, пока оно не коснётся определённого человека, мало кто вникает во все тонкости. Это вполне свойственно человеческой натуре.
Но на самом деле информацией по этой теме не стоит пренебрегать, так как этот недуг приобретает масштабное распространение и, к сожалению, часто ему подвергаются маленькие дети.
Существуют проверенные медикаментозные методы, используя которые, можно контролировать болезнь и добиваться ремиссии

Причины заболевания
Возможными причинами заболевания являются:
- нарушения в хромосомном аппарате и структуре клетки;
- воздействие повышенного уровня радиации на протяжении длительного периода времени;
- взаимодействие с токсичными препаратами и химическими веществами;
- вредные привычки, в том числе курение;
- после проведенной химиотерапии;
- генетическая предрасположенность.

Виды лейкемии
Лейкозы бывают острыми и хроническими. При острой форме начинают быстро делиться незрелые белые клетки, болезнь развивается в короткие сроки.
Хроническая лейкемия прогрессирует медленнее, в течение нескольких лет, при этом лейкоциты сначала созревают, затем становятся аномальными.
Заболевание классифицируют в зависимости от того, какие клетки поражены – лимфоциты, которые не содержат гранул, или миелоциты – молодые клетки с зернистой структурой.
Таким образом, выделяют четыре вида лейкозов:
- Острый миелоидный. Подвержены заболеванию и взрослые, и дети.
- Острый лимфобластный. Чаще болеют дети, хотя встречается и у взрослых.
- Хронический лимфоцитарный. Обычно развивается у людей от 55 лет.
Миелоидная лейкемия. Характеризуется быстрым ростом миелоидных клеток, в результате они накапливаются в периферической системе.

Симптомы лейкоза
Симптомы лейкоза, особенно в начале, очень неспецифичны и эти признаки легко пропустить. Поэтому мы рекомендуем вам очень внимательно относиться к тому, если вы:
- чувствуете выраженную слабость;
- быстро утомляетесь;
- страдаете от головных болей;
- не хотите есть;
- чувствуете боли в костях;
- отметили, что появилась сыпь и непонятные синяки;
- появились носовые кровотечения, кровят десна;
- теряете вес;
- часто болеете инфекционными заболеваниями.
Конечно, один-два эти симптома можно просто отнести, например, на рабочую нагрузку. Однако не упустите тяжелую болезнь, не рискуйте своей жизнью – раз заметили признаки, то приходите к нам на диагностику. Чем раньше вы начнете лечение заболеваний крови – тем больше шансов на ваше выздоровление.

Стадии
Отдельно нужно рассмотреть основные стадии лейкоза.
- Начальная. Чаще всего диагностируется у пациентов, которые страдают анемией.
- Развернутая. Тут уже проявляются все симптомы.
- Ремиссия. Может быть полная или неполная. Характеризуется повышением бластных клеток максимум на 5% именно в костном мозге (при их отсутствии в крови).
- Рецидив. Может развиваться как в костном мозге, так и иных органах. Стоит сказать о том, что каждый последующий рецидив опаснее предыдущего.
- Последняя. В таком случае у больного развиваются язвенно-некротические процессы, а также происходит угнетение кроветворения.

Шансы на выздоровление
В настоящее время диагноз лейкемия не является приговором, как это было раньше. Ответ на вопрос, лечится ли лейкоз, зависит от определенных факторов:
- разновидности заболевания;
- своевременной диагностики;
- характера поражения тканей и органов;
- возрастных особенностей;
- других возможных рисков.
Таким образом, важно тщательно и внимательно следить за состоянием своего здоровья. Максимальной гарантии того, что лейкемия лечится, у специалистов на данный момент нет, однако благодаря современной медицине существует немалое количество методов дают возможность продлить жизнь пациента на несколько десятков лет.

Лечение острых форм лейкемии
Острые лимфолейкозы у маленьких деток вылечиваются в 95%. Почти у 70% переболевших признаков заболевания нет минимум в течение пяти лет.
При лечении острой лимфобластной формы используется химиотерапия на основе трех препаратов. Если после использования химиотерапии возникает рецидив заболевания, врач советует использовать пересадку стволовых клеток при соответствующих показаниях, решение зависит от пациента.
При лечении миелоидной формы используется сильная лекарственная терапия в несколько курсов. Иногда применяется трансплантация костного мозга. Чем выше возраст пациента, тем ниже вероятность выздоровления.

Лечение хронической лейкемии
В отличие от острой формы заболевания, хроническая не требует такого срочного вмешательства. Она развивается медленнее и способы ее лечения отличаются. Прежде всего идет период наблюдения. На ранних стадиях симптомы практически незаметны, но наблюдение врача просто обязательно.
Таким пациентам тоже назначают привычное лечение, но в случае с трансплантологией клетки могут брать из организма пациента. Также применяют биологическую терапию, помогая организму улучшить защитные функции. К пациентам применяют и привычные методы лечения.

Методы лечения
Способ борьбы с недугом подбирается, исходя из его стадии и формы. При хронической лейкемии используют терапию, ориентированную на приостановление развития болезни, поддержание защитных функций организма и предотвращение осложнений. Кроме того, многих пациентов интересует, лечится или нет острый лейкоз крови. Стоит сказать, что при грамотном подходе, симптомы этой формы недуга также можно устранить. Для этого используют:
Химиотерапию. Она уничтожает раковые клетки. Лучевую терапию. Она разрушает пораженные клетки посредством рентгеновского излучения.
Пересадку стволовых клеток. С помощью этого метода восстанавливается образование здоровых клеток.
Прежде чем приступить к оперативному вмешательству, проводят химиотерапию. Она необходима для того, чтобы освободить место для новых, здоровых клеток костного мозга.

Профилактические меры
Чтобы избежать патологии необходимо:
- выбирать место проживания с насколько возможно более благополучной экологией,
- пациенты, у которых родственники болели раком, должны раз в полгода сдавать кровь на обследование;
- такая же рекомендация касается людей, у которых есть генные поломки, превышающие нормы.
Лейкоз является злокачественным заболеванием, которое часто называют раком крови. При заболевании красный костный мозг вырабатывает лейкозные клетки – патологические кровяные тельца. Почему это происходит в организме человека, ученые до настоящего времени так и не установили.
No related posts.
Врач с 36 летним стажем работы. Медицинский блогер Левио Меши. Постоянный обзор животрепещущих тем по психиатрии, психотерапии, зависимостям. Хирургии, онкологии и терапии. Беседы с ведущими врачами. Обзоры клиник и их врачей. Полезные материалы по самолечению и решению проблем со здоровьем. Посмотреть все записи автора Левио Меши
Читайте также:

