Мутации при раке почки

Приглашаем врачей, чья деятельность связана с онкоурологией, к активному сотрудничеству.
Почти каждый десятый случай почечно-клеточного рака имеет наследственный характер. О генетических синдромах, их влиянии на течение болезни и терапию — в системном обзоре на основании последних данных от EAU.
Известны онкологические синдромы, связанные со специфическими мутациями, гистологическим типом опухоли и сопутствующими заболеваниями. Однако ряд наследственных состояний не выдают себя особенностями; заподозрить их можно главным образом по молодому возрасту или семейному анамнезу. Медиана возраста при диагностике наследственного почечно-клеточного рака составляет 37 лет, 70 % опухолей выявляются у пациентов моложе 46 лет. Именно этот возрастной предел повышает вероятность успеха генетического тестирования.
Важное значение имеет анализ наследственных мутаций. Согласно данным Атласа ракового генома (The Cancer Genome Atlas, TCGA), в 6 % случаев светлоклеточного почечно-клеточного рака (сПКР, clear cell renal cell carcinoma — ccRCC) выявляются герминальные мутации, при наличии папиллярного и хромофобного рака их частота равна 9 и 6 % соответственно.
Эта наследуемая по аутосомно-доминантному типу патология характеризуется развитием целого ряда полиморфных опухолей (табл . 1) . Причиной развития синдрома является биаллельная инактивация гена-супрессора опухолевого роста VHL. Поражение почек проявляется наличием кист или светлоклеточного почечно-клеточного рака, обычно мультифокального и билатерального характера VHL-синдром традиционно делится на типы 1 и 2, последний, в свою очередь, — на подтипы (табл 2).
Тактика ведения
Обязательный скрининг пациентов с VHL-отягощенным анамнезом начинается с ретиноскопии в возрасте 5 лет и проведения МРТ головного мозга и брюшной полости каждые 2 года. Необходимы исследование крови и мочи на наличие метанефринов, контроль артериального давления, неврологический осмотр, наблюдение у офтальмолога, отоларинголога и уролога. Генетическая консультация показана пациентам с гемангиобластомами сетчатки глаза и/или ЦНС, лицам молодого возраста и больным с мультифокальными карциномами почек и надпочечников.
Наследуется по аутосомно-доминантному типу. Характеризуется медленным ростом, множественностью, билатеральностью поражения и исключительно папиллярным вариантом 1 типа строения опухоли. В отличие от других синдромов отсутствуют внепочечные проявления. Возраст начала заболевания варьирует; отмечены случаи диагностики болезни у лиц в возрасте 30 лет, к 80 годам фенотипическое проявление приближается к 100 %.
Тактика ведения
Для наблюдения рекомендуются МРТ или КТ с учетом того, что, подобно спорадическому пПКР, наследственные опухоли по большей части гиповаскулярные и при КТ контрастируются лишь на 10-30 единиц Хаунсфилда (HU). На ультразвуковых изображениях поражения часто изоэхогенны по отношению к фоновой паренхиме почки и могут оставаться незамеченными.
Размер опухолевых очагов обычно не превышает 3 см. Выявление активирующих мутаций гена MET привело к испытаниям его ингибиторов. Среди них форетиниб оказался наиболее эффективным у пациентов с герминальными мутациями MET; частичный ответ был получен у половины пациентов с наследственным раком и только в 9 % случаев спорадического пПКР.
Аутосомно-доминантный синдром, характеризующийся поражениями кожи, кистами легких, спонтанным пневмотораксом и многоочаговыми опухолями почек. Причиной синдрома является мутация в гене-супрессоре опухолевого роста FLCN.
У большинства пациентов старше 30 лет развиваются фиброфолликуломы и акрохордоны на лице и верхней части туловища. Двусторонние легочные кисты увеличивают сопутствующий риск пневмоторакса. Примерно у трети пациентов развиваются почечные карциномы различного гистологического строения, большинство из которых имеют промежуточную агрессивность, сравнимую с таковой в случае VHL-синдрома. Опухоли несколько менее агрессивны, чем при других наследственных состояниях, но заболевание не следует рассматривать как доброкачественное, поскольку возможно метастазирование.
Приблизительно 13-34 % пациентов имеют опухоли почек; часто наблюдаются ангиомиолипомы и поликистоз почек По сравнению с болезнью VHL, в рамках которой всегда развивается сПКР, связанные с BHD-синдромом опухолевые образования различаются по гистологическому типу:
- приблизительно 50-67 % опухолей имеют гибридный онкоцитарно- хромофобный тип;
- 23-34 % — хромофобные опухоли;
- 7-9 % — сПКР;
- 3-5 % — онкоцитомы;
- примерно 2 % — папиллярные раки почек.
Тактика ведения
Ежегодное МРТ- или КТ-исследование органов грудной клетки и брюшной полости рекомендовано начинать в возрасте 20 лет. У пациентов без поражения почек МРТ рекомендована каждые 3 года.
Аутосомно-доминантный синдромом, обусловленный мутацией в гене FH. Болезнь характеризуется предрасположенностью к доброкачественному лейомиоматозу кожи и матки, развитием двусторонних папиллярных почечно-клеточных карцином и ранних лейомиосарком матки. В большинстве случаев возникает папиллярный рак 2 типа с градацией ядер по Fuhrman 3-4.
Тактика ведения В качестве скрининга осуществляют:
- ежегодные МРТ-исследования органов брюшной полости;
- наблюдение у гинеколога и дерматолога.
Полиорганный синдром, при котором почти все пациенты имеют ассоциированные кожные проявления, в том числе гипопигментированные пятна, лицевые ангиофибромы и околоногтевые фибромы . У большинства имеются поражения ЦНС (дисплазия коры головного мозга, субэпендимальные узелки и с меньшей частотой — субэпендимальные гигантоклеточные астроцитомы).
Сопутствующие неврологические состояния включают судороги и расстройства аутистического спектра . Другие проявления включают лимфангиолейомиоматоз (ЛАМ) легкого, преимущественно поражающий женщин, миокардиальные рабдомиомы и гамартомы сетчатки.
Рак почки встречается у 1-4 % больных, опухоль часто бывает двусторонней. ПКР классифицируется на 3 типа:
- ТС-связанный папиллярный ПКР;
- Гибридные опухоли (хромофобный рак или онкоцитома);
- Неклассифицированные эпителиальные опухоли.
Тактика ведения
- МРТ органов брюшной полости каждые 1-3 года;
- КТ органов грудной клетки каждые 5-10 лет при отсутствии легочных проявлений;
- МРТ головного мозга;
- Наблюдение у дерматолога, невролога, офтальмолога.
В случаях опухолей высокой жировой плотности или биопсийно доказанных ангиомиолипом с низким содержанием липидов наблюдение является предпочтительным методом до тех пор, пока самая большая опухоль не достигнет в размерах около 4 см, после чего рассматривается селективная ангиоэмболизация . 4-сантиметровый порог основан на исторических данных относительно контроля ангиомиолипом, основанных на более высокой склонности к спонтанному кровотечению.
На основании результатов исследования EXIST-II FDA одобрило эверолимус для лечения ангиомиолипом, связанных с туберозным склерозом.
Это злокачественная эпителиальная опухоль, которая характеризуется развитием параганглиом, феохромоцитом, желудочно-кишечных стромальных опухолей и ПКР. Отличительным гистологическим признаком является обнаружение в цитоплазме атипических клеток вакуолей или хлопьевидных включений, содержащих эозинофильную взвесь.
Распространенность заболевания неизвестна. Небольшая серия случаев показала более ранний возраст начала (средний возраст 30-40 лет, диапазон 15-72 лет) и редкие двусторонние опухоли, которые могут проявлять агрессивное поведение и имеют большой риск развития метастатической болезни.
Таблица 1. Органы-мишени при синдроме Гиппеля—Линдау

Таблица 2. Типы синдрома Гиппеля—Линдау

Тактика ведения
Ведущим методом диагностики является иммуногистохимическое исследование, определяющее потерю экспрессии гена SDH-B. В связи с тем, что что поражение при SDH-дефицитном ПКР является полиорганным, после подтверждения диагноза требуется комплексный междисциплинарный контроль:
- МРТ брюшной полости каждые 2 года;
- анализа мочи и крови на метанефрины;
- анализ на хромогранин А;
- МРТ всего тела (от черепа до таза).
Учитывая возможность метастазирования даже при небольших опухолевых образованиях, ПКР у пациентов с герминальными мутациями гена SDH-B следует лечить аналогично опухолям при синдроме HLRCC. Вероятно, что препараты, подавляющие гликолиз и синтез жирных кислот, также могут использоваться при этих типах рака. В данный момент проводятся клинические испытания вандетаниба в сочетании с метформином.
Наследственный опухолевый синдром, при котором имеется повышенный риск возникновения почечно-клеточного рака. Тип карциномы при этом — светлоклеточный, опухоли могут быть одиночными или множественными, уни- или билатеральными. Это редкая наследственная форма рака почки, достоверно зарегистрированная у 7 семей.
Аутосомно-доминантный синдром, связанный с повышенным риском развития мезотелиомы легких, увеальной меланомы, кожной меланомы, ПКР и, возможно, других злокачественных новообразований.
Взаимосвязь герминальных мутаций гена BAP1 с возникновением злокачественных новообразований была впервые описана в 2011 году, когда исследования выявили повышенную частоту развития меланомы и мезотелиомы. Спустя 2 года было показано, что ПКР является одной из основных опухолей этого синдрома. Однако полный спектр опухолевых поражений, ассоциированных с данным состоянием, является предметом постоянного анализа.
Риск развития ПКР у носителей мутантного гена BAP1 оценивается в 10 %. Из-за небольшого числа зарегистрированных случаев фенотип BAP1-ассоциированного почечно-клеточного рака до сих пор полностью не выяснен. Преимущественно присутствует светлоклеточная карцинома, но есть как минимум 2 опубликованных случая несветлоклеточного рака. Существуют ли носители этой мутации с ранее установленным ПКР, пока неизвестно.
Тактика ведения
Рассматривается аналогично таковой при спорадическом ПКР, хотя зарегистрированы случаи агрессивного течения, поэтому рекомендуются раннее оперативное вмешательство и тщательный скрининг как почечных, так и внепочечных проявлений:
- наблюдение офтальмологом и дерматовенерологом;
- КТ или МРТ органов грудной клетки/брюшной полости.
Является результатом мультигенного наследования (вызывается комбинацией мутаций нескольких генов); каких-либо конкретных генетических аномалии выявлено не было. Гистологически это, как правило, светлоклеточные карциномы, но могут быть и другие варианты. Клиническая картина этих опухолей является типичной и неспецифической.
Тактика ведения
Для пациентов с семейным сПКР рекомендуется проводить генетическое тестирование на VHL, SDH-C, BAP1, TCS1 и TCS2. Если болезнь возникает в раннем возрасте, показано тестирование на SDH- и FH-мутации.
Тактика ведения
Диагностика частично основывается на изучении клинической картины пациента, но наиболее точный результат обеспечивает генетический анализ. Специфического лечения не существует, используется лишь симптоматическая терапия, в том числе и хирургические пособия для удаления новообразований.
Злокачественная опухоль почки формируется в эпителии проксимальных канальцев и собирательных трубочек (почечно-клеточная форма) или в эпителии чашечно-лоханочной системы (переходно-клеточная форма). Среди первичных злокачественных образований у взрослых эта онкопатология занимает 80–85 %.
Виды наследственного рака почки
Выделяют такие наследственные синдромы:
- Аутосомно-доминантный поликистоз почек. Повышает вероятность почечно-клеточной карциномы.
- Наследственная папиллярная карцинома. Это семейный синдром наследственного рака почки, а также высокопенетрантная, аутосомно-доминантная патология.
- Болезнь фон Гиппеля-Линдау. Аутосомно-доминантный синдром, сопровождающийся множественными доброкачественными и злокачественными образованиями, включая светлоклеточную карциному.
- Наследственный рак почек, ассоциированный с зародышевыми мутациями цикла Кребса. Это агрессивные формы почечно-клеточной карциномы, метастазирующие даже при небольшом размере и т. д.
Выявление генетических факторов риска по наследственному раку почки у пациента и его семьи позволяет разработать такую стратегию, которая минимизирует или предотвратит болезнь-ассоциированную заболеваемость. Анализу подлежат такие гены/протеины, как c-MET (локус 7q31), фумаратгидратаза (1q42), фолликулин (17p11), сукцинатдегидрогеназа (5p15), TSC1 (9q3416p13), TSC2 (3p25).
Причины рака почки
Основными факторами риска считаются:
- курение;
- ожирение;
- гипертония;
- мужской пол;
- удаление матки;
- тяжелые болезни почек;
- генетические патологии (вызывают наследственные формы рака почки);
- длительный диализ при хронической почечной недостаточности.
Симптомы рака почки
Основными признаками патологии являются:
- гематурия (наличие крови в моче);
- болевой синдром в проекции почки (боль ноющая, тупая, почечная колика);
- задержка мочи (из-за скопления в мочевом пузыре кровяных сгустков);
- повышение артериального давления (вторичная гипертензия);
- пальпируемое образование в области почки;
- симптомы общего характера (потеря веса, субфебрильная температура, нарастающая слабость).
При метастазах в легкие возникает кровохарканье и боль в груди, при поражении печени — признаки желтухи. Метастазирование в кости сопровождается патологическими переломами, в головной мозг — головными болями, радикулитом, неврологической симптоматикой.
Диагностика рака почки
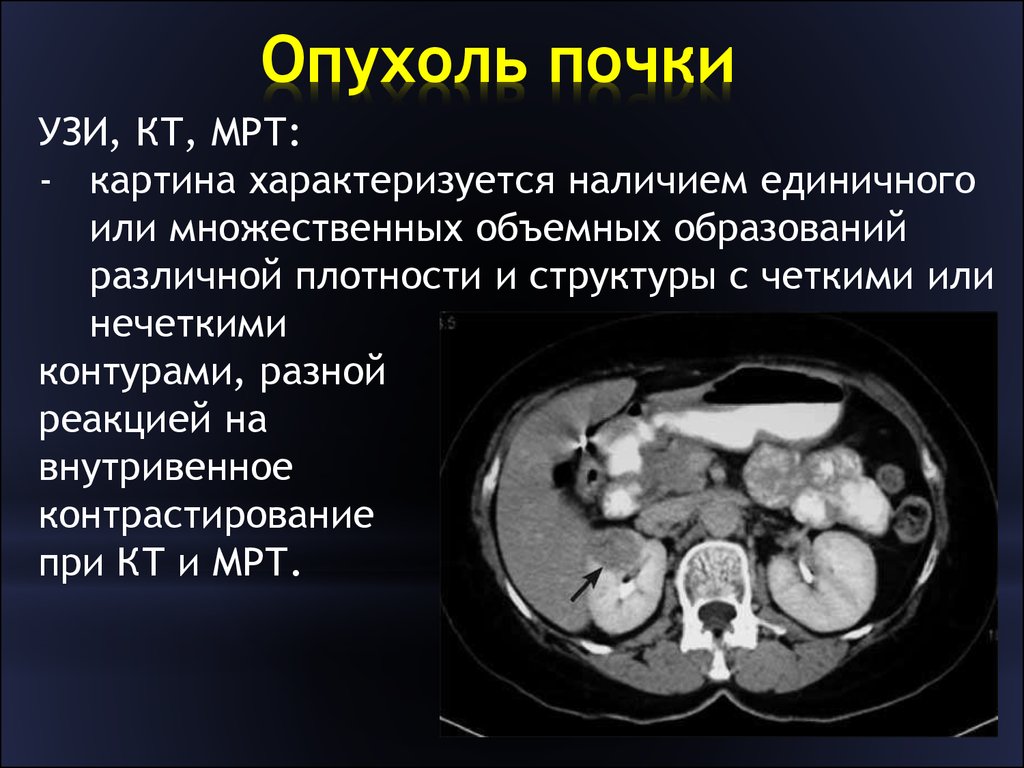
Для обследования используются такие методы:
- УЗИ;
- КТ;
- рентгенография с внутривенным контрастированием;
- МРТ;
- ангиография;
- сцинтиграфия;
- биопсия опухоли с гистологическим исследованием.
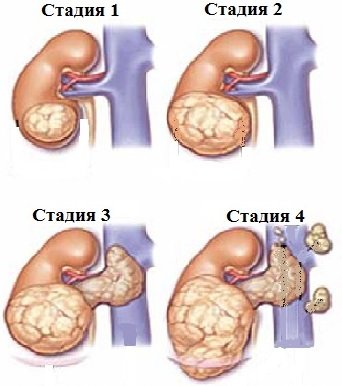
Выделяют четыре стадии рака почки:
- Опухоль ограничена почкой, через капсулу не проникает.
- Образование проникает через капсулу органа.
- Рак почки распространяется на ближайшие лимфоузлы, почечную и нижнюю полую вены.
- Опухоль разрастается на соседние органы (кишечник, поджелудочную железу), появляются метастазы (например, в легких).
Лечение рака почки
Основными методами являются:
Диагностика на ранней стадии онкопатологии позволяет в 90 % случаев добиться излечения.
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Успехи современной клинической онкологии неоспоримы. Все более сложные операции, новые препараты, эффективные методы обезболивания и устранения мучительных симптомов. Мы в нашем блоге достаточно рассказывали о том, как сегодня можно продлить и облегчить жизнь пациентам даже на последних стадиях болезни.
Но, тем не менее, тысячи онкологических больных во всем мире ежедневно узнают, что опухоль, которая вчера поддавалась определенному лечению — сегодня снова растет или дает метастазы. Врачи регулярно оказываются в тупике: все положенные лекарства и методы лечения перепробованы, и эффективных для данного пациента — не осталось.
Однако даже из этого тупика можно найти выход. С развитием генетики и молекулярной биологии в руках онкологов оказался новый способ изучить опухоль, чтобы найти в ней уязвимые места.
Для этого используют тестирование — определение особенностей ДНК раковых клеток. Метод сложный технически, дорогой, требует специфических знаний от врача.
Исследование занимает 3 недели, стоит от 250 до 670 т.р. В результате врач получает отчет в 30 страниц сложной информации, которой он еще должен уметь воспользоваться. Но пациентам, которые уже было перестали надеяться, это дает дополнительное время жизни.
Сегодня мы хотим рассказать о том, как делается тестирование, в каких случаях оно может помочь пациенту и какие знания дает врачу.
Мы все — мутанты, это норма. Но некоторые мутации приводят к раку
Для этого все соматические клетки (те, из которых состоит организм), кроме эритроцитов, беспрестанно делятся.
Иногда в процессе деления получаются сбои — мутации. То нить ДНК порвется, то скопируется с ошибкой, то участки хромосом перемешаются. Влиять на это может сотня факторов: от стресса и табачного дыма до воздействия радиации.
Мутации можно разделить на 4 вида
2. Хромосомные аберрации.
Делеция — утрата участка хромосомы. Происходят обрыва концевого участка или разрыва ДНК сразу в двух местах. Всё — этот ген в хромосоме больше не экспрессируется.
Мутации изменяют не только структуру участка ДНК, но и порядок этих участков
Злокачественную клетку от нормальной отличает нарушение клеточного цикла.
Клеточный цикл (жизнь клетки от деления до деления/гибели) строго регулируется работой специальных белков: киназы, циклины, факторы роста и транскрипционные факторы — в каждой живой клетке их десятки, и у каждого своя узкоспециальная, но важная функция.
Каждый этап клеточного цикла контролируется
Таких значимых генов, изменения в которых могут привести к канцерогенезу (возникновению рака) — две больших группы.
Из тех, что наиболее хорошо изучены и у всех на слуху:
- EGFR, ALK, BRAF — немелкоклеточный рак легкого;
- BRAF — меланома;
- HER2 — рак молочной железы (РМЖ);
- KRAS — колоректальный рак.
Причем, мутации этих генов бывают обнаружены при нескольких видах опухолей. Например, повышенная экспрессия HER2 обнаруживается не только при РМЖ, но и при раке легкого и желудка.
Мутация в протоонкогене белка BRAF приводит к неконтролируемому росту опухоли.
опухоли (антионкогены) — напротив, могут подавить рост опухолевых клеток или участвуют в репарации (починке) поврежденной ДНК. А вот инактивация в результате мутации — резко увеличивает вероятность появления злокачественной опухоли.
- мутации BRCA1, BRCA2 — рак молочных желез, яичников;
- мутации p53 — до 50% различных видов раковых опухолей, саркомы;
Всего изучено влияние нескольких десятков протоонкогенов и опухолевых супрессоров на канцерогенез.
Зачем столько сложностей и как они продлевают жизнь пациентам
Иматиниб связывается с активным участком молекулы белка , и блокирует его способность взаимодействовать с остальными молекулами в цепочках сигнальных путей.
Так что таргетные препараты имеют 2 важных преимущества перед классической химиотерапией.
Но и лечение для него должно быть соответствующее — индивидуально подобранное для конкретного пациента — на основе того, что мы определяем мутации в его опухолевых клетках.
В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
- обнаружим опухоль/метастаз на очень ранней стадии — по обрывкам ее ДНК в крови;
- можем прогнозировать благоприятное или агрессивное течение заболевания.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия — микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови — тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль — опасаются, что ее это спровоцирует на рост. На сегодня не доступны исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла — от кожи до опухоли — так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию исследований.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации — то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии — и даже визуализировать весь кариотип (хромосомный набор).
Под стрелкой слева — слияние красного и зеленого сигнала — свидетельство о слияния генетического материала хромосом 9 и 22 с образованием химерной филадельфийской хромосомы.
Кроме того, в полном исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) — нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.
После получения профиля опухоли — начинается его анализ
Специальные программы обрабатывают полученные результаты и составляют рекомендации автоматически. Но затем эти рекомендации обязательно вручную курируются командой экспертов. В анализе участвуют генетики, биоинформатики, , иммунологи и химиотерапевты. На этом этапе обязательно происходят уточнения и дополнения.
В итоге, в первой части отчета прописаны все найденные мутации в опухоли пациента, и таргетные препараты, которые будут наиболее эффективны в данном случае. Указана таргетная терапия, одобренная для данного типа опухолей с обнаруженными мутациями, и таргетная терапия, которая одобрена для лечения других типов рака с теми же мутациями. У нас в практике были случаи, когда назначались препараты именно второго порядка, — и хорошо действовали.
Далее сотрудники лаборатории проводят огромную работу по мониторингу научных исследований, которые могут быть значимы в случае с данным пациентом.
Во второй части отчета находится обзор существующих на тот момент исследований с подробными данными о частоте встречаемости данной мутации, о действии разных препаратов и о возможности использовать тот или иной вид таргетной терапии при выявленных мутациях. Это помогает составить хотя бы приблизительный прогноз для пациента.
В третьей части отчета собраны актуальные клинические исследования, в которых пациент может принять участие, чтобы получить экспериментальное лечение. Это самый последний запасной способ, но знать о нем все подробности — полезно для спокойствия пациента.
Отчет получается довольно увесистым — 30 страниц захватывающего чтения
Кому это нужно?
В этом случае исследование и дает нам понимание, какой препарат будет эффективен против данной опухоли, именно с этим набором мутаций. Назначение такого препарата позволяет выиграть главный для онкопациента ресурс — время.
Проблемы методики
Опухоли неоднородны. Они состоят из разных клеток, которые могут отличаться весьма значительно. И, например, в 80% клеток опухоли мутация определенного гена присутствует, а 20% клеток поделились с другим распределением хромосом — и остались немутировавшими. Да, мы назначаем препарат по результатам теста, и против 80% опухолевых клеток он сработает эффективно, но для оставшихся 20% нужно будет придумывать другое лечение.
Некоторые виды рака гетерогенны, например, РМЖ. А некоторые опухоли, такие как саркомы, напоминают по структуре винегрет. Это затрудняет и диагностику, и лечение: нельзя заранее узнать, в какой части опухоли какие клетки, сколько их видов, как сильно они отличаются. И нельзя, грубо говоря, взять 10 образцов из разных мест опухоли — по ним придется сделать 10 отдельных генетических исследований.
До 30% таргетных и иммунопрепаратов в России назначается без соответствующего обоснования — без исследований генетики опухоли. И часть этих лекарств оказывается пустой тратой средств бюджета и денег пациента, потому что назначать таргетное лечение без понимания генетики опухоли — это рулетка: зарегистрировано более 600 препаратов. Например, для рака молочной железы есть пять протоколов лечения, в зависимости от мутации гена HER2/Neu.
В западной медицине определение генетического профиля опухоли уже становится стандартом лечения. Для российских онкопациентов тестирования — все еще редкий случай, к сожалению — для бюджетной медицины это пока дорого. Но есть надежда, что все изменится к лучшему. Если сейчас оно стоит 600 тыс. руб., то 5 лет назад стоило больше миллиона — технология становится все проще и совершеннее, а, значит, популярнее и доступнее. Здесь время работает на нас.
Поэтому мало просо сделать генетический тест, нужно уметь понять результаты и сделать верные выводы. Мы с коллегами чаще всего сначала изучаем отчет сами (бывает, приходится посидеть над ним дома, в тишине после работы) — а потом еще и собираем консилиум, принимаем коллегиальное решение.
Но хорошие истории пациентов, честно говоря, всегда мотивируют лучше всего.
Сейчас у нас есть пациентка, 48 лет, с рецидивирующей глиобластомой (агрессивная опухоль мозга). К нам она попала после того, как прошла две линии терапии в государственном онкоцентре. Там все делали правильно, проводили лучевую терапию и назначали таргетный препарат, но опухоль все равно вернулась. Женщине отвели полгода жизни.
Мы предложили ей полное тестирование. Да, оно стоит 600 тыс. рублей, сокращенный вариант, за 250, в ее случае не подошел — нужно было расширенное тестирование, с максимально полным набором мутаций.
Но по результатам обследования назначили ей препарат, который предназначен обычно для лечения немелкоклеточного рака легкого. Он эффективен против опухолей с мутацией EGRF — у нашей пациентки глиобластома была именно с этой мутацией.
Женщина ходит к нам лечиться и наблюдаться уже 4 года. Это в 5 раз дольше, чем при стандартной терапии. Причем, она самостоятельна, живет эти 4 года обычной жизнью, ходит на работу и собирается дождаться внуков.

Рак — заболевание, которое ежегодно уносит миллионы жизней, уступая среди причин смертности только сердечно-сосудистым патологиям. Ученые и врачи-онкологи уже давно ведут с ним борьбу, постоянно внедряя новые средства, которые помогают сохранить жизни всё большего числа пациентов. За последние десятилетия поле сражения сильно сместилось с гистологического и клеточного уровня на молекулярно-генетический.
Если раньше было лишь известно, что при раке меняется внешний вид и поведение клеток, то теперь ученые стремятся разобраться в процессах на уровне генов и отдельных молекул. Это стало возможным с развитием молекулярной биологии, и на этом поприще достигнуты немалые успехи.
Рак развивается из-за мутаций, в результате которых эти гены начинают работать неправильно. Генетические дефекты возникают случайно или при воздействии внешних факторов: курения, ультрафиолетового излучения, канцерогенов в пище и окружающей среде. Некоторые мутации (наследственные) человек получает от родителей, другие (приобретенные) — в течение жизни.
Каждый рак уникален, несет собственный набор мутаций. И эти различия могут сильно влиять на прогноз, чувствительность раковых клеток к тем или иным лекарственным препаратам. Выяснить это помогают специальные генетические анализы.
Показания:
Генетические исследования в онкологии помогают решать важные задачи:
Все генетические исследования на мутации, связанные с раком, можно разделить на две большие группы: те, которые проводят у здоровых людей, чтобы выявить риски, и те, которые проводят у онкологических больных, чтобы изучить опухолевые клетки и подобрать правильное лечение. Для каждой группы есть свои показания.
Анализы для людей, у которых уже диагностирован рак
Обычно такие исследования назначают при поздних стадиях онкологических заболеваний, когда стандартные методы лечения не помогают. Эти анализы применяют для диагностики заболевания, подбора персонализированной терапии и оценки прогноза.
Наиболее распространенные исследования из этой группы:
- При меланоме: исследования мутация в гене BRAF.
- При немелкоклеточном раке легкого: гены EGFR, BRAF, ALK.
- При раке толстой и прямой кишки: ген KRAS.
- При раке молочной железы: ген HER2.
- При раке яичников: гены BRCA1, BRCA2.
Эти мутации будут встречаться только в опухолевых клетках. В остальных, здоровых, тканях организма указанные гены будут функционировать нормально.
Анализы для здоровых людей, направленные на оценку рисков
Наследственные мутации человек получает от родителей. Они присутствуют в половых клетках, а значит, их получат все клетки тела человека. В настоящее время с помощью генетического теста можно определить повышенный риск развития следующих типов рака:
- яичников;
- молочной железы;
- щитовидной железы;
- толстой кишки;
- поджелудочной железы;
- простаты;
- желудка;
- почки.
Кроме того, генетические исследования помогают оценить риск меланомы, сарком — злокачественных опухолей из соединительной ткани.
Эксперты из Американского общества клинической онкологии (American Society of Clinical Oncology) рекомендуют рассмотреть возможность проведения генетических исследований на наследственные мутации людям, у которых в семье часто встречались определенные типы злокачественных опухолей, если такой диагноз был установлен у близких родственников. Правильное решение о необходимости обследования помогут принять онколог, клинический генетик.
Что показывает анализ?
Генетические тесты показывают, в каких генах произошли изменения, связанные с повышенным риском рака. Выделяют две группы генов, в которых могут возникать такие мутации.
Распространенные примеры онкогенов — EGFR и HER2. Эти белки-рецепторы встроены в клеточную мембрану. При активации они запускают цепочку биохимических реакций, в результате чего клетка начинает активно, бесконтрольно размножаться. Все мутации в протоонкогенах — приобретенные, они не наследуются.
Европейская клиника сотрудничает с ведущими зарубежными лабораториями. Они применяют современные технологии секвенирования, которые помогают быстро изучить ДНК человека и выявить изменения в сотнях генов:
Существуют ли противопоказания?
Генетические тесты могут нести некоторые негативные эффекты. Когда здоровый человек узнаёт, что у него мутация, связанная с повышенным риском рака, это может стать сильным эмоциональным потрясением. Врач порекомендует рассказать об этом членам семьи, чтобы они тоже знали о рисках, и это может сделать семейную атмосферу более напряженной. Сам по себе генетический анализ стоит недешево. Если его проводят у онкологического больного для подбора персонализированной терапии, рекомендованные по результатам исследования препараты тоже могут оказаться очень дорогими.
Как происходит сдача анализа?
Насколько достоверны результаты?
Точность обнаружения мутаций с помощью современных генетических исследований составляет почти 95%.
Что может повлиять на точность результата?
Для того чтобы анализ показал достоверный результат, врач-онколог должен правильно провести биопсию, соблюдать технику фиксации (специальной обработки) ткани. Организация, которая отправляет материал в лабораторию, должна соблюдать правила транспортировки. В противном случае провести исследование не получится.

Расшифровка анализа
Если анализ на наследственные мутации показал отрицательный результат, это значит, что у человека нет генетических дефектов, повышающих риск развития тех или иных злокачественных опухолей. Но это не значит, что он никогда не заболеет раком. Просто его риски несколько ниже. Аналогично положительный результат не говорит о том, что у пациента обязательно будет диагностировано онкологическое заболевание. У него повышены риски, и, возможно, потребуются некоторые профилактические мероприятия.
Иногда результат исследования на наследственные мутации сомнителен. В таких случаях многие онкологи и клинические генетики предпочитают считать, что риск рака всё же повышен, и рекомендуют некоторые меры профилактики. В ряде случаев ситуацию помогают прояснить анализы близких родственников.
Иногда обнаруживают неизвестные изменения в генах. Непонятно, то ли это вариант нормы, то ли нейтральная мутация, то ли она повышает риск рака.
Если анализ проводится у онкологического пациента для подбора эффективного лечения, лаборатория высылает лечащему врачу отчет, в котором указывает:
- обнаруженные мутации;
- список научных публикаций, в которых эти мутации фигурируют;
- препараты, одобренные для лечения рака с такими генетическими дефектами;
- препараты, которые в настоящее время не одобрены для лечения данного типа рака, но успешно применяются для борьбы с другими злокачественными опухолями с аналогичными мутациями.
На основе этой информации онколог принимает решение по поводу дальнейшего лечения.
Генетические исследования на рак в Европейской клинике
В Европейской клинике есть всё для того, чтобы, при необходимости, назначить онкологическому пациенту персонализированную терапию, замедлить прогрессирование болезни и продлить жизнь. Мы применяем все препараты последних поколений, зарегистрированные на территории России, и сотрудничаем с ведущими европейскими, американскими лабораториями, которые проводят генетические исследования в онкологии.
Мы знаем, как помочь, если в другой клинике сказали, что больше ничего нельзя сделать, или лечение, назначенное ранее, перестало помогать. Свяжитесь с нами.
Читайте также:





