Может быть генетическая предрасположенность к меланоме








ГЕНЕТИЧЕСКАЯ ПРЕДРАСПОЛОЖЕННОСТЬ МЕЛАНОМЫ
Меланома — злокачественная опухоль, возникающая в результате атипического перерождения и размножения пигментных клеток (меланоцитов). Наиболее часто поражает кожу, но может встречаться и на слизистых. Характеризуется быстрым распространением опухолевых клеток по всему организму. Меланома диагностируется по данным исследования мазка-отпечатка, сделанного с ее поверхности. Гистологическое подтверждение диагноза производится после удаления образования. Лечение проводится в зависимости от стадии меланомы и может состоять в хирургическом иссечении образования, удалении лимфатических узлов, иммунотерапии, лучевой терапии и химиотерапии.
Меланома является одним из видов рака кожи. На долю меланомы приходится 1-1,5% от всех злокачественных новообразований. По данным ВОЗ каждый год в мире от меланомы погибает около 48 000 человек и отмечается рост заболеваемости. Наиболее часто меланома диагностируется у пациентов, проживающих в южных странах в условии повышенной природной инсоляции. Подвержены заболеванию в основном люди старше 30 лет, но отдельные случаи меланомы встречаются и у детей. В различных странах мира заболеваемость меланомой кожи варьирует от 5 до 30 человек на 100 000 населения.
История изучения меланомы кожи
Причины возникновения меланомы
Риск развития меланомы повышен у лиц с I и II фототипом кожи. Наиболее маловероятно развитие заболевания у людей со смуглой кожей и лиц негроидной расы. Вероятность возникновения меланомы повышают имеющиеся в анамнезе (даже в раннем детстве) солнечные ожоги, избыточное ультрафиолетовое облучение, как естественное, так и полученное в солярии.
Прослеживается наследственная предрасположенность — возникновение заболевания у лиц, имеющих в семейном анамнезе случаи меланомы. Ученые предполагают, что это связано с генетически передающимся нарушением в работе супрессоров, подавляющих опухолевый рост.
Около 70% случаев развития меланомы происходит в результате злокачественного перерождения пигментных невусов, к которым относятся: гигантский пигментный невус, голубой невус, невус Ота, сложный пигментный невус, пограничный невус. С высокой вероятностью трансформироваться в меланому могут также пигментная ксеродерма и меланоза Дюбрейля. К факторам, запускающим процесс малигнизации невуса или пигментного образования, относятся его травмирование и повышенная инсоляция, наследственные и эндокринные факторы.
Наследственная предрасположенностьк меланоме кожи
МК является этиологически гетерогенным заболеванием, его развитие связано с воздействием как средовых, так и генетических факторов. Среди всех факторов риска развития МК определяющее значение имеет взаимосвязь между генетически детерминированным кожным фенотипом и УФ-облучением. Однако, расположение многих очагов меланомы на участках кожи, не подвергающихся регулярной солнечной экспозиции, свидетельствует о том, что эта связь не является специфической. Выделяют спорадическую и наследственную формы МК. Если в семье пациента отсутствуют случаи заболевания данной патологией, речь идет о спорадической (90 % всех случаев) форме. В тех случаях, когда имеет место накопление случаев МК в семье, МК называют (семейной, генетически ассоциированной) наследственной (5-14 %). В этом случае заболевание обусловлено герминальными мутациями в генах предрасположенности с возможностью наследования структурных перестроек последующими поколениями в соответствии с классическими законами Менделя. Установлено, что наличие семейной истории МК увеличивает риск развития опухоли у здоровых членов семьи. По данным литературы, частота МК у близких родственников больных данной патологией составляет от 8 до 14 %. Речь о семейной истории МК идет в том случае, если поражены два и более родственника первой степени родства или у троих членов семьи диагностирована (независимо от степени родства) МК. Семейное накопление МК также отмечается в 5-10 % случаев в географических регионах с высоким уровнем заболеваемости МК. На основании проведенных многочисленных исследований были установлены основные клинические критерии семейной МК:1. ранний возраст возникновения заболевания: медиана возраста манифестации составляет 36 лет у мужчин и 29 лет у женщин при наследственной форме по сравнению с 57 годами у мужчин и 59 годами у женщин при спорадической форме. В 10 % случаев семейная МК диагностируется в возрасте 20 лет, тогда как спорадические случаи МК выявляют в этом возрасте лишь в 2 % случаев; 2. наличие большого количества пигментных невусов на коже; 3. первично-множественные очаги поражения МК: частота первично-множественной МК составляет 30 % при наследственной по сравнению с 4 % при спорадической МК. По клиническим, фенотипическим и гистологическим параметрам семейная МК не отличается от спорадической, тогда как ранний возраст манифестации и множественный характер поражения встречаются чаще именно при наследственной форм. В течение последних десятилетий усилия ученых направлены на установление молекулярно-генетических перестроек, лежащих в основе развития МК. С использованием сегрегационного анализа и сравнительной геномной гибридизации были картированы гены, вовлеченные в наследственный и спорадический канцерогенез МК, такие как CDKN2A, CDK4, MC1R, BRAF, NRAS, c-KIT, PTEN и др. Гены, ответственные за развитие семейной формы МК, разделяют на 2 большие группы:
-гены с высокой пенетрантностью
-гены с низкой пенетрантностью.
Высокопенетрантныегены
300 исследованных на наличие структурных перестроек CDKN2A образцов крови.
Кроме того, имеются сведения, что герминальные мутации, затрагивающие 5'-конец CDKN2A, могут иметь клиническое значение и ассоциированы с предрасположенностью носителей к МК. N. Hayward суммировал данные основных исследований, касающиеся происхождения наиболее часто встречающихся мутаций в CDKN2A. Отмечены популяционные различия выявленных мутаций в зависимости от национальной принадлежности. Стоит отметить, что мутации в CDKN2A обнаруживают также и при спорадической МК, однако их частота невелика - всего 1-2 %. Большая часть соматических мутаций гена представлена миссенс- и нонсенс-вариантами, а также мутациями со сдвигом рамки считывания. Гомозиготные делеции этого гена обнаруживаются в 19 % случаев опухолей, в то время как точковые мутации составляют не более 3 %. За время изучения этого гена были определены основные точковые мутации DKN2A/P16 при МК: Ile41Thr, Arg50Ter, Asn63Ser, Arg79Pro, Gly93Trp, Val118Asp, Ala140Th, а также мутация альтернативного сайта сплайсинга IVS2+1, считающиеся на сегодняшний день hot point. Суммируя работы, касающиеся частотного спектра мутаций, показано, что между соматическими и герминальными мутациями гена CDKN2A/p16 существует гомология.В то время, как мутации в CDKN2A/p16 ответственны за 20-40 % случаев наследственной МК , герминальные мутации CDKN2A/p14ARF (ARF - alternate reading frame - альтернативная рамка считывания) обнаруживают в среднем в 25 % наследственных форм МК. CDKN2A/p14ARF кодирует регулятор клеточного цикла, предотвращающий деградацию р53, что ведет к увеличению его концентрации и далее - к активации этого белка. Результатом активации р53 является остановка клеточного цикла и репликации ДНК. Таким образом осуществляется регуляция запуска и прекращения клеточного роста. Основными соматическими мутациями, повреждающими p14ARF являются делеции. Гомозиготные делеции этого гена обнаруживаются в 19 % случаев опухолей, в то время как точковые мутации составляют не более 3 %. Так как CDKN2A/p16 и CDKN2A/p14ARF кодируются одной последовательностью ДНК, оба гена очень часто инактивируются вследствие одного и того же повреждения. В целом, мутации и метилирование гена CDKN2A часто наблюдаются не только в наследственных и спорадических меланомах, но и в большой группе других ненаследственных новообразований: раке поджелудочной железы, пищевода, желчных путей, мочевого пузыря, Т- и В-клеточных острых лимфолейкозах, мезотелиомах, анапластических астроцитомах, глиобластомах и др. Исследование группы B.E.G. Rothberg было посвящено выявлению корреляции прогностических маркеров с общей выживаемостью больных МК. Анализ основан на определении уровней экспрессии белков, вовлеченных в патогенез МК. Установлено, что повышение экспрессии p16/CDKN2A значительно улучшает прогноз при МК (возможно, это связано с ингибированием абберантной клеточной пролиферации меланоцитов, индуцируемой данным белком). Более того, повышение экспрессии p16/CDKN2A обладает протективным эффектом в отношении снижения смертности пациентов от МК. Эти данные согласуются с ранее проведенным исследование O. Straume et al., в котором снижение экспрессии pl6/CDKN2A было ассоциировано с увеличение пролиферативной активности опухолевых клеток (Ki-67) и являлось независимым фактором прогноза снижения выживаемости больных МК. Наряду с этим было продемонстрировано, что аллельные потери в области p16/CDKN2A и последующее снижение экспрессии белка ведут к прогрессированию МК. В частности, гомозиготные делеции локуса INK4 (CDKN2), кодирующего как p16(INK4a) так и p14(ARF), являются наиболее частыми генетическими перестройками при МК и коррелируют со снижением общей выживаемости при различных типах опухолей, включая МК. На основании проведенной работы по оценке прогностической значимости генетических нарушений локуса CDKN2 Casula M. et al. пришли к выводу, что тестирование p16/CDKN2A может применяться в качестве маркера, предсказывающего одновременно предрасположенность к развитию МК и прогноз данного заболевания. Ген CDK4/ CYCLIN-DEPENDENT KINASE 4 (12q13) (OMIM № 123829). Ген CDK4 (циклин-зависимая киназа 4) расположен на длинном плече 12 хромосомы и является онкогеном. На сегодняшний день герминальные мутации этого гена (Arg24Cys и Arg24His) описаны лишь в нескольких семьях больных МК, встречаются редко и актуальны, по-видимому, лишь для небольшой подгруппы наследственной МК. Ген CMM1 (1p36) (OMIM № 155600). Ген CMM1, расположенный на коротком плече 1 хромосомы, был первым идентифицированным потенциальным геном, отвечающим за предрасположенность к МК, однако позже были получены данные, согласно которым его значение оказалось незначительным.
Заключение
Достижения в области молекулярной генетики вносят вклад в изучение этиологии, механизмов наследования, рисков развития и ассоциации генетический перестроек с клиническим течением наследственной меланомы кожи. Ген СБКША ответственен за 20-50% случаев наследственной меланомы кожи, вклад других изученных генов не превышает нескольких процентов, и они, скорее всего, играют модифицирующую роль в патогенетическом комплексе. Остальные ключевые гены, отвечающие за развитие семейной меланомы кожи, еще только предстоит идентифицировать. Таким образом, обзор представленных данных обосновывает необходимость дальнейшего изучения наследственной формы меланомы кожи для своевременной диагностики и последующего динамического наблюдения пациентов группы риска в условиях онкодиспансера.
Литература
Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ в 2008 г. // Вестн. РОНЦ им. Н.Н. Блохина. - 2010. - Т. 21, № 2. - C. 13-58.
Демидов Л.В., Харкевич Г.Ю. Адъювантное лечение больных меланомой кожи // Практическая онкология. Отечественная школа онкологов. - 2001. - № 4(8). - C. 42-49.
Копнин Б.П. Опухолевые супрессоры и мутаторные гены. В кн: Канцерогенез. / Под ред. Д.Г. Заридзе. -М.: Медицина, 2004. - С. 125-56.
Рак часто наблюдается у членов одной семьи, объективно подтверждена наследственная природа некоторых злокачественных опухолей. Есть точка зрения, что наследственная предрасположенность — самая вероятная причина всех онкологических заболеваний, и только дело времени, чтобы наука точно установила, мутация какого гена за какой конкретный рак отвечает. Но уже сейчас наследственную передачу рака можно прервать.
Если у человека возникло онкологическое заболевание, очень важно выяснить, есть ли в его роду другие случаи злокачественных новообразований. Семьям, в которых имеется более одного такого случая, нужно пройти консультацию врача-генетика, чтобы понять, есть ли в семейной истории основания для подозрений на наследственный характер патологии. Особенно настораживающим признаком будет онкологическое заболевание в нескольких поколениях семьи. Одним из основных методов работы врача-генетика является составление родословных. Другая важная часть медико-генетической консультации — осмотр и опрос пациента: наследственные заболевания нередко проявляются специфическими признаками.
Принципиальным отличием наследственного рака является возможность его прогнозировать путем выявления патогенных мутаций. На первом этапе семьям, в которых имеется более одного случая развития рака, рекомендуется пройти консультацию врача-генетика, по результатам которого можно будет понять, есть ли в семейной истории основания для подозрения на наследственный характер патологии.
Если в процессе консультации возникают подозрения на наследственную природу заболевания, то следующий этап — целенаправленное генетическое тестирование, поиск мутаций, которые могут вызывать конкретное заболевание. Одни исследования позволяют обнаружить изменения в самом гене, другие — в белке, который кодируется измененным геном. Один ген может претерпеть до 300 мутаций.
В последние годы найдены мутации, ответственные за возникновение и развитие рака молочной железы, яичников, толстой кишки и др. Цель генетического тестирования, или скрининга,— выявить риск возникновения заболевания до появления симптомов. Это дает возможность в одних случаях провести своевременное лечение, в других — рекомендовать меры, позволяющие избежать передачи наследственного заболевания потомству. Мутации генов найдены для нескольких видов рака, тесты на некоторые из них уже используют в клинике — например, тесты на рак груди и кишечника.
От предков или не от предков
Все онкологические заболевания имеют генетическую природу, поскольку при раке гены, отвечающие за правильное деление клетки, повреждены. Но в одних случаях имеют место наследственные мутации, а в других — приобретенные. Результатом повреждения (мутации) гена во всех случаях является бесконтрольное неограниченное деление клеток, что и является сутью ракового процесса.
Несмотря на то что онкологические заболевания имеют генетическую природу, только 10–15% из них передаются по наследству. Почему важно знать, наследственный или ненаследственный рак? Потому что если установлена его наследственная природа, то есть выявлена мутация, вызвавшая его, то известен прогноз и понятна тактика в отношении самого больного и его родственников. Особенно отчетливо наследование мутации прослеживается в случаях так называемого семейного рака молочной железы и яичников, при семейном аденоматозном полипозе и различных опухолевых синдромах (Линча — рак толстой кишки, Ли-Фраумени — разнообразные саркомы и др.). Многие люди, сами будучи здоровыми, являются носителями мутаций, приводящих к наследственным заболеваниям. Если носители одной и той же мутации — оба родителя, заболевание становится неизбежным. Генетическое тестирование позволяет это выявить.
Следует подчеркнуть, что наличие мутации не означает заболевания. Мутация может сидеть в гене много лет до того, как начнет развиваться опухоль. Но, зная про мутацию, врачи могут назначить рациональный режим обследования и профилактического лечения.
Например, у женщин—носительниц гена BRCA1 в 95% случаев в течение жизни разовьется рак груди и в 65% — рак яичников, причем часто рак развивается в молодом возрасте, до 50 лет. Это означает, что носительница должна все время находиться под наблюдением, а в некоторых случаях целесообразно ставить вопрос о профилактическом удалении груди и (или) яичников. У всех на слуху история Анджелины Джоли, которая настояла на удалении обеих молочных желез, поскольку у нее обнаружили мутацию гена BRCA1.
Специалисты знают результаты исследования ткани удаленных молочных желез у 54 шведских женщин—носительниц этого гена в возрасте до 51 года. Ни у одной из них обследование не показывало опухоли груди до операции, но гистологическое изучение удаленной ткани выявило наличие раковых клеток у пяти (10%!) из них.
К профилактической хирургии прибегают и при семейном аденоматозном полипозе, при котором вероятность развития рака толстой кишки после 40 лет достигает 100%, и при других онкологических заболеваниях, если установлена онкогенная мутация.
Понятно, что женщины с отрицательным результатом теста на мутации генов BRCA1 и BRCA2 не застрахованы от спорадического рака груди и яичников. Однако вероятность его возникновения несопоставимо ниже, чем у женщин с положительным тестом.
Женщине следует заподозрить у себя предрасположенность к наследственному раку груди, пройти консультацию врача и генетика и генетическое тестирование, если в семье:
— было более одного случая рака груди или яичников по женской линии (у матери, бабушки, тетки, сестер и т. д.);
— заболевание было диагностировано в молодом возрасте (до наступления климакса);
— были случаи рака груди у мужчины;
— были больные c множественными опухолями (например, у одного человека — рак груди, толстой кишки, матки, рак поджелудочной железы и т. д.);
— были случаи двустороннего рака обеих молочных желез или обоих яичников.
Тестирование и его последствия
Генетическое тестирование имеет несколько преимуществ. Отрицательный результат может принести человеку облегчение, избавить от страха ожидания тяжелой болезни, от которой, возможно, погибли его близкие, а также от регулярных обследований, которые должны быть обязательны в семьях с высоким онкологическим риском. Положительный результат дает человеку возможность принимать обдуманные решения о будущем своем и своего потомства.
Сегодня возможна профилактика наследственного рака, то есть возможность не передать от родителей потомству ген, несущий опасную мутацию. Метод, который позволяет это сделать, называется преимплантационная генетическая диагностика (ПГД). Он заключается в следующем: для пары выполняют ЭКО, проводят генетическую диагностику полученных эмбрионов и переносят в матку женщины только те из них, в которых нет онкогенных мутаций. У родившегося ребенка их не будет, а значит, не будет и наследственного рака.
Открытое письмо Анджелины Джоли, New York Times, 14 мая 2013 года
ПГД проводится не на всем эмбрионе, а на нескольких клетках, которые получают путем его биопсии. Доказано, что биопсия не оказывает влияния на здоровье и состояние ребенка. Другими словами, ПГД не снижает частоту наступления беременности и безопасна для будущего ребенка.
Кроме мутаций, отвечающих за развитие рака груди и яичников, установлены мутации, несущие предрасположенность к меланоме, раку желудка, матки, предстательной, поджелудочной и щитовидной железы, толстой и прямой кишки. Если мутация определена и в семье есть люди, которые хотят иметь ребенка, важно, чтобы они знали о возможности предотвратить передачу следующим поколениям этой мутации и связанного с ней рака с помощью ЭКО и ПГД.

- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Когда родственник заболевает раком, нам страшно. В какой-то мере страшно и за свое здоровье – передается ли рак по наследству? Прежде чем делать поспешные выводы и впадать в панику, давайте разберемся с этим вопросом.
По своей сути, рак – генетическое заболевание, которое возникает вследствие поломки генома клетки. Раз за разом в клетке происходит последовательное накопление мутаций, и она постепенно приобретает свойства злокачественной – малигнизируется.

Генов, которые участвуют в поломке, несколько, и перестают работать они не одновременно.
- Гены, кодирующие системы роста и деления, называются прото-онкогенами. При их поломке клетка начинает бесконечно делиться и расти.
- Есть гены-супрессоры опухолей, отвечающие за систему восприятия сигналов от других клеток и тормозящие рост и деление. Они могут сдерживать рост клетки, а при их поломке этот механизм выключается.
- И, наконец, есть гены репарации ДНК, кодирующие белки, которые чинят ДНК. Их поломка способствуют очень быстрому накоплению мутаций в геноме клетки.
Генетическая предрасположенность к онкологии
Существует два сценария возникновения мутаций, вызывающих онкологические заболевания: ненаследственный и наследственный. Ненаследственные мутации появляются в изначально здоровых клетках. Они возникают под воздействием внешних канцерогенных факторов, например, курения или ультрафиолетового излучения. В основном рак развивается у людей в зрелом возрасте: процесс возникновения и накопления мутаций может занимать не один десяток лет.
Однако, в 5-10% случаев предопределяющую роль играет наследственность. Происходит это в том случае, когда одна из онкогенных мутаций появилась в половой клетке, которой посчастливилось стать человеком. При этом каждая из примерно 40*1012 клеток организма этого человека также будет содержать начальную мутацию. Следовательно, каждой клетке нужно будет накопить меньше мутаций, чтобы стать раковой.
Повышенный риск развития рака передается из поколения в поколение и называется наследственным опухолевым синдромом. Встречается данный синдром довольно часто – примерно у 2-4% населения.
Несмотря на то, что основную массу онкологических заболеваний вызывают случайные мутации, наследственному фактору также необходимо уделять серьезное внимание. Зная об имеющихся унаследованных мутациях, можно предотвратить развитие конкретного заболевания.
Предрасположенность к раку наследуется как Менделевский доминантный признак, иными словами, как обычный ген с различной частотой возникновения. При этом вероятность возникновения в раннем возрасте у наследственных форм выше, чем у спорадических.
Распространенные генетические исследования
Коротко расскажем вам об основных видах генетических исследований, которые показаны людям из группы риска. Все эти исследования можно провести в нашей клинике.
Определение мутации в гене BRCA
В 2013 году благодаря Анджелине Джоли весь мир активно обсуждал наследственный рак молочной железы и яичников, о мутациях в генах BRCA1 и BRCA2 теперь знают даже неспециалисты. Из-за мутаций теряются функции белков, кодируемых этими генами. В результате основной механизм репарации (восстановления) двунитевых разрывов молекулы ДНК нарушается, и возникает состояние геномной нестабильности – высокой частоты мутаций в геноме клеточной линии. Нестабильность генома является центральным фактором канцерогенеза.
Учеными описано более тысячи различных мутаций в этих генах, многие из которых (но не все) связаны с повышенным риском возникновения онкологического заболевания.
У женщин с нарушениями в BRCA1/2 риск заболеть раком молочной железы составляет 45-87%, в то время как средняя вероятность этого заболевания – всего 5,6%. Растет вероятность развития злокачественных опухолей и в других органах: яичниках (с 1 до 35%), поджелудочной, а у мужчин – и в предстательной железе.
Генетическая предрасположенность к наследственному неполипозному колоректальному раку (синдром Линча)
Колоректальный рак – одно из самых распространенных онкологических заболеваний в мире. Около 10% населения имеет генетическую предрасположенность к нему.
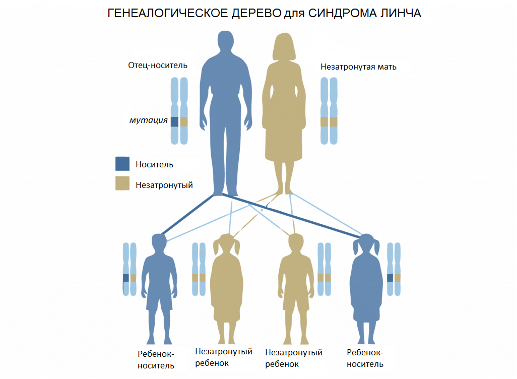
Генетический тест на синдром Линча, также известного как наследственный неполипозный колоректальный рак (НПКР), определяет заболевание с точностью 97%. Синдром Линча – наследственное заболевание, в результате которого злокачественная опухоль поражает стенки толстого кишечника. Считается, что около 5% всех случаев колоректального рака связаны с этим синдромом.
Определение мутации в гене BRaf
При наличии меланомы, опухолей щитовидной или предстательной железы, опухоли яичников или кишечника рекомендуется (а в некоторых случаях обязательно) проведение анализа на BRaf мутацию. Это исследование поможет выбрать необходимую стратегию лечения опухоли.
BRAF – это онкоген, который отвечает за кодировку белка, располагающегося в сигнальном пути Ras-Raf-MEK-MARK. Этот путь, в норме, регулирует деление клеток под контролем фактора роста и различных гормонов. Мутация в онкогене BRaf приводит к избыточному неконтролируемому разрастанию и устойчивости к апоптозу (запрограммированной смерти). Результатом является в несколько раз ускоренное размножение клеток и рост новообразования. По показаниям данного исследования специалист делает заключение о возможности использования ингибиторов BRaf, которые продемонстрировали значительное преимущество по сравнению со стандартной химиотерапией.

Методика проведения анализа
Любой генетический анализ – сложная многоэтапная процедура.
Генетический материал для анализа берут из клеток, как правило, из клеток крови. Но в последнее время лаборатории переходят на неинвазивные методы и иногда выделяют ДНК из слюны. Выделенный материал подвергается секвенции – определению последовательности мономеров при помощи химических анализаторов и реакций. Эта последовательность и является генетическим кодом. Полученный код сравнивают с эталонным и определяют, какие участки относятся к тем или иным генам. На основании их наличия, отсутствия или мутации делают заключение о результатах теста.
Сегодня в лабораториях множество методов генетического анализа, каждый из них хорош в тех или иных ситуациях:
За счет большого количества химических реактивов процедуры генетических исследований достаточно финансово затратные.. Мы стараемся устанавливать оптимальную стоимость всех процедур, поэтому цена на такие исследования у нас начинается от 4 800 рублей.
Группы риска
В группы риска по наследственному раку попадают люди, у которых наблюдается хотя бы один из перечисленных факторов:
- Несколько случаев одного вида рака в семье
(например, рак желудка у деда, отца и сына); - Заболевания в раннем для данного показания возрасте
(например, колоректальный рак у пациента моложе 50 лет); - Единичный случай определенного вида рака
(например, рак яичников, или трижды негативный рак молочной железы); - Рак в каждом из парных органов
(например, рак левой и правой почки); - Больше одного типа рака у родственника
(например, сочетание рака молочной железы и рака яичников); - Рак, нехарактерный для пола пациента
(например, рак молочной железы у мужчины).
Если для человека и его семьи характерен хотя бы один фактор из списка, то следует получить консультацию у врача-генетика. Он определит, есть ли медицинские показания для того, чтобы сдавать генетический тест.
Чтобы обнаружить рак на ранней стадии, носителям наследственного опухолевого синдрома следует проходить тщательный скрининг на онкологические заболевания. В некоторых случаях риск развития рака можно существенно снизить с помощью превентивных операций и лекарственной профилактики.
При проведении теста опухоль анализируется, составляется индивидуальный молекулярный паспорт. В комплексе с анализом крови, в зависимости от требуемого теста, проводится комбинацирование различных анализов на геном и белок. В результате данного теста появляется возможность назначения таргетной терапии, эффективной для каждого типа имеющейся опухоли.
Профилактика
Бытует мнение, что для определения предрасположенности к раку можно сделать простой анализ на наличие онкомаркеров – специфических веществ, которые могут быть продуктами жизнедеятельности опухоли.
Повышение показателя может зависеть от целого ряда причин, совершенно не связанных с онкологическими заболеваниями. В то же время, есть примеры людей с онкологическими заболеваниями, у которых значения онкомаркера оставались в пределах нормы. Специалисты используют онкомаркеры как метод для отслеживания протекания уже обнаруженного заболевания, результаты которого нужно перепроверять.
Для выявления вероятности генетической наследственности в первую очередь, если вы входите в группу риска, нужно обратиться за консультацией к врачу-онкологу. Специалист, исходя из вашего анамнеза, сделает вывод о необходимости проведения тех или иных исследований.
Важно понимать, что решение о проведении какого-либо теста должен принять именно врач. Самолечение в онкологии неприемлемо. Неправильно интерпретированные результаты не только могут вызвать преждевременную панику – вы попросту можете упустить наличие развивающегося онкологического заболевания. Выявление рака на ранней стадии при наличии вовремя поставленного правильного лечения дает шанс на выздоровление.
Стоит ли паниковать?
Рак – неизбежный спутник долгоживущего организма: вероятность накопления соматической клеткой критического числа мутаций прямо пропорциональна времени жизни. То, что рак – генетическое заболевание, не значит, что оно наследственное. Он передается в 2-4% случаев. Если у вашего родственника обнаружили онкологическое заболевание – не впадайте в панику, этим вы навредите и себе, и ему. Обратитесь к врачу-онкологу. Пройдите исследования, которые он вам назначит. Лучше, если это будет специалист, который следит за прогрессом в области диагностики и лечения рака и в курсе всего, что вы сами только что узнали. Следуйте его рекомендациям и не болейте.
Читайте также:





