Моноклональные антитела при раке сигмовидной кишки
Способность адаптировать биологическую терапию, основанную на статусе опухолевых биомаркеров и моноклональных антител, стала очень важной в последние годы. Была идентифицирована роль опухолевых биомаркеров в лечении колоректального рака, в частности гена K-RAS. У K-RAS был повышенный интерес после того, как Lievre и его коллеги сообщили на встрече Американского общества клинической онкологии (ASCO) 2008 года, их анализ мутаций K-RAS в опухолях у пациентов, которые, по-видимому, не получали преимущества от терапии цетуксимабом, предоставляя дополнительные данные, связанные с K-RAS мутантных опухолей и их отсутствие ответа на цетуксимаб, как часть первой линии терапии метастатического колоректального рака. Кроме того, в других исследованиях оценивали статус K-RAS и лечение первой линии метастатического колоректального рака, лечение рефрактерного метастатического рака и терапию двойным антителом при лечении рака прямой кишки первой линии. Пациенты с колоректальными опухолями мутантного K-RAS не имеют преимущества от цетуксимаба, независимо от типа режима химиотерапии.
В 2004 году бевацизумаб стал первым моноклональным антителом, направленным на фактор роста эндотелия сосудов (VEGFR). Впоследствии были обнаружены новые типы моноклональных антител, нацеленных на рецептор эпидермального фактора роста (EGFR), как цетуксимаб и панитумумаб.
Бевацизумаб является рекомбинантным гуманизированным моноклональным антителом, направленным против сосудистого эндотелиального фактора роста (VEGF), проангиогенного цитокина.
Цетуксимаб представляет собой химерное моноклональное антитело, указанное для использования у пациентов, которые прогрессировали на терапии на основе иринотекана или не переносят терапию на основе иринотекана.
Panitumumab — полностью человеческое моноклональное антитело, указанное для использования в качестве единственного агента у пациентов, которые прогрессировали на или после химиотерапевтических режимов, содержащих фторпиримидин, оксалиплатин и иринотекан.
Бевацизумаб связывается с VEGF и ингибирует связывание рецептора VEGF (проангиогенный цитокин), тем самым предотвращая рост и поддержание опухолевых кровеносных сосудов.
У пациентов с колоректальным раком ответы на терапию, ориентированную на EGFR, по-видимому, не зависят от уровня экспрессии EGFR. Таким образом, другие молекулярные механизмы могут влиять на эффективность реакции на эти агенты.
Цетуксимаб и панитумумаб являются моноклональными антителами, которые связываются с рецептором эпидермального фактора роста (EGFR) и ингибируют индуцированное лигандом фосфорилирование EGFR. Цетуксимаб в сочетании с химиотерапией на основе иринотекана улучшает показатели ответа (RR) и время прогрессирования у пациентов, которые не поддаются лечению иринотеканом. K-RAS представляет собой белок в нисходящем внутриклеточном сигнальном пути EGFR, участвующем в клеточной дифференцировке, пролиферации и ангиогенезе. Мутации в гене K-RAS вызывают активацию K-RAS даже в отсутствие связывания лиганда EGFR, в результате чего антитела, нацеленные на верхний EGFR, неэффективны [1].
Белок RAS является молекулой, участвующей в передаче сигналов EGFR; он играет центральную роль в других внутриклеточных сигнальных путях. В нормальных ячейках RAS действует как молекулярный переключатель включения / выключения. Расходы белков RAS между состоянием гуанозиндифосфата (ВВП) и состоянием гуанозинтрифосфата (ГТФ) на состояние. Действуя как молекулярные переключатели, эти белки связывают внеклеточные сигналы, инициируемые клеточными поверхностными рецепторами, такими как EGFR, и передают их вниз по течению к ядру клетки [2].
Когда EGF-лиганд связывается с EGFR, EGFR димеризуется, активируется и затем передает сигнал фосфорилирования в RAS. После активации фосфорилированием RAS, в свою очередь, фосфорилирует другие последующие белки, и через каскад последовательных событий фосфорилирования экспрессия гена изменяется. В результате активации EGFR эти изменения экспрессии гена могут приводить к пролиферации клеток, устойчивости к апоптозу, ангиогенезу, подвижности клеток и метастазированию (рис.1).
Роль белка RAS в сигнальном пути EGFR
(Источник: Medscape General Surgery)
EGFR-целевые агенты блокируют активацию рецептора EGFR на начальном этапе в каскаде и могут прекратить передачу сигналов RAS. Тем не менее, мутированный ген RAS, создающий молекулу RAS, который постоянно включен, скорее всего, не будет влиять на EGFR-нацеливающие агенты. Клинические данные подтверждают следующую идею: пациенты, у которых опухоли имеют RAS дикого типа, имеют гораздо больший ответ на ингибиторы EGFR по сравнению с теми, у кого мутировало RAS, которое постоянно включено [2].
Белки RAS, особенно K-RAS, играют важную роль в прогрессировании рака толстой кишки. Fearon и Vogelstein определили многоэтапную генетическую модель для образования колоректального рака. Согласно этой модели, мутации K-RAS, наряду с другими мутациями, необходимы, хотя и недостаточны, для развития рака от небольшой до большой аденомы. Колоректальный рак развивается после накопления серии молекулярных изменений, включая K-RAS, p53 и аденоматозную полипозную коли. Не все мутации необходимы для развития неоплазии [2].
Amado и его коллеги опубликовали первую демонстрацию мутаций K-RAS как негативный предсказательный маркер антител EGFR в рандомизированном исследовании. При использовании panitumumab и лучшей поддерживающей терапии в качестве терапии последней линии исследователи наблюдали статистически значимое улучшение выживаемости без прогрессирования (PFS) в группе panitumumab в целом по сравнению с лучшими поддерживающими средствами (8,0 недели и 7,3 недели). Этот эффект был более выражен среди пациентов с статусом дикого типа (нормальный) K-RAS (медиана PFS 12,3 недель в группе panitumumab против 7,3 недель для лучшей поддерживающей терапии). При добавлении панитумумаба у пациентов с K-RAS мутантным статусом не наблюдалось никакой пользы. K-RAS перенес мутации в 40% случаев колоректального рака [1,2].
Возникло несколько гипотез:
а). Мутации K-RAS влияют на эффективность цетуксимаба, включая ответы на комбинированную химиотерапию и терапию цетуксимабом в первой линии
б). является ли цетуксимаб полезным в сочетании со стандартной химиотерапией у пациентов с мутацией K-RAS?
В 2006 году Лиевр и его коллеги изучили опухоли у 30 пациентов, получавших цетуксимаб, которые были скринированы на мутации K-RAS, B-Raf и фосфатидил-инозитол-3-киназы (PI3K), а также состояние EGFR. Из всех пациентов 37% ответили на цетуксимаб. Ни один из 11 ответивших пациентов не обладал мутациями K-RAS по сравнению с 68,4% из 19 неответящих пациентов. Кроме того, выживаемость была также значительно увеличена у пациентов с K-RAS дикого типа по сравнению с мутантным K-RAS. Увеличенный номер экземпляра EGFR, присутствующий только у 3 пациентов, также был значительно связан с ответом на цетуксимаб. Это исследование было перезагружено Lievre на 89 случаях с метастатическим колоректальным раком, после того как они не прошли терапию на основе иринотекана, получив те же результаты [2].
В 2008 году Ди Фиоре и его коллеги сообщили о результатах метаанализа, который включал 281 пациента из 7 исследований. Пациенты с иринотекан-рефрактерным метастатическим колоректальным раком лечились химиотерапией cetuximab plus на основе иринотекана. 77 (27,4%) ответили на терапию (3 полных ответа), стабильное заболевание (SD) наблюдалось у 107 (38,1%) и прогрессирующего заболевания (ПД) у 97 (34,5%). Никаких ответов не наблюдалось среди пациентов с опухолями с мутациями K-RAS, а 59,8% имели прогрессирующее заболевание (ПД) [1,2].
Исследование CRYSTAL сравнило использование фолиновой кислоты / фторурацила / иринотекана (FOLFIRI) против FOLFIRI plus cetuximab в лечении первой линии метастатического колоректального рака. Первоначальные результаты исследования CRYSTAL, представленного Van Custem в 2007 году, показали, что добавление цетуксимаба в FOLFIRI увеличило RR примерно на 8% и продолжило PFS до 0,9 месяца (без отбора для статуса K-RAS). В ответ на возникающие данные, свидетельствующие о корреляции между мутациями в K-RAS и отсутствии клинической пользы от цетуксимаба, был проведен ретроспективный анализ для оценки влияния мутаций K-RAS на PFS и RR с использованием данных исследования CRYSTAL. Количественный анализ ПЦР для мутации K-RAS выполнялся на заархивированной опухолевой ткани у пациентов в исследовании CRYSTAL и был доступен для оценки в 45%. Было 64,4% пациентов с опухолями дикого типа K-RAS и 35,6% с мутантными опухолями K-RAS. В популяции дикого типа K-RAS медиана PFS для цетуксимаба плюс FOLFIRI составляла 9,9 месяца против 8,7 месяцев только для FOLFIRI (P = 0,017). Было также увеличение на 16% общего RR в группе дикого типа K-RAS, которая получала цетуксимаб плюс FOLFIRI. В отличие от этого, у пациентов с мутантным K-RAS, получающим FOLFIRI plus cetuximab или FOLFIRI, вообще не было никакой пользы в RR или PFS.
Это исследование дает четкие доказательства того, что пациенты с опухолями дикого типа K-RAS имеют преимущество от добавления цетуксимаба в FOLFIRI, чем у пациентов с опухолями K-RAS. Более того, у пациентов с мутантными опухолями K-RAS не было улучшения в RR или PFS, когда цетуксимаб добавляли к FOLFIRI; можно сделать вывод, что цетуксимам не должен использоваться для этих лиц для лечения метастатического колоректального рака первой линии 5.
В исследовании OPUS было проведено исследование использования 5-фторурацила / лейковорина / оксалиплатина (FOLFOX) 4 против FOLFOX4 plus cetuximab в лечении первой линии метастатического колоректального рака; первичная конечная точка была RR. Согласно первоначальным результатам, добавление цетуксимаба существенно не улучшало PFS или RR по сравнению с FOLFOX. Когда стратифицировано для статуса работоспособности (PS), RR значительно улучшилось с добавлением цетуксимаба. В группе дикого типа K-RAS добавление цетуксимаба в FOLFOX4 значительно увеличилось на RR (61%) по сравнению с FOLFOX4 (37%). Однако в группе мутантов K-RAS RR продемонстрировала тенденцию к худшей скорости в группе cetuximab plus FOLFOX4 (33%) против FOLFOX4 (49%). Среди пациентов с опухолями дикого типа K-RAS медиана PFS была значительно улучшена с использованием FOLFOX plus cetuximab против FOLFOX4 (7,7 месяца против 7,2 месяцев). Напротив, медиана PFS значительно ухудшилась у пациентов, которые получали FOLFOX4 plus cetuximab против FOLFOX4 (5,5 месяца против 8,6 месяцев) в группе мутантов K-RAS.
Исследователи OPUS пришли к выводу, что RR и PFS были значительно улучшены с добавлением цетуксимаба в FOLFOX4 у пациентов с опухолями дикого типа K-RAS. С использованием цетуксимаба плюс FOLFIRI, пациенты с мутированным K-RAS, по-видимому, не получали никакой пользы от комбинации цетуксимаба и FOLFOX [1,2,6-8].
Исследование BEAT (Bevacizumab Expanded Access Trial) оценивает безопасность и эффективность бевацизумаба, а также стандартные режимы первой линии химиотерапии у большой популяции пациентов с метастатическим неоперабельным колоректальным раком. Пациенты получали химиотерапию плюс бевацизумаб [5 мг / кг каждые 2 недели (схемы с 5-фторурацилом) или 7,5 мг / кг каждые 3 недели (схемы капецитабина)]. Первичной конечной точкой была безопасность. Вторичными целями были выживаемость без прогрессирования (PFS) и общая выживаемость (ОС).
Окончательный анализ включал 1914 оцениваемых пациентов (мужчины 58%, средний возраст 59 лет). Химиотерапия включала 5-фторурацил / лейковорин (5-FU / LV) + оксалиплатин (29%), иринотекан плюс 5-FU / LV (26%), капецитабин плюс оксалиплатин (18%) и монотерапию (16%). Серьезные / побочные эффекты 3-5 классов, представляющие интерес для бевацизумаба, включают кровотечение (3%), перфорация желудочно-кишечного тракта (2%), артериальная тромбоэмболия (1%), гипертония (5,3%), протеинурия (1%) и осложнения, 1%). Смертность в течение шестидесяти лет составляла 3%. Медиана PFS составила 10,8 месяцев [монотерапия — 8,6 месяца, FOLFIRI 11,6 месяцев, FOLFOX 11,3 месяца, XELOX 10,8 месяцев], а медиана ОС — 22,7 месяца (FOLFIRI 23,7 месяца, FOLFOX 25,9 месяца , XELOX 23 месяца, монотерапия — 18 месяцев).
Исследование BEAT показывает, что профиль эффективности и безопасности бевацизумаба в обычной клинической практике согласуется с результатами, наблюдаемыми в другом крупном обсервационном исследовании (BriTE) [9].
Исследование EVEREST было разработано для определения того, может ли эскалация цетуксимаба в сочетании со стандартной дозой иринотекана повысить эффективность у пациентов, которые не прошли терапию на основе иринотекана. После 22 дней лечения пациенты с кожными реакциями степени 0/1 были рандомизированы для продолжения приема иринотекана (180 мг / м2 в двухнедельный период) плюс стандартной дозы цетуксимаба (250 мг / м2 в неделю) в руке А или иринотекана (180 мг / м2 раз в две недели) плюс эскалированные дозы цетуксимаба (50 мг / м2 каждые 2 недели до 500 мг / м2 в неделю) в руке B. Данные исследования, представленные Тейпар и его коллегами в 2007 году, показали, что эскалация дозы цетуксимаба, улучшенная скорость ответа (RR). Это также было связано с удвоением диареи 3/4 степени и сывороткой сорта 2 или выше.
У пациентов с K-RAS дикого типа 21,1%, получавших стандартный цетуксимаб, имели ответ против 46,4%, которые получали эскалированные дозы цетуксимаба. Однако ни у одного из них с мутациями K-RAS в обеих группах не было ответа с комбинацией цетуксимаба и иринотекана [1,2,10].
Результаты этого анализа подтверждают результаты предыдущих ретроспективных исследований (OPUS, CRYSTAL и PACCE): пациенты с колоректальными опухолями K-RAS мутантов не получают преимущества от добавления цетуксимаба. Колоректальные опухоли следует оценивать на наличие мутации K-RAS. Если мутация присутствует, пациенту не следует предлагать цетуксимаб. Испытание мутаций K-RAS избавит тех, кто не получит дополнительной токсичности и затрат на цетуксимаб, а также гарантирует, что те, у кого опухоли дикого типа K-RAS, которые могут извлечь выгоду, могут получать цетуксимаб или панитумумаб. Действительно, европейское регулирующее агентство (EMEA) ограничило одобрение цетуксимаба и панитумумаба при колоректальном раке у пациентов с опухолями K-RAS дикого типа [1,3-8,11].
На основе доклинических моделей предполагается, что ингибирование фактора роста эндотелия сосудов (VEGF) в сочетании с бевацизумабом и EGFR с цетуксимабом оказывает аддитивное действие. Данные исследования BOND2 продемонстрировали, что использование двух агентов в комбинации с химиотерапией на основе иринотекана возможно и потенциально более эффективно, чем иринотекан плюс цетуксимаб среди пациентов, не поддающихся терапии на основе иринотекана. Результаты исследования PACCE, в котором сравнивались FOLFOX или FOLFIRI plus бевацизумаб с панитумумабом или без него, показали, что у пациентов с панитумумабом уступает PFS. Эти неожиданные результаты первоначально были связаны с повышенной токсичностью в руках панитумумаба [11,12].
Исследование CAIRO2 использовало аналогичный подход, как PACCE, исследуя влияние добавления цетуксимаба на капецитабин, оксалиплатин и бевацизумаб у пациентов с прогрессирующим колоректальным раком. Ранее в 2008 году Тол и его коллеги сообщили о анализе токсичности CAIRO2, демонстрируя, что двойная биологическая терапия не привела к чрезмерной или неожиданной токсичности. Результаты эффективности были представлены Пунтом и коллегами в ASCO 2008, в среднем периоде наблюдения 18,7 месяца [13].
Пациенты были рандомизированы на 1 из 2-х рук. Арм А принимал оксалиплатин 130 мг / м² в день 1, капецитабин 1000 мг / м² два раза в день, дни 1-14, бевацизумаб 7,5 мг / кг в день 1, повторяли каждые 3 недели. Оксалиплатин был прекращен после цикла 6. Внутрь В принимали оксалиплатин, капецитабин и бевацизумаб, как и в группе А, с добавлением кетуксимаба в неделю 250 мг / м² (первая доза 400 мг / м 2). Оценка опухолевого ответа повторялась каждые 3 цикла. Медиана PFS была значительно снижена в группе B (добавление цетуксимаба) с 10,7 месяцев до 9,6 месяцев. Никаких различий в RR или OS не наблюдалось между группами. Все побочные эффекты были значительно ухудшены в руке B, но токсичность в качестве причины прекращения лечения существенно не различалась между руками для лечения. Среднее количество введенных циклов также уменьшалось в плече, содержащем цетуксимаб.
Исследователи также оценили влияние мутации K-RAS на PFS и общую выживаемость (ОС). Среди пациентов с мутантными опухолями K-RAS добавление цетуксимаба значительно сократило среднюю PFS (8,6 месяца против 12,5 месяцев); ОС не отличалась. Не было различий в PFS или ОС между плечами A и B у пациентов с опухолями дикого типа K-RAS. Также не было статистически значимого снижения медианы PFS или ОС между теми, у которых были дикие типы K-RAS и мутантные опухоли K-RAS в руке цетуксимаба.
Авторы CAIRO2 пришли к выводу, что добавление цетуксимаба к иринотекану, капецитабину и бевацизумабу значительно сократило PFS, но это не оказало влияния на ОС. Токсичность была также увеличена в руке цетуксимаба, но считалась приемлемой. Среди пациентов с мутантными опухолями K-RAS добавление цетуксимаба ассоциировалось с уменьшением PFS, но опять же, существенно не повлияло на ОС [1,2,13].
Хотя первоначальные сообщения о терапии двойными антителами (цетуксимаб / бевацизумаб) в последней строке были интригующими, результаты CAIRO2 подтверждают и подтверждают данные от PACCE, что указывает на то, что добавление антител EGFR к бевацизумабсодержащей первой линии режим не повышает эффективность и, вероятно, связан с худшим результатом. В терапии первой линии терапия с двумя антителами не должна использоваться, например, [1].
1. В результате активации EGFR эти изменения экспрессии гена могут приводить к пролиферации клеток, устойчивости к апоптозу, ангиогенезу, подвижности клеток и метастазированию.
2. EGFR-целевые агенты блокируют активацию рецептора EGFR и останавливают передачу сигналов Ras; мутантный ген Ras, продуцирующий молекулу Ras, которая постоянно включена, не подвержена воздействию EGFR-нацеливающих агентов.
3. Пациенты с колоректальными опухолями мутантного K-RAS не имеют преимущества от добавления цетуксимаба, независимо от типа режима химиотерапии: первая линия или рефрактерный метастатический колоректальный рак.
4. В регионе EMEA было ограничено одобрение цетуксимаба и панитумумаба при колоректальном раке у пациентов с опухолями K-RAS дикого типа.
5. Использование антител EGFR к бевацизумабу, содержащему схему первой линии, не повышает эффективность и, вероятно, связано с более низким результатом.
Рак сигмовидной кишки часто в течение продолжительного времени не проявляется клиническими симптомами. По этой причине зачастую диагноз устанавливают на поздней стадии опухолевого процесса. Врачи Юсуповской больницы рекомендуют даже при незначительных проявлениях кишечного дискомфорта незамедлительно обращаться за помощью.
В Юсуповской больнице онкологи применяют новейшие методы диагностики заболеваний сигмовидной кишки. Обследование пациентов проводят с помощью новейшей аппаратуры ведущих мировых производителей. Лаборанты выполняют исследование крови, кала и других биологических материалов, используя качественные реагенты, что позволяет получить точные результаты анализов.
Хирурги клиники онкологии виртуозно выполняют традиционные и инновационные оперативные вмешательства. Химиотерапевты назначают пациентам эффективнейшие противоопухолевые препараты, которые оказывают минимальное побочное действие. Радиологи проводят лучевую терапию современными аппаратами, позволяющими прицельно воздействовать на патологический очаг, не повреждая окружающие опухоль ткани.

Причины опухолей
Рак сигмовидной кишки происходит из клеток железистого эпителия. Составляет 34% от общего количества случаев колоректального рака. В 60% случаев злокачественную опухоль выявляют у пациентов в возрасте 40-60 лет. Мужчины страдают в 1,5 раза чаще женщин.
Высокая вероятность развития рака сигмовидной кишки обусловлена особенностями органа. Сигмовидная кишка располагается в левой части живота, над прямой кишкой. Она имеет S-образную форму. Если замедляется продвижение содержимого по кишечнику, оно продолжительное время остается в сигмовидной кишке. Это увеличивает время контакта токсических продуктов переработки пищи со слизистой органа.
Рак сигмовидной кишки может развиться под воздействием следующих неблагоприятных факторов:
Несбалансированного питания – употребление в пищу большого количества жирной и мясной пищи, недостаточного потребления фруктов и овощей, продуктов, богатых клетчаткой;
Отягощённой наследственности – риск развития злокачественного новообразования увеличивается, если близкие родственники болели раком сигмовидной кишки;
Хронических воспалительных процессов в кишечнике – неспецифического язвенного колита, дивертикулеза, болезни Крона;
Малоподвижного образа жизни, вследствие чего замедляется эвакуация содержимого кишечника;
Возрастной атонии кишечника.
К развитию рака сигмовидной кишки приводит курение, злоупотребление спиртными напитками, употребление продуктов, содержащих канцерогенные пищевые добавки.
Классификация
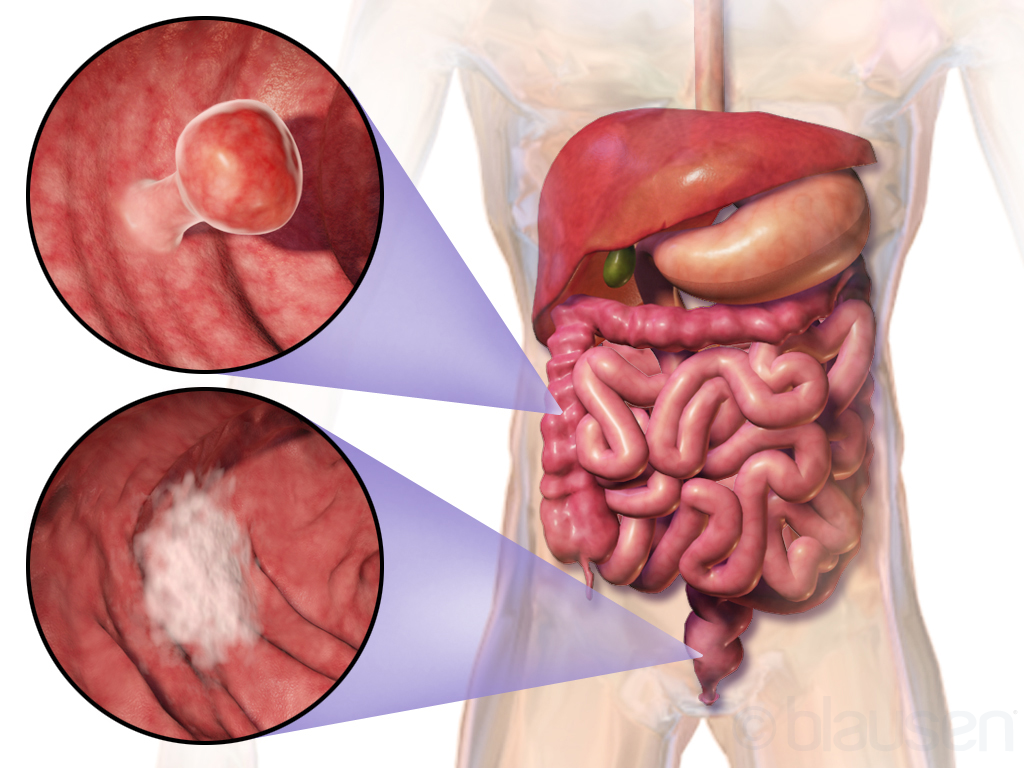
С учётом особенностей роста опухоли онкологи выделяют два типа рака сигмовидной кишки: экзофитный и эндофитный. Экзофитные опухоли растут в просвет кишечника. Они представляют собой выступающие узлы на толстой ножке. При прогрессировании патологического процесса рак сигмовидной кишки часто изъязвляется. Возникает кровотечение и инфицирование.
Эндофитный рак сигмовидной кишки растёт преимущественно вглубь кишечника. Опухоль распространяется по кишечной стенке и может циркулярно охватывать кишку. В её центре возникают участки изъязвления. Вследствие циркулярного роста рака сигмовидной кишки происходит сужение просвета кишечника, затрудняется движение каловых масс. Этот тип роста наиболее характерен для рака сигмовидной кишки.
Гистологи различают три вида рака сигмовидной кишки:
- Аденокарцинома происходит из клеток железистого эпителия. Бывает высокодифференцированной, умеренно дифференцированной и низкодифференцированной;
- Слизистая (мукозная) аденокарцинома является разновидностью низкодифференцированной аденокарциномы, представлена муцинозными клетками, которые выделяют большое количество слизи. Опухоль быстро растёт и рано даёт метастазы;
- Перстневидно-клеточный рак сигмовидной кишки представлен атипичными клетками перстневидной формы, которые образуются вследствие внутриклеточного скопления муцина, отодвигающего ядра клеток к периферии. Оухоль агрессивна, протекает неблагоприятно.
Рак ректо-сигмоидного отдела толстой кишки представлен двумя формами: скирром и аденокарциномой.
Стадии
Онкологи различают 4 стадии рака сигмовидной кишки:
При первой стадии опухоли размер новообразования не превышает двух сантиметров. Опухоль располагается в пределах подслизистого слоя или слизистой оболочки. Регионарные лимфатические узлы не поражены атипичными клетками.
Опухоль в случае второй А стадии рака занимает размер менее половины окружности кишки, не прорастает стенку. Метастазы в лимфатических узлах и внутренних органах отсутствуют. Раковая опухоль при 2В стадии располагается в стенке кишечника, но не выходит за его пределы. Онкологи выявляют метастазы в лимфатических узлах. Отдалённые метастазы отсутствуют.
При 3А стадии рака сигмовидной кишки размер опухоли превышает половину длины окружности кишки. Атипичные клетки в регионарных лимфатических узлах отсутствуют. При 3В стадии опухоли метастазами поражаются регионарные лимфатические узлы.
Опухоль при 4 стадии рака перекрывает просвет сигмовидной кишки. Выявляются гематогенные метастазы в других органах. При 4 стадии рака сигмовидной кишки поражаются близлежащие органы, образуются кишечно-пузырные свищи и конгломераты.
Симптомы
Вначале рак сигмовидной кишки нередко протекает бессимптомно либо малосимптомно, что усложняет своевременную диагностику. При прогрессировании опухоль распространяется на близлежащие органы, дает регионарные и гематогенные метастазы (в печень, легкие, позвоночник, реже – в другие органы).
В нижнем отделе кишечника – сигмовидной кишке – окончательно формируются каловые массы, всасывается вода и питательные вещества. При неправильном питании каловые массы задерживаются в этом сегменте толстого кишечника. Скопившийся кал давит на стенки кишки, в результате чего нарушается кровообращение, через стенки сигмовидной кишки в организм поступают токсические вещества. Постоянные запоры отрицательно воздействуют на весь организм. В результате застоя кишечного содержимого развиваются предраковые заболевания, злокачественные опухоли сигмовидной кишки.
Довольно долго опухоль сигмовидной кишки не проявляется клиническими симптомами, что усложняет своевременную диагностику. Первый симптом рака сигмовидной кишки – кишечный дискомфорт. Вначале он возникает периодически, а с ростом новообразования приобретает выраженный характер. Более поздние стадии рака сигмовидной кишки проявляются следующими симптомами:
Метеоризмом, отрыжкой, тошнотой, запором или поносом, болью;
Появлением прожилок слизи и крови в кале;
Интенсивными, тупыми или схваткообразными болями, не зависящими от приёма пищи;
Развитием кишечной непроходимости;
У пациентов поносы чередуются с запорами. Нередко в левой половине живота врачам удаётся прощупать опухолевидное образование. Иногда первым проявлением опухолевого процесса становится развитие кишечной непроходимости. При прогрессировании опухоль распространяется на близлежащие органы, дает регионарные и гематогенные метастазы (в печень, легкие, позвоночник, реже – в другие органы).
У больных раком сигмовидной кишки врачи выявляют следующие симптомы:
- Слабость;
- Утомляемость;
- Бледность или сероватый оттенок кожи;
- Гипертермию;
- Потерю веса и аппетита, обусловленные раковой интоксикацией.
При развитии кишечной непроходимости возникают приступообразные схваткообразные боли, которые повторяются через каждые 10-15 минут, отмечается вздутие живота, задержка газов и стула. Возможна рвота. В случае разрушения стенки кишки развивается перитонит. Рак сигмовидной кишки 4 степени с метастазами в печени проявляется кахексией (раковым истощением), анемией (малокровием), желтухой и увеличением печени. При появлении гематогенных метастазов присоединяются симптомы, которые свидетельствуют о нарушении функций поражённых органов.
Диагностика
Диагноз опухоли сигмовидной кишки онкологи Юсуповской больницы устанавливают с учетом анамнеза, жалоб, данных объективного осмотра и результатов дополнительных исследований. Наиболее информативными при раке сигмовидной кишки являются эндоскопические методы (ректороманоскопия и колоноскопия). Они позволяют визуально оценить объём и локализацию новообразования, взять материал для последующего гистологического исследования.
В процессе обследования пациентов с подозрением на рак сигмовидной кишки врачи Юсуповской больницы используют ирригоскопию (рентгеновское исследование с применением бариевой взвеси) и анализ кала на скрытую кровь. Чтобы детализировать стадию опухолевого процесса проводят магнитно-резонансную и компьютерную томографию. Все инструментальные методы исследования выполняются с помощью новейшей аппаратуры ведущих фирм-производителей США, Японии и европейских стран.
Для выявления метастазов применяют другие диагностические методики:
- Ультразвуковое исследование органов брюшной полости;
- Рентгенографию позвоночника;
- Рентгенографию грудной клетки.
Онкологи Юсуповской больницы выставляют окончательный диагноз на основании результатов гистологического исследования. Проводят дифференциальную диагностику злокачественных новообразований сигмовидной кишки с предраковыми и воспалительными болезнями кишечника, неподвижными опухолями забрюшинного пространства и подвижными новообразованиями брыжейки.
Комплексная терапия
Онкологи Юсуповской больницы проводят комбинированное лечение злокачественных опухолей сигмовидной кишки. Оно включает оперативное вмешательство, радиотерапию и химиотерапию. Ведущая роль отводится хирургическому лечению, которое направленно на радикальное удаление опухоли. Объём оперативного вмешательства зависит от распространённости рака сигмовидной кишки. На ранних стадиях заболевания в отдельных случаях применяют эндоскопические методики.
При распространённых опухолевых процессах хирурги выполняют резекцию сигмовидной кишки с участком брыжейки и близлежащими лимфатическими узлами. Поражённый участок сигмовидной кишки удаляют с пятью сантиметрами неизменённого отдела кишечника, расположенного выше и ниже опухоли. Хирургическое вмешательство при раке сигмовидной кишки бывает одноэтапным или двухэтапным. При проведении одноэтапных операций после удаления опухоли хирург восстанавливая непрерывность кишечника путём накладывания анастомоза. В запущенных случаях кишку резецируют и формируют колостому. Целостность кишечника восстанавливают через несколько месяцев с момента первой операции.
Оперативное вмешательство может быть типичным, комбинированным, расширенным или сочетанным. Типичная операция представляет собой резекцию участка кишечника с опухолью. Комбинированный метод лечения применяют в случае необходимости провести операцию на поражённом раком сегменте кишечника и других органах, в которые проросла опухоль. Расширенную операцию проводят при разрастании опухоли или наличии синхронных новообразований. Сочетанная операция подразумевает удаление пораженного сегмента кишечника вместе с другими органами из-за сопутствующих заболеваний.
При наличии метастазов рака врачи клиники онкологии проводят химиотерапию. Лечение противоопухолевыми препаратами при раке сигмовидной кишки после операции применяют с осторожностью – в некоторых случаях она может вызвать отрицательные результаты. Чаще всего применение химиотерапии целесообразно при неоперабельных опухолях – она помогает уменьшить размер новообразования. Рак сигмовидной кишки плохо поддаётся лучевому лечению. Радиоактивные лучи могут повредить нормальные ткани, поэтому этот метод не применяют в лечении рака сигмовидной кишки.
В запущенных случаях рака проводят паллиативную терапию для уменьшения болевого синдрома и обеспечения проходимости кишечника. Иногда при раке сигмовидной кишки выполняют экстренные оперативные вмешательства. Они направлены на санацию брюшной полости при перитоните, устранение кишечной непроходимости.

Питание после операции
После операции на сигмовидной кишке пациентов Юсуповской больницы обеспечивают диетическим питанием. Повара готовят блюда из качественных продуктов. В них достаточное количество витаминов и минералов. В меню вводят кефир, йогурт, бифидопродукты, свежие овощи и фрукты. Все блюда готовят с применением щадящих технологий: на пару, отваривают, запекают в духовке или на гриле. При наличии показаний пищу измельчают. Пациенты питаются регулярно, дробно, малыми порциями.
- употреблять в пищу только свежие продукты;
- продукты должны содержать достаточный комплекс витаминов и минералов;
- сократить до минимума потребление мяса;
- чаще употреблять кефир, йогурт, бифидопродукты;
- больше употреблять свежих овощей и фруктов;
- включать в меню злаковые каши, изделия из муки грубого помола с отрубями;
- периодически включать в меню отварную или приготовленную на пару морскую рыбу;
- пищу принимать в измельченном виде, тщательно пережевывать;
- не переедать, питаться дробно и регулярно.
Прогноз
Прогноз выживаемости больных раком сигмовидной кишки зависит от гистологического типа новообразования, уровня дифференцировки клеток, распространённости злокачественного процесса, наличия сопутствующих заболеваний и возраста пациента.
Средняя пятилетняя выживаемость – 65,2%. Боле оптимистичный прогноз после операции по поводу аденокарциномы сигмовидной кишки, поскольку опухоль растёт медленно и практически не метастазирует. При выявлении рака сигмовидной кишки первой стадии пятилетний рубеж преодолевает 93,2% пациентов, второй – 82,5%, третьей – 59,5%. До пяти лет доживает 8,1% больных раком сигмовидной кишки 4 стадии. Поэтому обращайтесь к врачу при появлении первых признаков дисфункции кишечника.
Чтобы установить точный диагноз на ранних стадиях рака сигмовидной кишки, при появлении первых признаков кишечных расстройств, звоните по телефону Юсуповской больницы. После комплексного обследования в случае подтверждения диагноза онкологи проведут адекватную терапию. После проведенного лечения врачи клиники онкологии проводят диспансерное наблюдение, цель которого – своевременное выявление и лечение ранних метастазов. Это позволяет улучшить качество и увеличить продолжительность жизни пациентов, у которых выявлен рак сигмовидной кишки.
Читайте также:

