Монографии по раку щитовидной железы
Проблеме рака щитовидной железы посвящено несколько монографий и значительное число публикаций в периодической печати. Однако обобщающих работ по комплексной проблеме рака щитовидной железы, выполненных на современном уровне, очень мало и суждения авторов нередко весьма противоречивы.
В данной монографии важные и сложные проблемы рака щитовидной железы излагаются с позиций онкологии в тесной связи с такими направлениями медицины, как патологическая анатомия, радиология, эндокринология и др. Ее авторы — профессор А. И. Пачес и доктор медицинских паук Р. М. Пропп, высокосрудированные онкологи общего профиля и признанные специалисты в области изучения опухолей головы и шеи — обобщили итоги почти 20-летнего периода работы Всесоюзного онкологического научного центра АМН СССР (далее ВОНЦ АМН СССР) по различным вопросам патологии щитовидной железы.
В этой монографии в свете Международной гистологической классификации освещаются общие вопросы рака щитовидной железы, описаны современные методики комплексной диагностики и хирургического лечения. Хирургические вмешательства, являющиеся основными в лечении больных раком щитовидной железы, рассматриваются в совокупности с другими методами терапии.
На основании клинико-анатомических особенностей злокачественных опухолей этого органа четко определяются показания к конкретным операциям, методика которых зависит от многих факторов и прежде всего от распространенности процесса и морфологии опухоли. Описывается техника хирургических вмешательств на первичном очаге и в зонах регионарного метастазирования.
В монографии удачно сочетается хорошо написанный текст с иллюстрациями, подготовленными авторами. Авторы щедро делятся многими важными идеями и рекомендациями. Все это делает монографию весьма полезным и интересным руководством для онкологов, хирургов, терапевтов, эндокринологов, радиологов, сталкивающихся с вопросами диагностики и лечения больных раком щитовидной железы.
Монография представляет также большой научный интерес. Для клиницистов, так как идеи, высказанные авторами, перспективны для дальнейшего изучения новообразований щитовидной железы.
Академик Н. Н. Блохин

Рецидив и метастазы (7 из 8 больных), а также летальность (14 из 16 больных) наблюдались у большинства наших больных в первые 3 года после лечения. При статистической обработке существенной разницы между 3- и 5-летними результатами лечения не выявлено. Поэтому оценка 3-летнего срока наблюдения правомочна. При опухолях I и Па стадий 3 года здоровы 98,4%, 5…

Нами проведена прогностическая оценка распространенности первичной опухоли и регионарных лимфатических узлов (Т и N) независимо от их сочетания у больных, леченных радикально. Клинические наблюдения показали, что при раке щитовидной железы на течение болезни и прогноз больше влияет распространенность первичной опухоли, чем регионарные метастазы. Существенной разницы в результатах лечения группы больных, объединенных символом Т, и категории…

Е. Mazzaferri и соавт. (1981), по данным Американского ракового регистра, изучили 576 случаев папиллярного рака щитовидной железы и пришли к заключению о том, что метастазы в регионарные лимфатические узлы не отягощают прогноз данного заболевания. Аналогичного мнения придерживается В. Cady из клиники Lahey (1981). Работы М. Staunton и соавт. (1979), W. Farrar и соавт. (1980) также…

По данным D. Stanley (1970), 5-летняя выживаемость при раке из остатков щитовидно-язычного протока, составляет 95%. Из 4 наших больных 2 здоровы более 5 лет, одна умерла через год от рецидива, одна оперирована менее года назад. Следующим фактором, определяющим прогноз рака щитовидкой железы, является гистологическая структура и гистогенетическая принадлежность опухоли. R. Willis (1960), признавая, что гистологическая…

При медуллярном раке 3 года живы 42%, 5 лет — от 17 до 80%, обычно 50-70% [Williams E. et al., 1969; Gordon P. et al., 1973; Chong С et al., 1975; Hainan K, 1977]. В связи с разной терминологией и классификацией опухолей выживаемость больных с недифференцированным раком щитовидной железы, по разным данным, варьирует в весьма…

В наших наблюдениях 5- и 10-летнее выздоровление при папиллярной аденокарципоме зафиксировано в 95,3 и 94,2%, при фолликулярной аденокарципоме — в 90,1 и 85,7%, при медуллярном раке — в 87,2 и 80% соответственно. Поскольку у нас мало больных с папиллярной и фолликулярной адепокарцииомой из В-клеток, мы их объединили с аналогичными дифференцированными опухолями из А-клеток для укрупнения…

Дийодбепзотэф является одним из производных этиленамина, по своим физико-химическим свойствам, а также по противоопухолевой активности и влиянию на организм экспериментальных животных близок к бензотэфу; дийодбепзотэф разрешен для применения в клинической онкологии [Карев Н. И. и др., 1974]. Малочувствительным оказался рак щитовидной железы к асти-рону, йодбензотэфу, тиофосфамиду и метотрексату. Так как у основного контингента больных была…

Больная Л., 31 года, поступила с диагнозом: недифференцированный рак щитовидной железы, IIIб стадии ( T2N3MO ). В 1972 г. перенесла тиреоидэктомию и фасциалыю-футлярное иссечение клетчатки шеи справа. Проведена послеоперационная дистанционная гамма-терапия в суммарной очаговой дозе 4100 рад (41 Гр). Через 3 года рецидива и видимых метастазов не обнаружено. Все наши больные после паллиативного лечения по поводу недифференцированного…

Изучение распределения противоопухолевых препаратов как при системном, так и при регионарном введении имеет большое значение в клинической практике, позволяя рационально подходить к выбору химиотерапевтического агента, его дозы и методики введения. Г. Е. Островерхов и соавт. (1967) изучили распределение Тио ТЭФа, меченного 35S , при введении его в систему наружной сонной артерии. Мы поставили задачу экспериментально разработать…

Пол, возраст больных Больные лечение радикально лечение паллиативно 3года 5 лет 3 года 5 лет число больных живы здоровы % ±mt число больных живы здоровы % ±mt число больных живы здоровы число больных живы здоровы Женщины 147 147 145 98,63 95,61—100 95 95 93 97,89 96,89—100 3 3 1 - - - Мужчины 50 50…
РАК ЩИТОВИДНОЙ ЖЕЛЕЗЫ У ДЕТЕЙ И ПОДРОСТКОВ
Рак щитовидной железы - злокачественное эпителиальное новообразование из клеток щитовидной железы
Код по МКБ-10: С73
Эпидемиология: В структуре всех злокачественных опухолей РЩЖ составляет 1-1,5% [Давыдов М.И.,Аксель Е.М., 2007; Kilfoy B.A. et al, 2008]. Ежегодный прирост заболеваемости РЩЖ в различных странах мира варьирует от 2 до 12% [Netea-Maier R.T. et al, 2008; Sprague B.L. et al, 2008]. Рак щитовидной железы у детей составляет от 1,5 до 3 % всех опухолей, и от 8 до 22 % злокачественных солидных опухолей головы и шеи [Лебединский А.В. 1993; Демидчик Е.П. 1996; Поляков В.Г 1995, 2004; Pizzo A.P 2006]. РЩЖ преобладает у лиц женского пола, у детей соотношение девочек и мальчиков составляет от 2:1 до 6:1, в среднем соотношении 3,6:1. Основной возраст больных на момент заболевания составляет 8-14 лет. Дети до 6 лет составляют 15-20%, от всех наблюдений, зафиксированы редкие случаи возникновения рака щитовидной железы у детей до 3 лет жизни (около 3% наблюдений). Наибольшее количество детей (61%) заболевает в возрасте 11-14 лет, т.е. в пубертатный период, при этом соотношение девочек к мальчикам составляет 4,6:1.
Основные сведения: Злокачественные опухоли щитовидной железы (ЩЖ) эпителиальной природы согласно международной гистологической классификации опухолей ЩЖ (ВОЗ, 2004г.) представлены: дифференцированными (папиллярной и фолликулярной) карциномами, медуллярными или С-клеточными и недифференцированными (анапластическими) карциномами ЩЖ. Эти разные по гистогенезу раки ЩЖ существенно различаются не только по распространенности и гистологической структуре, но и по клиническому течению, диагностической и лечебной тактике, прогнозу. Это обусловливает необходимость стандартизации и оптимизации диагностических и лечебных методик для всех нозологических форм РЩЖ.
У детей рак щитовидной железы встречается реже, чем у взрослых, и при этом имеет более агрессивный характер течения. Причём чем меньше возраст ребёнка, тем более агрессивно протекает заболевание. РЩЖ преобладает у лиц женского пола, у детей соотношение девочек и мальчиков составляет от 2:1 до 6:1. Рак щитовидной железы диагностируется у детей на более поздних стадиях, чем у взрослых. По данным Zimmerman D. et al. (1988), опухоль менее 1см диагностируется только у 9% детей, в противовес 22% взрослых, в то же время 36% выявляемых карцином у детей имеют размеры более 4см, в то время как у взрослых опухоли подобных размеров выявляются в 15% случаев.
Вторым по частоте встречаемости у детей является фолликулярный рак (ФР), он составляет от 1,3% до 5% случаев. У взрослых по данным различных авторов ФР составляет от 11% до 20%. У детей в отличие от взрослых ФР имеет более доброкачественное и медленное течение.
Медуллярный рак ЩЖ у детей возникает как спорадически, так и при семейном эндокринном синдроме и составляет от 2 до 25% (чаще от 2 до 5%) от всех случаев РЩЖ, в 70% это спонтанные случаи заболевания и в 30%-семейный вариант. У взрослых эта опухоль составляет 12,6% среди всех злокачественных опухолей щитовидной железы. Наследственный МРЩЖ – генетическое заболевание с аутосомно – доминантным типом наследования.
Семейные формы МРЩЖ могут быть представлены в сочетании с множественными эндокринными неоплазиями (МЭН) либо как изолированный МРЩЖ:
МЭН 2А (синдром Сипла) - сочетание МРЩЖ с феохромоцитомой (в 10-60%), патологией паращитовидных желез(20-23%) и кожным лихеноидным амилоидозом (менее 5%).
МЭН 2Б (синдром Горлина) - сочетание МРЩЖ с феохромоцитомой (50-60%), множественными невриномами слизистой полости рта, губ, век (100%), “морфаноидное” телосложение (100%).
Семейный МРЩЖ (без МЭН).
Недифференцированный рак ЩЖ у детей описан в виде единичных случаев. У взрослых – это также относительно редкая опухоль, составляющая по данным разных авторов от 0,5 до 2%.
Тактика диагностики и лечения РЩЖ аналогична тактике у взрослых, но у детей РЩЖ имеет ряд существенных отличий. Во - первых у детей и подростков не бывает клинически латентных карцином ЩЖ. Такое мнение было высказано Международной коллегией патологов и основано на том, что злокачественная опухоль ЩЖ даже очень малого размера в детском возрасте потенциально опасна. Необходимо отметить, что детский возраст как фактор, активирующий потенциал опухолевой агрессии, проявляется при любом гистологическом типе РЩЖ. Риск тем выше, чем меньше возраст ребёнка. В детском и подростковом возрасте пролиферативные изменения в тканях имеют гораздо более высокую интенсивность по сравнению с взрослыми. Наибольшей активности эти процессы достигают в пубертатном возрасте в органах эндокринной системы. В это же время активно формируется и совершенствуется иммунная система растущего организма, в том числе и антиканцерогенный иммунитет. Этим реактивным физиологическим состоянием вероятно и объясняются высокие показатели частоты и обширности опухолевой диссеминации, и как следствие бурное и агрессивное течение РЩЖ в детском и подростковом возрасте.
До настоящего времени, тактика органосохраняющих операций, ввиду частого внутриорганного распространения при РЩЖ и не диагностированного регионарного метастазирования, вызывает большие споры. Одни авторы считают, что операции в объеме гемитиреоидэктомии или субтотальной резекции и в дальнейшем супрессивная гормональная терапия будут адекватны для ДРЩЖ у детей, в отличие от ТЭ после которой, необходима пожизненная заместительная терапия левотироксином в больших дозах [Newman K.D. 1993; Kомиссаренко И.В., Рыбаков И., Koваленко A. 1999; Романчишен А.Ф., Гостимский А.В. 2002; Leger A.F.2005]. Многие авторы высказывают сомнение в том, что применение этого препарата не может полностью заменить функцию удаленной ЩЖ, особенно у растущего организма детей. Известны негативные последствия длительного применения высоких доз левотироксина, а именно его кардиотоксичность, гепатотоксичность и влияние на содержание минеральных компонентов костной ткани. Cторонники органосохраняющих операций считают их преимуществом меньший процент послеоперационных осложнений, по сравнению с ТЭ. В специализированных центрах осложнения после ТЭ в среднем составляют не более 3 %, кроме этого число осложнений в большей степени определяется распространенностью процесса. По данным Udelsman R. и соавт. (1996) суммарный процент послеоперационных осложнений после ТЭ составляет 5,6 %, тогда как после гемитиреоидэктомии – 2,1 %. Отмечено, что у 5 – 47 % больных после гемитиреоидэктомии развивается локальный рецидив заболевания, риск которого в среднем в два раза выше, чем после выполнения ТЭ, что может быть связано с неверной диагностикой распространенности опухолевого процесса. Даже сами сторонники органосохраняющих операций отмечают высокий процент повторных операций по поводу рецидивов, он может достигать 37 % при среднем сроке наблюдения 18,5 месяцев. Повторное хирургическое вмешательство всегда сопряжено с определенными техническими трудностями, следовательно, увеличивает риск развития послеоперационных осложнений.
Другая и большая группа авторов однозначно высказываются в пользу ТЭ, аргументирую свою позицию высокой частотой мультицентричного роста ДРЩЖ у детей и подростков [Belleguic C. 1996.; Segal K., Shvero J., Stern Y., Mechlis S., 1998; Sierk A.E., Askin F.B., Reddick R.L.1990; Wiest P.W., Hartshorne M.H., Inskip P.D. et al 1998]. В пользу этого утверждения говорят результаты исследования, при котором в 53,8 % случаев только при гистологическом исследовании обнаруженны скрытые опухолевые очаги в удаленной ткани ЩЖ [Eroglu A., Unal M., Kocaoglu H. 1998].
Большинство исследователей считают, что единственная возможность для проведения операции у детей в объеме меньшем, чем ТЭ – это ПРЩЖ диаметром 99 m Тс-пертехнетата и 99 m Тс-технетрила; рентгенографии органов грудной клетки (при подозрении на метастазы - дополнительно рентгенотомография или, что более оптимально - компьютерная томография); рентгенография и сцинтиграфии костей (по показаниям); фибротрахеоскопия и рентгенография трахеи (по показаниям),
Рак щитовидной железы – злокачественное узловое образование, способное образовываться из эпителия, естественно функционирующего в железе.
Рак щитовидной железы составляет более четверти всех злокачественных новообразований в области головы и шеи. За последние десятилетия, по данным ВОЗ, заболеваемость РЩЖ в мире выросла в 2 раза. Рак щитовидной железы ежегодно является причиной смерти 1% всех больных, умирающих от злокачественных опухолей. Среди всех злокачественных новообразований, это заболевание составляет 0.5 — 3.5 %. То есть на 100 000 населения РЩЖ заболевают в среднем 0.5-0.6 мужчин и 1.2-1.6 женщин.
В России самые высокие показатели заболеваемости отмечаются в Брянской области: 4.9 на 100 000 мужчин и 26.3 на 100 000 женщин. Также наиболее неблагополучные районы в отношении заболеваемости РЩЖ — Архангельская, Саратовская, Свердловская и Магаданская области.
Факторы риска развития рака щитовидной железы
Основные факторы риска:
- Йодная недостаточность
- Ионизирующее излучение (Радиация)
- Наследственность (Семейный анамнез)
К факторам риска также относится наличие у пациентов узловых образований в щитовидной железе, т.е. узловые зобы, рецидивирующие их формы, узловые формы хронических тироидитов.
Регионы мира с пониженным содержанием йода в воде и пищевых продуктах, являются эндемичными для узлового зоба, на фоне которого нередко развивается рак щитовидной железы. В Российской Федерации эндемичными районами считаются Алтайский край и республика Адыгея.
С момента обнаружения данного физического явления и до настоящего момента роль этого фактора, как причины развития РЩЖ, резко возросла. Действие данного фактора, прежде всего, связано с попаданием в организм радиоактивных изотопов йода ( 131 I, 125 I). Так, было установлено, что жители Хиросимы и Нагасаки, которые попали под облучение после взрыва атомных бомб, болели раком щитовидной железы в 10 раз чаще, чем остальные японцы.
В России был отмечен резкий рост заболеваемости РЩЖ, особенно у детей, в регионах, которые подверглись радиоактивному загрязнению после аварии на Чернобыльской АЭС, это Брянская, Тульская, Рязанская области.
Риск развития РЩЖ выше в семьях, где отмечались случаи этого заболевания. Наследственная форма рака связана с наследственными синдромами множественной эндокринной неоплазии (МЭН).
Типы рака щитовидной железы
По гистологическим формам классифицируются четыре типа рака щитовидной железы: папиллярный, фолликулярный, медуллярный и анапластический.
Папиллярный рак — наиболее благоприятный тип. Встречается у детей и взрослых, чаще заболевают в 30-40 лет. Является преобладающей формой РЩЖ у детей. Опухоль чаще возникает в одной из долей и лишь у 10-15% пациентов отмечается двустороннее поражение.
Папиллярная карцинома отличается достаточно медленным ростом. Метастазирует в лимфоузлы шеи, отдаленные метастазы в другие органы наблюдаются редко.
Фолликулярный рак встречается у взрослых с пиком заболеваемости в 50-55-м возрасте. Этот вид опухоли характеризуется медленным ростом. В поздних стадиях образует метастазы в лимфатических узлах шеи, а также в костях, печени и легких. Метастазы фолликулярного рака сохраняют способность захватывать йод и синтезировать тиреоглобулин.
Медуллярный рак может быть как самостоятельным заболеванием, так и компонентом МЭН синдрома. Чаще определяется в пожилой возрастной группе пациентов с узловым зобом. Характеризуется быстрым ростом с инвазией в близлежащие органы и ранним метастазированием.
Анапластический рак чаще возникает у пожилых пациентов с узловым зобом. Его отличает агрессивная форма и раннее метастазирование. Быстрый рост опухолевого узла может приводить к его некротическому распаду, изъязвлению и может служить источником кровотечений.
Гистогенетическая классификация рщж
| ИСТОЧНИК РАЗВИТИЯ | ГИСТОЛОГИЧЕСКАЯ СТРУКТУРА ОПУХОЛИ | |
| доброкачественные | злокачественные | |
| А-клетки | Папиллярная аденома | |
Симптомы
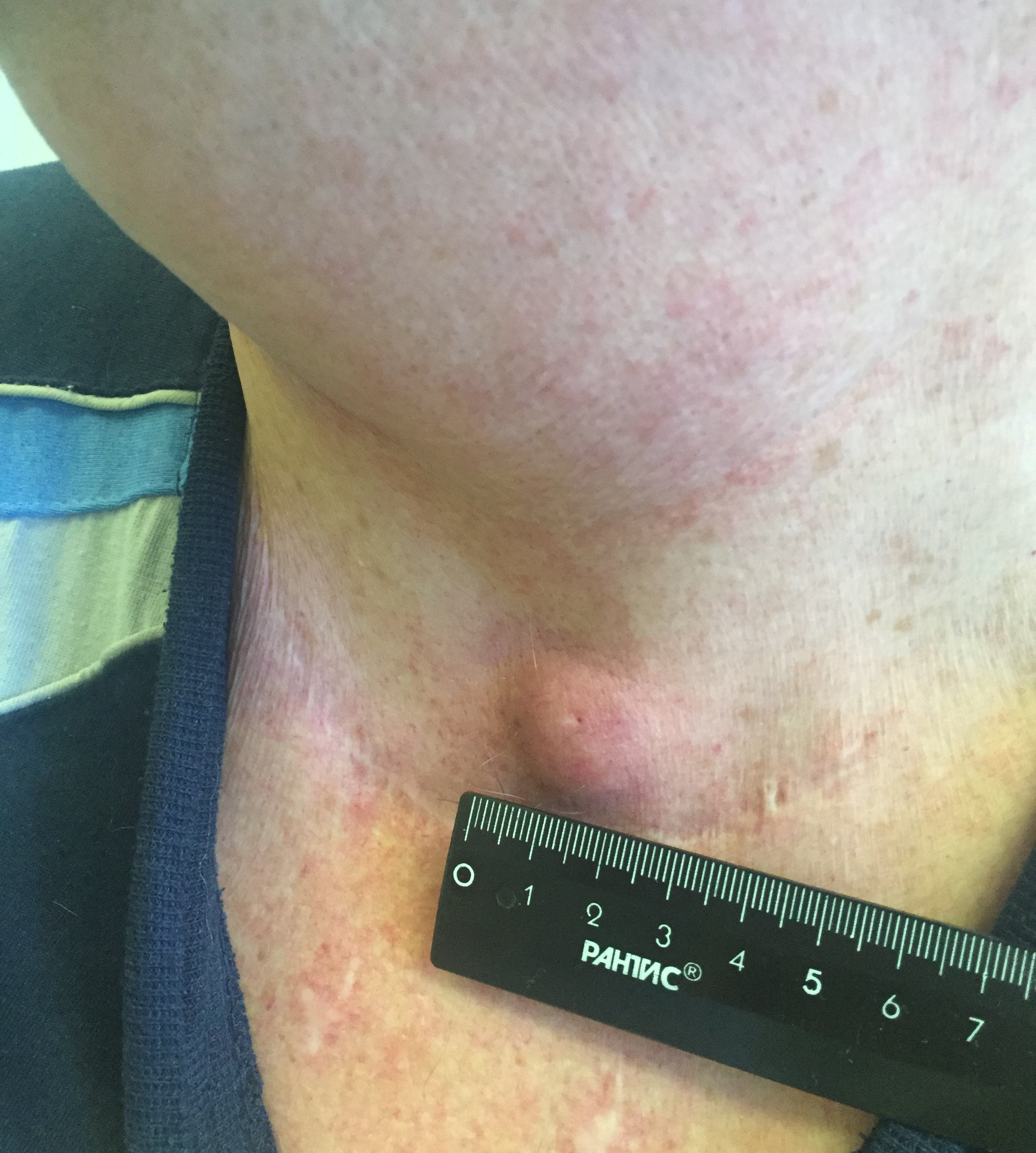
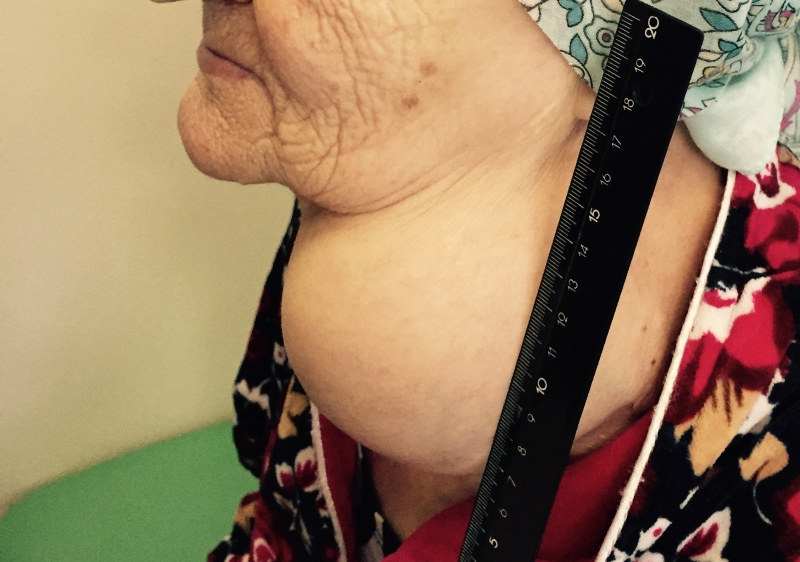
Заболевание может проявляться различными симптомами. Они зависят от стадии, распространенности опухолевого процесса и развившихся осложнений. Небольшие опухоли щитовидной железы обычно не сопровождаются клинической симптоматикой и выявляются случайно при ультразвуковом исследовании. Первой причиной обращения к врачу может послужить увеличение одного шейного лимфатического узла, который при дальнейшем обследовании оказывается метастазом РЩЖ.
Симптомы рака щитовидной железы часто схожи с симптомами простуды, ангины, инфекционных заболеваний:
- Припухлость на шее. Небольшие узлы на шее может выявить только врач, но иногда припухлость можно заметить во время глотания.
- Увеличение шейных лимфоузлов. Однако, этот симптом часто сопровождает простуду или ангину и не связан со злокачественным процессом.
- Изменение тембра голоса. Иногда большой узел щитовидной железы давит на гортань, это может вызвать охриплость.
- Одышка. Причиной может явиться то, что увеличившаяся щитовидная железа вызывает сужение просвета трахеи.
- Затруднение глотания. Также узел щитовидной железы может сдавливать пищевод.
- Боль в шее или горле. Развитие рака щитовидной железы редко вызывает боль, но в сочетании с другими симптомами это сигнал незамедлительно обратиться к врачу.
Большая часть подобных симптомов связана с появлением узла щитовидной железы, который в более чем 95% случаев оказывается доброкачественным. Узлы щитовидной железы довольно частое явление, и в пожилом возрасте риск их появления увеличивается. При обнаружении узелков в области щитовидной железы следует обратиться к врачу.
Диагностика
Ультразвуковая диагностика позволяет обнаружить опухолевые образования от 2-3 мм, определить точное топографическое расположение в железе, визуализировать инвазию капсулы, оценить размеры и состояние лимфатических узлов шеи.
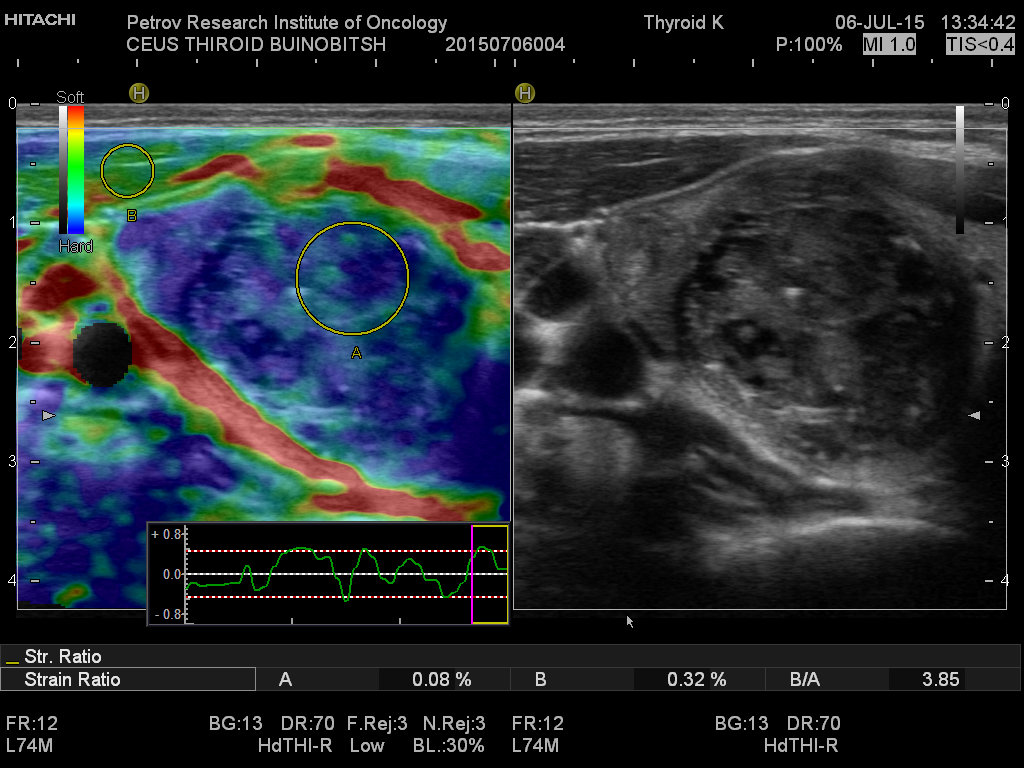
Магнитно-резонансная томография (МРТ) позволяет получить детальную топографо-анатомическую картину опухоли и ее соотношение с органами и структурами шеи. Это необходимо при планировании хирургического лечения в случае инвазии опухоли в соседние структуры.
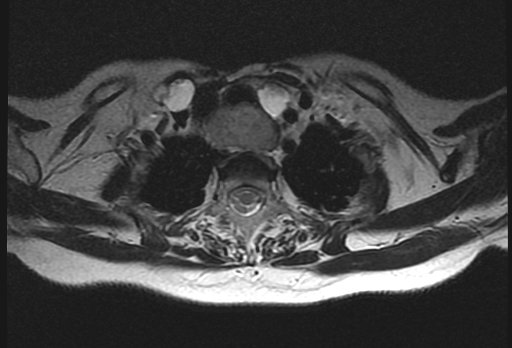
Компьютерная томография применяется для определения метастатического поражения легких и костей.
Сцинтиграфия щитовидной железы с 125 I, 131 I применяется в основном для выявления остаточной тиреоидной ткани после хирургического лечения, а также для диагностики рецидивов. Она позволяет оценить способность метастазов захватывать йод при планировании радиойодтерапии.
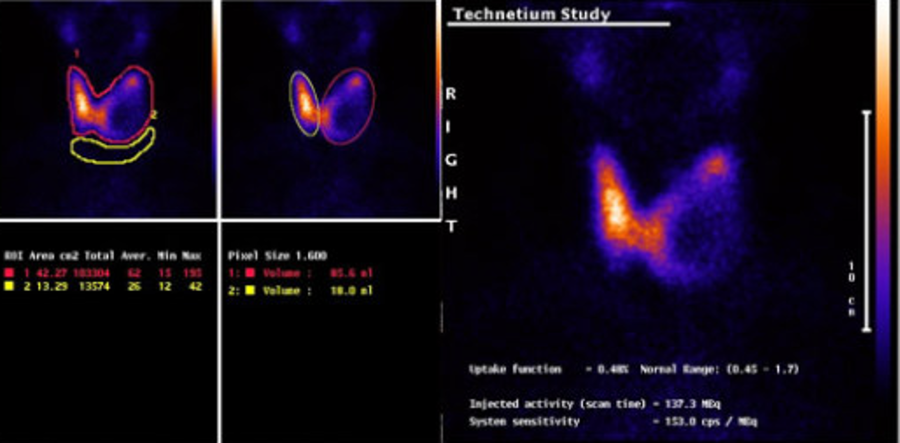
Остеосцинтиргафия позволяет оценить наличие/отсутствие метастатического поражения костей скелета.
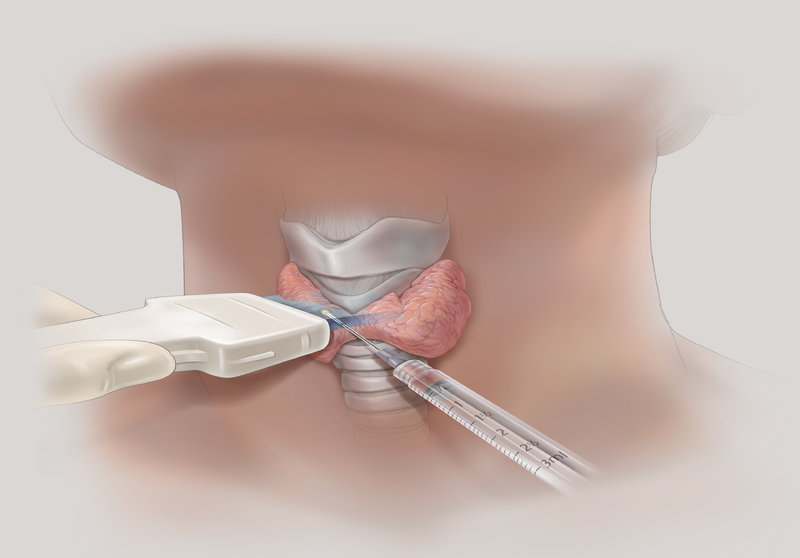
Тонкоигольная аспирационная биопсия выполняется преимущественно под контролем УЗИ, позволяет прицельно получить материал для цитологического исследования, что позволяет в большинстве случаев верифицировать диагноз. ТАБ подозрительных лимфатических узлов дает возможность установить метастатический характер поражения.
Позитронно-эмиссионная томография (ПЭТ) выявляет очаги повышенной метаболической активности, выполняется для диагностики метастазов РЩЖ, не накапливающих йод и не выявляемых при сцинтиграфии.
Кальцитонин: гормон щитовидной железы, вырабатывается С-клетками. (Норма-0-11,5 пг/мл). Значительное повышение уровня гормона наблюдается при медуллярном раке, уровень повышения связан со стадией заболевания и размерами опухоли.
Тиреоглобулин: определение уровня при дифференцированном раке щитовидной железы позволяет контролировать возникновение рецидива опухоли. После тиреоидэктомии уровень тиреоглобулина должен приближаться к нулю.
Стадирование рака щитовидной железы

Лечение
Основной метод лечения больных раком щитовидной железы – хирургическое лечение в сочетании с курсами радиойодтерапии, таргетной терапией и супрессивной гормонотерапией, а также дистанционной гамма-терапией по показаниям.
Объем оперативного вмешательства зависит в первую очередь от стадии заболевания, от того, насколько распространился злокачественный процесс. Кроме того, лечение определяется морфологическим вариантом опухоли и возрастом пациента.
У больных папиллярным и фолликулярным раком при небольших стадиях может выполняться гемитиреоидэктомия — удаление одной доли с оставлением или резекцией перешейка железы. При распространении опухоли (T1-3N0M0) производят тотальное удаление щитовидной железы. На поздних стадиях злокачественного процесса производят экстрафисциальную тотальную тиреоидэктомию с удалением лимфоузлов.
Если диагностирован медуллярный, недифференцированный и папиллярный рак, во всех случаях показано тотальное удаление железы — тиреоидэктомия.
Если лимфатические узлы шеи поражены метастазами, выполненяют шейную лимфаденэктомии, в некоторых случаях — расширенную шейную лимфаденэктомию с резекцией соседних органов и структур, в зависимости от распространенности процесса.
Радиойодтерапия После хирургического лечения пациентам с РПЖ назначают проведение радиойодтерапия для уничтожения возможных микрометастазов и остатков тиреоидной ткани (используется 131 I).
Дистанционная лучевая терапия: стандартом лечения является проведение неоадъювантной (предоперационной) терапии для больных с недифференцированным и плоскоклеточным РЩЖ.
Супрессивная гормональная терапия (СГТ) назначается пациентам с папиллярным и фолликулярным РЩЖ в качестве компонента комплексного лечения после операции, чтобы подавить секрецию тиреотропного гормона (ТТГ).
Химиотерапия показана при медуллярном и недифференцированном РЩЖ.
Таргетная терапия применяется для лечения медуллярного и радиойодрезистентных форм дифференцированного РЩЖ.
Наблюдение и прогноз
Сроки наблюдения
- 1й год после лечения – 1раз в 3 мес
- 2 – 3й год после лечения – 1 раз в 4 мес
- 4 – 5й год после лечения – 1 раз в 6 мес
- 6й и последующие годы после лечения – 1 раз в год
Прогноз
| 5-летняя выживаемость: | 10-летняя выживаемость: | |
| Папиллярный рак | 95,3% | 94,2% |
| Фолликулярный рак | 90,1% | 85,7% |
| Медуллярный рак | 87,8% | 80% |


Рак щитовидной железы (РЩЖ) занимает 5 место в структуре заболеваемости злокачественными заболеваниями у женщин и 9 место в структуре общей заболеваемости злокачественными новообразованиями в США. Ежегодно от этой патологии умирают менее 2000 человек. На протяжении нескольких десятилетий показатели смертности остаются стабильными. Наиболее часто встречающаяся форма РЩЖ, дифференцированный РЩЖ (ДРЩЖ), возникает из фолликулярных клеток щитовидной железы (ЩЖ). Выделено 2 гистотипа ДРЩЖ – папиллярный и фолликулярный РЩ. Большинство пациентов излечиваются от этой патологии или заболевание имеет индолентное течение. Небольшой процент больных имеют метастазы, не отвечающие на терапию радиоактивным йодом или тироксином [4].
В России за последнее десятилетие отмечается неуклонный рост заболеваемости РЩЖ. В структуре заболеваемости злокачественными заболеваниями женского населения страны в 2014 году рак щитовидной железы составил 2.8 %. К примеру, в 2004 году в России было выявлено 1141 человек с впервые установленных диагнозов РЩЖ. В 2014 эта цифра составила 1655 человек. Динамика стандартизованных показателей заболеваемости РЩЖ в России характеризуется приростом на 13,11 % за 10 лет (2004–2014). Самые высокие показатели заболеваемости РЩЖ приходятся на возрастную группу от 52 до 54 лет [1].
Показатели выживаемости у больных ДРЩЖ высокие. У них, как привило, не бывает отдалённых метастазов и не отмечено локального роста. В 85 % случаев эти больные преодолевают порог 10-летней выживаемости [4].
Большинству пациентов с диагнозом дифференцированного РЩЖ показано оперативное лечение первичной опухоли. Объем операции (гемитиреоидэктомия, тиреоидэктомия или удаление ЩЖ с лимфодиссекцией) определяется согласно предоперационному риску рецидива. Так же назначается и терапия радиоактивным йодом после тиреоидэктомии. Локальные или отдалённые метастазы могут выявляться у 10 % больных дифференцированным РЩЖ. В этих случаях имеются различные варианты лечения. Терапия может включать назначение нескольких сеансов терапии радиоактивным йодом, удаление метастаза хирургически, и /или ДЛТ [5]. Несмотря на лечение, одна – две трети пациентов с метастатическим дифференцированным РЩЖ становятся резистентными к радионуклидной терапии. Радиойодрезистентность случается менее, чем у 5 % пациентов с РЩЖ. Эта группа пациентов имеет плохой прогноз, 10–летняя выживаемость составляет 10 % , а средняя продолжительность жизни от выявления метастазов колеблется в диапазоне от 3 до 5 лет. Пациентам с распрострарнённым, прогрессирующим и радиойодрезистентным ДРЩЖ назначается таргетная терапия мультикиназными ингибиторами (МКИ) [4]. На настоящий момент одобрены 2 МКИ – сорафениб и ленватиниб. Практическое применение МКИ в клинике варьирует в зависимости от локальных рекомендаций и опыта лечащего врача [3]. Существуют некоторые аспекты назначения этих препаратов в клинической практике. Наиболее важными задачами в клинике являются установление факта радиойодрефрактерности и отбор кандидатов для системной терапии [10].
Гистологические особенности ПРЩЖ
Недавно проведённые исследования указывают, что некоторые варианты ПРЩЖ (диффузно-склерозирующий, высококлеточный и инсулярный варианты) проявляют себя либо как высокоагрессивные опухоли, либо как дифференцированный ПРЩЖ или недифференцированная карцинома ЩЖ, с высокой частотой метастазирования, рецидивов, радиойодрезистентностью.
Фолликулярный вариант ПРЩЖ сложно отличить от фолликулярной аденомы. Отличия выявляются на уровне цитологических признаков. По этой причине в сложных случаях необходимо определять иммуногистохимические и молекулярные маркеры для установления диагноза. Прогноз при этом типе опухоли такой же, как и при ПРЩЖ, за исключением случаев диффузного или многоузлового фолликулярного варианта с более агрессивным течением. Прогноз зависит от степени инвазии. Высококлеточный вариант составляет лишь 1 % ПРЩЖ, имея боле агрессивное течение в отличие от типичного ПРЩЖ. Он представлен клетками, которые в 2–3 больше в длину, чем в ширину. Исходя из имеющихся данных, при этом варианте распространение за пределы ЩЖ наблюдается в 33 % случаев. Также поражение лимфоузлов чаще наблюдается у мужчин, чем у женщин. Мутация BRAF обнаружена у 93 % пациентов с высококлеточным типом и в 77 % случаев типичного ПРЩЖ. Диффузно-склерозирующий вариант ПРЩЖ составляет 0.7–6.6 % ПРЩЖ. Зачастую этот вариант встречается в педиатрической практике и у пациентов, подвергшихся воздействию излучения [8]. Наиболее частые мутации – T1799A миссенс – мутация в 15 экзоне гена BRAF и мутация RET/PTC, ведущие к активации сигнального каскада RAS-RAF-MAPK [10]. Этот подтип связан с высокой частотой отдалённых метастазов, плохим прогнозом, женским полом и молодым возрастом [9]. Инсулярный РЩЖ встречается в 0.3 % ПРЩЖ. Зачастую эта опухоль выявляется у пожилых пациентов в возрасте от 48–61 года. Характерна для мужчин [10]. Распространяется за пределы ЩЖ в 47.3 % случаев, лимфоузлы вовлечены в 61.9 % случаев, около 30 % пациентов имеют отдалённые метастазы [6].
Молекулярные особенности ДРЩЖ
За последние тридцать лет наблюдается значимый прорыв в понимании влияния соматических генных нарушений на клинические исходы у больных ДРЩЖ. Большинство этих генетических реаранжировок и мутаций влияют на инициацию опухолевого роста, но не на прогрессирование. Реаранжировки RET/PTC были описаны среди первых молекулярных нарушений при ДРЩЖ. Наиболее распространённые реаранжировки – RET/PTC 1 и RET/PTC3. Перестройка RET/PTC 1 характерна для молодых пациентов и ассоциирована с высокой частотой метастатического поражения лимфоузлов. С другой стороны, реаранжировка RET/PTC 3 встречается в детском возрасте и ассоциирована с предшествующим облучением. Онкогены RAS кодируют 3 белка (H-, K-, and N-RAS). Наиболее часто при ДРЩЖ выявляются точковые мутации в кодонах 12 или 61. Активация этих белков увеличивает пролиферативную активность клеток ЩЖ и снижает экспрессию тиреоглобулина, тиреопероксидазы и NIS протеина. Мутации RAS встречаются с одинаковой частотой в аденомах ЩЖ, ДРЩЖ и анапластических опухолях. Около 15 %–20 % папиллярных опухолей ЩЖ могут иметь мутации онкогена RAS, в основном фолликулярного варианта, которые инкапсулировнаы и имеют низкую частоту метастазирования в лимфоузлы [4]. Высокая частота этой мутации выявлена у больных ДРЩЖ с отдалёнными метастазами, чувствительными к радиойоду. Несмотря на способность к накоплению препарата, радиойодтерапия оказывается неэффективной у большинства пациентов с ДРЩЖ, чувствительным к радиойоду и имеющим мутацию RAS [7]. Тем не менее, наличие мутации RAS может служить предиктором эффективности терапии МКИ селюметинибом у больных радиойодрефрактерным ДРЩЖ. Описаны случаи более агрессивного течения ДРЩЖ при наличии этой мутации.
Мутации в гене B-RAF (V600E) обнаружены у 30 %–70 % больных папиллярным РЩЖ. Установлено, что опухоли с этой мутацией чаще распространяются за пределы ЩЖ, метастазируют в лимфоузлы, чаще рецидивируют и меньше поглощают радиойод. Также описано ,что B-RAF мутация может присутствовать в различных участках опухоли.
Сигнальный каскад фосфоинозитид – 3 – киназы (PI3K) регулирует рост, подвижность и выживаемость клеток. Активирующие мутации гена PI3K в основном присутствуют в клетках фолликулярного и анапластического рака. Тем не менее, амплификация PI3K встречается в 13 % фолликулярных аденом, 16 % папиллярного РЩЖ, 30 % фолликулярного РЩЖ и в 50 % анапластического РЩЖ.
Недавно при ДРЩЖ обнаружена гиперэкспрессия гена обратной транскриптазы теломеразы (TERT), которая играет значимую роль в иммортальности клеток. Также обнаружены соматические точковые мутации, которые повышают активность теломеразы. TERT мутации обнаружены в 11 % случаев при фолликулярном РЩЖ и в 16 %–40 % случаев папиллярного рака ЩЖ (зачастую ассоциированы с B-RAF мутациями). Гиперэкспрессии или мутации гена TERT коррелируют с более агрессивным течением опухолей, чем при наличии мутаций B-RAF. Эти пациенты имеют высокий риск рецидива заболевания.
Фактор роста эндотелия сосудов (VEGF) гиперэкспрессирован как в самой опухоли, так и в кровеносных сосудах опухоли. Его основной рецептор – VEGFR-2– гиперактивирован при ДРЩЖ и вовлечен в неопластический рост, прогрессирование и агрессивность. На сегодняшний день это основная мишень многих МКИ при радиойодрефрактерном ДРЩЖ [4].
Возможности таргетной терапии при ДРЩЖ
Сорафениб – это МКИ одобренный для лечения первичного рака почки, распространённой гепатоцеллюлярной карциномы и распространённого прогрессирующего ДРЩЖ. Мишени Сорафениба – C-RAF, B-RAF, VEGF – рецептор (VEGFR)-1, -2, -3, PDGF receptor (PDGFR)-β, RET, c-kit, and Flt-3. Препарат ингибирует рост опухоли, прогрессию, метастазирование и ангиогенез, а также нарушает механизмы защиты клетки от апоптоза [4].
В июле 2014 года опубликовано первое рандомизированное, двойное слепое, плацебо-конролируемое исследование (DECISION) по анализу эффективности стандартной дозы сорафениба 800 мг у больных радиойдрефрактерным местнораспространённым или метастатическим ДРЩЖ. Популяция включила 417 пациентов (207 в группе сорафенибва и 210 в группе плацебо) с медианой наблюдения 16.2 месяца. Выживаемости без прогрессирования (ВБП) была длиннее на 5 месяцев в группе больных, получавших сорафениб в сравнении с пациентами, получавшими плацебо (10.8 и 5.8 месяцев соответственно, отношение рисков [ОР] 0.587, 95 % ДИ 0.454–0.758; P
Читайте также:

